氨基酸对小麦成熟胚愈伤组织诱导率的影响
2018-05-11吴一磊孙清栩曲继鹏彭正松杨在君
吴一磊,孙清栩,路 璐,余 燕,曲继鹏,彭正松,杨在君
(1.西华师范大学/西南野生动植物资源保护教育部重点实验室,四川南充 637009; 2.西华师范大学环境科学与工程学院,四川南充 637009;3.西昌学院农业科学学院,四川西昌 615013)
小麦传统育种技术主要是基于杂交、回交和选种的品种选育过程,其缺点是费时和费力[1]。随着基因工程和基因组学的发展,利用现代基因工程技术对小麦进行定向改造的研究发展迅速。其中,利用转基因技术对小麦基因进行定向改变,可得到理想的小麦品种。但小麦转基因研究明显滞后于水稻和玉米,这在很大程度上归结于小麦转化体系的构建难度大[2,4]。迄今为止,学者们在进行小麦组织培养的研究中采用了多种不同的外植体材料来进行愈伤组织的诱导,其中包括花药、幼穗、幼胚和成熟胚等,不同的外植体材料对小麦的组织培养再生率和农杆菌侵染效率都会有一定的影响[5]。成熟胚因取材方便、周期短、出愈率高、愈伤组织生长快等特点,已成为外植体的主要来源[6]。但采用成熟胚存在愈伤组织诱导率低的问题。影响愈伤组织诱导率的因素多而复杂,有学者指出基因型是影响愈伤组织诱导率的关键因素,其次是激素类型、含量及培养条件的影响[5,7]。小麦成熟胚愈伤组织诱导及分化的研究目前正处于起步阶段,建立高效、稳定的成熟胚植株再生体系,对于小麦基因工程育种和基因功能研究具有重要意义。
氨基酸是构建生物机体的众多生物活性大分子之一,是构建细胞、修复组织的基础材料。近20年来,直接以植物为材料的氨基酸生化研究越来越多,对植物氨基酸代谢的认识也更加深刻,这些研究不仅证实了绝大多数来自动物和微生物的氨基酸代谢过程和原理同样适用于植物,如天冬氨酸代谢途径[8]、芳香族代谢途径[9]等,同时也发现了不少植物特有的氨基酸代谢途径和特征[10]。愈伤组织诱导培养基主要使用酸水解酪蛋白作为氮源,但迄今为止尚无学者对各氨基酸成分在成熟胚愈伤组织诱导中的必要性进行讨论。本研究结合酸水解酪蛋白的主要氨基酸成分及其在植物中的作用[11-12],分析了氨基酸缺失对小麦成熟胚的影响,以期找出小麦成熟胚愈伤组织诱导所必须的氨基酸,为优化小麦成熟胚再生体系及研究小麦氨基酸代谢的生理过程提供参考。
1 材料与方法
1.1 植物材料
本研究选用的小麦成熟胚种子为2016年收获的中国春(Chinese Spring,CS),实验材料种植于四川南充西华师范大学生命科学学院试验田。
1.2 培养基和处理方法
MS基本培养基作为成熟胚愈伤组织的诱导培养基,并根据实验设计添加不同种类的氨基酸。灭菌前调节pH到6.5,于108 kPa、121 ℃高压灭菌锅内灭菌20 min。当温度降到40~55 ℃时,加入用0.22 μm针头过滤灭菌的100 μmol·L-1乙酰丁香酮、250 mg·L-1羧苄青霉素、100 mg·L-1头孢噻肟钠和2.0 mg·L-1的2,4-D[13-18]。
1.3 培养方法
挑选成熟、饱满、颜色和大小相对一致的种子,用75%乙醇震荡灭菌30~60 s,然后用灭菌双蒸水洗涤5~6次,再用质量体积比为30%的过氧化氢浸泡3~5 min,于灭菌双蒸水中洗涤5~6次后浸泡在双蒸灭菌水中45 min。用手术刀对种子进行解剖,暴露出成熟胚,切去部分胚芽后盾片朝上接种于培养皿中暗培养一周(25 ℃,湿度60%),每皿20~25粒种子,当绿色结构出现时,用手术刀对绿色结构进行切割,并挑出完全白色(偏淡黄色)的愈伤组织,于新的培养基中培养3周以上(新培养基成分与上述培养基成分相同)[19-20],各实验均重复3次,每次100粒种子。
1.4 数据分析方法
出愈率=(愈伤组织块数/接种的成熟胚数)×100%。利用SPSS 19.0进行正交实验设计和相关数据分析。
2 结果与分析
2.1 灭菌方式及时间对出愈率的影响
利用控制变量法,分别探究酒精和双氧水的作用效果与作用时间的关系。当用75%酒精浸泡时间控制在180 s、30%双氧水灭菌时间在15 s以上时,成熟胚无染菌情况发生;当30%双氧水消毒时间控制在180 s、75%酒精浸泡时间在15 s以上时,成熟胚不会出现污染。但随着酒精浸泡时间延长,酒精对种子造成损害,出现成熟胚出愈率减少、生长状态变差、愈伤组织变小等现象;而双氧水灭菌时间延长对出愈率有微弱的促进作用(P<0.05)(图1)。
2.2 氨基酸缺失对出愈率的影响
采用酸水解酪蛋白培养液(casein hydrolysate solution,CHS)[13]和对植物有明显作用的9种氨基酸配制的氨基酸配合液(amino acid combination solution,AaCS)[12](甘氨酸300 mg·L-1、L-天冬酰胺10 mg·L-1、L-谷氨酰胺50 mg·L-1、亮氨酸3 mg·L-1、精氨酸10 mg·L-1、L-脯氨酸50 mg·L-1、丝氨酸50 mg·L-1、酪氨酸50 mg·L-1、L-色氨酸30 mg·L-1),分别对小麦成熟胚愈伤组织进行诱导。结果表明,CHS的出愈率为93.4%,而AaCS的出愈率为93.5%,二者差异不显著(P=0.835),说明酸水解酪蛋白与氨基酸混合液在愈伤组织诱导过程中具有相近的功效。
通过控制变量法,分别将缺失1种氨基酸的培养基与含有9种氨基酸的AaCS培养基进行比较(表1),结果表明,当培养基缺乏甘氨酸、天冬氨酸、脯氨酸和亮氨酸时,成熟胚的出愈率显著低于对照组,由此可以推测上述4种氨基酸是小麦成熟胚愈伤组织诱导的必需氨基酸。

图1 灭菌时间对小麦成熟胚出愈率的影响
表1氨基酸缺失对小麦成熟胚出愈率的影响
Table1Effectofaminoaciddeficiencyonthecallusrateofmaturewheatembryo

缺失氨基酸Unaddedaminoacid出愈率Callusrate/%甘氨酸Glycine45±1.41dL⁃天冬酰胺Asparagine35±1.63eL⁃谷氨酰胺Glutamine95±0.81a亮氨酸Leucine65±2.16c精氨酸Arginine95±1.63aL⁃脯氨酸Proline5±1.41f丝氨酸Serine90±2.44ab酪氨酸Tyrosine85±1.63bL⁃色氨酸Tryptophan85±1.41b对照(AaCS)Controlgroup93.5±2.44a
数据后字母不同表示处理间差异显著(P<0.05)。
Different letters following data meant significant difference among treatments at 0.05 level.
将甘氨酸、天冬氨酸 、脯氨酸和亮氨酸分别记作 A、B、C、D,进行四因素正交实验,各因素均取3个水平,暂时不考虑其交互作用,选择L9(34)表进行正交实验(表2)。
表2L9(34)正交表和小麦成熟胚出愈率
Table2L9(34)Orthogonaltableandthecallusrateofmaturewheatembryo
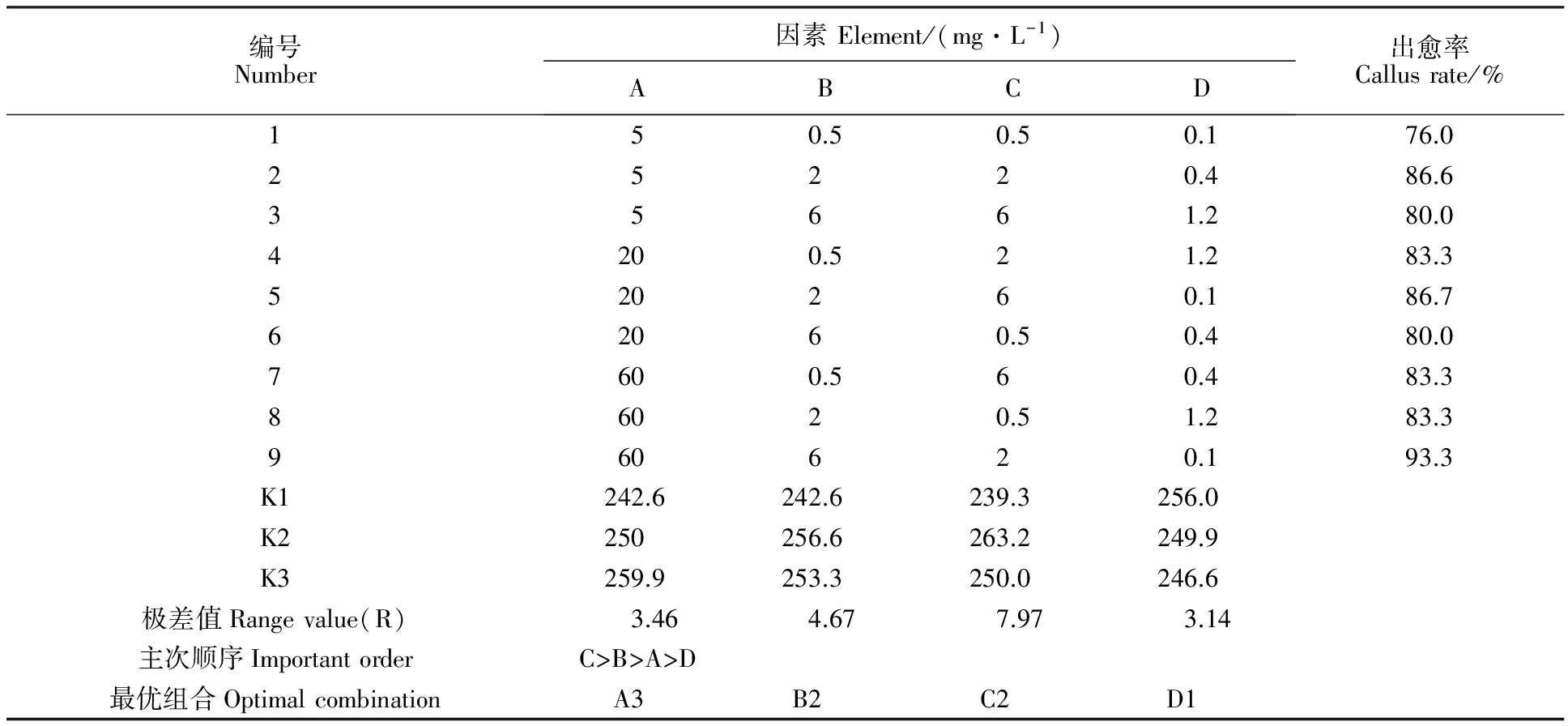
编号Number因素Element/(mg·L-1)ABCD出愈率Callusrate/%150.50.50.176.025220.486.635661.280.04200.521.283.3520260.186.762060.50.480.07600.560.483.386020.51.283.3960620.193.3K1242.6242.6239.3256.0K2250256.6263.2249.9K3259.9253.3250.0246.6极差值Rangevalue(R)3.464.677.973.14主次顺序ImportantorderC>B>A>D最优组合OptimalcombinationA3B2C2D1
正交实验结果如表2所示,影响出愈率的各因素极差大小顺序为C>B>A>D,即脯氨酸对出愈率影响最大,其次是天冬氨酸,甘氨酸和亮氨酸对其影响较小。但在设定范围内,各个因素的浓度变化对出愈率的影响不大。根据各因素各水平的出愈率的平均值,确定出最优的氨基酸配方组合为A3B2C2D1,即甘氨酸60.0 mg·L-1、天冬氨酸2.0 mg·L-1、脯氨酸2.0 mg·L-1和亮氨酸0.1 mg·L-1。利用该最优配方组合,小麦成熟胚的出愈率达可达97% 。图2显示了利用最优配方组合(图2A)和利用AaCS(图2B)培养14 d 的小麦成熟胚出愈情况,可以明显地看出,利用本实验优化后的配方组合出愈率更高,愈伤组织长势也更好。

A:利用最优配方组合培养结果;B:利用AaCS培养结果。
A: Results of culture with optimal combination,B: Results of culture with AaCS.
图2培养14d后的愈伤组织
Fig.2Callusesofembryoculturedfor14days
3 讨 论
小麦种子消毒的研究不仅在小麦成熟胚愈伤组织诱导培养中有重要应用,而且在以小麦种子为基础的未成熟胚研究和以幼苗等不同部位为外植体的其他研究中也有广泛的应用。传统的灭菌是利用100%酒精、10%双氧水或0.1%升汞处理种子[13,17],通过长时间的浸泡达到对种子表皮灭菌的目的。氯化汞作为最常用的消毒剂,杀菌能力最强,但它却是一种剧毒物质,极易进入人体,对眼睛有刺激性,是可疑致癌物。同时,汞污染是一个带有地方性后果的全球性问题。从实验人员安全和环境安全的角度考虑,在小麦种子灭菌的过程中应尽量避免或不使用氯化汞。双氧水杀菌力强,性质不稳定,不易残毒,是使用较多的杀菌剂之一,而且浸泡时间与小麦愈伤组织的诱导率呈微弱的正相关。因此本实验采用相对于100%酒精具有更好的灭菌效果的75%酒精和30%双氧水浸泡小麦种子,大大降低了浸泡时间,减少了对种子的潜在损伤,达到了更好的灭菌效果。
氨基酸在植物信号应激反应和二次代谢中具有重要的作用,不仅为植物生长发育提供能源或呼吸底物,还能提供合成其他氨基酸的前体物质,增强植物抗逆性,提高植物渗透压调节能力,有助于组织持水,维持植物高效的生理反应作用,减弱脱落酸的效应,促进植物生长[21]。本研究通过氨基酸筛选实验发现甘氨酸、天冬氨酸、脯氨酸和亮氨酸是小麦成熟胚诱导的必须氨基酸。
甘氨酸是唯一能够同时增加过氧化物酶和苯丙氨酸氨裂解酶活性的氨基酸,能够参与产生乙醛酸盐,减少植物中H2O2含量从而降低脂质过氧化,并且乙醛酸产生的NADPH和ATP能量分子将用于各种代谢过程[22]。同时,甘氨酸也可以增加植物对磷钾元素的吸收,增强植物抗逆性。而天冬氨酸是高等植物中赖氨酸、苏氨酸、甲硫氨酸和异亮氨酸的共同前体,处于转氨基作用的中心地位,是植物中氮的运输和储存的关键化合物;此外,在潜在的竞争反应中天冬氨酸也可能转化为天冬酰胺[23]。甘氨酸和天冬氨酸以及脱氨后形成的有机酸是重要的中间产物,转化途径多,代谢活跃,需要在植物体内高浓度积累[21],在愈伤组织诱导早期大量添加甘氨酸和天冬氨酸具有重要意义。而脯氨酸能够促进植物组织的生长[11],它的生物合成独立于多胺调节和γ- 氨基丁酸生物合成[24],是水溶性最好的氨基酸,具有易于水合的趋势或具有较强的水合能力,有助于细胞或组织持水,维持渗透压和生物活性,对于除去胚乳的小麦胚,其持水能力是发育的巨大难题。由此可见,添加脯氨酸在小麦胚发育早期的必要性。亮氨酸是植物生长促进剂,而且富含亮氨酸的重复受体样激酶(LRR-RLKs)在植物生长发育及应激反应中起重要作用,拟南芥中PnLRR-RLK27的异源表达提高了种子萌发和早期根生长过程中对盐、脱落酸及氧化菌的耐受性,增强活性氧清除剂的活性并降低丙二醛和活性氧的水平[25],降低活性氧对幼嫩组织的毒害作用。
正交实验结果表明,4种氨基酸的浓度对小麦成熟胚的出愈率影响不大。这可能是因为通过各种氨基转换途径,氨基酸发生相互转化[12],所以自身的解释力被其他控制变量稀释,出现差异不显著的现象,但具体原因还需要进一步深入研究。
参考文献:
[1] SABETTA W,CROSATTI C,SOLTSZ A,etal.Screening auxin response,invitroculture aptitude and susceptibility toAgrobacterium-mediated transformation of italian commercial durum wheat varieties [J].Molecules,2016,21(11):1440.
[2]HIEI Y,OHTA S,KOMARI T,etal.Efficient transformation of rice(OryzasativaL.) mediated byAgrobacteriumand sequence analysis of the boundaries of the T-DNA[J].ThePlantJournal,1994,6(2):271.
[3]ISHIDA Y,SAITO H,OHTA S,etal.High efficiency transformation of maize(ZeamaysL.) mediated byAgrobacteriumtumefaciens[J].NatureBiotechnology,1996,14(6):745.
[4] SINGH R K,PRASAD M.Advances inAgrobacteriumtumefaciens-mediated genetic transformation of graminaceous crops [J].Protoplasma,2016,253(3):691.
[5] CHAUHAN H,DESAI S A,KHURANA P.Comparative analysis of the differential regeneration response of various genotypes ofTriticumaestivum,TriticumdurumandTriticumdicoccum[J].PlantCell,TissueandOrganCulture,2007,91(3):191.
[6] DING L,LI S,GAO J,etal.Optimization ofAgrobacterium-mediated transformation conditions in mature embryos of elite wheat [J].MolecularBiologyReports,2009,36(1):29.
[7] REPELLIN A,BÅGA M,JAUHAR P P,etal.Genetic enrichment of cereal crops via alien gene transfer:New challenges [J].PlantCell,TissueandOrganCulture,2001,64(2-3):159.
[8] AZEVEDO R A,ARRUDA P,TURNER W L,etal.The biosynthesis and metabolism of the aspartate derived amino acids in higher plants[J].Phytochemistry,1997,46(3):395.
[9] AZEVEDO R A,LEA P J.Lysine metabolism in higher plants [J].AminoAcids,2001,20(3):261.
[10] 莫良玉,吴良欢,陶勤南.高等植物GS/GOGAT循环研究进展[J].植物营养与肥料学报,2001,7(2):223.
MO L Y,WU L H,TAO Q N.Research advances on GS/GOGAT cycle in higher plants [J].PlantNutritionandFertilizerScience,2001,7(2):223.
[11] 陈克贵,朱庆麟.脯氨酸在小麦愈伤组织培养中的作用初探[J].植物科学学报,1993,11(1):67.
CHEN K G,WU Q L.Preparation of proline in wheat callus culture [J].ChineseJournalofPlantScience,1993,11(1):67.
[12] 张夫道,孙 羲.氨基酸对水稻营养作用的研究[J].中国农业科学,1984,17(5):61.
ZHANG F D,SUN X.Studies on the nutritional effects of amino acids on rice [J].ChinesAgriculturalSciences,1984,17(5):61.
[13] DING L,LI S,GAO J,etal.Optimization ofAgrobacterium-mediated transformation conditions in mature embryos of elite wheat [J].MolecularBiologyReports,2009,36(1):29.
[14] HIEI Y,ISHIDA Y,KOMARI T.Progress of cereal transformation technology mediated byAgrobacteriumtumefaciens[J].FrontiersinPlantScience,2014,5:1.
[15] PARMAR S S,SAINGER M,CHAUDHARY D,etal.Plant regeneration from mature embryo of commercial Indian bread wheat(TriticumaestivumL.) cultivars [J].PhysiologyandMolecularBiologyofPlants,2012,18(2):177.
[16] SABETTA W,CROSATTI C,SOLTSZ A,etal.Screening auxin response,in vitro culture aptitude and susceptibility toAgrobacterium-mediated transformation of italian commercial durum wheat varieties[J].Molecules,2016,21(11):1440.
[17] SHAH M M,KHALID Q,KHAN U W,etal.Variation in genotypic responses and biochemical analysis of callus induction in cultivated wheat [J].GeneticsandMolecularResearch,2009,8(3):783.
[18] BELLUCCI M,DE MARCHIS F,FERRADINI N,etal.A mutant synechococcus gene encoding glutamate 1-semialdehyde aminotransferase confers gabaculine resistance when expressed in tobacco plastids [J].PlantCellReports,2015,34(12):2127.
[19] MEDVECK E,HARWOOD W A.Wheat(TriticumaestivumL.) transformation using mature embryos [J].AgrobacteriumProtocols,2015,1:199.
[20] ISHIDA Y,TSUNASHIMA M,HIEI Y,KOMARI T.Wheat(TriticumaestivumL.) transformation using immature embryos [J].AgrobacteriumProtocols,2015,1:189.
[21] 杨 靖,孙海燕,李友勇.11 种非必需氨基酸对离体植物生长的胁迫作用[J].生物技术,2008,18(4):72.
YANG J,SUN H Y,LI Y Y.Stress on the growth of plants in vitro of non-essential amino acids [J].Biotechnology,2008,18(4):72.
[22] TEIXEIRA W F,FAGAN E B,SOARES L H,etal.Foliar and seed application of amino acids affects the antioxidant metabolism of the soybean crop [J].FrontiersinPlantScience,2017,8(327):1.
[23] AZEVEDO R A,LANCIEN M,LEA P J.The aspartic acid metabolic pathway,an exciting and essential pathway in plants [J].AminoAcids,2006,30(2):143.
[24] MAJUMDAR R,BARCHI B,TURLAPATI S A,etal.Glutamate,ornithine,arginine,proline,and polyamine metabolic interactions:the pathway is regulated at the post-transcriptional level [J].FrontiersinPlantScience,2016,7(78):1.
[25] WANG J,LIU S,LI C,etal.PnLRR-RLK27,a novel leucine-rich repeats receptor-like protein kinase from the Antarctic moss Pohlia nutans,positively regulates salinity and oxidation-stress tolerance[J/OL].PloSONE,2017,12(2):e0172869.
