副溶血弧菌与Hela细胞表面蛋白结合相关外膜蛋白的筛选和鉴定
2018-05-07王婧婷李卓昱袁增智孙金生
王婧婷 ,陈 萌 ,李卓昱 ,袁增智 ,孙金生
(1.天津师范大学 生命科学学院,天津 300387;2.天津师范大学 天津市动植物抗性重点实验室,天津 300387)
副溶血弧菌是一种嗜盐性革兰氏阴性短杆菌,除了能够感染海水甲壳类、贝类以及鱼类等水生动物以外,其引发的人类胃肠炎已成为世界范围内重要的公共卫生问题之一[1-2].
革兰氏阴性菌的外膜由蛋白、糖和脂质构成,在细菌与宿主的相互关系中发挥着重要作用.外膜蛋白约占外膜全部成分的1/2,其数量和种类随着菌种和培养条件的不同而有所差异[3].外膜蛋白作为外膜的主要组分,在细菌的生命活动中具有重要的生理功能.如富含β折叠结构的外膜蛋白A(OmpA),不但维持着外膜的完整性,而且还是不同噬菌体的受体[4].微孔蛋白(OmpC)以非共价键与肽聚糖紧密结合,形成了相对非特异性的通道,在对外界营养物质摄取、代谢物质运输、物质合成方面起着重要作用.脂蛋白(Lpp)是含量最丰富的结构蛋白,具有稳定细菌外膜-肽聚糖复合体的功能[5].另外,某些病原菌外膜蛋白还具有黏附素的作用,有助于病原菌对宿主细胞的黏附[6-7].
由于病原菌的黏附作用与其致病性密切相关,因此探究VP外膜蛋白在菌体对宿主细胞进行侵染过程中的作用有助于阐明VP的致病机制[8].本研究通过VP外膜蛋白与Hela细胞表面蛋白的互作实验,筛选出可与宿主细胞表面蛋白互作的一类VP外膜蛋白,研究其与宿主细胞的黏附作用,为进一步探究VP与宿主细胞的黏附作用机制提供理论基础.
1 材料与方法
1.1 材料
副溶血弧菌NY-172菌株,天津市水生动物疫病预防控制中心;大肠杆菌DH5α、BL21(DE3)菌株、Hela细胞株、pET-28a、pET-32M质粒,本实验室保存.
1.2 主要仪器与试剂
1.2.1 仪器
C1000 Touch PCR仪、GDS-8000凝胶成像仪、蛋白质电泳槽、核酸蛋白检测仪,美国Bio-Rad公司.
1.2.2 试剂
Sal I和Xho I限制性内切酶,美国Takara公司;镍柱,生工生物工程(上海)股份有限公司;DMEM培养基、胎牛血清、青霉素链霉素双抗、胰酶,美国Thermo Fisher Scientific公司;同源同组试剂盒,南京诺唯赞生物科技有限公司;多聚组氨酸标签单抗、HRP-标记羊抗鼠IgG、异硫氰酸荧光素(FITC)标记的羊抗鼠二抗,天津三箭生物技术有限公司.
1.3 方法
1.3.1 Hela细胞表面蛋白的生物素化(biotin)标记
将在细胞瓶中长至单层的Hela细胞去除培养基,用PBS缓冲液清洗3次,加入预冷的PBS缓冲液,将细胞从瓶上轻轻刮下,置入15mL离心管中,离心收集细胞.用预冷的PBS缓冲液清洗细胞3次,洗后用PBS缓冲液细胞重悬至2.5×107mL-1.加入浓度为2 mmol/L的NHS-PEG4-biotin试剂,4℃孵育30 min.用PBS缓冲液清洗细胞3次,加入终浓度为100 mmol/L的甘氨酸终止液,于4℃颠倒混合15 min,终止后用PBS缓冲液离心清洗3次.取出1份细胞按体积比1∶250的比例加入FITC-Avidin试剂,于37℃孵育30 min,反应结束后用PBS缓冲液洗涤3次,在荧光显微镜下观察荧光并拍照保存.剩余细胞加入适量裂解液重悬,4℃下裂解30 min,之后4℃下以12 000 r/min的速率离心30 min,取上清液保存于-80℃.
1.3.2 与细胞表面蛋白结合相关的外膜蛋白的筛选
取2个自旋柱,用PBS缓冲液离心清洗,分别加入中性卵白素树脂,4℃下500 r/min离心1 min.PBS缓冲液离心清洗树脂3次,将含生物素化表面蛋白的Hela细胞蛋白样品加入其中一个自旋柱,另一个自旋柱作为阴性对照加入PBS缓冲液,于室温下颠倒混合15 min,多次上样,每次上样结束后于4℃下500 r/min离心1 min.之后用PBS缓冲液离心清洗树脂1次,分别加入体积分数为0.02%的生物素封闭液封闭未结合蛋白的树脂,于室温下孵育15 min.孵育后离心除去封闭液,用PBS缓冲液离心清洗树脂3次,在自旋柱中加入使用PMSF法提取的副溶血弧菌的外膜蛋白[9],可多次重复上样,每次上样时于4℃下颠倒混合1 h.上样结束后离心除去样品,并用洗涤液离心清洗树脂5次,最后用刚好没过树脂的洗脱液于室温下孵育5 min,孵育后于4℃下500 r/min离心1 min,收集洗脱物.将洗脱物进行SDS-PAGE凝胶电泳分析并送至上海中科新生命公司进行蛋白质谱鉴定.
1.3.3 基因克隆、重组表达与纯化
分析质谱鉴定结果,从NCBI获取VP的Peptidase、PLP(PirA Like Protein)、OmpW、OmpN、Chaperonin 等基因序列,经THMHH以及SignalP 4.1在线预测跨膜区及信号肽.去除基因序列上的跨膜区、信号肽及终止密码子后,设计引物,并在上、下游引物前分别添加一段15 bp左右的载体序列作为同源重组序列,设计的上、下游引物如表1所示.选取已报道的VP黏附因子——VpadF作为后续黏附因子鉴定时的阳性对照.
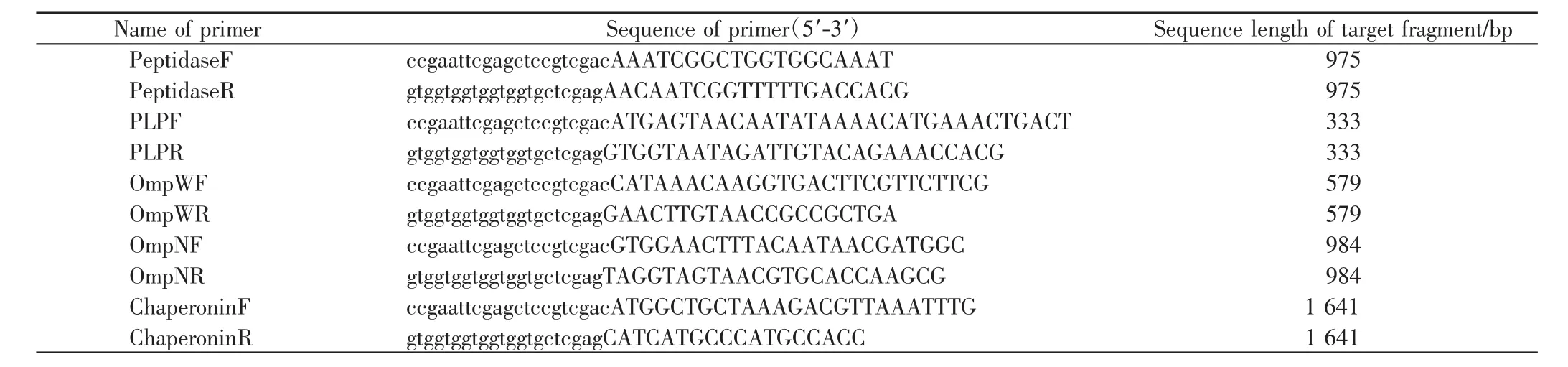
表1 引物序列Tab.1 Sequence of PCR primers
提取VP NY-172菌株基因组作为模板,使用表1中的引物分别扩增出以上蛋白的编码序列,纯化后使用同源重组连接试剂盒将其与线性化的载体PET-28a或PET-32M进行同源重组,得到PET-28a-Peptidase、PET-32M-OmpW、PET-32M-OmpN、PET-32M-PLP、PET-32M-Chaperonin重组质粒,经过菌落PCR验证正确后,送样测序.
挑选测序结果正确的克隆,将这些原核表达载体分别转入BL21(DE3)感受态细胞,对其进行小量诱导表达,参照杜欣军等[10]的方法对各个表达菌的表达条件进行优化,通过SDS-PAGE凝胶电泳确定各个重组蛋白的最佳诱导条件,之后进行大量表达并使用镍柱进行亲和纯化.对上清液中表达的蛋白进行纯化,之后通过透析将其缓冲液置换为PBS缓冲液;对包涵体中表达的重组蛋白则采取尿素梯度复性法进行复性,于PBS缓冲液中进行透析.
1.3.4 Western Blot验证重组蛋白
取5 μg纯化的重组蛋白进行SDS-PAGE凝胶电泳,电泳结束后用转膜仪将蛋白由PAGE胶转印至PVDF膜.转膜结束后,用去离子水洗去SDS,使用TBST缓冲液振荡洗涤PVDF膜3次,每次5 min.使用质量分数为5%的脱脂奶粉TBST缓冲液作为封闭液,于4℃下封闭过夜.封闭后,用TBST缓冲液振荡洗涤3次,每次5 min,清洗后将PVDF膜与多聚组氨酸标签单抗(稀释比例为1∶1 000)于室温下孵育2 h.孵育后用TBST缓冲液振荡洗涤PVDF膜3次,每次5min,洗后将PVDF膜与HRP-标记羊抗鼠IgG(稀释比例为1∶5 000)于室温下孵育2 h.孵育后使用TBST缓冲液振荡洗涤PVDF膜5次,每次10 min.在避光条件下加入新配置的HRP-底物显色试剂,反应10 min,显色完成后,使用去离子水冲洗PVDF膜以终止反应,扫描拍照.
1.3.5 间接免疫荧光分析
在12孔板中加入细胞爬片进行Hela细胞培养,当细胞生长密度约为80%时用PBS缓冲液清洗细胞3次,再向各孔分别加入100 μg重组蛋白或牛血清白蛋白(BSA),37℃下孵育1 h,加入PBS缓冲液的孔作为空白对照.孵育完成后每孔加入1mL体积分数为4%的多聚甲醛固定15 min,固定后用PBS缓冲液清洗细胞3次,向各孔中加入1 mL多聚组氨酸标签单抗(稀释比例为1∶500),37℃下孵育30 min.PBS缓冲液清洗3次,将异硫氰酸荧光素(稀释比例为1∶1000)标记的羊抗鼠二抗加入细胞孔中,37℃下避光孵育30 min.在避光条件下,用PBS缓冲液清洗细胞5次,使用荧光显微镜观察细胞表面的荧光,拍照保存.
2 结果与分析
2.1 Hela细胞表面蛋白的生物素化标记
由于Avidin可特异性结合biotin,为证明Hela细胞的表面蛋白已被成功地生物素化,将FITC-Avidin试剂与生物素化后的细胞进行孵育,并用FITC-Avidin试剂同样处理未生物素化的Hela细胞作为对照组,观察细胞表面荧光,结果如图1所示.通过与对照组对比,证实Hela细胞的表面蛋白已经被成功地生物素化,可以进行Hela细胞蛋白的提取.

图1 FITC-Avidin标记生物素化的Hela细胞Fig.1 Detection of biotinylated Hela cells by FITC-Avidin
2.2 VP与Hela细胞表面蛋白结合外膜蛋白的筛选
提取VP的外膜蛋白后,将生物素化修饰的Hela细胞的表面蛋白结合于中性卵白素树脂上,作为诱饵蛋白垂钓VP外膜蛋白,洗脱物进行SDS-PAGE凝胶电泳,结果发现,其中的蛋白分子质量主要在50~100 ku之间,如图2所示.

图2 SDS-PAGE分析洗脱蛋白Fig.2 Representative SDS-PAGE analysis of the eluted protein
对洗脱物进行质谱鉴定,共得到5个与Hela细胞表面蛋白黏附相关的VP外膜蛋白,质谱峰如图3所示.
对5种蛋白的生物信息学分析结果如表2所示,这5种蛋白均为胞外蛋白,且OmpW和OmpN均在其他革兰氏阴性菌中起到黏附宿主相关的作用.
2.3 重组蛋白的基因克隆、纯化及Western Blot检测
利用SDS-PAGE凝胶电泳检测纯化后的重组蛋白,结果如图4(a)所示,重组蛋白的条带较单一,杂蛋白含量较少,说明各个重组蛋白纯化成功.对重组蛋白进行Western Blot验证,结果如图4(b)所示,每种蛋白均与多聚组氨酸标签抗体有较强的结合,但重组蛋白Chaperonin结合条带的相对分子质量约为非重组蛋白相对分子质量的1/2,猜测Chaperonin蛋白可能发生了降解或解聚.
2.4 间接免疫荧光分析结果
为进一步验证各候选蛋白的作用,利用间接免疫荧光实验检测重组蛋白黏附Hela细胞的能力,结果如图5所示.
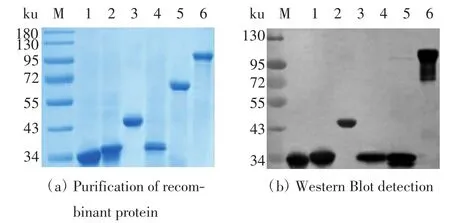
图4 各重组蛋白的纯化与检测Fig.4 Representative SDS-PAGE analysis of purified recombinant proteins and Western Blot assay
由图5可以看出,与阳性对照组VpadF结果相比,OmpW、OmpN、Peptidase、PLP、Chaperonin 组在Hela细胞表面的荧光更明显,说明这5种重组蛋白均能与宿主细胞相结合.比较5种蛋白的细胞结合能力发现,OmpW、Chaperonin、Peptidase组的荧光强度均较强,表明这3种蛋白与Hela细胞的黏附作用很强,更可能为副溶血弧菌的潜在黏附因子;OmpN的荧光强度次之;PLP组的荧光强度最弱,即PLP与Hela细胞的黏附作用也最弱.

图5 间接免疫荧光验证各重组蛋白与Hela细胞间的相互作用Fig.5 Confirmation of the interaction between recombinant proteins and Hela cells by indirect immune-fluorescence assays
3 讨论与结论
黏附作用对病原菌入侵宿主细胞具有重要意义[11],外膜蛋白是革兰氏阴性菌黏附因子的重要来源.本研究首次将生物素化的Hela细胞表面蛋白作为互作垂钓诱饵,通过亲和层析的方法大规模垂钓并筛选鉴定副溶血弧菌可与宿主发生黏附的外膜蛋白,为规模化筛选鉴定副溶血弧菌的黏附因子奠定基础.最终筛选出了5种可黏附Hela细胞表面蛋白的副溶血弧菌外膜蛋白,并对这些可能的黏附因子进行功能验证.通过间接免疫荧光实验,发现OmpW、OmpN、Peptidase、PLP、Chaperonin重组蛋白均可结合于Hela细胞的表面,说明这些蛋白均可能是VP黏附宿主细胞过程中重要的黏附素.Peptidase是相对分子质量约为45×103的肽酶,在蜡样芽胞杆菌中发现其细胞壁中的Peptidase FM是一种黏附素,并对细胞具有一定的毒性[12].OmpW是一种常见的革兰氏阴性菌外膜通道蛋白,在多种致病菌侵染宿主的过程中发挥重要作用.如霍乱弧菌的OmpW是一种黏附相关因子,与霍乱弧菌的侵袭力和毒力有关[13].在VP中,OmpW既是外膜通道蛋白,也是免疫原性蛋白.OmpN是一种外膜微孔蛋白,鮰爱德华氏菌的OmpN可与其免疫血清发生免疫反应,说明OmpN在鮰爱德华氏菌侵染宿主的过程中起到了重要作用[14].Chaperonin蛋白与大肠杆菌的GroEL蛋白具有较高同源性,位于菌体表面的GroEL蛋白有利于大肠杆菌黏附宿主的巨噬细胞,而表面具有GroEL的大肠杆菌也会导致小鼠更容易受到侵染并引起严重的腹膜炎[15].PLP是一种类似于PirA毒素的蛋白,荧光发光杆菌中的PirA毒素对多种昆虫均具有口服杀虫的活性,是该细菌一种重要的毒素蛋白[16],因此PLP可能作为毒素蛋白通过黏附宿主的表面再发挥其毒素作用,其是否具有黏附因子的作用有待进一步研究.
综上所述,本研究从VP中筛选并鉴定出了外膜蛋白 OmpW、OmpN、Peptidase、PLP、Chaperonin,是 VP菌潜在的黏附因子.该结果有助于进一步探索副溶血弧菌的致病机制,为后续预防与治疗副溶血弧菌的感染奠定实验基础.
参考文献:
[1]HARA-KUDO Y,KUMAGAI S.Impact of seafood regulations for Vibrio parahaemolyticus infection and verification by analyses of seafood contamination and infection[J].Epidemiology and Infection,2014,142(11):2237-2247.
[2]CECCARELLI D,HASANNA,HUQ A,et al.Distribution and dynamics of epidemic and pandemic Vibrio parahaemolyticus virulence factors[J].Frontiers in Cellular and Infection Microbiology,2013,3:97-106
[3] 陆盼盼,郭松林,关瑞章,等.致病性弧菌外膜蛋白及其免疫原性研究进展[J].生物技术通报,2014,30(4):30-35.LU P P,GUO S L,GUAN R Z,et al.Review on the immunogenicity of pathogenic Vibrio outer membrane protein[J].Biotechnology Bulletin,2014,30(4):30-35(in Chinese).
[4]KHALID S,BOND P J,CARPENTER T,et al.OmpA:Gating and dynamics via molecular dynamics simulations[J].Biochimica et Biophysica Acta,2007,1778(9):1871-1880.
[5] NGUYEN M T,GÕTZ F.Lipoproteins of gram-positive bacteria:Key players in the immune response and virulence[J].Microbiology and Molecular Biology Reviews,2016,80(3):891-903.
[6] LITWIN C M,BYRNE B L.Cloning and characterization of an outer membrane protein of Vibrio vulnificus required for heme utilization:Regulation of expression and determination of the gene sequence[J].Infection&Immunity,1998,66(7):3134-3141.
[7] AECKERSBERG F,LUPP C,FELICIANO B,et al.Vibrio fischeri outer membrane protein OmpU plays a role in normal symbiotic colonization[J].Journal of Bacteriology,2001,183(22):6590-6597.
[8]GHENEM L,ELHADI N,ALZAHRANI FAISAL,et al.Vibrio parahaemolyticus:A review on distribution,pathogenesis,virulence determinants and epidemiology[J].Saudi Journal of Medicine and Medical Sciences,2017,5(2):93-103.
[9] 阎斌伦,张晓君,秦国民,等.4种病原弧菌外膜蛋白的提取及抗原性初步分析[J].海洋科学,2012,36(5):71-74.YAN B L,ZHANG X J,QIN G M,et al.Isolation and antigenicity analysis of outer membrane proteins from 4 Pathogenic vibrio sp.[J].Marine Sciences,2012,36(5):71-74(in Chinese).
[10]杜欣军,王学连,李萍,等.金黄色葡萄球菌表面蛋白SdrD的原核表达及抗体制备[J].动物医学进展,2015,36(3):1-5.DU X J,WANG X L,LI P,et al.Prokaryotic expression and antibody preparation of SdrD surface protein of staphylococus aureus[J].Progress in Veterinary Medicine,2015,36(3):1-5(in Chinese).
[11]杨振泉,焦新安.副溶血弧菌毒力因子及其致病机理研究进展[J].中国人兽共患病学报,2008,24(11):1070-1073.YANG Z Q,JIAO X A.Advances of study on infection mechanism and virulence factor of Vibrio parahaemolyticus[J].Chinese Journal of Zoonoses,2008,24(11):1070-1073(in Chinese).
[12]TRAN S L,GUILLEMET E,GOHAR M,et al.Cwpfm (entfm)is a Bacillus cereus potential cell wall peptidase implicated in adhesion,biofilm formation,and virulence[J].Journal of Bacteriology,2010,192(10):2638-2642.
[13]李建华.霍乱弧菌外膜蛋白W的原核表达及抗原性分析[J].军事医学,2011,35(10):30-32.LI J H.Expression of Vibrio cholerae outer membrane protein W and identification of its antigenicity[J].Military Medicine Science,2011,35(10):30-32(in Chinese).
[14]潘延乐.鮰爱德华氏菌ompN基因的克隆及其原核表达产物对斑点叉尾鮰的保护效果评价[D].雅安:四川农业大学,2015.PAN Y L.Study on Cloning and Protective Efficacy of Recombinant Outer Membrane Protein N m(rOmpN)-based Vaccine of Edwarsiella ictaluri[D].Yaan:Sichuan Agricultural University,2015(in Chinese).
[15]ZHU H Y,LEE C Y,ZHANG D M,et al.Surface-associated GroEL facilitates the adhesion of Escherichia coli to macrophages through lectinlikeoxidizedlow-densitylipoproteinreceptor-1[J].Microbes&Infection,2013,15(3):172-180.
[16]孙建宇.荧光发光杆菌TT01菌株pirAB基因的克隆表达及杀虫谱研究[D].广州:中山大学,2012.SUN J Y.Cloning,Expression and Insecticidal Spectrum Analysis of the pirAB Gene from Photorhabdus luminescens TT01[D].Guangzhou:Sun Yat-Sen University,2012(in Chinese).
