高铁酸钾氧化-絮凝处理苯酚废水过程中pH值的变化
2018-05-07贾世超崔建国
贾世超,崔建国
(1.太原理工大学环境科学与工程学院,太原 030024;2.山西省市政工程研究生教育创新中心,太原 030024 )
近年来,随着石化、印染、农药等行业的发展使得含酚类化合物的污废水大量排入河道,常造成严重的突发性有机污染[1],而酚类化合物对人体具有致癌、致畸、致突变的潜在毒性[2,3],因此寻找新型高效处理酚类污染物的绿色药剂已迫在眉睫。过去的研究表明,高铁酸钾是一种环境友好型高效水处理剂,集氧化、消毒、助凝于一身,具有安全、高效、pH值使用范围广和方便简单等特点[4]。而高铁酸钾处理酚类物质近几年也是研究热点,主要表现在提高污染物去除率及联合其他药剂共同处理的工艺[5,6],但在去除过程中pH值变化、机理分析及pH值达标排放等方面鲜有研究。苯酚废水为弱酸性溶液[7],高铁酸钾溶液为强氧化性碱性溶液。高铁酸钾处理苯酚废水的过程中,酸性条件下氧化段处理效果较好,碱性条件下絮凝段处理效果较好,在较好地处理效果下苯酚最终被转化为羧酸类物质,因此整个过程中产物的变化情况、处理效果的彻底性也可通过高铁酸钾处理苯酚废水各阶段溶液的pH值变化充分体现出来。
因此本文拟选苯酚作为模拟废水的污染物,以高铁酸钾为处理药剂,通过改变去除条件,研究高铁酸钾处理苯酚废水的氧化-絮凝过程中初始快速反应、氧化反应及絮凝反应后最终滤液pH值的变化,从而研究pH值的变化对苯酚处理效果的指示作用。
1 材料与方法
1.1 试剂与仪器
主要试剂:无水苯酚、无水亚硫酸钠、盐酸和氢氧化钠、高铁酸钾(质量分数为92%)等药品均为分析纯,甲醇、乙腈为色谱纯,所需溶液均由Millipiore Milli-Q超纯水系统配制。
主要仪器:LC-100液相色谱仪(λ=280 nm,流动相V乙腈∶V水=25∶75,流速0.8 mL/min),色谱柱(5 μm×4.6 mm×150 mm);TG328B光学分析天平;DHG-9070B智能型电热恒温鼓风干燥箱;FE28 pH计;HJ-6A 六联数显控温磁力搅拌器;SC-390冰箱;JY 0002电子天平等。
1.2 原水水质
参照GB 8978-1996污水综合排放标准-三级标准[8],模拟突发情况配置成pH值为8~10,苯酚浓度为15 mg/L的原水,处理后的水质达GB 3838-2002地表水Ⅴ类标准[9],可做景观用水。
1.3 实验方法
整个实验分成氧化和絮凝两个过程(以亚硫酸钠溶液完成氧化淬灭反应),分别考查改变高铁酸钾投加量、原水pH值、温度、氧化时间、氧化段搅拌速度、絮凝时间、絮凝段搅拌速度对高铁酸钾与原水初始快速反应1 min、氧化反应、絮凝反应后最终滤液中pH值,滤液所含苯酚和羧酸类物质的影响及其变化[10]。每个条件做3次平行实验,经检测3组实验数据标准偏差均小于5%,证明实验重复性良好。
1.4 分析方法
采用液相色谱法测定苯酚含量及滤液中羧酸类物质的含量[11,12]。
2 结果与讨论
2.1 氧化段条件对各阶段反应液pH的影响
2.1.1 高铁酸钾投加量对各阶段反应液pH的影响
分别取原水100 mL于250 mL锥形瓶中,反应温度15 ℃,pH=8,加入与苯酚质量比为5∶1~45∶1的高铁酸钾溶液,即75、150、225、300、375、450、525、600、625 mg/L,以300 r/min快速搅拌1 min,氧化30 min(120 r/min);加入灭活剂-亚硫酸钠溶液完成淬灭反应进入絮凝段30 min(60 r/min),静置沉降30 min过滤,测各阶段结束后溶液的pH值。
过去的研究表明[13,14]高铁酸钾将苯酚氧化分解至醌类物质进而最终分解至羧酸类物质,本研究检测出最终滤液剩余产物为苯酚及最终产物为草酸。
苯酚分子中羟基直接与苯环相连接,羟基中氧原子的未公用电子对所在的p轨道与苯环大π键的π电子轨道相互重叠形成p-π共轭体系。随着高铁酸钾的加入,接着氧原子的未共用电子对分散到整个共轭体系中,降低了氧原子上的电子云密度,导致氧氢键的成键电子云更偏向于氧原子,有利于氢原子电离成氢离子,苯酚溶液呈弱酸性,故如图1~图6所示在氧化反应完成后溶液的pH值整体下降。
如图1(a)所示,随着投加量的增大快速搅拌1 min后溶液的pH值在8.8~9.0之间波动变化,在150 mg/L时达到最大值;最终滤液的pH值在225 mg/L时达到最大。
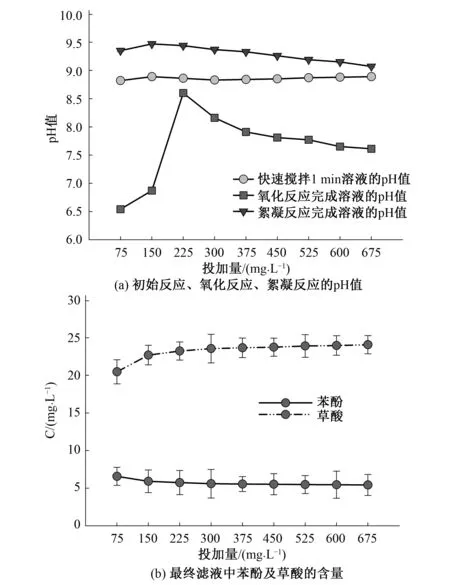
图1 不同投加量下初始反应、氧化反应、絮凝反应后溶液的pH值和最终滤液中苯酚及草酸的含量Fig.1 The pH value of initial reaction, oxidation reaction, flocculation reaction solution with different dosage, the content of phenol and oxalic acid in the final filtrate with different dosage
对比图1(b),苯酚随着高铁酸钾投加量增大至225 mg/L时达到较好去除点,之后便基本趋于平缓。高铁酸钾自身的碱性使快速搅拌1 min后溶液的pH值随其投加量(75~150 mg/L)的增加而增加,但随着投加量的增大溶液中的中间体被充分氧化成羧酸,使得溶液的pH值又下降。
高铁酸钾氧化苯酚后,高价铁降低价位产生的低价铁Fe3+、Fe2+会与溶液中OH-(水中原有的OH-及灭活剂中的OH-)结合生成Fe(OH)2、Fe(OH)3;由于该氧化反应需要在较长的时间才可完成,故随着投加量增至225 mg/L时氧化反应完成后溶液的pH值和最终滤液的pH值才因Fe(OH)2、Fe(OH)3的产量增加达到最大值,明显地表现为增大趋势;虽然越多的高铁酸钾加入会使反应溶液产生越多的Fe(OH)2、Fe(OH)3,但苯酚会随着高铁酸钾的投加量(225 mg/L后)增大,使得苯酚被氧化产生更多的中间产物(酚类、羧酸和醌类等小分子有机物)开始争夺高铁酸根[15]进而分解产生较多草酸,这些草酸与碱性物质的结合使得最终滤液的pH值逐步降低。
2.1.2 原水酸碱性对各阶段反应液pH的影响
取原水100 mL于250 mL锥形瓶中,加入225 mg/L高铁酸钾溶液(由上节可知此时达到较好的祛除效果),反应温度为15 ℃,调节pH到(2、3、4、5、6、7、8、9、10、11、12、13),先以300 r/min快速搅拌1 min,氧化30 min(150 r/min);加入灭活剂-亚硫酸钠溶液,进入絮凝段30 min(60 r/min),静置30 min过滤,测各阶段结束后溶液的pH值。
如图2(a)所示,快速搅拌1 min后溶液的pH值会随着原水pH值的增大而增大,说明此时高铁酸钾与苯酚的反应受苯酚溶液的pH值影响较大并线性增长;由于苯酚转化成羧酸,故氧化反应后溶液的pH值基本比快速搅拌1min后溶液的pH值低,但在原水pH值为5~7之间高于初始搅拌后的pH值;最终滤液的pH值虽随着原水pH值的增大而增大,但基本在8~10之间的碱性范围内变化,表明该反应最终滤液pH值基本保持在弱碱性范围。

图2 在不同原水的pH值下初始反应、氧化反应、絮凝反应后溶液的pH值和最终滤液中苯酚及草酸的含量Fig.2 The pH value of initial reaction, oxidation reaction, flocculation reaction solution with different pH values of raw water, the content of phenol and oxalic acid in the final filtrate with different pH values of raw water
原水pH值在9~13之间对最终滤液的pH值影响明显增强。结合图2(b)可知,在原水pH值为9时苯酚的去除效果最好,更表明高铁酸钾在弱碱性环境下与苯酚反应充分。
如图2(b)所示苯酚在pH为5和9时出现较好去除效果,也有较大的产酸率。高铁酸钾的氧化作用在酸性条件下发挥较好,絮凝作用在碱性条件发挥较好。而原水pH值为9时苯酚的去除效果最好,在弱碱性条件下苯酚逐步离解出酚氧根,极易与高铁酸根结合失去电子进而被氧化,此碱性条件下的OH-离子也有利于与氧化段产生的Fe3+结合更好地完成絮凝作用(吸附未被氧化的苯酚及中间产物)[13-16],但不可完全偏碱性,过之会使得高铁酸钾在氧化段无法充分发挥氧化作用。且由图2(a)可知pH=9时,恰好是最终滤液pH值刚开始低于快速反应1 min后的pH值,对比图2(b)在pH=9时产酸量最大,进一步说明在pH=9时进行了较充分的氧化反应产生较多的草酸,使得最终滤液的pH值呈现上升减缓的趋势。
2.1.3 温度对各阶段反应液pH的影响
取原水100 mL于250 mL烧杯中, pH=9,加入225 mg/L高铁酸钾溶液,温度为0、5、10、15、20、25、30、35、40、45 ℃,先以300 r/min快速搅拌1 min氧化30 min(120 r/min);加入灭活剂-亚硫酸钠溶液,进入絮凝段30 min(60 r/min),静置30 min后过滤,测各阶段结束后溶液中的pH值。
如图3(a)所示,0~5 ℃时3个阶段溶液的pH值基本保持原溶液的pH值,说明在温度较低的情况下苯酚分子与高铁酸钾分子的活化性被低温封闭,结合度较少,苯酚被转化成中间体较少,产酸也较少,在低温下各分子间的反应速度较慢。大于5 ℃后快速搅拌1 min溶液的pH值随着温度的增大而增大,在30 ℃达到最高点,氧化反应的pH值随温度的升高逐渐降低,温度的升高有利于氧化段产酸。而絮凝后最终滤液的pH值整体变化不明显,但在30 ℃达到最大,结合图3(b),30 ℃时苯酚出现最好的去处效果,且产酸率较多,说明随着反应时间的延长30 ℃时高铁酸钾与苯酚结合较好且充分反应产生较多的草酸;过氧化物的氧化反应为放热反应,高铁酸钾为过氧化物,随温度的升高溶解度增大[17],随着温度上升,逐步对放热反应起到了抑制作用,溶液中微颗粒间运动速度加快,不利于高铁酸钾与苯酚及其中间体结合,且较高的温度使高铁酸钾更容易遇水变质,溶解度增大,产生较多的KOH、Fe(OH)3,进而导致pH值仍接近原溶液pH值。
4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑
(1)

图3 不同温度下初始反应、氧化反应、絮凝反应后溶液的pH值和最终滤液中苯酚及草酸的含量Fig.3 The pH value of initial reaction, oxidation reaction, flocculation reaction solution with different temperatures, the content of phenol and oxalic acid in the final filtrate with different temperatures
最终滤液的pH值保持在9.0~9.2左右,反应温度在10~30 ℃表现为温度越高氧化效果越好,高价铁被降低至低价铁,淬灭反应后低价铁结合OH-以无机高分子胶体态在杂质颗粒间进行黏结架桥[18]。但随着温度的升高,胶体的吸附性降低且对苯酚去除效果变差。高温下苯酚被氧化成酸的量较少,且高铁酸钾变质形成的Fe(OH)3使最终滤液pH值表现为降低的趋势。
2.1.4 氧化段搅拌速度对各阶段反应液pH的影响
取原水100 mL于250 mL烧杯中,调节pH=9,控制反应温度为30 ℃,加入225 mg/L高铁酸钾溶液,先以300 r/min快速搅拌1 min,氧化30 min分别以60、80、120、150、200、250、300 r/min搅拌;加入灭活剂-亚硫酸钠溶液,进入絮凝段30 min(60 r/min),静置30 min后过滤,测各阶段结束后溶液中的pH值。
如图4(a)所示,快速搅拌1 min后,由于高铁酸钾溶液的碱性,此时pH值基本保持稳定在10.31~10.38之间。氧化段转速在60~300 r/min之间调整时氧化反应后溶液pH值、最终滤液的pH值表现为波动变化,在60~150 r/min间逐步增加,在150~250 r/min下降,250 r/min达到最小值。如图4(b)所示,苯酚的去除效果在200 r/min时达到最佳状态。

图4 在氧化段不同搅拌速度下初始反应、氧化反应、絮凝反应后溶液的pH值和最终滤液中苯酚及草酸的含量Fig.4 The pH value of initial reaction, oxidation reaction, flocculation reaction solution with the oxidation stage at different stirring speed, the content of phenol and oxalic acid in the final filtrate with the oxidation stage at different stirring speed
此现象说明,随着氧化段转速的逐步增大高铁酸钾分子与苯酚分子的结合度在逐步增强,在150~250 r/min之间分子间的结合较好,且分解苯酚产生的中间体也逐步开始与高铁酸根结合,此时高价铁的氧化作用随机增强,产生较多的酸类,pH值下降。随着搅拌强度的继续增强在超过200 r/min后分子运动速度过快,不利于各分子间的碰撞及结合,后续反应中高价铁未能完全发挥其氧化作用,故在高速搅拌下产生较少酸类物质。
2.1.5 氧化时间对各阶段反应液pH的影响
取原水100 mL于250 mL烧杯中, pH=9,加入225 mg/L高铁酸钾溶液,控制反应温度为30 ℃,以300 r/min快速搅拌1 min,在200 r/min的搅拌速度下反应0、5、10、20、30、40、50、60 min后;加入灭活剂-亚硫酸钠溶液,进入絮凝段30 min(80 r/min),静置30 min后过滤,测各阶段结束后溶液中的pH值。
如图5(a)所示,氧化反应及最终滤液的pH值随着氧化时间的增加而降低,而图5(b)中草酸含量也在逐渐增加。说明随着氧化的时间的延续,苯酚被氧化分解逐渐增加产酸量,使得pH值降低,苯酚去除效果提高。

图5 在氧化段不同氧化时间下初始反应、氧化反应、絮凝反应后溶液的pH值和最终滤液中苯酚及草酸的含量Fig.5 The pH value of initial reaction, oxidation reaction, flocculation reaction solution with the oxidation stage under different oxidation time;The content of phenol and oxalic acid in the final filtrate with the oxidation stage under different oxidation time
结合图5(b)所示,去除效果随着时间的增加也在逐步增加,而在40 min后逐步趋于平衡。延长氧化时间有助于祛除苯酚,但5 min后去除率的增长缓慢,40 min后基本趋于平缓,说明反应前期高铁酸钾表现为将苯酚快速氧化,后期受高铁酸根的浓度影响主要表现为逐步氧化中间产物使对苯二酚、对苯醌转化为羧酸。而过长的时间不利于节能,氧化时间为40 min较为合适。而随着时间的延长,酸量的增加使得pH值的降低,酸性更有利于增强氧化反应,形成良性循环,因此延长氧化时间有利于提高去除率。
2.2 絮凝条件对各阶段反应液pH的影响
2.2.1 絮凝段搅拌速度对各阶段反应液pH的影响
取原水100 mL于250 mL烧杯中, pH=9,加入225 mg/L高铁酸钾溶液,控制反应温度为30 ℃,以300 r/min快速搅拌1 min,氧化30 min(200 r/min);加入灭活剂-亚硫酸钠溶液,进入絮凝段以0、60、80、120、150、200 r/min搅拌絮凝30 min,均静置30 min后过滤,测各阶段结束后溶液中的pH值。
如图6(a)所示,最终滤液的pH值随絮凝段搅拌速度的变化而变化,在0~50 r/min之间缓慢增加,50~80 r/min之间陡然增加,在80 r/min时pH值达到9.69,80 r/min后又逐步下降。如图6(b)所示,去除效果在80 r/min时达到最佳状态。

图6 在絮凝段不同搅拌速度下初始反应、氧化反应、絮凝反应溶液的pH值和最终滤液中苯酚及草酸的含量Fig.6 The pH value of initial reaction, oxidation reaction, flocculation reaction solution with the flocculation section at different stirring speed, the content of phenol and oxalic acid in the final filtrate with the flocculation section at different stirring speed
此现象说明,在氧化阶段完成后产生的Fe(OH)3此时开始与苯酚及中间产物结合发生絮凝作用。随着搅拌强度的逐步增强,在80~150 r/min间胶体的吸附情况较好,且此时pH值增大刚好有利于Fe(OH)3絮凝体产生并与污染物结合实现网捕絮凝[19]。随着搅拌速度逐步加快使得分子运动速度加快,但过快的运动不利于分子间的结合及絮凝胶体的产生,且会打破已结合的絮凝体,所以絮凝段在高速搅拌下絮凝效果较差。
2.2.2 絮凝时间对各阶段反应液pH的影响
取原水100 mL于250 mL烧杯中,pH=9,加入225 mg/L高铁酸钾溶液,控制反应温度为30 ℃,先以300 r/min快速搅拌1 min,氧化40 min(200 r/min);加入灭活剂-亚硫酸钠溶液,进入絮凝段,以80 r/min慢速搅拌絮凝0、10、20、30、40、50、60 min,均静置30 min后过滤,测各阶段结束后溶液中的pH值。
如图7(a)所示,最终滤液的pH值随着氧化时间的延续而降低,在40 min后趋于平缓。如图7(b)所示,苯酚去除效果随着时间的增加先增加最终趋于平缓,而在40 min后也逐步趋于平衡。
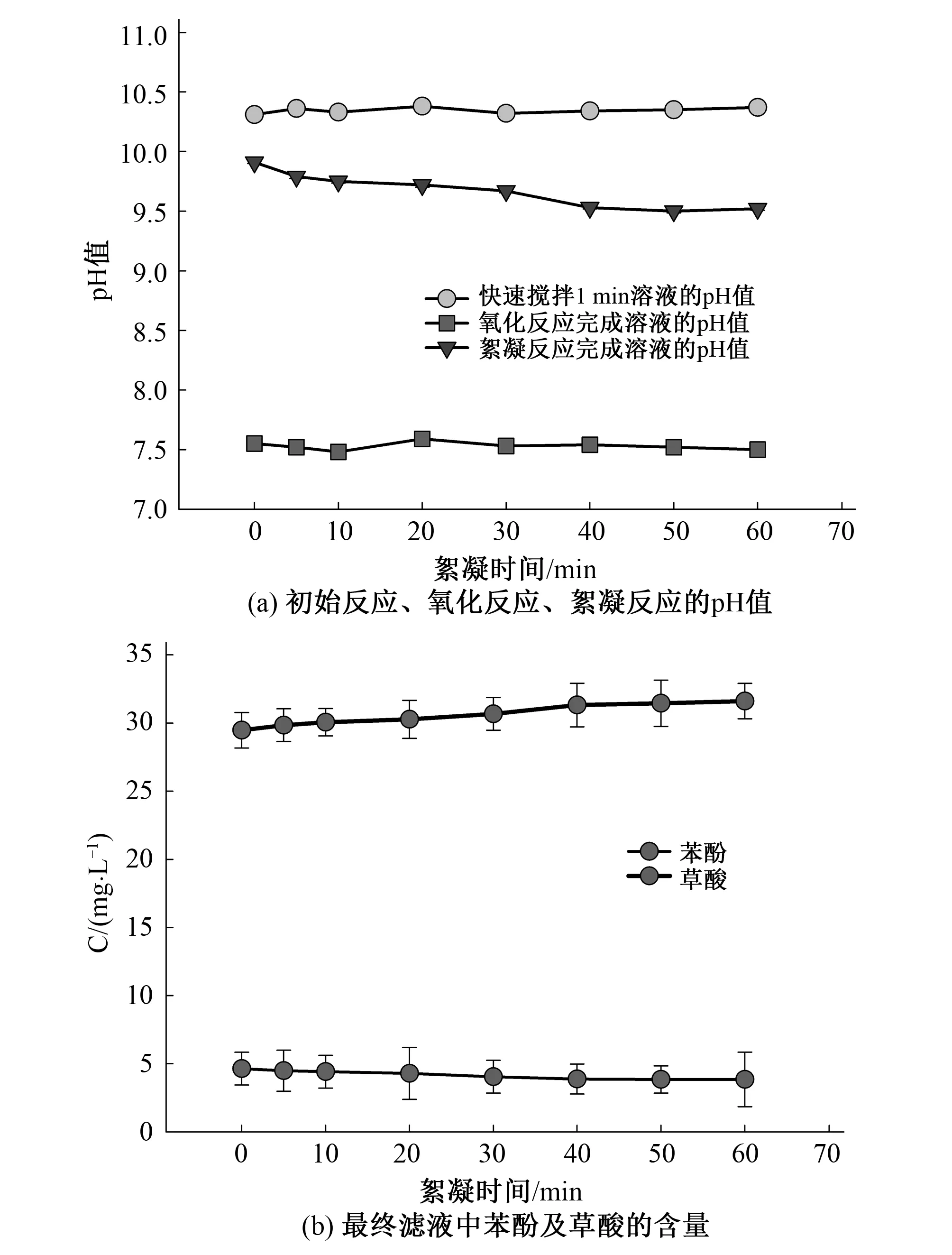
图7 在絮凝段不同絮凝时间下初始反应、氧化反应、絮凝反应后溶液的pH值和最终滤液中苯酚及草酸的含量Fig.7 The pH value of initial reaction, oxidation reaction, flocculation reaction solution with the flocculation section under different flocculation time, the content of phenol and oxalic acid Lin the final filtrate with the flocculation section under different flocculation time
此现象表明,絮凝时间的延长有助于苯酚的祛除,但祛除效果变化不是很明显,这说明絮凝段时间的延长主要是增强无机高分子对苯酚及中间体的网捕絮凝作用。而随着絮凝时间的延长,草酸量也表现为较大的增加趋势,最终滤液的pH值也在逐步减少,说明絮凝段随时间的延续还在进行着部分分解产酸过程。产生较多的Fe(OH)3胶体主要对未氧化的苯酚增加吸附量,且随过滤过程被过滤,对最终滤液pH值未造成降低趋势。
3 结 语
(1)改变氧化段条件主要对初始快速反应1 min及氧化反应过程两阶段溶液的pH值有影响。高铁酸钾为碱性药剂,氧化条件有利于反应进行,初始快速反应1 min溶液的pH值向增大趋势发展;氧化充分,苯酚被氧化为酸类物质,pH值向降低趋势发展。
(2)氧化条件较好的情况下,高价铁降低至低价铁,产生较多的Fe(OH)3胶体,最终滤液的pH值表现为下降趋势。
(3)改变絮凝段条件主要增强Fe(OH)3胶体对苯酚及其他中间体的吸附效能,Fe(OH)3胶体在过滤过程中较多被过滤掉,未对最终滤液pH值未造成降低趋势。
(4)采用高铁酸钾氧化-絮凝处理苯酚废水的技术,最终滤液的pH值保持在9左右,已基本符合pH=6~9的排放水标准,从而大大减轻了pH值调整的技术与经济代价。
□
参考文献:
[1] 徐小钰, 朱记伟, 李占斌,等. 国内外突发性水污染事件研究综述[J]. 中国农村水利水电, 2015,(6):1-5.
[2] Boukhatem H, Khalaf H, Djouadi L, et al. Photocatalytic activity of mont-La (6%)-Cu 0.6 Cd 0.4 S catalyst for phenol degradation under near UV visible light irradiation[J]. Applied Catalysis B Environmental, 2017,211:114-125.
[3] Qixing Z. Combined chromium and phenol pollution in a marine prawn fishery[J]. Bulletin of Environmental Contamination & Toxicology, 1999,62(4):476-482.
[4] Liu G M, Jia X, Jia F A. Oxidation treatment of phenol contaminated soil using potassium ferrate (K2FeO4)[J]. Advanced Materials Research, 2013,800(2):98-102.
[5] 周建红, 李 军, 令玉林,等. 高铁酸钾和次氯酸钠联用处理苯酚废水研究[J]. 工业水处理, 2013,33(10):27-29.
[6] 苗宗成, 王 蕾, 张永明,等. 高铁酸钾对COD去除作用的机理研究[J]. 工业水处理, 2011,31(8):32-34
[7] 李允超, 王贤华, 隋海清,等. 竹炭对生物油模型组分的吸附特性试验[J]. 农业机械学报, 2013,44(11):154-159.
[8] GB 8978-1996,污水综合排放标准[S].
[9] GB 3838-2002,地表水环境质量标准[S].
[10] 崔建国, 刘幼琼, 李 娜. 高铁酸钾同时降解微污染水中苯酚和Cr(Ⅵ)的研究[J]. 中国环境科学, 2011,31(9):1 461-1 465.
[11] 杨建涛, 王建中, 张 萍,等. 电化学氧化苯酚模拟废水中间产物的高效液相色谱分析[J]. 环保科技, 2009,15(3):21-25.
[12] Liu S C, Lin J T, Hu C C, et al. Phenolic compositions and antioxidant attributes of leaves and stems from three inbred varieties of Lycium chinense Miller harvested at various times[J]. Food Chemistry, 2017,215:284.
[13] 谢 淳. 高铁酸钾处理微污染水中苯酚和COD的研究[D]. 太原:太原理工大学, 2010.
[14] Li W T, Xu Z X, Li A M, et al. HPLC/HPSEC-FLD with multi-excitation/emission scan for EEM interpretation and dissolved organic matter analysis[J]. Water Research, 2013,47(3):1 246.
[15] Du P, Zhao H, Li H, et al. Transformation, products, and pathways of chlorophenols via electro-enzymatic catalysis: how to control toxic intermediate products[J]. Chemosphere, 2016,144(FEB):1 674-1 681.
[16] Gan W, Sharma V K, Zhang X, et al. Investigation of disinfection byproducts formation in ferrate(VI) pre-oxidation of NOM and its model compounds followed by chlorination[J]. Journal of Hazardous Materials, 2015,292:197.
[17] 邓子峰. 高铁酸钾及锰钾矿型化合物的合成、表征及在水处理中的应用研究[D]. 上海:同济大学, 2005.
[18] 武秀文, 蓝惠霞. 高铁酸钾氧化处理苯酚废水的研究[J]. 环境工程学报, 2011,5(5):1 021-1 024.
