双重衍生化-质谱法同时分析检测人血清中酸性与中性N-糖链
2018-05-05何振宇丁慢慢林亚维
何振宇, 汪 耀, 丁慢慢, 林亚维*
(1.武汉市疾病控制预防中心,湖北武汉 430015;2.武汉理工大学化学化工与生命科学学院,湖北武汉 430070)
糖基化是真核生物内最常见的蛋白质翻译后修饰[1]。糖基化修饰会改变蛋白质性质以及生物活性[2],它广泛参与众多生物进程,如细胞间信号传递、细胞-基质相互作用以及细胞-细胞相互作用等。因此,糖链分析至关重要[3 - 4]。根据糖基化位点以及糖类物质与蛋白质之间连接方式的不同,可将糖蛋白中糖链的构成类型主要分为两大类:N-糖链与O-糖链。目前已发现N-糖基化异常与许多重大疾病,如癌症、心血管疾病等均有密切关系[5 - 6],研究N-糖链的结构变化对于阐明糖链在疾病发生与发展中的作用,寻找疾病标志物进而实现疾病的早期诊断治疗乃至药物的研发具有重要意义。
复杂生物基质中糖链相对丰度较低,且由于糖链本身结构复杂、无法扩增、离子化效率低[7]、无生色团或荧光基团等因素,N-糖链的高灵敏度、高选择性检测依然是一个充满挑战的课题。糖链分析方法主要有核磁共振法(NMR)与质谱法(MS)[8 - 9]。其中,基质辅助激光解吸质谱法(MALDI-MS)[10]相较于其他方法,具有分析时间短、图谱解析较为简单、易于操作等优点,能实现快速、高灵敏、高通量的糖链检测。其分析流程大致为:糖蛋白或其他生物样品经酶切等前处理后进行衍生化、纯化后质谱分析。常用的衍生方法有还原胺化法、肼标记法等[11],它们均通过糖链的还原端进行衍生。但N-糖链中唾液酸化糖链糖苷键在质谱检测中易断裂,进而引起唾液酸残基的解离与脱落[12 - 14]而导致信号的丢失。因此,通常选择甲酯化[13]、酰胺化[15]或甲胺化[16]等方法来保证唾液酸的稳定性。但这些方法无法实现中性与酸性糖链的同时检测,为生物样品中聚糖分析引入了误差。
本文提出一种“双重衍生化”方法结合MALDI-MS分析,实现了生物样品中酸性与中性N-糖链的同时检测。其中,酸性糖链衍生采取甲胺化方法,中性糖链则采取肼标记法。因唾液酸可与肼试剂反应而干扰糖链还原端的肼标记,我们首先选用甲胺化方法中和唾液酸,然后采用吉拉尔特试剂P(GP)对N-糖链还原端进行标记。
1 实验部分
1.1 仪器及试剂
5800 MALDI-TOF质谱仪(美国,AB SCIEX);真空浓缩仪(德国,Eppendorf);电子天平(美国,梅特勒-托利多);WH-2微型漩涡混合仪(上海沪西);TW50SPE-12S固相萃取装置(北京东方)。
麦芽七糖、2,5-二羟基苯甲酸(DHB)、三氟乙酸(TFA)、核糖核酸酶B(RNase B)、牛胎球蛋白(Fetuin)、二甲基亚砜(DMSO)、甲胺盐酸盐、4-甲基吗啉、六氟磷酸(7-氮杂苯并三唑-1-氧基)三吡咯烷磷(PyAOP)(美国Sigma公司);冰乙酸(国药集团);吉拉尔特试剂P(GP)、吉拉尔特试剂T(GT)、甲醇(Aladdin(中国));β-株蛋白生成障碍性贫血洗脱缓冲试剂包(G7,10X)、10%壬基酚聚氧乙烯醚(NP-40)(美国BioLabs);肽N-糖酰胺酶F(PNGase F)(250 U,美国ThermoFisher);多孔石墨化碳(PGC)(ENVI-Carb,中国);纤维素填料(美国Sigma)。所用试剂如无特别说明均为分析纯。纯水经Milli-Q系统(美国Millipore)纯化。
人血清样品由武汉同济医学院协和医院提供。
1.2 实验方法
1.2.1GP与麦芽七糖衍生反应于1 μL麦芽七糖(0.2 mmol/L)中,分别加入2 μL GP(10 mmol/L)、0.2 μL冰乙酸与16.8 μL纯水,60 ℃下反应120 min,真空离心干燥,待MALDI-MS分析。
1.2.2RNaseB中中性N-糖链GP衍生反应(1)标准糖蛋白RNase B的酶切:10 μg RNase B 100 ℃下煮沸10 min,冷却后加入12 μL 10% NP-40,静置30 min。随后加入PNGase F 0.5 μL,37 ℃下反应18 h后,煮沸5 min以终止反应。(2)N-糖链固相萃取纯化:先后用3 mL 80%的乙腈溶液(乙腈/水/TFA:80/19.9/0.1,V/V/V)、3 mL纯水预洗、平衡PGC柱。样品经平衡液稀释加载到PGC柱中,用3 mL水洗涤,最后用1.3 mL 40%乙腈溶液(乙腈/水/TFA:40/59.9/0.1,V/V/V)洗脱,洗脱液真空离心干燥。(3)GP衍生:干燥样品用10 μL水溶解,取1 μL与10 μL GP(10 mmol/L)、0.2 μL冰乙酸与8.8 μL纯水混合,60 ℃反应120 min后,干燥。
1.2.3Fetuin中酸性N-糖链的双重衍生化反应(1)酶切与PGC纯化同1.2.2项(1)。(2)甲胺化:7 mg 甲胺盐酸盐溶于100 μL DMSO,加入5.5 μL 4-甲基吗啉,混合、离心,配制成A溶液。2.6 mg PyAOP溶于100 μL DMSO,混合、离心,配制成B溶液。取A、B溶液各25 μL加入(1)的干燥样品,混合均匀,室温下避光反应30 min后,加入正丁醇/乙醇/水(4/1/1,V/V/V)溶液500 μL终止反应。(3)纤维素柱纯化:3 mL纯水、3 mL正丁醇/乙醇/水(4/1/1,V/V/V)预洗、平衡纤维素柱,平衡液稀释样品加载到纤维素柱,3 mL正丁醇/乙醇/水(4/1/1,V/V/V)冲洗柱后1.0 mL乙醇/水(1/1,V/V)洗脱,收集干燥洗脱液。(4)GP与糖链的衍生同1.2.2项(3)。
1.2.4人血清N-糖链双重衍生化反应同Fetuin中酸性糖链的双重衍生化法(1.2.3项)。
1.2.5MALDI-TOFMS检测(1)干燥样品溶解在20 μL 50%甲醇/水(V/V)中,取出0.5 μL样品与0.5 μL基质(5 mg/mL DHB、5 mmol/L NaAc的50%甲醇/水(V/V)溶液)混合,点在靶板上,空气中晾干。(2)质谱分析以正离子模式进行。激光光源Nd∶YAG(355 nm,400 Hz),激光强度为5 500,加速电压为20 kV,质量扫描范围为m/z1 000~5 000。
2 结果与讨论
2.1 甲胺化法
甲胺化反应原理如图1(a)所示。Fetuin糖链甲胺化衍生结果如图2(B)所示,Fetuin所有5种唾液酸化糖链([M+Na]+峰)均在质谱上有较好响应。而未经甲胺化衍生则无明显糖链信号(图2(A))。结果表明,甲胺化能极大提高唾液酸化糖链的检测灵敏度。
2.2 肼标记法
GP与GT试剂与DP7衍生反应如图1(b)所示。因二者均具有一个永久正电荷,其糖链衍生产物在质谱检测时离子化效率增强,且质谱图上只呈现其[M]+峰,消除了其他加合物离子峰的干扰[17 - 18]。我们采用麦芽七糖(DP7)为模型聚糖,考察了两种试剂与聚糖的衍生化反应。
本研究中,观察组患者的脑出血治疗效果明显优于对照组,差异显著(P<0.05),同时观察组患者的血肿扩大率明显低于对照组,差异显著(P<0.05)。因此,在脑出血患者的临床治疗中应用小剂量甘露醇进行治疗则有更好的应用效果,更好地防控血肿扩大,值得在临床推广应用。

图1 甲胺化(a)与肼标记(b)反应式Fig.1 Schematic diagram of methylamidation(a) and hydrazine labeling(b)
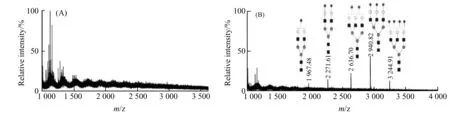
图2 未甲胺化Fetuin(A)和甲胺化Fetuin(B)质谱图Fig.2 Mass spectra of Fetuin (A) and Fetuin after methylamidation (B)

图3 (A)DP7的GT衍生质谱图(内插图为GT/DP7摩尔比(a),反应温度(b),反应时间(c)对GT衍生效率的影响);(B)DP7的GP衍生质谱图(内插图为GT/DP7摩尔比(d),反应温度(e),反应时间(f)对GP衍生效率的影响)Fig.3 (A)Mass spectrum of DP7 with derivatization of GT (Inset:the derivatization efficiency in relationship to molar ratio of GT to DP7(a),reaction temperature(b),reaction time(c));(B)Mass spectrum of DP7 with derivatization of GP(Inset:the derivatization efficiency in relationship to molar ratio of GP to DP7(d),reaction temperature (e),reaction time (f))
GT与DP7衍生反应结果如图3(A)所示,观察到明显DP7-GT衍生产物峰[M]+(m/z1 266.32),同时也观察到了未反应的DP7信号峰[M+Na]+。为提高衍生效率,我们对反应条件进行了优化,得到最优的衍生条件为:GT/DP7摩尔比100/1,温度60 ℃,反应时间60 min。当温度大于60 ℃,反应时间大于60 min时,衍生效率降低。这说明GT-DP7衍生物不稳定、易分解。GP与DP7衍生反应结果如图3(B)所示,观测到DP7-GP衍生物信号[M]+(m/z1 286.28)与未反应DP7信号。优化反应条件后,得到最优的条件为:GP/DP7摩尔比为100/1,温度60 ℃,反应时间120 min。结果表明,GP衍生能极大提高聚糖检测灵敏度。因GP衍生效率高且衍生产物稳定,我们选择GP试剂进行糖蛋白糖链分析。
2.2.3GP衍生化分析RNaseB中N-糖链标准糖蛋白RNase B进GP衍生后结果如图4所示。其中图4(A)为未GP衍生结果,只检测到4种糖链信号,且背景峰干扰明显;图4(B)为GP衍生后结果,检测到RNase B所有5种糖链,且均为GP衍生化[M]+峰。

图4 未衍生RNase B(A)和GP标记RNase B(B)质谱图Fig.4 Mass spectra of RNase B N-glycans (A) and RNase B N-glycans after GP labeling (B)
2.3 双重衍生化分析Fetuin中N-糖链
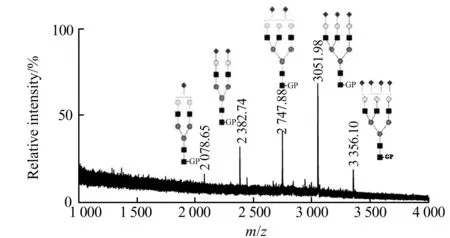
图5 双重衍生化Fetuin质谱图Fig.5 Mass spectrum of Fetuin after dual derivatization
采用双重衍生化方法(即甲胺化和后续的GP衍生)检测Fetuin中N-糖链结果如图5所示。与单纯甲胺化(图2(B))相比,双重衍生化法检测到Fetuin中所有5种酸性糖链,且信号明显增强。可见双重衍生化法较单纯甲胺化法更能提高糖链检测灵敏度。
2.4 双重衍生化分析人血清中N-糖链

图6 甲胺化衍生的血清中糖链检测质谱图(A)与双重化衍生的血清中糖链检测(B)质谱图Fig.6 Mass spectra of N-glycans in serum after methylamidation(A) and after dual derivatization(B)
图6(A)为人血清只经过甲胺化衍生得到的质谱图,从中我们只观察到三种唾液酸化聚糖的质谱信号,而没有观察到任何中性糖链的信号。图6(B)为人血清经双重衍生化得到的质谱图,从中我们观察到了16种N-糖链的质谱信号,并确定了其糖链组成与结构,见表1。这16种N-糖链包括7种中性糖链和9种酸性糖链,可以分为4种高甘露糖型糖链、7种二天线型糖链、3种三天线型糖链以及2种平分型糖链。其中,二天线型糖链丰度较大,且种类最多。这16种糖链中有7种糖链为岩藻糖化糖链,而且均为核心岩藻糖化。由此可见,双重化衍生同时提高了中性与酸性聚糖的检测灵敏度,更实现了复杂基质中酸性与中性糖链的同时检测。

表1 血清中糖链双重衍生化质谱检测信号解析
3 结论
本文发展了一种高效、快速的双重衍生化方法用于生物样品中中性、酸性糖链的检测。在实际检测量为25 ng的人血清样品中检测出16种糖链结构。该方法包括修饰唾液酸残基的甲胺化与针对糖链还原端的GP试剂肼衍生,既保证了质谱检测中酸性糖链的稳定性,又提高了所有聚糖的离子化效率。方法实现了生物样品中中性、酸性糖链的同时检测;提高了糖链检测的灵敏度与准确性,为疾病相关糖链标志物的检测提供了新的检测方法。
参考文献:
[1] Apweiler R,Hermjakob H,Sharon N.Biochimica et Biophysica Acta(BBA)-General Subjects,1999,1473(1):4.
[3] Rudd P M,Elliott T,Cresswell P,et al.Science,2001,291(5512):2370.
[4] Wen H Y,Hsu P H,Chen G S,et al.RSC Advances,2013,3(24):9530.
[5] Reiter R E,Gu Z,Watabe T,et al.Proceedings of the National Academy of Sciences,1998,95(4):1735.
[6] Májek P,Pecankova K,Maly M,et al.Translational Research,2015,165(2):360.
[7] Qin H,Hu Z,Wang F,et al.Chemical Communications,2013,49(45):5162.
[9] Wuhrer M.Glycoconjugate Journal,2013,30(1):11.
[10] Ruhaak L R,Zauner G,Huhn C,et al.Analytical and Bioanalytical Chemistry,2010,397(8):3457.
[11] Harvey D J.Journal of Chromatography B,2011,879(17-18):1196.
[12] Harvey D J.Mass Spectrometry Reviews,1999,18(6):349.
[13] Jang K S,Kim Y G,Gil G C,et al.Analytical Biochemistry,2009,386(2):228.
[14] Nie H,Li Y,Sun X L.Journal of Proteomics,2012,75(11):3098.
[15] Sekiya S,Wada Y,Tanaka K.Analytical Chemistry,2005,77(15):4962.
[16] Liu X,Qiu H,Lee R K,et al.Analytical Chemistry,2010,82(19):8300.
[17] Mirzaei H,Regnier F.Journal of Chromatography A,2006,1134(1):122.
[18] Wang C,Wu Z,Yuan J,et al.Journal of Proteome Research,2013,13(2):372.
