中空纤维离心超滤-高效凝胶排阻色谱法测定青霉素V钾中蛋白杂质
2018-05-05杨中华张立娜高敬林庞海英王聪聪
杨中华, 张立娜, 张 锦, 高敬林, 庞海英, 王 薇, 王聪聪, 蒋 晔*
(河北医科大学药学院,河北石家庄 050017)
青霉素V钾属于β-内酰胺类抗生素[1],是一种重要的原料药和医药前体,在国内外广泛应用于口服制剂加工、半合成青霉素和头孢菌素的生产,是裂解生产6-APA等半合成抗生素中间体的重要原料[2]。青霉素V钾主要通过发酵法产生[3],由于菌丝和发酵培养基需要添加碳氮源麸质粉、乳糖、硫酸铵、玉米浆等,青霉素V钾在发酵过程中易产生蛋白多肽等大分子杂质[4]。虽然发酵工艺和纯化制备工艺不断改进,但发酵过程中的蛋白等大分子物质仍可能残留于终产品中而引起人体内的诸多不良反应[5]。故用灵敏的痕量蛋白检测方法对青霉素V钾等发酵产品进行有效的工艺验证、在线监测及考察是极其重要的。
采用常规的光谱等分析方法[6]检测蛋白质存在基质影响大、操作复杂、结果不准确、灵敏度低等问题。即使采用了高灵敏度的现代分析方法如质谱等,其分析检测灵敏度仍然不高[7],故需在样品前处理时对蛋白质进行分离富集。目前,痕量蛋白质富集技术已由透析袋浓缩法、冷冻干燥浓缩法、沉淀法、萃取法等传统非在线富集技术,发展到场放大堆积技术[8]、扫集技术[9]、等速电泳[10 - 12]、pH调节浓缩技术[13]等在线富集手段。然而这些富集技术存在操作繁琐、大量使用有毒有机溶剂、蛋白质易变性等问题。虽然国外已商品化的平膜装置是一种利用离心超滤原理富集大分子的装置,但在富集大分子过程中普遍存在浓差极化、吸附、富集液干燥[14 - 15]等问题。
本实验利用中空纤维超滤膜特异性截留大分子的原理,采用中空纤维离心超滤(HFCF-UF)富集青霉素V钾中的蛋白杂质,离心过程中离心力与中空纤维膜一直是平行的状态,消除了浓差极化,离心时中空纤维浸没在滤液中,避免了浓缩物干燥的问题,同时通过对膜进行亲水性基团的移植减小了吸附现象,同时本研究还使用将末端吸收波长作为检测波长的高效凝胶排阻色谱法(HPSEC)对蛋白杂质进行含量测定。经富集后的方法灵敏度比质谱法提高了约30倍[7],比常用的测定蛋白的考马斯亮蓝法[16]提高了300多倍,为同类药物中的痕量大分子的检测提供了一种新的富集和检测手段。
1 实验部分
1.1 仪器与试剂
Ultimate 3000液相色谱仪(美国,戴安公司);LXJ-64-01离心机(北京医疗仪器修理厂);聚砜中空纤维(PS)(杭州凯洁膜分离技术有限公司,壁厚150 μm,内径1 000 μm,截留分子量10 kD)。
青霉素V钾(华北制药股份有限公司提供,批号及含量分别为:20051508041(99.0%)、20051508042(98.9%)、20051508043(99.2%)、20051508044(99.4%)、20051508045(98.9%)、20051508046(99.0%))。牛血清蛋白(BSA)对照品(New Zealand ),其他试剂均为分析纯,水为重蒸水。
1.2 溶液配制
对照品溶液:精密称取BSA 10.0 mg于100 mL容量瓶中,加流动相溶解并稀释至刻度,制备成100.0 μg/mL储备液。分别精密吸取适量的储备液,加入流动相进行稀释,混匀,定容得浓度为1.0、2.5、5.0、10.0、20.0、50.0、100.0 μg/mL的对照品溶液。
供试品溶液:取约1.0 g的青霉素V钾样品,精密称定,用流动相溶解并稀释定容至10 mL,将3 mL 样品溶液置于图1a所示的富集装置中,超滤离心(671 g,10 min)后,用微量注射器取出富集液,作为供试品溶液。
1.3 HFCF-UF装置制作及富集过程

图1 HFCF-UF装置示意图及富集过程Fig.1 The schematic diagram of the HFCF-UF unit and the enrichment procedure(a)introduction of test solution into the enrichment device;(b)macromolecules were concentrated in the hollow fiber after centrifugation;(c)removal of the retentate by a 100 μL syringe.
将PS膜切成约9 cm的小段,弯曲成U形,放入一5 mL离心管中,取另一个5 mL离心管(将离心管底部剪掉)与该离心管用环氧树脂胶粘合,并插入两个针头连接,并将PS膜粘在两个针头上,做成如图1a所示的装置。使用前,向PS膜内部打入适量5%的吐温20,并向中空纤维所在的离心管中加入适量5%的吐温20以浸泡中空纤维,超声20 min后继续浸泡9 h,备用。使用时,将3 mL样品溶液(0.1 g/mL青霉素V钾样品溶液)置于图1a装置中,超滤离心(671 g,10 min),大分子将被富集在中空纤维内部,用微量注射器取出富集液,作为供试品溶液。
1.4 色谱条件
色谱柱:TSK gel Super SW2000凝胶排阻柱(300×4.6 mm,4 μm);流动相:0.06 mol/L NaCl-0.02 mol/L Na2HPO4(pH=7.0);流速:0.3 mL/min;检测波长:220 nm;进样量:20 μL;柱温:室温。
2 结果与讨论
2.1 非特异性吸附现象的处理及影响参数的优化
2.1.1非特异性吸附现象的处理非特异性吸附(NSB)是在排阻色谱和膜分离技术中一个普遍存在的问题[15,17 - 18],同时也是影响痕量蛋白富集回收率的一个很重要的因素。为了解决排阻色谱柱对蛋白的吸附问题,我们选择了在其硅胶基质表面键合了亲水性基团的TSK gel Super SW2000色谱柱对蛋白进行分析,大大减弱了吸附现象,同时为了进一步减小吸附,进样前我们对蛋白柱用高浓度的BSA对其进行预饱和,从而基本消除了排阻色谱柱对蛋白吸附的影响。
PS膜具有化学稳定性好、强度高、变形性好等优点,故本研究中选用了PS膜进行试验。为降低蛋白的吸附,我们首先尝试了用BSA预饱和的方法来降低PS膜对后面富集物的吸附,但是由于无法避免离心过程中预饱和的BSA从PS膜上脱落,测定回收率超过了100%,故该方法测定不准确。后考虑到PS膜对蛋白吸附是由于其疏水性,可在PS膜上移植亲水性基团,改善PS膜的疏水性。而非离子表面活性剂由亲水基和疏水基所构成,由于官能团的作用,非离子表面活性剂会在与它相接的膜界面上形成致密的亲水层,从而改善膜的亲水性[19]。本实验选用5%的吐温20水溶液对PS膜进行处理,并考察了浸泡时间、离心力及离心时间的影响。
2.1.2浸泡时间的考察将PS膜用5%的吐温20分别处理1、3、5、7、9、12、24 h后,分别取3 mL浓度为1.00 μg/mL的BSA溶液,放入图1所示的装置在671 g离心力下离心10 min。结果所示,当浸泡时间逐渐延长时,EF逐渐增加;但超过9 h后,由于膜的通透性逐渐变差,样品溶液离心不完全,因此选取浸泡9 h用于后续的实验,实验结果见图2a。
2.1.3离心力及离心时间的考察取3 mL浓度为1.00 μg/mL的BSA溶液放入图1所示的装置中,固定浸泡时间为9 h,离心时间为10 min,分别考察不同离心力671 g(2 000 r/min)、1 048 g(2 500 r/min)、1 509 g(3 000 r/min)、2 054 g(3 500 r/min)、2 683 g(4 000 r/min)对超滤效率的影响。固定浸泡时间为9 h,离心力为671 g(2 000 r/min),考察不同离心时间10、15、20、25、30 min对超滤效率的影响。由图2b、图2c结果所示,离心力为671 g(2 000 r/min),离心时间为10 min时,EF最高。

图2 各因素对富集倍数的影响 Fig.2 Effect of various factors on the EF obtained from HFCF-UF (a)dipping time,(b)centrifugal force,(c)centrifugal time.
2.2 方法学验证

图3 空白溶液(a)、BSA溶液(b)和青霉素V钾溶液(c)色谱图Fig.3 Chromatograms of blank solution(a),BSA solution(b) and phenoxymethylpenicillin potassium(c)1.phenoxymethylpenicillin potassium(0.1 g/mL;2.multimeric proteins;3.BSA(50.0 μg/mL).
2.2.1专属性实验在上述色谱条件下分别取空白溶液(流动相)、BSA溶液(50.0 μg/mL)、青霉素V钾样品溶液(0.1 g/mL)各20 μL,进行色谱分析,得图3。可见BSA峰与其余峰分离良好,样品基质不干扰BSA的测定。
2.2.2线性关系在上述色谱条件下,取浓度为1.0、2.5、5.0、10.0、20.0、50.0、100.0 μg/mL的BSA对照溶液各20 μL,分别进样分析,记录色谱峰,以峰面积(y)为纵坐标,浓度(x)为横坐标,计算回归方程和相关系数。其回归方程为:y=0.210x-0.112(R2=0.999),BSA在1.0~100.0 μg/mL的范围内线性关系良好。
2.2.3精密度和回收率取含低、中、高三个浓度(1.0、50.0、100.0 μg/mL)的BSA样品溶液(样品批号为:20051508046,样品中未检测到BSA杂质),在同一天内连续进样三次,记录峰面积,计算相对标准偏差(RSD)分别为0.8%、0.5%、0.2%,表明精密度良好。取含低、中、高三个浓度(1.0、50.0、100.0 μg/mL)的BSA样品溶液(样品批号为:20051508046,样品中未检测到BSA杂质),且每个浓度的样品取三份,按1.3节对样品进行富集处理,将得到的富集液再稀释至富集前的体积,分别取20 μL进行分析,记录色谱图,计算回收率,见表1。

表1 回收率试验结果
2.2.4耐用性换用不同的检测波长(218、220、222 nm)、流速(0.28、0.30、0.32 mL/min)对1.0 μg/mL的BSA对照品溶液进行测定,测得不同波长下峰面积的RSD为1.7%,不同流速下峰面积的RSD为1.5%,说明该方法耐用性良好。
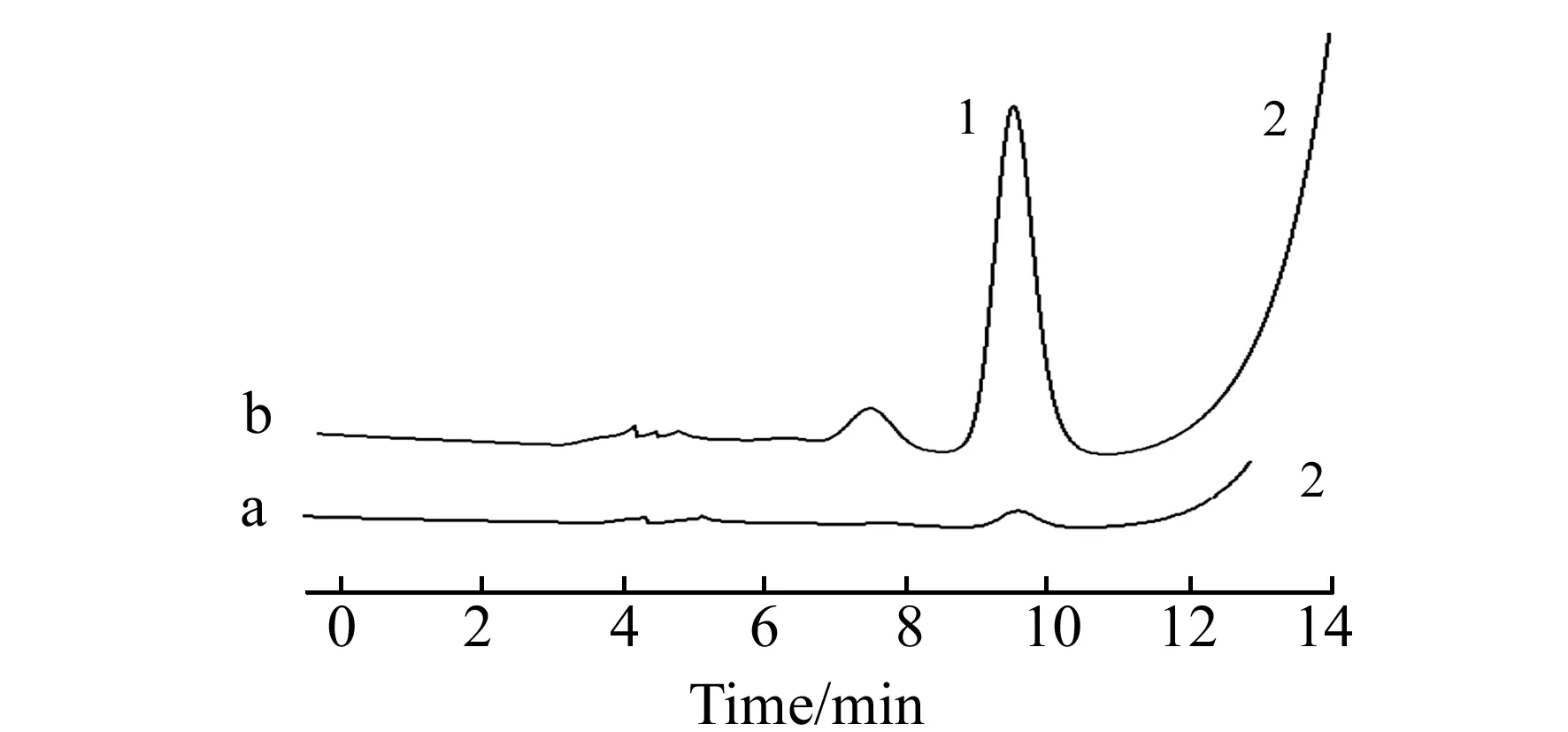
图4 1.0 μg/mL BSA供试品溶液富集前(a)和富集后(b)的色谱图Fig.4 Chromatograms of 1.0 μg/mL BSA sample solution before concentration(a) and after concentration(b)1.BSA;2.phenoxymethylpenicillin potassium.
2.2.5富集倍数及检测限的考察取含1.0 μg/mL BSA供试品溶液3份,分别经HFCF-UF装置富集,计算富集倍数,求得平均EF为99倍,见图4。因该方法BSA浓度为0.3 μg/mL时,信噪比(S/N)=2.8,故检测限为:0.3 μg/mL/99=3.03 ng/mL。
2.3 含量测定
取青霉素V钾6批,制备供试品溶液进行分析,样品中均未检测到蛋白杂质。为了验证BSA在青霉素V钾中的可测性,向批号为:20051508046的青霉素V钾样品加入3.03 ng/mL BSA对照品溶液,按照1.2节制备供试品溶液,经富集后可检测到BSA的色谱峰,其信噪比达2.7,证明该方法可成功检测到样品中低至3.03 ng/mL的痕量蛋白质。
2.4 本方法与其他蛋白测定方法灵敏度对比
目前中国药典和ICH尚未见对青霉素V钾等发酵类产品的残留蛋白提出控制要求,但美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)均对发酵类产品提出了控制发酵残留物质的要求。然而目前对发酵类产品中残留蛋白的研究报道较少[5,20]。本方法与其他常用测定蛋白的方法相比不仅克服了因基质干扰、操作步骤繁琐而影响蛋白测定准确性的问题,且大大提高了灵敏度,具体比较见表2。极高的灵敏度可以对发酵类产品残留蛋白进行更严格的控制,最大限度的控制产品质量,保证用药安全。

表2 测定蛋白方法的灵敏度比较
3 结论
本研究建立了一种新的膜分离技术对样品中痕量蛋白进行分离富集,并利用末端吸收的HPSEC方法可成功检测到样品中低至3.03 ng/mL的大分子蛋白。该样品前处理HFCF-UF是在半封闭的情况下完成对样品的富集的,减少了外来人员及环境的污染,从而减少了假阳性的情况。使用该装置对样品进行前处理,快速、有效、操作简单,为其他同类药物中的大分子杂质的检测提供了一种可借鉴的手段。
参考文献:
[1] Vellore S A,Priyabrata P,Deepak C,Arvhana P,Cheravakattu G S,Sureshkumar R.Journal of Structural Biology,2016,193(2):85.
[2] Arroyo M,Mata I D L,Acebal C,Castillon M P.Applied Microbiology and Biotechnology,2003,60(5):507.
[3] Genowefa P,Katarzyna M,Stefan T.Jounal of Chromatography A,2005,1087:197.
[4] Yang S,Zhu X,Wang J,Jin X,Liu Y,Qian F,Zhang S,Chen J.Bioresource Technology,2015,193:156.
[5] WANG Y,YAO S C,CHANG Y,et al.Chinese Journal of New Drug(王琰,姚尚辰,常艳,等.中国新药杂志),2015,24(10):1178.
[6] 2.5.33 Total protein,European Pharmacopoeia 8.0.
[7] WANG S S,ZHAO R S,YUAN J P,et al.Jonrnal of Instrumental Analysis(王珊珊,赵汝松,苑金鹏,等.分析测试学报),2011,27(1):60.
[8] Zhang L,Yin X F.Jounal of Chromatography A,2006,1137:243.
[9] Jen H P,Tsai Y C,Su H L,Hseieh Y Z.Jounal of Chromatography A,2006,1111:159.
[10] Takeda S,Fukushi K,Chayama K,Nakayama Y,Tanaka Y,Wakida S.Jounal of Chromatography A,2004,1051:297.
[11] Jeong Y,Choi K,Kang M K,Chun K,Chung D S.Sensor and Actuators B-Chemical,2005,104(2):269.
[12] Prest J E,Baldock S J,Day P J R,Fielden P R,Goddard N J,Brown B J T.Jounal of Chromatography A,2007,1156:154.
[13] Kim J B,Okamoto Y,Terabe S.Jounal of Chromatography A,2003,1018:251.
[14] Vincenzo V,Au V,Bugnaux S B.United States Patent,5647990,1997.
[15] Li J M,Jiang Y,Sun T,Kang L Y.Jounal of Chromatography A,2009,70:1023.
[16] SHAO H,LÜ J,CHEN G.Drug Standards of China(邵泓,吕晶,陈钢.中国药品标准),2011,12(2):135.
[17] Li W,Lin H,Smith H T,Tse F L S.Jounal of Chromatography B,2011,879:1927.
[18] Wang C G,Williams N S.Journal of Pharmaceutical and Biomedical Analysis,2013,75:112.
[19] LU X F,CHEN S Y,LI C Z,WANG B F.Membrane Science and Technology(陆晓峰,陈仕意,李存珍,王彬芳.膜科学与技术),1997,17(4):36.
[20] XU M Z,MA S,HU C Q.Journal of Pharmaceutical Sciences,2004,13(4):262.
