PCR法在鸡毒支原体污染检测中的应用
2018-05-04,,
, ,
(山西农业大学 动物科技学院,山西 太谷 030801)
0 引言
鸡毒支原体(Mycopiasma Galliscepticum, MG)是引起鸡慢性呼吸道病(chronic respiratory disease, CRD)的主要病原,发病特征主要以出现呼吸道啰音、咳嗽、流鼻涕为主要症状,引起鸡呼吸道黏膜卡他性炎症,造成幼鸡生长发育受阻,种鸡产蛋量、受精率和孵化率下降。支原体感染一般发病率高,死亡率低,但也可出现10%~30%,甚至更高的死亡率。MG通过降低病鸡免疫力,引起其他病原微生物的混合感染,增加鸡群的病死率,严重影响了养鸡业的发展[1-2]。MG传染性极强,传播方式多,途径广泛。一方面通过空气尘埃、飞沫核以及饮水和饲料水平传播,另一方面,随种蛋和精液垂直传播,此外,注射被MG污染的疫苗也会引起感染[3]。感染后病鸡没有明显的特征症状,因此可长期持续存在于鸡群中。控制MG感染的最根本有效方法就是对感染鸡群进行及时准确的检测和诊断,净化鸡群,从根本上切断MG流行。因此建立一种简单、快速的MG检测方法尤为重要。
目前,MG检测方法主要有分离培养法、DNA荧光染色法、电镜法、血清学方法等[4]。此外,分子生物学诊断方法如核酸探针法、聚合酶链反应(Polymerase Chain Reaction ,PCR)等也被广泛应用到鸡毒支原体的检测,PCR技术比培养法快速、简单、灵敏,对某些难以用培养法和血清学方法检测的支原体,PCR技术有明显的优势,因此广泛应用于支原体的实验室诊断。1998年屈小玲等[5]建立了 PCR检测 MG的方法,其结果最低能检出18 pg的 DNA,在MG 感染的分子流行病学调查中有重要的应用价值。周云雷等[6]针对MG pvpA基因建立了实时荧光定量PCR检测MG的方法,20 μL的体系中其最低检测限为72拷贝,并具有较高的特异性、稳定性和灵敏度。贾丽艳等[7]以16s rRNA基因序列建立了套式PCR检测方法。
MG脂蛋白位于细胞膜表面,是一种由MGA0674基因编码的脂蛋白家族2同系物,具有免疫原性,在弱毒株中表达降低,在强毒株Rlow敲除该基因后毒力衰减[8]。迟秀玲等[9]研究表明MG膜蛋白可直接诱导细胞凋亡。本试验针对MG脂蛋白的基因序列进行PCR扩增,并测定了其灵敏度和特异性,利用该PCR对鸡胚样品进行检测,为MG的临床诊断提供了一定的理论依据。
1 材料与方法
1.1 菌种和主要试剂
鸡毒支原体(Mycoplasma Gallisepticum,MG)、大肠杆菌(E.coil)、猪肺炎支原体(Mhp)、新城疫病毒(NDV)、沙门氏菌(SE),由本实验室保存;MEM培养基,购自江苏省宜兴市赛尔生物化工厂;无菌胎牛血清、ExTaq酶、dNTPs、DL2000 Marker,购自北京索莱宝科技有限公司;蛋白酶K,购自德国Merch KgaA公司;Tris-饱和酚,购自TBD BIO公司;酵母提取物(Yeast extract)和胰蛋白胨(Tryptone),购自OXOID公司;琼脂糖,购自iowest;其他常规试剂均为分析纯产品。
1.2 主要仪器
DNP-9052型电热恒温培养箱,购自上海精宏实验设备有限公司;GL-20G-II型高速冷冻离心机和TGL-16G高速冷冻离心机,购自上海安亭科学仪器厂;PCR仪,购自Eppendorf公司;LDZM型立式智能压力蒸汽灭菌器,购自上海申安医疗器械厂;DYY-Ⅲ电泳槽,购自北京六一仪器厂;JEDA801E凝胶成像分析系统,江苏省捷达科技发展有限公司软件;EPS-100稳压稳流电泳仪,购自上海天能科技有限公司。
1.3 MG菌体培养
MG菌种在KM2液体培养基中复壮后,按照1:10接种,传代培养3代后扩大培养。37 ℃培养至培养物pH值降至6.6~6.8,即菌液颜色由红色变为黄色,无沉淀即可收获。培养物经涂片,瑞士染色,镜检呈多形态菌体,无杂菌,进行传代培养,共传3代。
1.4 MG脂蛋白基因的引物合成
根据文献[10],合成两条引物,预期扩增的产物大小为400 bp:
MG-LP上游引物
P1:GATTTCGAAGAATCAACTGT
MG-LP下游引物
P2:AAGGGATTAATATTCCCAAC
1.5 MG模板的制备
1.5.1 MG菌体收集
取对数生长期的MG培养物,4℃ 12000 r·min-1离心10 min,弃沉淀,将上清液于4 ℃ 10000 r·min-1离心30 min,收集沉淀,用PBS(0.2 moL·L-1pH 7.2)洗涤3次,最后将沉淀用微量PBS悬浮,-20℃保存备用。
1.5.2 采用酚氯仿抽提法提取MG基因组DNA[11]
4 ℃ 12000 r·min-1离心10 min收集支原体,沉淀用570 μL TE缓冲液悬浮,加入10%SDS 15 μL和蛋白酶K(20 mg·mL-1)15 μL,混匀后37℃水浴作用1 h,加入等体积的苯酚:氯仿,充分混匀后,静置30 min,4 ℃10000 r·min-1离心5 min,取上清液,沉淀用酚氯仿重新抽提1次,离心后将上清液移入一干净Eppendorf管中,加入1/10体积的3 moL·L-1醋酸钠,2倍体积无水乙醇,-20 ℃作用1 h,4 ℃ 10000 r·min-1离心10 min,沉淀用70%乙醇洗涤,10000 r·min-1离心10 min,弃上清,沉淀于超净台上风干后,溶于30 μL TE缓冲液中,-20 ℃保存备用。
1.5.3 凝胶电泳检测MG基因组NDA
取5 μL DNA样品于1%琼脂糖凝胶上电泳,拍照保存;取1 μL样品进行浓度和光密度值测定。
1.6 PCR扩增
1.6.1 PCR反应体系(见表1)

表1 PCR反应体系
1.6.2 PCR反应条件
95 ℃ 10 min
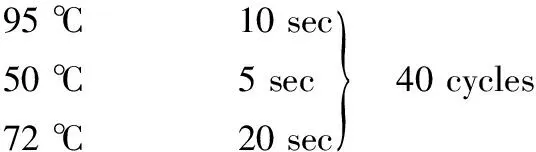
72 ℃ 5 min
将PCR产物在1%琼脂糖凝胶电泳中检测,紫外灯下观察,与标准DNA Marker条带进行比较,判断是否与预期大小一致,其余产物于-20 ℃保存,凝胶成像系统中拍照保存。
1.7 PCR反应的灵敏度检测
用TE缓冲液(pH 8.0)对浓度为195.7 ng·μL-1的 DNA模板进行10倍的倍比稀释,共设8个浓度稀释度,采用上述PCR反应体系进行PCR扩增,以检测其灵敏度。
1.8 PCR反应的特异性检测
取已制备好的鸡毒支原体(MG)、沙门氏菌(SE)、大肠杆菌(E.coli)、猪肺炎支原体(Mhp)、鸡新城疫病毒(NDV)的DNA或cDNA,在上述PCR反应体系和反应条件下进行PCR反应,进行特异性检测。
1.9 样品的检测
1.9.1 鸡胚(尿囊液)样品模板DNA的制备
提取方法参考文献[12],并稍有改动。抽取尿囊液1000 μL在4 ℃12000 r·min-1离心5 min;弃上清,取沉淀加30 μL TE溶液,重悬后煮沸10 min,再次离心,取上清,-20 ℃保存备用。
1.9.2 样品PCR检测
随机抽取样品25个,用上述PCR反应体系和条件进行检测。
2 结果与分析
2.1 基因组DNA测定结果
通过微量蛋白核酸测定仪测定基因组DNA浓度为195.7 ng·μL-1,OD260/OD280值为2.07;琼脂糖凝胶电泳结果见图1。
由图1可见,电泳条带清晰无拖尾,符合PCR扩增条件,可进行后续试验。
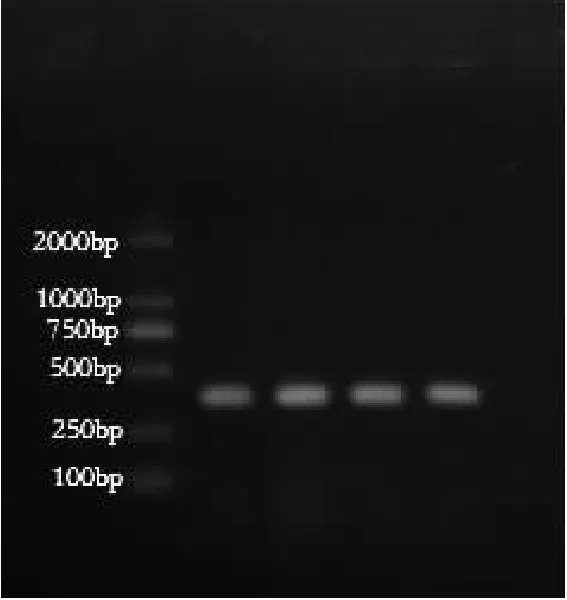
图1 MG基因组DNA
注:1-5:MG基因组DNA
2.2 MG脂蛋白基因PCR扩增结果
对提取的基因组DNA进行PCR扩增,由图2可见电泳条带与预期结果(400 bp)相符,利用此PCR条件和体系扩增出了MG脂蛋白基因。

图2 MG脂蛋白基因的PCR扩增
注:M:DNA分子量标准;1-4:PCR产物
2.3 灵敏度检测
以不同浓度稀释后的MG基因组DNA,进行PCR扩增,结果见图3。
图中可见,1-7扩增出了400bp大小的目的片段,初始浓度为195.7 ng·μL-1的 DNA模板经107倍稀释后,未能扩增出目的片段。经计算得最低检出浓度为0.2 pg·μL-1。
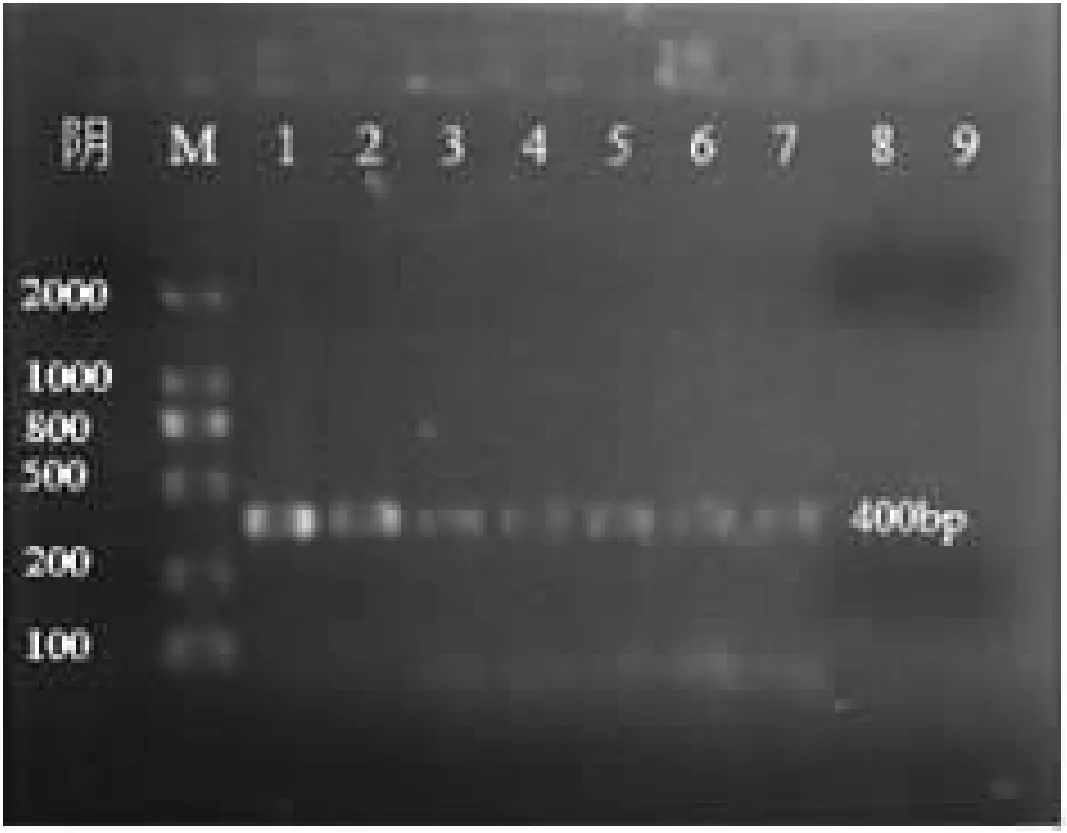
图3 PCR反应的灵敏度检测
注:M:DNA分子量标准; 1-9:100、10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8稀释度
2.4 特异性检测
按上述反应体系及条件,分别用鸡毒支原体、大肠杆菌、猪肺炎支原体、新城疫病毒、沙门氏菌的基因组DNA为模板,作PCR反应特异性检测。结果见图4。
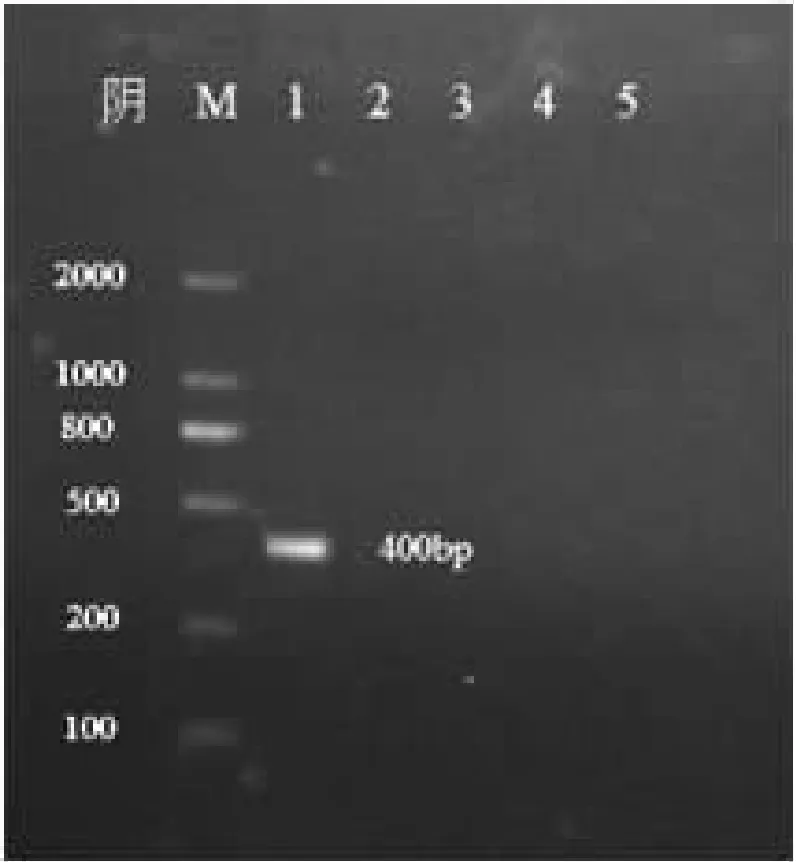
图4 PCR反应的特异性检测
注:M:DNA分子量标准;1-5:鸡毒支原体,大肠杆菌、猪肺炎支原体、新城疫病毒、沙门氏菌
由图4可见,只有以MG基因组DNA为模板扩增出与预期相符的目的条带,其他均未扩增出条带,说明PCR反应的特异性较好。
2.5 样品检测
制备鸡胚样品DNA模板后,PCR法检测鸡胚样品中有无MG污染,结果见表2。

表2 样品检测结果 %
在随机抽检的25份样品中,琼脂糖凝胶电泳结果显示有17份扩增出了特异性条带,核酸阳性率达76%,部分琼脂糖凝胶电泳结果见图5。
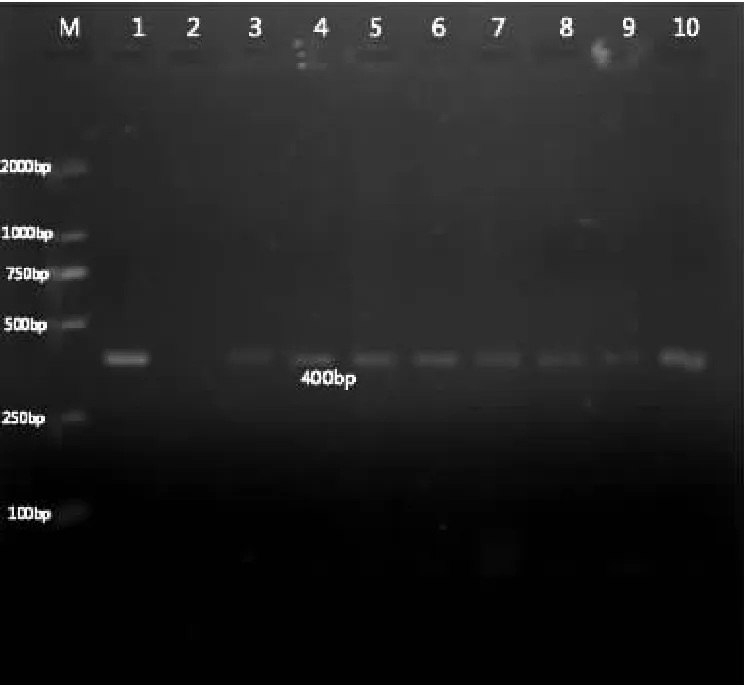
图5 部分鸡胚样品检测结果
注:M:DNA分子量标准;1:阳性对照;2:阴性对照;3-10:鸡胚样品
3 讨论与结论
MG分类学上属于支原体科支原体属,无细胞壁,仅细胞膜包裹,目前只发现一个血清型,但各个分离株之间的致病性和趋向性不一致[13]。有研究证实支原体具有显著改变抗原成分以逃避宿主免疫反应的能力,使致病支原体在感染期间持续存活于鸡群[14-17],给MG的诊断带来了很大的困难。
MG污染检测的传统方法主要有病原分离和血清学诊断如血清平板凝集试验、酶联免疫吸附试验(ELISA)等,但这些方法存在MG分离困难,培养时间长,成本高,假阳性等问题,在实际养禽生产应用中均受到一定的限制。2015年,宁官保[18]等首次建立了MG胶体金免疫层析试纸条诊断鸡MG感染,具有很好的准确性、灵敏性和特异性,但制作成本高,生产受限,目前难以在生产线大规模生产。
近二十年来,PCR法在MG的污染检测中得到了广泛的应用,出现了许多针对MG特异性片段检测方法。目前使用PCR检测MG主要包括常规的PCR扩增以及斑点杂交法、套式PCR扩增和实时荧光定量PCR等技术方法。针对MG16srRNA,贾丽艳[19]等在2005年建立PCR检测方法,但易出现假阴性实验结果。张映[20]等采用地高辛标记探针检测MG的斑点杂交法特异性较好,但操作过程繁琐,实验试剂昂贵,增加了检测成本。周云雷等针对pvpA建立的实时荧光定量方法因荧光易与引物二聚体结合,增加了假阳性的风险以及鉴别引物二聚体的困难。黎敏[21]等针对pMGA基因建立的多重套式PCR扩增方法特异性好,敏感度高,具有较好的应用价值。
如前言所述,MG脂蛋白具有较好的特异性,在MG致病机理中发挥重要作用。本研究针对MG脂蛋白基因进行PCR扩增,进行了PCR反应的灵敏度和特异性检测。结果显示,该PCR法特异性强,灵敏度高,操作简单快捷,实验条件要求低,提高了实验结果的准确性,可同时检测多份样品,在MG污染检测中可行、易推广。
实验中样品选择鸡胚,是由于随着近年来随着生物制品的快速发展,尤其是鸡群疫苗的制备是以鸡胚为原型,若用感染或污染的不合格鸡胚会影响疫苗的质量,故对随机抽检的鸡胚样品中的MG进行检测,以防MG的进一步感染。随机检测的25份样品中,阳性检出率为76%。该PCR法为MG的预防和临床检测提供了一定的理论参考。
[1] 蒋红霞,陈杖榴,邓旭明,等.MG敏感株与耐药株超微结构的比较[J].中国预防兽医学报,2004,26(6):439-442.
[2] Nakamura K, Ueda, Tanimural T, et al. Effect of mixed live vaccine(Newcastle disease and infectious bronchitis) and Mycoplasma gallisepticum on the chicken respiratory tract and on Escherichia coli infection[J].J Comp Pathol.1994,111(1):33-42.
[3] 王廷鸿.MG感染诊断方法与防治[J].中国动物保健,2016,37(7):106-110.
[4] 陈继荣,曾振灵,邓碧琴,等.临床分离MG粘附素蛋白编码基因pvpA的分子特征[J].中国农业科学,2008,41(8):2467-2473.
[5] 屈小玲,毕丁仁.鸡毒霉形体感染的PCR检测方法的建立及应用[J],华中农业大学学报,1998,17(5): 70-75.
[6] 周云雷,魏飞龙,李健,等.鸡毒支原体实时荧光定量PCR检测方法的建立[J],中国农业科学,2011,44(11):2371-2378.
[7] 贾丽艳,逯晓敏,张映.两步PCR法检测鸡新城疫疫苗中MG污染的研究[J].山西农业大学学报(自然科学版),2008,28(3):316-319.
[8] Szczepanek S M, Frasca S Jr, Schumacher V L, et al. Identification of lipoprotein MslA as a neoteric virulence factor of Mycoplasma gallisepticum[J].Infect Immun,2010,78(8):3475-3483.
[9] 迟秀玲,严奉祥.支原体引起细胞凋亡的机制[J].国际病理科学与临床杂志,2006,26(6):546-549.
[10] Serpil Kahya, Seran Temelli, Aysegul Eyigor, et al. Real-time PCR culture and serology for the diagnosis of Mycoplasma gallisepticum in chicken breeder flocks[J]. Veterinary Microbiology,2010,144(3-4):319-324.
[11] 谢志勤,谢芝勋,庞耀珊,等.应用多重聚合酶链式反应检测鸡毒支原体、鸡滑液囊支原体和禽衣阿华支原体的研究[J],畜牧与兽医,2000,32(5):4-6.
[12] 王嘉力, 贾存灵, 苏利红, 等. 家鸡CHD1 基因PCR 快速性别鉴定方法的建立及其在早期鸡胚中的应用[J], 家禽科学2009,(12):3-7.
[13] 张磊.鸡毒支原体JN株的分离鉴定及PCR检测方法的建立[D].泰安:山东农业大学,2010.
[14] 宁宜宝.鸡群健康的潜在杀手――MG病的防制[J].中国兽医杂志,2003,39(10):44-46.
[15] Boguslavsky S, Menaker D, Lysnyansky I, et al. Molecular characterization of the Mycoplasma gallisepticum pvpA gene which encodes a putative variable cytadhesin protein[J].Infection and Immunity,2000,68(7):3956-3964.
[16] Liu T, Garcia M, Levisohn S, et al. Molecular variability of the adhesin-encoding gene pvpA among Mycoplasma gallisepticum strains and its application in diagnosis[J].Journal of Clinical Microbiology,2001,39(5):1882-1888.
[17] Reinhardt A K, Gautier-Bouchardon A V, Gicquel-Bruneau M, et al. Persistence of Mycoplasma gallisepticum in chickens after treatment with enrofloxacin without development of resistance[J].Veterinary Microbiology,1998,106(20):129-137.
[18] 宁官保,刘国莉,张鼎,等.MG胶体金免疫层析试纸条的研制和初步应用[J],动物医学进展,2015,36(5):25-28.
[19] 贾丽艳,李彦明,张映.兽用疫苗支原体污染的PCR检测技术的建立及应用[J],动物医学进展,2005, 26(6):55-58.
[20] 马艳琴,张映.斑点杂交法在鸡毒支原体污染检测中的应用[J], 中国畜牧兽医,2010,37(3):201-203.
[21] 黎敏,管凤霞,刘玲,等.应用多重套式PCR检测鸡毒支原体和鸡滑液囊支原体[J], 广东畜牧兽医科技2010, 35(4):34-36.
