miR-126对结肠癌SW480细胞增殖、凋亡、周期及SOX2表达的影响
2018-05-04宗治国史晓宇赵峻峰
孟 玮,宗治国,史晓宇,张 敬,赵峻峰
(1.河北北方学院附属第一院肿瘤内科,河北 张家口 075000; 2.河北北方学院附属第一院骨外科,河北 张家口 075000)
结肠癌是一种常见的消化道恶性肿瘤,近年来由于人们生活方式转变、环境变化及遗传因素的影响,结肠癌的发病率呈上升趋势[1-2]。研究发现结肠癌的发生发展与癌基因的激活、抑癌基因的失活密切相关[3-4]。miRNA是一类小分子的非编码RNA,能够结合于靶基因的mRNA 3’UTR区域,参与细胞的增殖、分化与凋亡等[5-6]。miRNA在肿瘤中被分为“原癌miRNA”或者“抑癌miRNA”,进而参与肿瘤的发生发展[3- 4]。miR-126在肺癌、肝癌、结肠癌、乳腺癌、宫颈癌等多种癌组织中低表达,因此被认为是一种抑癌miRNA,但在结肠癌发生发展过程中的具体机制报道较少[7-8]。同时SOX2是一种高度保守的能够维持胚胎干细胞功能的核转录因子,有研究表明SOX2可能是miR-126的下游靶基因[9-10],因此本研究将探讨miR-126是否能够通过靶向调控SOX2表达影响结肠癌细胞的增殖与凋亡。
1 材料和方法
1.1 细胞株
结肠癌SW480细胞购于中国科学院细胞库,目录号TCHu172。
1.2 主要试剂与仪器
miR-126 mimics和miR-126 NC均购于上海吉马生物技术有限公司;兔抗人SOX2及GAPDH多克隆抗体均购于美国Abcam公司;胎牛血清,DMEM培养基均购于美国Hyclone公司;BCA蛋白测定试剂盒,MTT均购于南京凯基生物技术有限公司;Trizol总RNA提取试剂盒,LipofectamineTM3000脂质体,一步法miRNA反转录试剂盒均购于大连宝生生物技术有限公司;重组质粒pGL-3 SOX2 3’UTR-Wt及pGL-3 SOX2 3’UTR-Mut购于广州锐博生物技术有限公司。
DYCZ-40D型转印电泳仪均购于北京六一仪器厂;Mini-PROTEAN#1658000小型垂直电泳仪,GelDoc 2000凝胶成像系统购于美国伯乐公司;MK3型酶标仪,FACSCanto II型流式细胞仪均购于美国BD公司。
1.3 实验方法
1.3.1 miRNA的转染
当SW480细胞密度达到50%时候,利用LipofectamineTM3000脂质体将miR-126 mimics和miR-126 NC转染到SW480细胞并于6 h后换液,再继续培养48 h,RT-PCR法检测细胞中miR-126的表达。
1.3.2 RT-PCR法检测细胞中miR-126表达
根据Trizol试剂盒提取细胞中总RNA,并检测总RNA的纯度,接着根据反转录试剂盒将RNA逆转录成cDNA,逆转录产物以琼脂糖凝胶电泳。反应体系:Rnase 9.5 μL,模板1 μL,上游引物1 μL,下游引物1 μL,UItraSYBR Mixture 12.5 μL。反应程序:预变性:95℃,5 min;变性:95℃,20 s;退火:50℃,30 s;延伸:72℃,30 s。引物序列如下:miR-126:上游引物:5′-GCUCGUACCGUGAGUA AU-3′,下游引物:5′-CAGTGCAGGGTCCGAGGT-3′,SOX2:上游引物:5′-GCTACAAGACAACACCCTGAT-3′,下游引物:5′-CAATCTCCTAAGCCACGAG-3′,GAPDH:上游引物 5′-TCAACGACCACTTTGTCAAGCTCA-3′,下游引物:5′-GCTGGTG GTCCAGGGGTCTTACT-3′。
1.3.3 MTT法检测细胞活力
将5×103个SW480细胞接种到96孔板并培养24 h,按“1.3.2”进行转染48 h后,加入20 μL终浓度为5 mg/mL的MTT孵育4 h后,弃去上清液,继续加入150 μL 二甲基亚砜,震荡10 min,在酶标仪570 nm处测吸光值。
1.3.4 Annexin V-FITC/PI法检测细胞凋亡情况
将8×103个SW480细胞接种到6孔板,培养24 h后,按“1.3.2”进行转染48 h后,每组收集1×105/mL个细胞,再加入结合缓冲液吹打混匀后,依次加入5 μL的Annexin V-FITC及PI,继续吹打混匀,并于室温避光孵育10 min,于1 h内在流式细胞仪上进行细胞凋亡分析。
1.3.5 流式细胞术检测细胞周期
将8×103个SW480细胞接种到6孔板,培养24 h后,按“1.3.2”进行转染48 h后,每组收集1×105/mL个细胞,加入RNase吹打混匀后于室温下孵育1 h,再加入PI染液于室温下孵育30 min,在流式细胞仪上进行细胞周期分析。
1.3.6 Western blot检测细胞中SOX2表达
将8×103个SW480细胞接种到6孔板,培养24 h后,按“1.3.2”转染48 h后,收集细胞并裂解,离心得到上清液就是总蛋白,并用BCA试剂盒检测蛋白浓度。蛋白煮沸10 min变性后,制作浓缩胶及分离胶,室温水封30 min。30 ng样品上样后进行十二烷基苯磺酸钠凝胶电泳,PVDF湿法转膜。2%的BSA室温下孵育1 h,一抗溶液(兔SOX2及GAPDH多克隆抗体,稀释度为1∶100)4℃过夜孵育,第2天在室温条件下,于二抗溶液孵育1~2 h,在凝胶成像系统中曝光。
1.3.7 荧光素酶报告基因表达分析
将miR-126 mimics+pGL-3 SOX2 3’UTR-Wt,miR-126 NC+ pGL-3 SOX2 3’UTR-Wt,miR-126 mimics+ pGL-3 SOX2 3’UTR-Mut,miR-126 NC+ pGL-3 SOX2 3’UTR-Mut四组重组载体转染到SW480细胞,采用双荧光素酶系统检测酶活性。计算公式:相对荧光值=萤火虫荧光素梅荧光值/海肾荧光素梅荧光值。
1.4 统计学方法
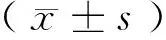

表1 miR-126 mimics对SW480细胞凋亡及细胞周期的影响Tab.1 Effect of miR-126 mimics on SW480 cell apoptosis and cell cycle
注:与miR-126 NC比较,**P< 0.01。
Note.Compared with the miR-126 NC,**P< 0.01.
2 结果
2.1 miR-126 mimics转染效果的检测
miR-126 mimics和miR-126 NC转染SW480细胞48 h后,与miR-126 NC组(0.14±0.01)比较,miR-126 mimics组(0.92±0.08)中miR-126表达量显著上调(P< 0.01)。

图1 miR-126 mimics转染效果的检测Fig.1 Transfection effects of miR-126 mimics
2.2 miR-126 mimics对SW480细胞活力的影响
miR-126 mimics和miR-126 NC转染SW480细胞24、48、72 h后,与miR-126 NC组比较,miR-126 mimics组细胞活力逐渐降低(P< 0.01)。
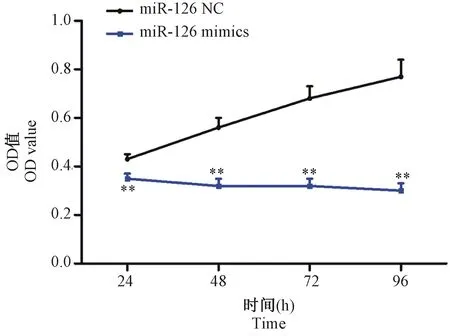
注:与miR-126 NC比较,**P< 0.01。图2 miR-126 mimics对SW480细胞活力的影响Note.Compared with miR-126 NC, **P< 0.01.Fig.2 Effect of miR-126 mimics on SW480 cell viability
2.3 miR-126 mimics对SW480细胞凋亡及细胞周期的影响
如图3,图4及表1所示,miR-126 mimics和miR-126 NC转染SW480细胞48 h后,与miR-126 NC组比较,miR-126 mimics组细胞早期凋亡率及晚期凋亡率均显著提高(P< 0.01),且细胞周期阻滞于G1期(P< 0.01)。
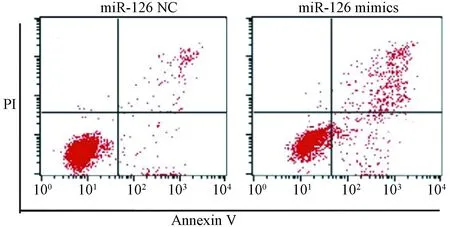
图3 miR-126 mimics对SW480细胞凋亡的影响Fig.3 Effect of miR-126 mimics on SW480 cell apoptosis

图4 miR-126 mimics对SW480细胞周期的影响Fig.4 Effect of miR-126 mimics on SW480 cell cycle
2.4 报告基因分析
将miR-126 mimics+pGL-3 SOX2 3’UTR-Wt,miR-126 NC+ pGL-3 SOX2 3’UTR-Wt,miR-126 mimics+ pGL-3 SOX2 3’UTR-Mut,miR-126 NC+ pGL-3 SOX2 3’UTR-Mut四组重组载体转染到SW480细胞,结果发现miR-126 mimics+pGL-3 SOX2 3’UTR-Wt组荧光强度最低(P< 0.01),其它几组荧光强度差异无显著性(P> 0.05)。

注:与miR-126 NC比较,**P< 0.01。图6 miR-126 mimics对SW480细胞中SOX2表达的影响Note.Compared with the miR-126 NC, **P< 0.01.Fig.6 Effect of miR-126 mimics on the expression of SOX2 in SW480 cells

注:与miR-126 NC比较,**P< 0.01。图5 报告基因分析Note.Compared with the miR-126 NC, **P< 0.01.Fig.5 Reporter gene analysis
2.5 miR-126 mimics对SW480细胞中SOX2蛋白及mRNA表达量的影响
如图6所示,miR-126 mimics和miR-126 NC转染SW480细胞48 h后,与miR-126 NC组比较,miR-126 mimics组SOX2蛋白及mRNA表达量显著下调(P< 0.01)。
3 讨论
miRNA是一类高度保守的能够与靶基因3’UTR区域结合的非编码RNA分子,进而负性调控靶基因的转录,参与细胞的增值、分化与凋亡。研究发现miRNA基因组主要位于肿瘤基因的脆性区,因此常作为癌基因或者抑癌基因参与肿瘤的发生发展[3-4]。2003年Michael等[6]学者首次报道了结肠癌中存在差异性表达的miRNA(miR-143及miR-145),其表达量显著下调,且发现G蛋白γ7和HGK等是其靶基因。后续研究人员通过微阵列芯片分析法及RT-PCR技术不断在肠癌组织中发现异常表达的miRNA[5-6]。至此miRNA作为肠癌的潜在诊断标志物,受到了研究人员的极大关注,并成为近几年的研究热点[5-6]。miR-126是最早在人乳腺癌中被发现的且基因组位于人类染色体9q34.3上的一种抑癌miRNA,在血管丰富的组织中高表达,如肺、心等[7-8]。研究表明 miR-126在多数肿瘤组织中低表达,并与肿瘤的发生发展密切相关[7-8]。如Dfaz等[11]首次发现miR-126在结肠癌中低表达,并与病理分级有关。后续研究者进一步证实了miR-126在结肠癌组织中的低表达,但具体的作用机制尚未明确,因此本研究将对此展开探讨[8, 12]。本研究首先利用脂质体转染miR-126 mimics和miR-126 NC,RT-PCR结果证实转染成功。接着采用MTT及annexin V-FITC/PI流式双染技术检测miR-126 mimics对SW480细胞活力及细胞凋亡的的影响,结果表明miR-126 mimics能显著降低SW480细胞活力,并提高细胞早期凋亡率及晚期凋亡率,此结论与以往观点一致[13],说明miR-126 mimics能显著的抑制SW480细胞增殖,并诱导细胞凋亡。肿瘤细胞的无限增殖与凋亡受限制源自于细胞周期的不可控制,特别是细胞周期调控点的紊乱,如G1、G2及S期,此细胞周期调控点也是众多抗肿瘤药物的作用靶点[14-15]。因此本研究继续利用流式细胞术检测miR-126 mimics对SW480细胞周期的影响,结果表明miR-126 mimics能使细胞周期阻滞于G1期。从而说明miR-126 mimics能显著的抑制SW480细胞增殖,并诱导细胞凋亡。
miR-126同众多miRNA一样,基本都是通过靶向调控靶基因转录进而参与细胞的增殖、分化、凋亡及细胞周期等生物学行为。有研究显示SOX2是miR-126的下游靶基因之一[9],但在结肠癌进展过程中尚未得到验证,因此本研究将探讨miR-126 是否能够靶向调控SOX2的表达。SOX基因家族最早发现于Y染色体缺失的小鼠上,该家族成员广泛分布于鸟类、鱼类、果蝇、哺乳动物中,迄今为止已发现超过30种。SOX-2是SOX基因家族的一员,是与哺乳动物性别决定基因相关的一种核转录因子,对胚胎形成、发育,神经发育,性别决定起着重要作用,特别对于维持胚胎干细胞的全能性起着关键性作用。近些年来研究也发现SOX2对肿瘤的发生发展过程起着重要作用,在结肠癌、肺癌、肝癌中高表达[10]。本研究首先探讨miR-126 mimics对SW480细胞中SOX2表达的影响,western blot及RT-PCR结果显示miR-126 mimics组SOX-2蛋白及mRNA表达量均较miR-126 NC组显著下调,说明miR-126 mimics能够负性调控SOX2表达。接着荧光素酶报告基因表达也证实了miR-126 mimics能靶向结合于SOX2的3’UTR区域,进一步说明miR-126 mimics 在SW480细胞中对SOX-2的负性调控,继而发挥其对SW480细胞的增殖抑制及凋亡诱导作用。
综上所述,miR-126 mimics能显著降低SW480细胞活力,诱导细胞凋亡,阻滞细胞周期于G1期,是通过负性调控SOX2表达实现的。
参考文献:
[1] 王莉莉, 雷蕾, 杨进. 结直肠癌表观遗传学研究进展 [J]. 基因组学与应用生物学, 2014, 33(1): 200-204.
[2] 陈铁晖, 黄少芬, 李晓庆, 等. 福建省2007-2011年恶性肿瘤死亡流行病学特征及变化趋势分析 [J]. 中国预防医学杂志, 2013, 14(5): 370-374.
[3] Ahmed FE. miRNA as markers for the diagnostic screening of colon cancer [J]. Expert Rev Anticancer Ther, 2014, 14(4): 463-485.
[4] Kanematsu S, Tanimoto K, Suzuki Y, et al. Screening for possible miRNA-mRNA associations in a colon cancer cell line [J]. Gene, 2014, 533(2): 520-531.
[5] Gambari R, Brognara E, Spandidos DA, et al. Targeting oncomiRNAs and mimicking tumor suppressor miRNAs: New trends in the development of miRNA therapeutic strategies in oncology (Review) [J]. Int J Oncol, 2016, 49(1): 5-32.
[6] Michael MZ, O’Connor SM, van Holst Pellekaan NG, et al. Reduced accumulation of specific microRNAs in colorectal neoplasia [J]. Mol Cancer Res, 2003, 1(12): 882-891.
[7] 李少君, 段建敏. miRNA-126与肿瘤靶基因的研究进展 [J]. 现代肿瘤医学, 2016, 24(7): 1150-1153.
[8] 岑俊威, 曾骏成, 周宇. miRNA-126与消化系统疾病关系的研究进展 [J]. 新医学, 2015, 46(10): 645-649.
[9] Zhao C, Li Y, Zhang M, et al. miR-126 inhibits cell proliferation and induces cell apoptosis of hepatocellular carcinoma cells partially by targeting Sox2 [J]. Hum Cell, 2015, 28(2): 91-99.
[10] 纪晓宁, 王小杰. 基因Sox2与肿瘤的研究进展 [J]. 肿瘤防治研究, 2014, 41(12): 1352-1356.
[11] Diaz R, Silva J, Garcia JM, et al. Deregulated expression of miR-106a predicts survival in human colon cancer patients [J]. Genes Chromosomes Cancer, 2008, 47(9): 794-802.
[12] Jia AY, Castillo-Martin M, Bonal DM, et al. MicroRNA-126 inhibits invasion in bladder cancer via regulation of ADAM9 [J]. Br J Cancer, 2014, 110(12): 2945-2954.
[13] Ebrahimi F, Gopalan V, Wahab R, et al. Deregulation of miR-126 expression in colorectal cancer pathogenesis and its clinical significance [J]. Exp Cell Res, 2015, 339(2): 333-341.
[14] McInerny CJ. Cell cycle regulated transcription: from yeast to cancer [J]. F1000Res, 2016, 5.
[15] Otto T, Sicinski P. Cell cycle proteins as promising targets in cancer therapy [J]. Nat Rev Cancer, 2017, 17(2): 93-115.
