寡核苷酸探针套涂染结合基因组原位杂交和分子标记分析准确鉴定小麦-百萨偃麦草异源易位系的研究
2018-05-04刘志涛陈健泳王艳芝庄丽芳亓增军
杨 骄,刘志涛,陈健泳,王艳芝,庄丽芳,亓增军
(南京农业大学作物遗传与种质创新国家重点实验室,江苏南京 210095)
染色体工程是小麦遗传改良的重要途径,在转移和利用外源基因、培育持久抗性品种和拓宽小麦遗传基础研究中做出了重要贡献[1]。近年来,采用多种染色体诱变技术,越来越多的小麦异源易位系不断创造出来,不但为小麦品种改良提供了重要基因资源,而且为染色体生物学和基因组学研究提供了重要工具材料。染色体分带、基因组原位杂交(Genomicinsituhybridization, GISH)和以质粒为探针的荧光原位杂交(Fluorescenceinsituhybridization, FISH)[1-3]技术在外源染色体研究中发挥重要作用,但是,这些技术染色体专化性差,染色体识别清晰度低,探针制备和杂交程序复杂、成本高,因此尚不能大规模和准确鉴定各类易位系,特别是小片段和非补偿性易位系[4-5],从而限制了这些新易位系的深入研究和应用。
最新发展的寡核苷酸探针套涂染技术可以通过一次FISH准确识别小麦及其亲缘植物染色体,不但能揭示不同品种间染色体的多态性[4-5],而且还可以不通过GISH分析直接识别我国小麦品种中常见的三种易位系,即T1BL·1RS,T6VS·6AL及相互易位T1RS·7DL和T7DS·1BL[5],显示了该技术的简单、经济和高效特点。但是,单一的寡核苷酸探针套涂染仍难以准确判断发生在小麦和外源染色体常染色质区或缺少明显带纹特征区段的易位断点,仍然存在一定的局限性[4-5]。分子标记在鉴定染色体易位片段、染色体部分同源性和物理作图中发挥重要作用[6-13],特别是在鉴定小片段易位时更有独特的优势[10-13]。但是,单一的分子标记分析难以鉴定相互易位等复杂变异,分子标记分析揭示的易位片段必须结合细胞学分析才能得到确证,因此,综合利用细胞遗传和分子标记分析,可以取长补短,提高染色体变异鉴定效率。为探讨最新发展的寡核苷酸探针套涂染技术与GISH和分子标记分析相结合在准确鉴定各类染色体变异中的应用潜力,本研究以通过电离辐射诱致的两个小麦-百萨偃麦草5J染色体易位系为材料,探讨综合利用寡核苷酸探针套涂染、GISH和分子标记分析准确鉴定染色体易位片段及其他染色体变异,确定染色体易位断点并进行染色体物理作图,以期为准确鉴定小麦异源易位系提供更有效的方法,并为更好地研究和利用这些易位系、揭示外源染色体的共线性特点提供信息。
1 材料与方法
1.1 材 料
供试材料包括中国春(2n=6x=42)、中国春-百萨偃麦草双倍体(2n=8x=56)、百萨偃麦草(2n=2x=14)、中国春-百萨偃麦草二体异代换系DS5J(5A)及DS5J(5A)经配子电离辐射并与中国春回交获得的稳定的小麦-百萨偃麦草易位系NAU16YJ127和NAU16YJ124(两个易位系的具体易位片段尚未得到准确鉴定)[14-15]。
1.2 方 法
1.2.1 细胞遗传分析
根尖细胞有丝分裂中期染色体制片:参考Kato[16]的方法并加以改动。将种子置于23 ℃恒温箱培养24 h左右,在种子露白后倒掉多余水分,继续培养到根长约1~2 cm时,剪取根尖放于一氧化二氮(N2O)中处理2 h,然后将处理过的根尖用90%冰醋酸固定10 min后,取出,置于70%乙醇中保存。制片时,取出根尖,吸去乙醇后置于45.0%醋酸中解离3~5 min,然后,切取分生组织压片。染色体制片在-70 ℃冰箱中过夜,然后,揭去盖玻片,在无水乙醇中脱水后备用。
原位杂交所用探针及其标记方法:百萨偃麦草基因组DNA探针采用缺口平移法,利用Fluorescein-12-dUTP进行标记,具体参照Du等的方法[4]。所用寡核苷酸探针套包括(GAA)10、pSc119.2-1、pAs1-1、pAs1-3、AfA-3和AfA-4 六个寡核苷酸探针,其序列组成和修饰参照Du等[4]和王丹蕊等[5]的方法,其中(GAA)10、pSc119.2-1为FAM修饰,pAs1-1、pAs1-3、AfA-3和AfA-4为TAMRA修饰。
杂交液组成:每张染色体制片所用的杂交液总体积为22 μL,包含99.5%的甲酰胺(Sigma公司)7.5 μL,20 × SSC 1.5 μL,10 mg·mL-1的Salmon sperm DNA 0.5 μL,50.0%的Dextran Sulfate 2.5 μL,Blocking DNA(2 000 ng·L-1) 2 μL,百萨偃麦草基因组DNA探针2 μL,1 pmol·μL-1的(GAA)10,10 pmol·μL-1的pSc119.2-1、pAs1-1、pAs1-3、AfA-3和AfA-4各1 μL。
杂交程序和显微镜观察:杂交液于105 ℃变性13 min,随后迅速将含有杂交液的离心管置于-20 ℃酒精中冷却10 min以上,然后将杂交液加到已经变性的染色体制片上,在37 ℃恒温箱中杂交6 h以上,揭去盖玻片,在42 ℃蒸馏水中洗2次(各5 min),于常温下在McIIvaine buffer(3.6 g C6H8O7和58.9 g Na2HPO4用ddH2O定容至1 000 mL)中洗5 min,用洗耳球迅速吹干后,用含DAPI的Mounting胶(Vectashield H-1200,Vector公司)在黑暗中套染10 min,盖上盖片,在Olympus BX51型荧光显微镜下观察,用SPOT CCD(SPOT Cooled Color Digital Camera)获取图像。
1.2.2 分子标记分析
植物基因组DNA提取采用CTAB法,具体步骤参考文献[14],本研究选用21个百萨偃麦草染色体5J特异分子标记[14-15],其标记名称、引物序列、染色体定位和来源见表1。
PCR扩增体系为10 μL,包含2×Tsingke Master Mix(即用型快速PCR反应缓冲液,擎科公司) 5 μL,模板DNA 1.5 μL,引物0.5 μL,ddH2O 3 μL。PCR反应程序为94 ℃预变性3 min;94 ℃ 30 s,52~55 ℃ 45 s,72 ℃ 1 min 10 s,34~36个循环;72 ℃退火10 min;置于4 ℃保存。
对扩增产物进行8.0%非变性聚丙烯酰胺凝胶电泳,电泳后使用“两步法”对扩增产物进行银染检测,然后进行观察拍照,利用凝胶成像分析仪(JS-680D,上海培清科技有限公司)提供的图像分析软件Launch SensiAnsys对目标条带分子量进行测定。
1.2.3 物理作图分析
根据21个标记在中国春、中国春-百萨偃麦草双倍体、DS5J(5A)及NAU16-YJ127和NAU16YJ124两个易位系中的扩增结果,分别统计5J和5A特异标记的扩增情况,具有预期扩增位点的记为“1”,没有预期位点的记为“0”,实验重复两次,综合标记在5J、5A、T5JS·5JL-5AL#1和T5JS·5JL-6AL的扩增情况、染色体区段大小和区段重叠特点,结合刘志涛[14]前期的定位信息对21个5J特异标记和3个5A特异标记进行染色体区段定位,并绘制相应的染色体物理图谱,物理图中每个区段包含的标记为随机排列,不代表遗传顺序,模式图中区段大小参考易位区段在染色体上的实际比例绘制。
2 结果与分析
2.1 寡核苷酸探针套涂染和GISH分析结果
利用Du等[4]开发和王丹蕊等[5]优化的寡核苷酸探针套结合GISH分析,对2个易位系(NAU16YJ127和NAU16YJ124)的染色体组成进行了鉴定。结果表明,易位系NAU16YJ127(2n=6x=42)包含一对易位染色体,其中外源片段包含完整的短臂和长臂大片段,而小麦染色体仅涉及顶端小片段且没有任何B和D基因组染色体的特异杂交信号,同时整个核型中未发现完整的5A染色体,因此推测该易位发生在5J和5A之间,初步命名为T5JS·5JL-5AL#1,除了该易位染色体外,其6A和2D染色体长臂顶端发生相互易位,初步命名为T6AS·6AL-2DL和T2DS·2DL-6AL,其他染色体未见明显变化(图1)。易位系NAU16YJ124包含44条染色体,添加了一对小麦-百萨偃麦草易位染色体,其外源区段包含完整短臂但长臂区段明显小于NAU16YJ127中T5JS·5JL-5AL#1的长臂区段,同时6A长臂发生缺失,仅包含近着丝粒绿色信号,命名为del6AL,而含有近端部绿色信号的6AL缺失区段易位到5JL上,形成T5JS·5JL-6AL(图2),其他小麦染色体未见明显变化。
2.2 分子标记分析结果
利用21个5J染色体特异分子标记(包括2个短臂和19个长臂标记)对供试材料进行分析,发现这些标记均可以在中国春-百萨偃麦草双倍体和DS5J(5A)扩增出特异位点(表1),说明标记稳定可靠;进一步分析发现,两个易位系均包含2个5J短臂标记,但19个5J长臂标记中,NAU16YJ127仅包含12个,其余7个定位于5JL缺失区段,而NAU16YJ124仅包含2个,其余17个定位于缺失区段,上述结果表明两个易位系易位断点明显不同,与细胞学结果一致(表2、图3)。

表1 用于本研究的21个百萨偃麦草5J染色体特异标记Table 1 Twenty one markers specific for chromosome 5J of Th. bessarabicumused in this study
“a”表示来自王艳芝[15];“b”表示来自刘志涛[14];“c”表示引物序列来自https://wheat.pw.usda.gov/cgi-bin/GG3/browse.cgi?class=marker。
“a” indicates markers from Wang Yanzhi[15]; “b” indicates from Liu Zhitao[14]; “ c” indicates primer sequences from https://wheat.pw.usda.gov/cgi-bin/GG3/browse.cgi?class=marker.

a:蓝色为DAPI套染;b:绿色为百萨偃麦草基因组DNA探针、寡核苷酸探针(GAA)10和pSc119.2-1信号;c:红色为寡核苷酸探针pAs1-1、pAs1-3、AfA-3和AfA-4信号;d:a、b和c的合成图,箭头示变异染色体;A、B和D分别为小麦的三个基因组。
a:Blue indicates chromosomes counterstained with DAPI; b:Green shows signals from(GAA)10, pSc119.2-1 and genomic DNA ofTh.bessarabicumL labeled with Fluorescein-12-dUTP; c:Red shows signals from pAs1-1, pAs1-3, AfA-3 and AfA-4; d:Merged of a, b and c.Arrows indicate chromosome aberrations.A, B and D indicate the three genomes of wheat, respectively.
图1普通小麦-百萨偃麦草易位系NAU16YJ127的寡核苷酸探针套涂染和GISH分析
Fig.1ChromosomepaintingusingoligonucleotidemultiplexandGISHanalysisinNAU16YJ127
根据21个标记在DS5J(5A)中的扩增结果,发现其中3个为共显性标记(图3、图4),可以同时检测染色体5A和5J。其中,NAU16Y124包含全部3个5A特异标记,表明其含有完整的5A染色体,而NAU16YJ127仅包含2个5A特异标记(X1EST281-5A和X5EST203-5A),缺少5A特异标记XZ2206-5A,由于NAU16YJ127含有的易位染色体T5JS·5JL-5AL#1仅含有5AL顶端小片段,因此X1EST281-5A和X5EST203-5A两个标记定位于5AL顶端区段,而XZ2206-5A在NAU127中没有特异位点,因此定位于易位掉的5A区段,进一步证明了NAU16YJ127中的易位涉及5J和5A染色体(图3、图4),验证了细胞学结果。

a:蓝色为DAPI染色;b:绿色为百萨偃麦草基因组DNA探针、寡核苷酸探针(GAA)10和pSc119.2-1信号;c:红色为寡核苷酸探针pAs1-1、pAs1-3、AfA-3和AfA-4信号;d: a、b和c的合成图,箭头示变异染色体;A、B和D分别为小麦的三个基因组。
a:Blue indicates chromosomes counterstained with DAPI; b:Green shows signals from(GAA)10,pSc119.2-1 and genomic DNA ofTh.bessarabicumL labeled with Fluorescein-12-dUTP; c:Red shows signals from pAs1-1, pAs1-3, AfA-3 and AfA-4; d:Merged of a, b and c.Arrows indicate chromosome aberrations;A, B and D indicate the three genomes of wheat, respectively.
图2普通小麦-百萨偃麦草易位系NAU16YJ124的寡核苷酸探针套涂染和GISH分析
Fig.2ChromosomepaintingusingoligonucleotidemultiplexandGISHanalysisinNAU16YJ124
2.3 物理作图
根据21个5J特异标记在完整5J和两条易位染色体上的扩增结果,将21个标记定位于5J染色体4个不同区段,其中短臂区段1个,包含2个标记,长臂区段3个,命名为5JL-1~3,分别包含2、10和7个标记(图4)。可以追踪5A的3个特异标记定位于5A的2个区段,其中2个位于5AL顶端,1个位于5A长臂近着丝粒区段(图4)。
3 讨 论
如何快速准确地鉴定染色体变异一直是染色体工程的重要研究内容。本研究结果表明,综合分子标记、寡核苷酸探针套涂染和GISH技术为实现这一目标提供了新的方案。GISH技术可以准确判断易位片段大小,但无法明确身份和断点位置,分子标记可以快速识别大多数丢失的小麦和外源染色体或区段,但是不能直观鉴定易位片段大小,对相互易位和倒位鉴定难度大甚至无法鉴定,寡核苷酸探针套涂染技术可以高清晰识别小麦染色体变异[4-5],但是无法识别易位断点发生的精确位置。本研究综合利用这些技术清晰地识别了两种经辐射诱导的两个小麦-百萨偃麦草易位类型,除明确了两种小麦-百萨偃麦草染色体5J易位外,还发现小麦染色体的缺失和相互易位,三种技术相互印证,增加了鉴定的准确性。物理作图发现,2个共显性标记同时定位于5J和5A长臂顶端小片段,暗示两条染色体具有很好的共线性。进一步筛选定位更多的5AL近端部特异标记,有利于发现5AL存在的易位断点,对进一步鉴定5JL断点也具有重要的参考价值,充分体现了分子标记在准确鉴定易位断点中的优势。Patokar等[17]利用中国春 ph1突变体诱导,选育出涉及5JL小片段易位到5AL上形成的小片段易位T5AS·5AL-5JL,与我们选育的易位系相比,其外源片段只占很小部分,而我们选育的易位系外源片段占很大部分。Li 等[18]报道,禾谷类作物染色体4L/5L存在的易位断点可能代表一类染色体断裂重接热点。本研究以及国外科学家相继育成涉及5JL不同类型易位系的报道,进一步证明5JL类似于谷类作物5L,可能同样存在一个断裂重接热点,因此可以推测5J和5A的关系可能更近些,本研究已经鉴定出涉及这两条染色体的更多的易位类型。上述结果表明,综合采用三种技术,可以取长补短,提高鉴定的效率和准确性,为长期以来难以鉴定的复杂变异体的准确识别提供了可靠的方法。研究还发现,除准确鉴定了小麦-百萨偃麦草染色体易位外,从两个材料中还发现明显的小麦染色体变异,一种是6A缺失,另一种是6A和2D间的相互易位,充分反映了电离辐射诱发变异的复杂性。对于NAU16YJ124而言,除了包含一对缺失染色体del6AL外,6A缺失掉的片段易位到5JL上形成了小麦-百萨偃麦草易位T5JS·5JL-6AL,因此6A的遗传信息是完整的,只是分成了两个不同的区段,像这样的复杂变异,单纯利用分子标记是无法识别的,但是细胞学标记特别是本研究开发的寡核苷酸探针套可以清晰区分;同理,发生在NAU16YJ127中的6A和2D相互易位,也是靠细胞学标记才能加以准确区分,充分反映了寡核苷酸探针套涂染等细胞学鉴定技术的重要性。

1:中国春;2:中国春-百萨偃麦草双倍体;3:DS5J(5A);4:NAU16YJ127;5:NAU16YJ124;M:DL2000。长箭头示5J特异条带,短箭头示5A特异条带。
1:Chinese Spring; 2:CS-Th.bessarabicumamphiploid; 3:DS5J(5A); 4:NAU16YJ127; 5:NAU16YJ124;M:DNA ladder(DL2000).Long arrows indicate the 5J specific loci, and short arrows indicate the 5A specific loci.
图3百萨偃麦草染色体5J的特异标记(X5EST205,X5EST636,XZ2206)扩增结果
Fig.3Amplificationwithspecificmolecularmarkers(X5EST205,X5EST636,XZ2206)forchromosome5JofTh.bessarabicumL
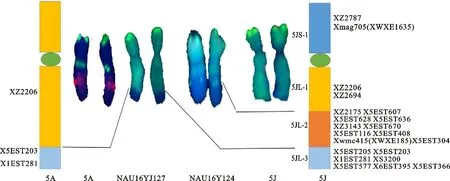
图4 百萨偃麦草5J染色体物理作图(显示红色的标记为共显性标记)

表2 21个百萨偃麦草染色体5J专化标记的扩增结果Table 2 Amplification with 21 specific markers for Th.bessarabicum chromosome 5J
“0”表示没有染色体5J或5A特异条带,“1”表示有5J或5A特异条带。
“0” indicates absence of the 5J- or 5A-specific loci, and “1” indicates presence of the specific loci.
小麦族植物第五群染色体定位了很多有利基因,例如籽粒硬度基因[19-21]、春化基因[22-23]、 Ph1基因[24-25]、光敏色素基因[26-27]等,初步研究发现,百萨偃麦草5J染色体导入小麦背景对小麦株高、穗型和耐盐性等具有明显影响[9, 15, 28],但是这些基因尚未得到发掘和利用。本研究所鉴定的易位系涉及不同的外源区段,结合前期选育的其他变异体,为准确鉴定和转移利用5J染色体有利基因提供了重要的种质资源。本研究物理定位的21个标记,特别是定位于5JL和5AL顶端的共显性标记为进一步检测染色体易位断点、追踪5JL特异区段提供了重要信息。
参考文献:
[1]JIANG J M,FRIEBE,B,GILL B S.Recent advances in alien gene transfer in wheat [J].Euphytica,1994,73(3):199.
[2] 亓增军,刘大钧,陈佩度.利用染色体C-分带和双色荧光原位杂交技术鉴定普通小麦-黑麦-簇毛麦双重易位系1RS·1BL,6VS·6AL[J].遗传学报,2001,28(3):267.
QI Z J,LIU D J,CHEN P D.Development and identification ofT.astivum-S.cereal-H.villosadouble translocation line 1RS.1BL,6VS.6AL via chromosome C-banding and dual color FISH[J].JournalofGenetic&Genomics,2001,28(3):267.
[3] 宫文萍,李光蓉,韩 冉,等.济麦系列小麦荧光原位杂交(FISH)分析[J].山东农业科学,2016,48(1):16.
GONG W P,LI G R,HAN R,etal.Fluorescenceinsituhybridization analysis of Jimai serial wheat[J].ShandongAgriculturalSciences,2016,48(1):16.
[4]DU P,ZHUANG L,WANG Y,etal.Development of oligonucleotides and multiplex probes for quick and accurate identification of wheat andThinopyrumbessarabicumchromosomes[J].Genome,2017,60(2):93.
[5] 王丹蕊,杜 培,裴自友,等.基于寡核苷酸探针套painting的中国春非整倍体高清核型及应用[J].作物学报,2017,43(11):1575.
WANG D R,DU P,PEI Z Y,etal.Development and application of high resolution karyotypes of Chinese Spring aneuploids [J].ActaAgronomicaSinica,2017,43(11):1575.
[6]WILLIAM M D H M,MUJEEB-KAZI A.Biochemical and molecular diagnostics ofThinopyrumbessarabicumchromosomes inTriticumaestivumgermplasm[J].TheoreticalandAppliedGenetics,1995,90(7-8):952.
[7]WILLIAM M D H M,MUJEEB-KAZI A.Thinopyrumbessarabicum:biochemical and cytological markers for the detection of genetic introgression in its hybrid derivatives withTriticumaestivumL.[J].TheoreticalandAppliedGenetics,1993,86(2-3):365.
[8]ZHANG J Y,LI X M,WANG R,etal.Molecular cytogenetic characterization of E(b)-genome chromosomes inThinopyrumbessarabicumdisomic addition lines of bread wheat[J].InternationalJournalofPlantSciences,2002,163:167.
[9]KING I P,PURDIE K A,REZANOOR H N,etal.Characterization ofThinopyrumbessarabicumchromosome segments in wheat using random amplified polymorphic DNAs(RAPDs) and genomicinsituhybridization[J].TheoreticalandAppliedGenetics,1993,86(8):895.
[10]QI Z,DU P,QIAN B,etal.Characterization of a wheat-Thinopyrumbessarabicum(T2JS-2BS·2BL) translocation line [J].TheoreticalandAppliedGenetics,2010,121(3):589.
[11]SHEN Y,SHEN J,DAWADONDUP,etal.Physical localization of a novel blue-grained gene derived fromThinopyrumbessarabicum[J].MolecularBreeding,2013,31(1):195.
[12]TEKIEH F.Towards the identification of candidate gene(s) forFusariumhead blight resistance on the 7EL chromosome ofThinopyrumelongatum:Design and use of genetic markers[D].Ottawa:University of Ottawa,2017:50.
[13]ZHAO R,WANG H,XIAO J,etal.Induction of 4VS chromosome recombinants using the CS ph1b mutant and mapping of the wheat yellow mosaic virus resistance gene fromHaynaldiavillosa[J].TheoreticalandAppliedGenetics,2013,126(12):2921.
[14] 刘志涛.基于转录组测序的百萨偃麦草EST-SSR标记开发与染色体物理作图[D].南京:南京农业大学,2015:32.
LIU Z T.Development of EST-SSR markers based on transcriptome sequencing and physical mapping forThinopyrumbessarabicum[D].Nanjing:Nanjing Agricultural University,2015:32.
[15] 王艳芝.百萨偃麦草染色体小片段易位的创制、鉴定与基因定位分析[D].南京:南京农业大学,2013:30.
WANG Y Z.Development and characterization of small segment translocation ofThinopyrumbessarabicumand cytological mapping of interest genes[D].Nanjing:Nanjing Agricultural University,2013:30.
[16]KATO A.Air drying method using nitrous oxide for chromosome counting in maize[J].BiotechnicandHistochemistry,1999,74(3):160.
[17]PATOKAR C,SEPSI A,SCHWARZACHER T,etal.Molecular cytogenetic characterization of novel wheat-Thinopyrumbessarabicumrecombinant lines carrying intercalary translocations [J].Chromosoma,2016,125(1):163.
[18]LI W,CHALLA G S,ZHU H,etal.Recurrence of chromosome rearrangements and reuse of DNA breakpoints in the evolution of theTriticeaegenomes [J].G3,2016,6(12):3837.
[19]GIROUX M J,MORRIS C F.A glycine to serine change in puroindoline b is associated with wheat grain hardness and low levels of starch-surface friabilin [J].TheoreticalandAppliedGenetics,1997,95(5):857.
[20]GIROUX M J,MORRIS C F.Wheat grain hardness results from highly conserved mutations in the friabilin components puroindoline a and b [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1998,95(11):6262.
[21]MORRIS C F,MASSA A,GEDYE K,etal.Sequence diversity of the puroindoline a and b genes inAegilopstauschii-relationship to kernel texture in wheat [C].Proceedings of the 10th Internatonal Wheat Genetics Symposium.2003,1:451.
[22]FU D,SZÜCS P,YAN L,etal.Large deletions within the first intron in VRN-1 are associated with spring growth habit in barley and wheat[J].MolecularGeneticsandGenomics,2005,273(1):54.
[23]KIPPES N,DEBERNARDI J M,VASQUEZ-GROSS H A,etal.Identification of the VERNALIZATION 4 gene reveals the origin of spring growth habit in ancient wheats from South Asia[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2015,112(39):e540.
[24]GILL K S,GILL B S.A PCR-based screening assay of Ph1,the chromosome pairing regulat or gene of wheat[J].CropScience,1996,36(3):719.
[25]GRIFFITHS S,SHARP R,FOOTE T N,etal.Molecular characterization of Ph1 as a major chromosome pairing locus in polyploid wheat [J].Nature,2006,439(7077):749.
[26]DEVOS K M,BEALES J,OGIHARA Y,etal.Comparative sequence analysis of the phytochrome C gene and its upstream region in allohexaploid wheat reveals new data on the evolution of its three constituent genomes [J].PlantMolecularBiology,2005,58(5):625.
[27]CHEN A,LI C,HU W,etal.PHYTOCHROME C plays a major role in the acceleration of wheat flowering under long-day photoperiod [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2014,111(28):10037.
[28]KING I P,FORSTER B P,LAW C C,etal.Introgression of salt-tolerance genes fromThinopyrumbessarabicuminto wheat [J].NewPhytologist,1997,137(1):75.
