陕西略阳铁矿尾矿放线菌的分离、鉴定及抗菌活性
2018-05-03姜午春解修超邓百万刘军生
姜午春, 解修超,2*, 彭 浩,2, 邓百万,2, 刘军生
(1.陕西理工大学 生物科学与工程学院, 陕西 汉中 723000; 2.陕西理工大学 陕西省食药用菌工程技术研究中心, 陕西 汉中 723000)
放线菌(Actinomycete)作为一类单细胞微生物,属原核生物DNA中G+C含量百分比大于55%的革兰氏阳性菌,具有多种不同的细胞形态结构。其大多数具有发达的分枝菌丝,且菌丝纤细,宽度近于杆状细菌,约0.5~1 μm。放线菌多腐生好气,在自然界分布广泛,主要以孢子或菌丝状态存在于土壤、空气和水中,在大气中也有悬浮,尤其以含水量低、有机物丰富、呈中性或微碱性的土壤中数量较为丰富。一般在中性和偏碱性的土壤和有机质丰富的土壤中放线菌种类和数量会最多,春秋季的放线菌数量则会多于夏冬[1-2]。略阳地处陕西省汉中盆地西部,坐落于陕甘川三省交界地带,全县矿藏资源种类多、分布广、储量大、品位高、易开采。而尾矿中常含有重金属离子及部分放射性物质,所以会导致重金属残留、空气污染、水污染等,随着大气流动,水的渗透等地球运动,会一定程度上影响尾矿周边的环境。土壤中的微生物则是调节土壤成分的重要影响者,促进土壤中各种成分之间的转换,对调节土壤环境起到了至关重要的作用[3-5]。
国内如今已有部分研究人员将视野转向尾矿附近微生物的分离研究,如铜矿[6]、铀矿等,寻找通过这类微生物的生物特性来寻找改变尾矿情况、恢复尾矿附近自然环境的方法,在发现微生物可以通过吸附沉淀、溶解、转化等不同方法减少环境中重金属的含量[7]的同时,筛选新抗生素产生菌株。近些年来有纪翠平[8]通过免培养法对邯邢铁矿放线菌多样性进行研究,吕志堂[9]针对铁矿放线菌系统发育进行分析,路桃香[10]针对金川矿区微生物多样性进行分析,李静等[11]针对耐铬放线菌的研究,房君佳等[12]针对铅锌尾矿污染下土壤微生物群落碳源代谢特征。少有对矿产丰富地——陕西略阳地区尾矿放线菌及其代谢产物抑菌活性所开展的研究。故而本研究通过组织培养法从略阳铁矿尾矿中分离得到放线菌菌株,在通过对菌落形态进行初步排重的基础上,结合16S rRNA测序、比对结果,进而分析铁矿尾矿中放线菌的生物多样性,同时对微生物代谢产物的抑菌活性进行检测,为研究陕西略阳尾矿放线菌多样性及抑菌活性,进而筛选新抗生素提供理论依据[13-14]。
1 材料与方法
1.1 材料
1.1.1 供试材料
本次试验材料取自陕西略阳县白水江区(N33°42′89.53″,E106°09′20.28″)铁矿尾矿土壤,以五点取样法取样,记为F1、F2、F3、F4、F5。
1.1.2 指示菌
大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、沙门氏菌(Salmonellatyphl)、枯草芽草杆菌(BacillusSubtilis)属细菌类致病菌,白假丝酵母菌(CanidiaAlbicans)属真菌类致病菌,均由陕西省食药用菌研究中心提供,活化培养24 h备用。
1.1.3 培养基
ATCC172培养基:葡萄糖(Glucose)1.0 g/L,可溶性淀粉(Soluble starch)2.0 g/L,酵母粉(Yeast extract)0.5 g/L,CaCO31.5 g/L,琼脂(Agar)18.0 g/L,酸水解酪蛋白(N-Z-amine)0.5 g/L,pH 7.0~7.4。
GPT培养基:葡萄糖(Glucose)10.0 g/L,蛋白胨(Pepton)5.0 g/L,胰蛋白胨(Tryptone)3.0 g/L,NaCl 5.0 g/L,琼脂(Agar)15.0 g/L,环乙酰亚胺50.0 mg/L,K2Cr2O750.0 mg/L,制霉菌素(Mystatin)30.0 mg/L,pH 7.0。
HV培养基:腐殖酸(Humic acid)1.0 g/L,CaCO30.02 g/L,Na2HPO40.5 g/L,KCl 1.7 g/L,FeSO4·7H2O 0.01 g/L,MgSO4·7H2O 0.5 g/L,琼脂(Agar)18.0 g/L,复合维生素0.5 g/L,对氢基苯甲酚0.5 g/L,pH 7.2。
高氏1号培养基:可溶性淀粉(Soluble starch)2.0 g/L,KNO30.1 g/L,K2HPO40.05 g/L,MgSO4·7H2O 0.05 g/L,NaCl 0.05 g/L,FeSO4·7H2O 0.001 g/L,琼脂(Agar)2.0 g/L,pH 7.2~7.4。
SLM(淀粉-黄豆粉发酵)培养基:黄豆粉(Soy extract)15.0 g/L,可溶性淀粉(Soluble starch)20.0 g/L,蛋白胨(Pepton)2.0 g/L,酵母粉(Yeast extract)5.0 g/L,NaCl 4.0 g/L,CaCO34.0 g/L,pH 7.2~7.4。
LB(Luria-Bertani)培养基:蛋白胨10.0 g/L,酵母粉(Yeast extract)5.0 g/L,NaCl 10.0 g/L,琼脂(Agar)15.0 g/L,pH 7.0。
1.1.4 主要仪器与试剂
光学显微镜(SA3000,北京泰克仪器有限公司制造)、PCR仪(TC-4000,英国TECHNE公司)、电泳仪(DYCP-34A,北京市六一仪器厂)、电泳仪(712BR,BIO-RAD公司)、凝胶成像系统(UVItec,Cambridge,United Kingdom)等。
氯仿、异戊醇、琼脂糖(Agarose)、乙二胺四乙酸二钠(EDTA Na2)等。
1.2 方 法
1.2.1 放线菌分离及纯化
取F1—F5五处不同的土壤样品各1.0 g,风干研磨分散均匀,以1∶10比例溶入无菌水中,过滤取滤液作为10-1初始液,梯度稀释获得10-2和10-3菌悬液[15-16]。分别在ATCC、GPT、HV、高氏1号4种放线菌分离培养基上进行稀释涂布,28 ℃培养10 d,直至有单个菌落长出,挑取单菌落在培养基上进行纯化,至最终获得单一菌株[17-18]。
1.2.2 插片法培养和形态观察
通过划线插片方式使菌丝生长于盖玻片上。插片平板倒置于28 ℃恒温箱中培养3~7 d。待菌丝长上载玻片,依次使用低倍镜、高倍镜和油镜进行观察,并与图谱对比[20-21]。
1.2.3 DNA提取及PCR扩增
采用CTAB法提取DNA[22],对提取的DNA进行PCR扩增。使用引物27f:5′-AGA GTT TGA TCC TGG CTC AG-3′和1492r:5′-TAC GGC TAC CTT GTT ACG ACT T-3′。50.0 μL PCR扩增反应体系:MIX 25 μL、引物27f、引物1492r、DNA模板2 μL、ddH2O 19 μL。PCR扩增程序:94 ℃ 5 min;94 ℃ 1 min,51 ℃ 1 min,72 ℃ 2 min,33个循环;72 ℃ 10 min。产物以冰袋包裹,委托上海生工检测。将测得的核苷酸序列在EZ BioCloud中进行比对。根据所获得的相似性序列,采用邻接法来构建系统进化树[23-24]。
1.2.4 抑菌试验
纯化所得菌株分别接种于SLM液体培养基,28 ℃下振荡培养10 d后,4 ℃ 12 000 rpm离心10 min,取上清液过滤,4 ℃保存,做抑菌试验待用。
分别以大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、沙门氏菌和白假丝酵母菌作为指示菌,分别接种LB培养基振荡培养24 h成指示菌悬液。指示菌加入培养基制成平板,滤纸片浸入发酵液,均匀转放在的平板处,37 ℃倒置培养24 h后[25-26],观察测量不同发酵液产生的抑菌圈直径大小。
2 结果分析
2.1 陕西略阳尾矿中放线菌分离
从陕西略阳铁矿尾矿土壤中共分离得到44株菌株,通过菌落颜色、大小等形态学比较排重,最终获得27株菌株。
2.2 尾矿中放线菌形态学鉴定
从陕西略阳尾矿土壤中所分离纯化的27株菌株,部分菌落图片如图1所示,部分菌落形态描述如表1所示。
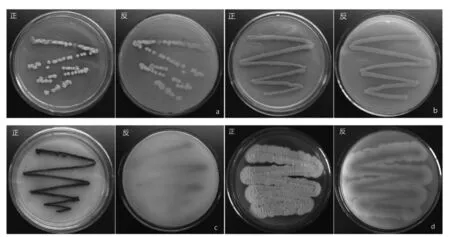
图1 部分代表菌株菌落正反面
图1a中菌落呈点状,边缘光滑,表面呈颗粒状凸起,菌丝致密略有黏液,产生浅黄色色素;图1b中菌落呈线状,边缘整齐,表面呈颗粒状凸起,产橘黄色色素;图1c中菌落连续、边缘整齐,菌落小且产生紫红色色素;图1d中菌落边缘不规则,表面干燥呈粉状褶皱,气生菌丝呈灰白色,基内菌丝呈灰黄色,菌落整体较大,菌丝易剥落。

表1 分离纯化的尾矿菌株菌落形态
如表1结果所示,IMW01、IMW02等10株菌表面干燥呈粉状且菌落易剥离,占总分离菌株71.43%,其菌落表面呈现粉状,基内菌丝多表现为灰黄色和紫灰色,所对应气生菌丝则分别为黄棕色与深棕色;IMW14、IMW16等4株表面粗糙有粒状凸起,菌落略大附有黏液菌丝致密,占总分离菌株28.57%,基内菌丝纤细,无气生菌丝或气生菌丝罕见,菌落表面粗糙有颗粒状凸起,基内菌丝分别为深棕色、紫红色和深褐色。
结合图1和表1分析,IMW01、02、03、04、05、08、11、12、13、15菌落形态与链霉菌属相似,IMW14、16、18、20菌落形态与小单孢菌属相似。
2.3 尾矿中放线菌分子生物学鉴定
2.3.1 凝胶图谱
对27株菌进行16S rRNA扩增,其中14株菌通过1%琼脂糖凝胶检测确定扩增出16S rRNA片段,经PCR扩增后所得片段长度处于1000~2000 bp之间,大致1500 bp左右。将扩增产物送至上海生工进行测序,将双向测通后的序列进行拼接,获得16S rRNA完整序列信息。
2.3.2 菌株序列进化树
将测序结果提交至NCBI获取登录号,并在EZ BioCloud进行比对,根据结果,选择同源性较高的14株放线菌的16S rRNA序列,利用MEGA5.0构建系统发育树(图2)。

图2 尾矿放线菌16S rRNA系统发育树
图2结果表明,菌株IMW01、02、03、04、05、08、11、12、15号菌与链霉菌(Streptomyces)形成一个分支,IMW13号菌属与链霉菌另单独形成一个分支,属链霉菌属,占比71.42%;IMW14、16、18号菌属小单孢子菌属(Micromonospora),占比21.44%。IMW20菌株与原小单孢菌属(Promicromonospora)单独聚为一支,属原小单孢属,占比7.14%。陕西略阳铁矿尾矿中分离出的14株菌株主要分属:链霉菌(Streptomyces)、小单孢子菌属(Micromonospora)、原小单孢菌属(Promicromonospora)。
2.4 抑菌试验
2.4.1 抑菌圈大小统计及分析
以用滤纸片法进行抑菌试验48 h后,测量抑菌圈大小,统计观察,有明显抑菌效果(如表2所示)。
表2结果表示,以上10株菌株代谢产物对靶标菌株大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、沙门氏菌、白假丝酵母存在不同程度的抑制作用,对金黄色葡萄球菌及白假丝酵母的抑制作用较强,对大肠杆菌抑制作用较弱。其中IMW01、08、12、15这4株链霉菌对5种靶标菌均存在抑制作用,且所分离出的菌株中抑菌作用链霉菌属强于小单孢属。
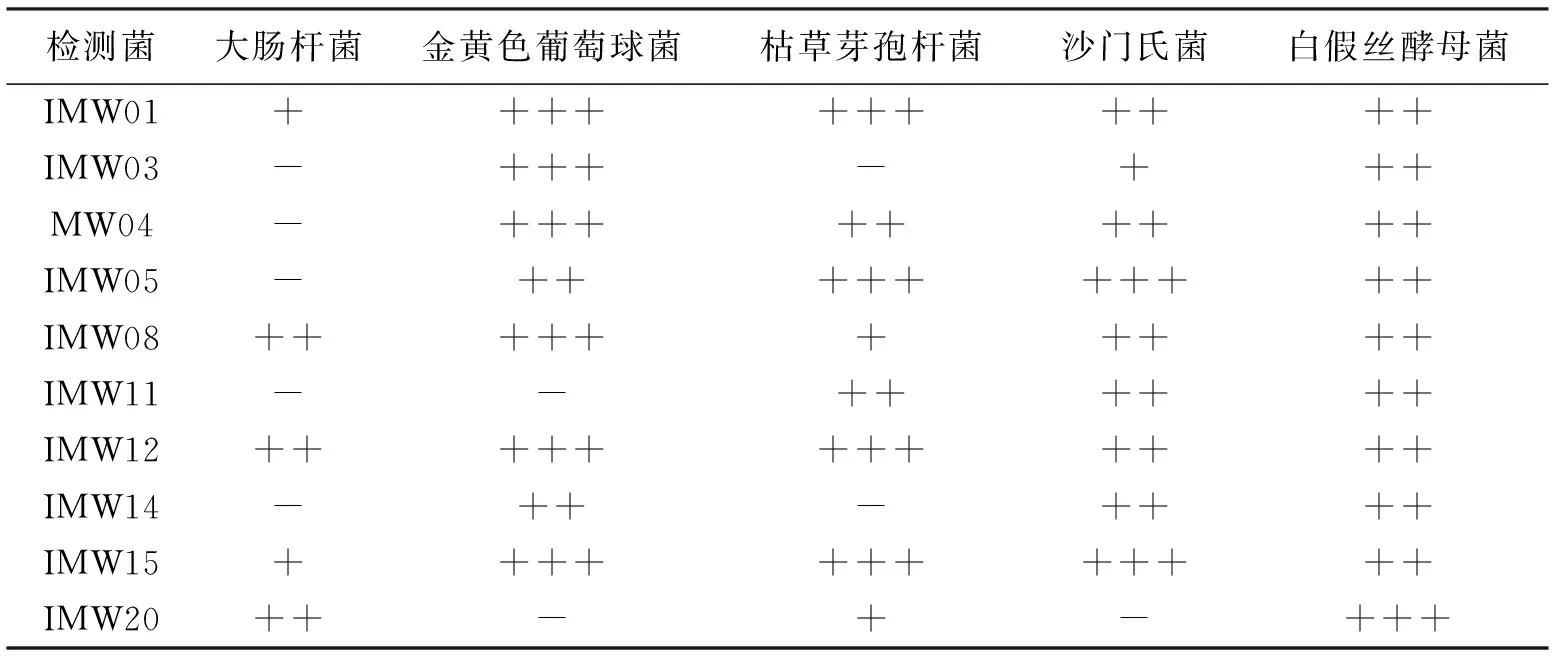
表2 抑菌圈大小
注:+++表示抑菌作用明显;++表示抑菌作用较明显;+表示抑菌作用有效果但不明显;-表示无抑菌效果
3 讨 论
对陕西略阳铁矿尾矿土壤中菌株进行的分离,结合形态学及分子生物学进行鉴定,确认共分离纯化出14株放线菌。其中链霉菌属占71.42%,与纪翠平[8]、吕志堂[9]所研究铁矿尾矿中通过对放线菌类群以链霉菌为主的情况相同。本文在此基础上,进一步通过代谢产抑菌活性物质的检测,确认所分离得到的放线菌对至少1种靶标菌表现出不同程度的抑菌活性,印证了近年来研究放线菌产物活性。特别是其中LMW01、08、12、15号菌株代谢产物对5种靶标菌均表现出明显抑菌性,占总检测菌株的28.57%,与其他环境微生物中抑菌菌株占比相当,且链霉菌属8株,占比80%。
试验表明,所筛选出菌株,代谢产物均具有不同程度的抑菌活性,部分菌种具有较强的抑菌活性,且对真菌性病原菌抑制效果较为明显,说明代谢产物中含有部分活性成分,与放线菌为抗生素主要产生菌这一结论相同,且具有活性产物的菌株中,链霉菌占比较高,符合链霉菌属为主要产抗生素菌属这一结论[27-28]。由此,陕西略阳尾矿放线菌在活性物质研究方面具有较大潜力,可进一步研究,为研究抑菌活性及新抗生素筛选提供理论依据。
[参考文献]
[1] 姜成林,徐丽华.微生物资源学[M].北京:科学出版社,1997.
[2] 洪亮.不同生境中稀有放线菌的研究进展[J].红河学院学报2009,7(2):27-30.
[3] 徐岩.发酵工程[M].北京:高等教育出版社,2011:3-7.
[4] GOODFELLOW M,WILLIAMS S T.Ecology of actinomycetes[J].Annu Rev Microbiol,1983,37(1):189-216.
[5] OKAMI Y.Concepts and techniques for isolation and characterization of actinomycetes[C].Madison:University of Wisconsin,1991:1-3.
[6] 谢学辉,范凤霞,袁学武,等.德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响[J].微生物学通报,2012,39(5):624-637.
[7] 曹书苗.放线菌强化植物修复土壤铅镉污染的效应及机理[D].西安:长安大学,2016:9-14.
[8] 纪翠平.非培养方法研究邯邢铁矿矿区放线菌多样性[D].保定:河北大学,2010:14-19.
[9] 吕志堂,刘江,张维维.铁矿尾矿放线菌分离株的系统发育分析[J].安徽农业科学,2010,38(7):3350.
[10] 路桃香.金川矿区土壤微生物的分离鉴定及多样性研究[D].兰州:兰州交通大学,2016,22-36.
[11] 李静,程雪芬,廖萍,等.攀枝花矿区糙野青茅根际耐铬放线菌筛选及促生能力评价[J/OL].环境科学学报:1-14.(2017-08-10).http://kns.cnki.net/kcms/detail/11.1843.X.20170810.1629.023.html.DOI:10.13671/j.hjkxxb.2017.0308.
[12] 房君佳,李强,刘畅,等.铅锌尾矿砂污染下的岩溶土壤微生物群落碳源代谢特征[J/OL].环境科学,2018(2017-12-01).http://kns.cnki.net/kcms/detail/11.1895.X.20171201.1640.049.html.DOI:10.13227/j.hjkx.201709093.
[13] ZHAN Jing,SUN Qing-ye.Development of microbial properties and enzyme activities in copper mine wasteland during natural restoration[J].Catena,2014,116(3):86-94.
[14] DHAL P K,SAR P.Microbial communities in uranium mine tailing and mine water sediment fron Jaduguda U mine,India:A culture independent analysis[J].Environmental Science and Heath Part A Toxic/hazardous Substances and Environmental Engineering,2014,49(6):694-709.
[15] 沈平,陈向荣.微生物学实验[M].4版.北京:高等教育出版社,2007:30-31.
[16] 周德庆.微生物实验教程[M].2版.北京:高等教育出版社,2006:200-201.
[17] 司美茹,薛泉宏,来航线.放线菌分离培养基筛选及杂菌抑制方法研究[J].微生物学通报,2004,31(2):61-65.
[18] 冯轶男,杨润清.放线菌分离与筛选方法的研究进展[J].生物技术,2010,20(4):95-98.
[19] 钱恒,段淑蓉.放线菌选择性分离方法综述[J].安徽农学通报,2011,17(15):60-61.
[20] 阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2011:69-71.
[21] 阎逊初.放线菌的分类和鉴定[M].北京:科学出版社,1992.
[22] 李焕宇,付婷婷,张云,等.5种方法提取真菌基因组DNA作为PCR模板效果的比较[J].中国农学通报,2017,33(16):28-35.
[23] LANE D J.16S/23S rRNA Sequencing[M]//STACKEBRANDT E,GOODFELLOW M.Nucleic acid techniques in bacterial systematics.Great Britain:Biddles Ltd,Guildford and KingsLynn,1991:1-18.
[24] 徐丽华,李文均,刘志恒,等.放线菌系统学[M].北京:科学出版社,2007,167-189.
[25] 刘冬梅,李理,杨晓泉,等.牛津杯法测定益生菌的抑菌活力[J].食品研究与开发,2006,27(3):110-111.
[26] 陈文强,彭浩,邓百万,等.药用植物虎杖内生放线菌的分离及抑菌活性的研究[J].陕西理工学院学报(自然科学版),2012,28(6):61-67.
[27] DANIES J.Origins and evolution of antibiotic resistance[J].Microbiologia,1996,12(1):9-16.
[28] BENTLEY S D,CHATER K F,CERDEOTRRAGA A M,et al.Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2) [J].Nature,2002,417(6885):141-147.
[29] 景炬辉,刘晋仙,李毳,等.中条山铜尾矿坝面土壤细菌群落的结构特征[J].应用与环境生物学报,2017,23(3):527-534.
[30] 罗强,解修超,陈文强,等.陕西宁强铅锌尾矿中细菌的分离、鉴定及金属离子耐受性评价[J].陕西理工大学学报(自然科学版),2017,33(4):75-80.
