DNA条形码技术在陕西汉中地区管蓟马物种鉴定中的应用
2018-05-03党利红
党利红, 高 植, 胡 杨
(陕西理工大学 生物科学与工程学院, 陕西 汉中 723000)
管蓟马是缨翅目Thysanoptera管尾亚目Tubulifera管蓟马科Phlaeothripidae物种的总称,蓟马种类繁多,世界已知831属6000余种,管蓟马世界已知2亚科457属3566种[1],管蓟马科是缨翅目中最大的一个科,在我国分布广泛,包括79属285种[2]。陕西省汉中地区是我国南北过渡地区,气候潮湿,生态环境优良,适宜生物生存,同时也是世界上物种多样性最丰富的地区之一,该地区以种植水稻、玉米、油菜等经济作物为主,适宜的生存环境和良好的食源,为缨翅目昆虫提供了较好的繁殖生境。管蓟马为锉吸式口器,常锉破植物表皮组织吮吸汁液造成为害,危害性广,是重要的农业害虫之一[3],阻碍农作物叶、花、种子的正常生长,严重威胁到农作物产量而越来越受到人们重视[4]。
DNA条形码(DNA Barcoding)是近几年来国际生物学研究的热点之一。DNA条形码是依据较短的标准DNA序列进行物种鉴定的方法[5]。DNA条形码技术的出现可以更好更快地的鉴别物种,了解物种的分类地位和系统发育关系[6]。DNA条形码自提出以来,已在多个类群的研究中得到了应用,包括真菌、植物、纤毛虫、珊瑚、腹足类、蜘蛛、甲壳动物、昆虫、鱼类、两栖类、鸟类及灵长类等。国内也有一批学者开展了相关研究,如屠云洁等[7]对3个地方鸡的线粒体COI基因多样性进行了研究,结果表明COI基因对鸡品种的鉴定结果与形态鉴定基本相符。冯毅等[8]用DNA条形码信息研制DNA芯片,成功鉴定了3种西花蓟马。彭居俐等[9]的研究表明以COI基因作为鲌属鱼类DNA条形码进行物种鉴定具有一定的可行性。王中铎等[10]探讨了COI基因在硬骨鱼类辅助物种鉴别的适用性。DNA条形码为生物分类提供了一个快速、简便的鉴定系统。在一些生物多样性调查研究中,DNA条形码鉴定物种的准确率达到了97%或97.9%。在鳞翅目等类群中,通过DNA条形码发现了大量隐存种或新种。如朱丹丹和谢瑾[11]利用DNA条形码技术鉴定了卷蛾科昆虫22种,发现了近缘种;杨瑞生等[12]通过DNA条形码技术快速准确地鉴定了鳞翅目11种害虫。在科技部基础工作专项的支持下,我国DNA条形码技术规范体系与信息系统已经初步构建,并在农林害虫、药用昆虫、媒介昆虫、传粉昆虫、外来人侵物种、重要保护动物等领域已有应用。
对于蓟马而言,依赖形态特征的物种鉴定具有一定的局限性。由于蓟马体型微小,近似种之间的区别特征少且不明显,对于蓟马的精准防治不能起到指导性作用。随着分子生物学的发展,分子鉴定为物种的鉴定提供了新的方法,可以检测物种间及同种个体间的细微差别。DNA条形码技术是最佳的手段,可方便快捷地确定蓟马的种类、特点、习性、生活史等重要信息,为蓟马的鉴定提供有效手段,这也是未来物种鉴定的发展趋势。但是我国有关蓟马的分子系统学研究还很欠缺,正处于初期探索阶段,仅涉及到DNA条形码基础数据的积累。因此,开展该类群DNA条形码研究来填补我国在该领域研究的匮乏,同时提供更多的管蓟马条形码序列,为将来结合形态和分子数据深入探讨我国管蓟马的系统发育关系研究、农作物害虫的生物防治提供可靠的基础数据。
本文通过对陕西省汉中地区管蓟马线粒体COI基因序列进行比对分析,构建系统发育树,探讨管蓟马的系统发育关系;快速、准确、高效地确定陕西地区管蓟马物种,为陕南地区农作物产量和质量的提高以及管蓟马的生物学防治提供坚实的理论基础。
1 材料、仪器与试剂
1.1 材 料
本研究所用蓟马标本均为成虫,为充分研究陕西省汉中地区管蓟马的分布与危害,于2015—2017年分别在陕西理工大学北校区、汉台区陕南植物园、城固县周边农田、洋县梨园及草坝村周边农田等地采集蓟马标本,涉及的植物种类繁多,主要有小麦、油菜、蚕豆、葱、三叶草及杂草等。
1.1.1 标本的采集
蓟马种类繁多,生活环境复杂,寄主丰富,因此采集方法多样。本研究主要运用两种采集方法:
1)扫捕法:对于生活在杂草丛中的管蓟马,通过用捕虫网在杂草种来回扫动;
2)敲打法:最常用的蓟马采集方法,将一个白色托盘置于植物下,直接敲打植物的叶子、花、枯树枝叶以及杂草等,使蓟马脱离寄主,掉在白盘上。
通过以上方法采得的蓟马,用小号毛笔直接刷入装有体积分数95%酒精的采集小管,详细记录每瓶蓟马样品的采集信息,包括瓶号、体色、寄主植物、为害状、数量、采集时间、地点以及采集人等。
1.1.2 标本的保存
将采集到的蓟马标本置于盛有体积分数95%酒精的离心管中,-20 ℃保存,以备分子实验用。
1.2 仪 器
本实验所用仪器有:双目解剖镜、marker笔、镊子、酒精灯、烧杯、剪刀、胶带、滤纸、小毛笔、大头针、离心管、移液枪、离心机、电子天平、XH-C旋转混合器、水浴锅、微波炉、电泳仪、高压灭菌锅、冰箱等。
1.3 试 剂
本实验用到的试剂包括:博日组织基因组试剂盒、蛋白酶K、DNA Lodding buffer、核酸染料、DNA marker、Taq mix、无水乙醇、超纯水、TAE×50、琼脂糖、引物LCO1-1490和HCO1-2198。
2 实验步骤
2.1 实验准备
实验开始前,准备好蓟马标本、酒精灯、离心管、解剖镜、大头针、小毛刷、镊子、离心机、水浴锅、混合仪等仪器,设置水浴锅温度为56 ℃,并等待水温恒定。
2.2 蓟马DNA无损伤提取
2.2.1 消 化
(1)准备1.5 mL的离心管数个(一头蓟马一个离心管,离心管均需高温蒸汽灭菌)放置于离心管支架台上,分别加入180 μL的ATL Buffer,并用marker笔在离心管上标出相应的样品编号;
(2)从所采集的蓟马标本中选取不同地区、不同虫态、不同颜色、不同大小的完整蓟马标本,用小毛笔轻轻放在吸水纸上,吸附体壁上酒精,再转移到解剖镜下,冷却后,在蓟马腹部刺3~5针,以保证消化液与虫体组织充分接触,再转移到装有ATL Buffer的离心管中,按顺序编号(实验所涉及到蓟马种类信息见表1);
(3)重复步骤2,直至所有管蓟马标本处理完;
(4)向离心管中加入20 μL的Proteinase K(蛋白酶K),用混合仪震荡混匀,放入56 ℃水浴锅中水浴18 h(或过夜)。
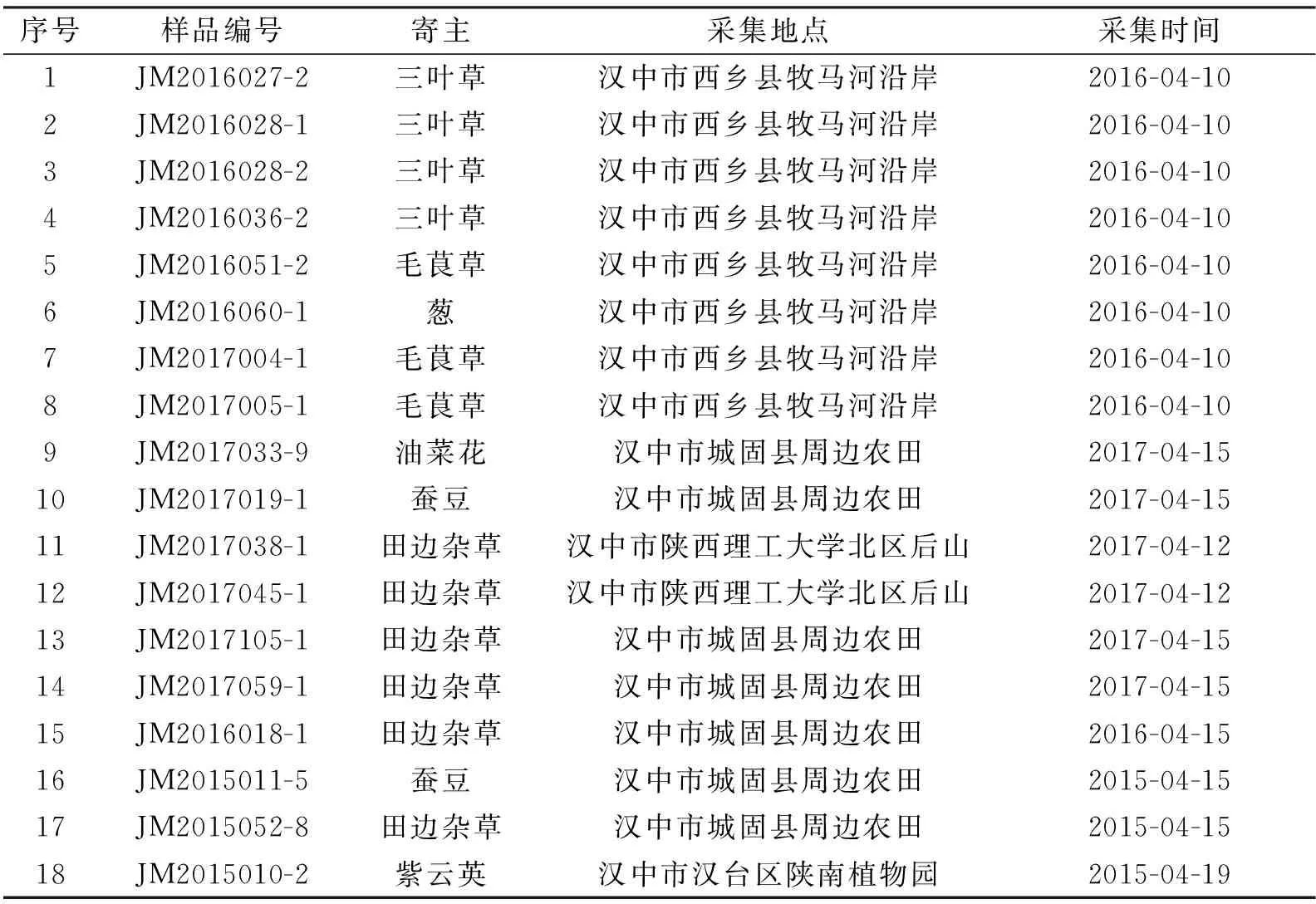
表1 本研究涉及的蓟马样品信息
2.2.2 提 取
(1)将标本从水浴锅中取出,用移液枪将虫体从离心管中吸出放入蒸馏水中,编号,以备形态分类学鉴定;
(2)准备1.5 mL的灭菌离心管和指形管,分别对应编号;
(3)将消化好的离心管离心20 s,分别加入200 μL AL Buffer和200 μL无水乙醇(冰),在混合仪上混合数秒;
(4)将离心管(含有DNA样品的混合试剂)全部转移到1.5 mL的指形管里,进行离心,8000 rpm,1 min;
(5)弃掉原来的collection tube(即含有废弃溶液的指形管),再将具有DNA附着膜的柱子放入新的collection tube,分别加入500 μL的AW1 buffer,进行离心,8000 rpm,1 min;
(6)同步骤(5),弃掉原来的collection tube,再将具有DNA附着膜的柱子放入新的collection tube,分别加入500 μL的AW2 buffer,进行离心,14 000 rpm,3 min;
(7)弃掉原来的collection tube然后将中间的柱子移入到之前准备的1.5 mL的离心管里;
(8)加入25 μL的AE buffer,室内静置1 min,然后离心,8000 rpm,1 min;
(9)弃掉中间的柱子,得到DNA;
(10)将得到的DNA保存于-20 ℃冰箱中,准备PCR。
2.3 PCR扩增
PCR扩增的引物设计为:LCO1-1490:GGTCAACAAATCATAAAGATATTG和HCO1-2198:TAAACTTCAGGGTGACCAAAAAATCA,由北京奥科鼎盛生物科技有限公司合成。
本实验采用30 μL扩增体系,包含试剂有21 μL超纯水,5.8 μL Taq mix,0.6 μL引物LCO1-1490,0.6 μL HCO1-2198,2 μL DNA模板。主要步骤如下:
(1)将超纯水、Taq mix、引物、DNA混入0.5 mL的离心管中;
(2)将离心管放在PCR仪中进行扩增;
(3)扩增循环:94 ℃预变性3 min,然后94 ℃变性0.5 min,55 ℃退火0.5 min,72 ℃延伸1 min,共40个循环,最后在72 ℃充分延伸10 min;
(4)将扩增好的样本放置于4 ℃下保存。并准备电泳检测。
2.4 电泳检测
将扩增出来的结果进行电泳,检测是否出现目的条带,以便确定是否送样检测。电泳检测主要步骤如下:
(1)制胶:将50×TAE稀释为1×TAE,取50 mL 1×TAE和0.5 g琼脂糖混溶,置于微波炉内加热1 min后取出加入10 μL核酸染料,充分混合倒入制胶板静置,等待胶凝固;
(2)点样:等胶凝固后,取PCR扩增后的DNA混合液4 μL和Marker 4 μL点入胶孔;
(3)电泳:在90 V电压下进行电泳60 min;
(4)观察:将点样后的胶放置于紫外灯照射下,观察是否出现目的条带。
2.5 送样检测
将经过电泳检测成功的PCR产物原液送往北京奥科鼎盛生物科技有限公司进行DNA测序,以获得蓟马样品的COI序列。
2.6 系统发育树构建
将获得的DNA条形码序列运用MEGA5.05进行系统发育分析,其中以蓟马科Thripidae的2属2种为外群,管蓟马科Phlaeothripidae管蓟马亚科Phlaeothripinae的3属5种作为内群,完成系统发育树的构建。
3 结 果
3.1 PCR扩增
本次实验经过PCR扩增,得到的PCR产物原液进行电泳检测后,在紫外灯照射下,蓟马样品的COI基因序列可在接近600 bp处检测出有明显亮带,经过实验研究,共成功获得18条COI基因序列。
3.2 系统发育树构建
对已获得18条COI序列进行编辑、拼接,应用软件MEGA5.05使用最大简约树法构建系统发育树,结果共得5属7种,如图1所示。
3.2.1 系统发育结果
图1中,蓟马COI基因分别聚为四个分支,第一支为主分支,由3个物种构成,经凭证标本的形态学鉴定为豆简管蓟马(Haplothripskurdjumovi)、华简管蓟马(Haplothripschinensis)和稻管蓟马(Haplothripsaculeatus),此3种均属于管尾亚目、管蓟马科、简管蓟马属,系统发育分析其聚为一支;第二、三、四支:有四条序列支持,分属于滑管蓟马属Liothripssp.、器管蓟马属Hoplothripssp.和蓟马科物种,系统发育树结果其分为3个独立的分支。
3.2.2 结果分析
第一支:从形态学特征上分析,豆简管蓟马和华简管蓟马的区别仅为背板前缘鬃是否发达,豆简管蓟马背板前缘鬃退化,而华简管蓟马背板前缘鬃发达。从COI基因分子层面上也有极大的相似性,因此在系统进化树中可以看到华简管蓟马嵌进了豆简管蓟马分支内。华简管蓟马和稻管蓟马二者仅在体表主要鬃端部尖细或膨大区别。因此,无论是分子还是形态数据均表明以上三者亲缘关系较近。但由于本研究获得的COI序列较少,因此无法说明此三者的单系性。
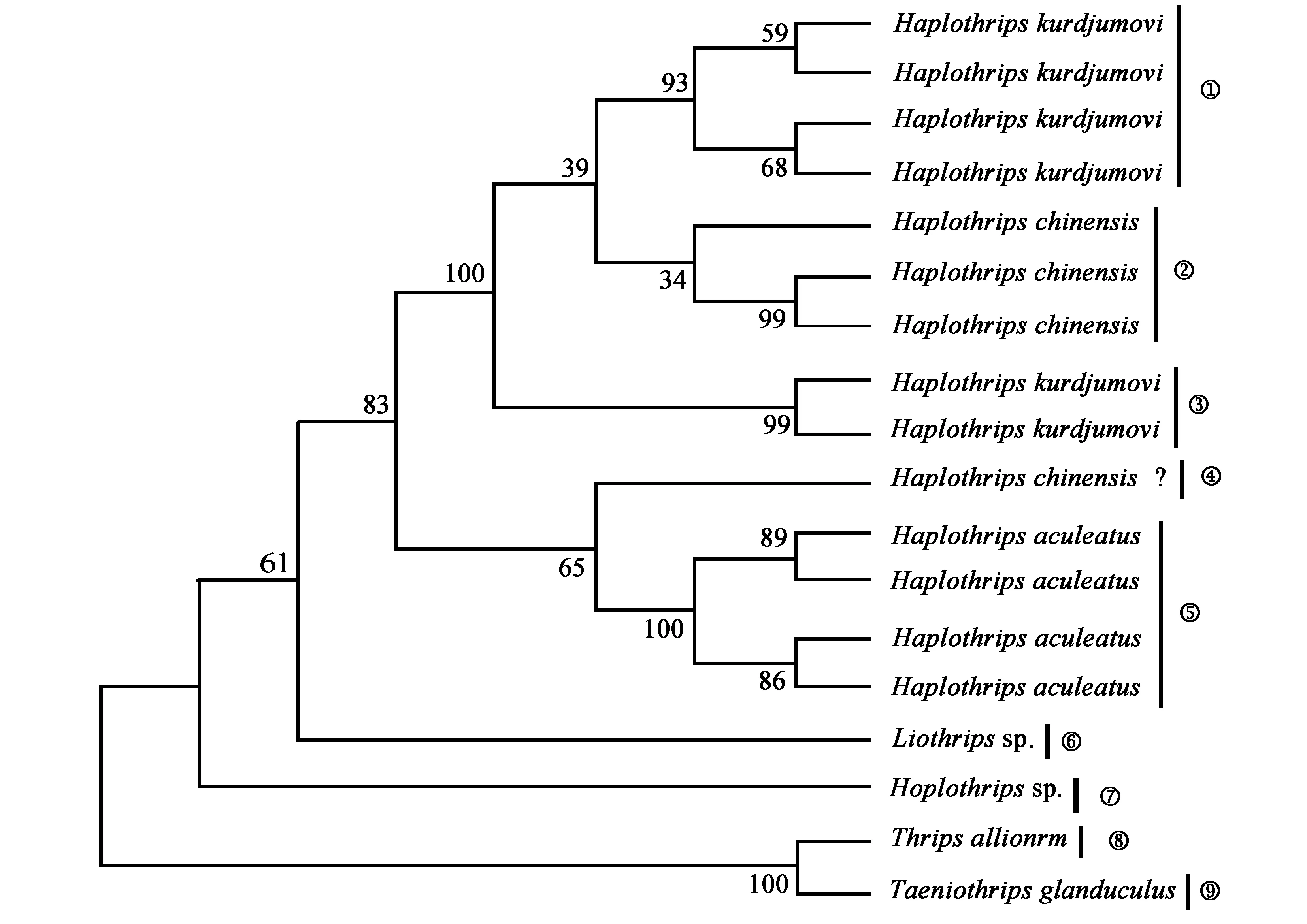
图1 运用最大简约法构建陕西省汉中地区管蓟马系统发育树
稻管蓟马分支中的④,经形态学分析确定为华简管蓟马,但分子数据分析,系统进化树中其镶嵌到稻管蓟马分支内,分析原因可能是由于在其COI基因提取时破坏了某些重要的区分特征所致。因此建议在后续实验中进一步确定该条序列对应的凭证标本是否与华简管蓟马物种混淆。
分支①和③,依据形态特征,其均为豆简管蓟马,不同个体分别聚集为2个分支,表明豆简管蓟马可能存在隐存分类单元。
第二、三、四支:该分支由⑥、⑦、⑧和⑨三部分组成,经凭证标本的形态学鉴定为滑管蓟马属、器管蓟马属和蓟马科,利用形态学与分子数据结合,鉴定四者分别为:滑管蓟马属、器管蓟马属、葱韭蓟马Thripsalliorum和小腺带蓟马Taeniothripsglanduculus,前两者属于管蓟马科,后两者属于蓟马科,系统发育树结果也表明其亲缘关系较远,支持其属于不同的亚科。
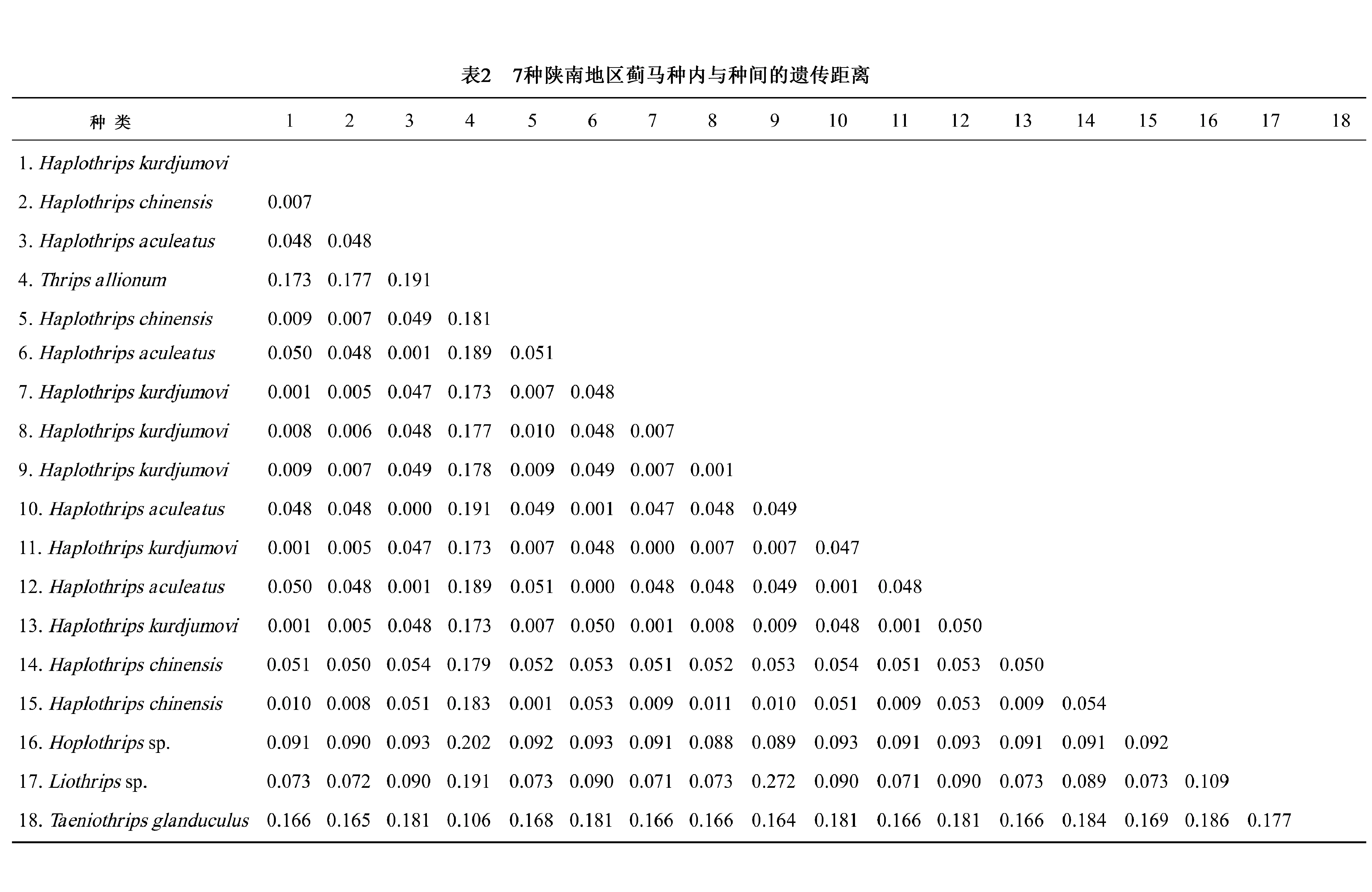
3.3 种内遗传距离
利用MEGA5.05中的Kimuar双参数模型,对5属7种共18头蓟马个体的COI基因序列的种内及种间的遗传距离进行分析。结果表明(如表2)种内遗传距离为0.000~0.009,其中稻管蓟马和华简管蓟马的种内遗传距离均为0.001,豆简管蓟马的种内遗传距离为0.001~0.009,平均是0.004;种间遗传距离平均为0.096,其中,豆简管蓟马与华简管蓟马的种间遗传距离最小为0.005,葱韭蓟马和小腺带蓟马的种间遗传距离最大为0.186。
4 结论与讨论
在对5属7种共18条蓟马标本的COI序列进行系统发育树构建,可辅助形态学进一步确定物种,区分形态上难以区分的物种,如对简管蓟马属的豆简管蓟马的鉴定给予很好的数据支持;其次,从分子水平上初步验证了豆简管蓟马与华简管蓟马之间的亲缘关系较近。结合管蓟马形态学和生物学等特征,本研究结果与传统的形态学基本一致,证实所构建的陕西省汉中地区管蓟马系统发育树真实有效,对陕西省汉中地区简管蓟马属内物种分类具有一定的帮助。
本研究蓟马DNA的提取采取无损伤提取方法,由于管蓟马个体较小,提取DNA量较少等原因,使得COI基因的提取成功率较低,显得管蓟马COI基因样本提取不足,数据范围较狭小,物种的单系性分析缺乏较大量数据支持。
管蓟马种类丰富,个体微小,依据形态特征进行物种鉴定存在一定的难度。DNA条形码技术可以快速地确定物种的种类,尤其对个体微小、形态相近的物种进行区分具有明显优势。利用DNA条形码技术对管蓟马种类进行鉴定,结合形态学的分析可以快速、准确地掌握管蓟马的种类,为后期陕西省汉中地区管蓟马物种多样性调查研究和蓟马害虫防治措施方面提供科学依据;相信通过后期的努力,我们能够优化实验流程,减少实验误差,扩展数据样本,使得该方法能够更加准确地鉴定整个陕南地区管蓟马种类,也可快速地将危害陕西植物的管蓟马快速有效进行区分,为后续管蓟马的物种多样性研究和管蓟马害虫的生物防治提供更加完善的基础数据。
[参考文献]
[1] LAURENCE M.ThripsWiki-providing information on the World’s thrips[EB/OL].Australia:MediaWiki,2017[2017-11-20].http://thrips.info/wiki/Main_Page.
[2] 党利红.中国及东南亚管尾亚目系统学研究[D].北京:中国科学院大学,2014.
[3] 韩运发.中国经济昆虫志:第五十五册[M].北京:科学出版社,1997:195-198.
[4] 冯会文.甘肃中部蓟马区系研究[D].兰州:甘肃农业大学,2006.
[5] YU Wen-bin,HUANG Pan-hui,REE R H,et al.DNA barcoding ofPedicularisL. (Orobanchaceae):Evaluating four universal barcode loci in a large and hemiparasitic genus[J].Journal of Systematics and Evolution,2011,49(5):425-37.
[6] 武宇鹏,丁亮,李捷,等.DNA条形码的应用进展及讨论[J].环境昆虫学报,2011,33(1):99-106.
[7] 屠云洁,陈国宏,高玉时,等.3个地方鸡种线粒体DNA COI基因条形码遗传多样性研究[J].家畜生态学报,2009,30(1):16-19.
[8] 冯毅,王莉,白云峰,等.基于COI序列快速鉴定花蓟马的DNA条形码芯片初探[J].生物技术通报,2009(8):169-173.
[9] 彭居俐,王绪祯,王丁,等.基于线粒体COI基因序列的DNA条形码在鲤科鲌属鱼类物种鉴定中的应用[J].水生生物学报,2009,33(2):271-276.
[10] 王中铎,郭昱嵩,陈荣玲,等.南海常见硬骨鱼类COI条码序列[J].海洋与湖沼,2009(5):608-614.
[11] 朱丹丹,谢瑾.基于COI基因对卷蛾科昆虫的分子系统发育关系研究[J].农技服务,2016,10(33):9-10.
[12] 杨瑞生,陈玉波,王勇,等.DNA条形码在柞树主要鳞翅目害虫种类鉴定中的应用[J].蚕业科学,2017,43(5):750-756.
