镁及镁合金植入性医疗器械的应用研究进展
2018-05-03吴戍戌王守仁刘文涛
吴戍戌,王守仁,刘文涛
(济南大学机械工程学院,山东 济南 250022)
随着镁及镁合金材料的不断发展,其作为生物医用材料制造植入性医疗器械的研究受到材料学和医学领域研究者的广泛关注。早在19世纪初,植入性医疗器械的材料主要是不锈钢,20世纪初又出现了钴-铬基合金、钛合金等金属材料的植入性医疗器械[1]。这些金属材料称为惰性金属,因为具有优异的耐腐蚀性能、力学性能和机械加工性能,在临床上得到广泛应用,但仍存在许多缺点,例如其密度及弹性模量与自然骨相差较大,容易造成应力遮挡现象,影响骨组织的生长和延长愈合时间等等。这些金属材料制备的植入性医疗器械植入人体内后基本上不会发生降解,还需要进行二次手术将其取出来,这增加了患者的痛苦和经济负担。另外,这些金属材料在人体内会发生磨损和磨蚀,释放有毒的离子(铝离子、镍离子等),从而引发炎症,造成组织损伤[2-4]。从20世纪50年代开始,生物陶瓷和高分子材料开始受到研究者的关注,这些材料虽然具有优异的生物相容性和骨诱导性,但是其力学性能较差[5]。
基于以上原因,寻找一种既满足力学性能又满足生物相容性的植入性医疗器械材料成为关键。而镁及镁合金材料就符合以上要求:(1)镁合金与人体自然骨的力学性能指标(表1)最为接近,这样就能够有效地避免应力遮挡效应,展现出良好的力学相容性;(2)镁具有较低的标准电极电位(-2.37 V),化学性质活泼,在人体体液中特别容易与Cl-等发生化学反应,可自主完全降解;(3)镁不但是人体中必不可少的基本元素,而且是体内含量第四的阳离子,具有良好的骨诱导效应,会缩短骨折修复时间,对组织无刺激性,多余的Mg2+将随尿液排出体外。(4)镁在自然界中分布非常广泛,是地壳中含量第八的元素,价格低廉,易于加工成型[6-9]。为此,在20世纪初期,研究者开始基于镁及镁合金在体内的可自主完全降解性和生物相容性,研制出新一代的植入性医疗器械,并将其用于骨科及心血管等领域[10]。本文对镁及镁合金植入性医疗器械在骨科和心血管领域的应用研究进展进行综述,以期为医疗器械领域材料研究提供参考依据。
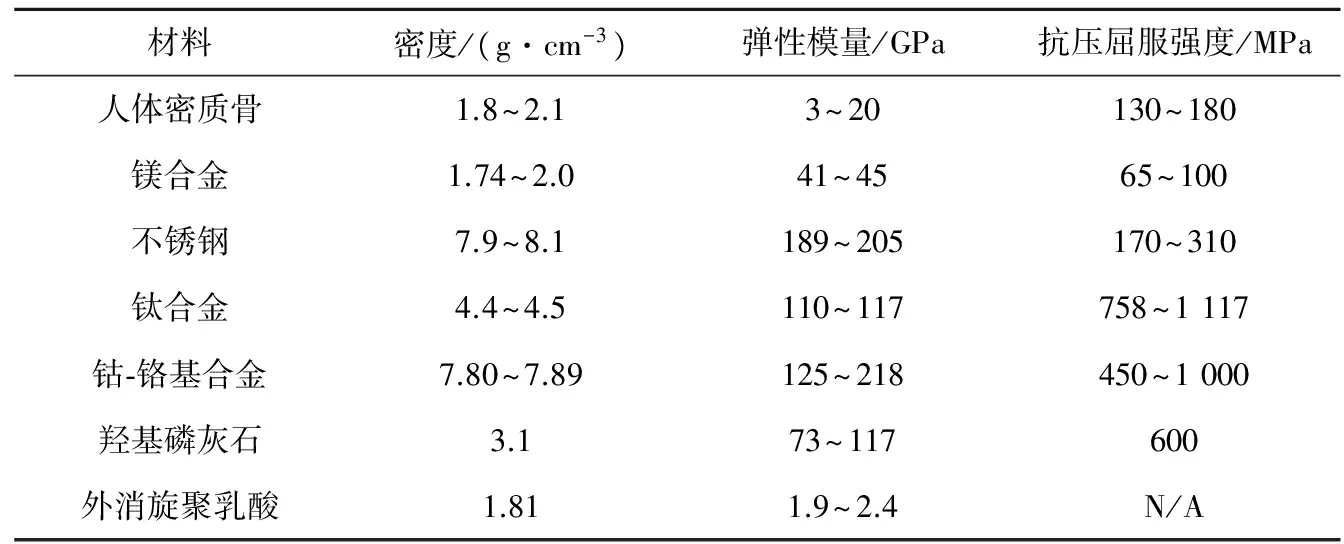
表1 自然骨和现有骨植入材料的力学性能对比[11]Table 1 Comparison of mechanical properties of various currently available implant materials and naturalbone [11]
1 骨科领域
1.1 骨板和螺钉
镁及镁合金骨板和螺钉通过植入,对骨折处进行良好的复位和坚强固定,通过骨组织的再生能力实现骨折处的自我修复,从而达到治愈的目的[12]。1907年,Lambotte[13]将纯镁制备的骨板和螺钉进行植入,发现除了在骨板周围产生少量的气体外,并没有出现其他症状,骨折处愈合。随后在1938年,Mcbride[14]将镁锰合金制备的骨板和螺钉进行骨折内固定,发现镁合金全部降解,而且该材料有可能会促进硬质骨的形成。1944年,Troitskii等[15]将镁钙合金制备的骨板和螺钉植入34例骨折患者中,其中有9例患者由于感染或皮下气肿等原因而失败,但是所有患者的血清中均未出现Mg2+浓度升高的现象。以上早期对镁及镁合金骨板和螺钉的研究表明,其具有优异的生物相容性并且有可能会刺激新骨的形成,但是由于其在体内耐腐蚀性较差、降解速度太快,短时间内产生大量的气体,无法长期提供有效的固定支撑,再加上随着不锈钢等惰性金属的应用,限制了其在临床上的应用。直到二十世纪90年代[16],随着冶金、金属表面防护处理、热处理及塑性加工工艺等技术的快速发展,镁及镁合金的耐腐蚀性得到显著提高,其作为骨板和螺钉等植入性医疗器械材料的研究取得了较大的发展。
1.1.1 改进镁及镁合金的冶金技术
1.1.1.1 提高镁的纯度
当具有杂质(Fe、Cu、Ni等元素)的镁及镁合金与腐蚀介质接触时,电极电位较低的镁与电极电位较高的杂质将会形成原电池,加速镁及镁合金的腐蚀[17-18]。其中,Fe、Cu、Ni 3种元素在纯镁中容许极限(质量分数)是1.70×10-4、1.0×10-3、5×10-6,当杂质含量超过其容许极限时,纯镁的耐腐蚀性能会急剧下降[19]。为此,通过净化熔炼技术、选用高纯度原料等方法可以有效地提高镁及镁合金的耐腐蚀性能,减缓其降解速率。Han等[20]利用净化熔炼技术制备高纯度镁(HP Mg)螺钉,发现HP镁螺钉在兔股骨髁间骨折固定显示形态均匀且具有足够弯曲力。Chaya等[21]选用高纯度镁(99.9%)制备骨板,并将其在兔尺骨骨折模型中进行评估,发现其降解速度减缓,而且骨板周围形成新的骨组织。Wang等[22]利用净化熔炼技术制备高纯度镁骨板,并在Hank动态液和静态液中进行分析,发现在稳定环境下,镁的表面会形成一层磷酸盐类保护膜,提高了其耐腐蚀性。虽然提高镁的纯度可以改善其耐腐蚀性,但是工艺复杂、效率低,在临床上应用的较少。
1.1.1.2 制备新型镁合金
通过添加不同含量的钙、铝、稀土、锶及锌等元素进行冶炼而得到新型镁合金,可以改善镁合金的耐腐蚀性能、力学性能及生物相容性[23]。Naujokat等[24]用镁合金(WE43)制备骨板和螺钉,发现其降解速度缓慢,平均腐蚀率为0.122±0.042 mm/a,而且骨板的外形和体积基本上不变,仍起到固定作用。Zhang等[25]发现在镁锌合金中加入0.2%的钙元素后,镁合金的腐蚀速率下降约1/3,其表面膜层电阻增加了5倍,但是随着钙含量的增加,其腐蚀速率加快。Feyerabend等[26]在镁合金Mg-Nd-Zn-Zr(JDBM)中加入少量的稀土元素,发现不但能保证镁合金具有良好的力学性能,并且还可以提高镁合金的电极电位,从而提高镁合金的耐腐蚀性能。张广道[27]将AZ31B镁合金制备的骨板植入新西兰大白兔下颌骨,观察到在骨板周围包裹有一层纤维结缔组织,将该纤维结缔组织与骨板分离,可见骨板边缘处有新生骨生成。目前应用比较成熟的新型镁合金大多都是商用镁合金,虽然这些镁合金可以有效地改善其耐腐蚀性能,但是并没有考虑生物相容性,大多含有对人体有害的元素。
1.1.2 提高镁及镁合金的表面防护处理技术
金属表面防护处理技术是改善镁及镁合金腐蚀过快问题最有效的方法之一。通过化学转化涂层、有机高分子涂层、微弧氧化涂层、激光表面处理等方法,不仅能够有效地改善镁及镁合金耐腐蚀性能,而且还能提高生物相容性。Wu等[28]利用微弧氧化技术,在镁合金(AZ31)骨板上制备了具有生物相容性MAO涂层,并设置未处理的镁合金骨板为对照组,发现有MAO涂层和未涂层的镁合金骨板均能促进骨折愈合,但是有涂层的降解速度缓慢。Schaller等[29]对镁合金(WE43)骨板表面进行等离子体电解,将未处理的镁合金骨板设置为对照组,实验结果表明具有涂层的骨板改善了其耐腐蚀性能,而且具有很好的稳定性。Wang等[30]通过脉冲电沉积法在镁合金(Mg-Zn-Ca)骨板表面制备羟基磷灰石(HA)涂层,发现该涂层不仅显著提高了镁合金的耐腐蚀性能,而且具有优异的生物相容性。曲立杰[31]采用超声微弧氧化技术对镁合金螺钉进行表面处理,发现其起到固定作用的时间长达半年,而且血液中镁离子的浓度均在参考范围内。虽然镁及镁合金表面防护处理技术繁多,但是其成本较高、部分处理技术污染较为严重,而且缺乏在不同的环境下都具有突出性能的表面防护处理技术。
1.1.3 改进镁及镁合金的热处理及塑性加工工艺
热处理及塑性加工工艺不但可以调整镁及镁合金内部的组织,获得更好的强韧化效果,而且能转变组织中的第二相的结构、形态和分布,从而改善其综合性能[32-33]。常见的热处理方法有固溶处理、固溶时效处理、人工时效处理等,塑性加工工艺有挤压、轧制、锻造等。Zhang等[34]研究了固溶处理和时效处理对Mg-4.5Zn-4.5Sn-2Al合金的显微组织和力学性能的影响,并在模拟体液中检测其腐蚀速度,结果表明,经热处理后合金的强度和塑性都得到了提高,而且其腐蚀速度下降。Gu等[35]研究ZK60合金在模拟体液中的耐蚀性能,发现挤压态ZK60合金的晶粒得到了优化,因此减小了其腐蚀速率。Kuwahara等[36]将热处理后的纯镁置于HBSS溶液中浸泡,发现试样的重量不但没有减小,反而有所增加,表明热处理工艺处理的纯镁在其表面形成的氧化层,有效地提高了其耐蚀性。虽然镁合金热处理和塑性加工工艺的方法较多,但是加工过程复杂、成本高,而且不同系列的镁合金在加工过程中出现的微观组织形态、分布和数量各有不同,还需要对其进行深入研究。
1.2 骨组织多孔支架
骨组织多孔支架是植入体内一个具有生物活性的多孔三维支架,通过诱导骨细胞的繁殖、分化,在支架表面及孔隙中生长出新的矿化骨组织,同时生物三维支架逐渐降解、吸收,达到修复骨缺损、实现骨再生的目的[37-38]。Witte等[39]发现孔隙率为72%~76%的多孔镁合金(AZ91D)支架的降解对周围骨组织无任何有害影响,且有良好的生物相容性,能促进新骨的形成和再吸收。Zhang等[40]制备的相互连接的多孔镁合金支架,孔隙率为33%~54%,实验测得其弹性模量和抗压屈服强度范围分别为0.10 GPa~0.37 GPa和11.1 GPa~30.3 MPa,这与自然骨的力学性能类似。

镁及镁合金骨组织多孔支架由于增加了其与体液的接触面积,所以其腐蚀更加严重,降解速率加快。为了改善这种情况,通过表面防护处理技术、冶金技术、热处理等方法能提高其耐腐蚀性能,但是效果最明显的方法还是表面防护处理技术[45]。Yu等[46]在多孔可降解的AZ31镁合金支架表面用氟化物处理来获得MgF2涂层,结果表明增强了多孔支架的耐腐蚀性,减缓了降解速度,而且在体内诱导形成更多的新骨。Yazdimamaghani等[47]在低真空条件下,采用浸涂技术,在多孔镁合金支架表面制备聚己内酯(PCL)和生物活性玻璃(BG)的生物活性陶瓷涂层,实验结果表明复合支架的生物活性、机械完整性、耐蚀性和降解速度均明显改善。沈剑等[48]采用粉末冶金方法制备的多孔生物镁,孔隙率为35%,并通过碱热处理法对其进行表面改性,实验结果表明制得的多孔生物镁的力学性能可以满足作为植入材料的要求,而且耐腐性显著增强。
1.3 国内外临床应用现状
在骨科临床应用方面,目前应用最多的是钛合金材料,用来制作骨板、螺钉和骨组织多孔支架等[49]。由于镁及镁合金的降解速率未得到有效的控制,耐腐蚀性较差以及可降解金属体内风险评估标准未健全等问题,在临床上应用的较少,主要处于实验室研究阶段,目前只有镁合金螺钉在临床上得到应用[50-51]。国外最具代表的是德国的汉诺威公司生产的镁合金螺钉,在2013年获得欧盟的CE认证,应用于治疗手部、脚部骨折的手术中[52]。2015年,韩国U&I公司生产的镁钙合金螺钉也获得了韩国药监局的认证,应用在手部骨折内固定手术中[53]。在国内,中国科学院、上海交通大学、重庆大学等高校对镁合金植入性医疗器械进行了大量的相关研究,并取得了可喜的成果[54-55]。其中,东莞宜安科技和大连大学附属中山医院合作制备的镁合金金属螺钉,已经在中国食品药品安全检定研究院进行注册形式检验[56]。2017年,沪创医疗科技(上海)有限公司与上海交通大学合作已将JDBM镁合金制备成骨板和螺钉,正在申请临床实验[57]。
虽然我国研究者对镁及镁合金的理论研究走在了世界的前列,但是在临床应用与转化方面已经落后于德国和韩国等发达国家,目前需要加快国内镁及镁合金植入性医疗器械的临床应用转化进程。
2 心血管领域
2.1 血管支架
血管支架置入重建血运是临床上治疗心绞痛、急性心肌梗死以及各种心脑血管疾病的重要手段[58]。镁及镁合金血管支架具有克服传统惰性金属支架因长期植入引起的慢性炎症、晚期支架血栓以及需长期服用抗血小板药物等问题的潜在优势[59]。Erbel等[60]将镁合金(WE43)血管支架植入患者的冠状动脉中,发现器官狭窄率由61.5%±13.1%降低到12.6%±5.6%,支架完全降解后总体靶病变血运重建率为45%。Waksman[61]将镁合金支架(AMS)植入患者的冠状动脉内,发现镁合金支架缓慢消失,血管通畅率72.4%,保肢率为94.7%,与永久性血管支架相比,避免了慢性炎症和内膜增生。孙建红[62]通过有限元分析镁合金WE43材料和316L不锈钢材料的心脏血管支架,发现镁合金支架的变形抗力和膨胀内压力均小于不锈钢支架,而回弹率和顺柔性较高,从而在治疗心血管狭窄疾病方面具有很大的潜力。
改善镁及镁合金血管支架的耐腐蚀性和制备药物洗脱支架,已成为近几年的研究热点[63]。
(1)通过冶金、表面防护处理等技术能有效地改善镁及镁合金血管支架的耐腐蚀性,减缓其降解速率。Lu等[64]通过在镁合金AZ81血管支架表面上制备微弧氧化/聚乳酸(MAO/ PLL A)复合涂层,在Hank's溶液中进行体外分析,其结果显示耐腐蚀性提高,减缓了其降解速率,而且相比于316L不锈钢具有更好的血液相容性。Liu等[65]在新型镁合金Mg-Zn-Y-Nd血管支架上制备了复合涂层,上层为聚多巴胺(PDA)层,下层为MgF2层,将其进行体外实验测试,实验结果显示其耐腐蚀性增强、具有良好的细胞粘附和增殖性能。毛琳等[66]在镁合金Mg-Nd-Zn-Zr支架(JDBM)表面制备了一层均匀的纳米级MgF2涂层,并进行体外腐蚀性能测试,发现镁合金支架的腐蚀速度从之前的0.337±0.021 mm/a下降到了0.269±0.043 mm/a,耐腐蚀性能提高了约20%,而且MgF2膜层的表面鳞片有利于细胞的增殖、粘附,从而增强了支架的生物相容性。
(2)药物洗脱支架不但可以对血管进行扩张,而且可以避免出现血管局部炎症。Shi等[67]在镁合金Mg-Nd-Zn-Zr血管支架上制备了雷帕霉素载药涂层,在磷酸盐缓冲系统中进行分析研究,发现镁合金支架上的载药系统对体外平滑肌细胞增殖具有有效的长期抑制作用,而且支架腐蚀缓慢。Gu等[68]在镁合金血管支架表面制备聚乳酸-乙醇酸共聚物(PLGA)涂层,将其植入大鼠血管中,并采用裸支架作为对照组,实验结果显示该涂层有效地改进了支架的耐腐蚀性和减少血管中血栓的沉积。Zhang等[69]通过在聚合物(3-羟基丁酸酯-3-羟基己酸酯)中,添加阿魏酸(FA)的方法制备可生物降解的药物洗脱镁合金血管支架的涂层,实验结果显示该涂层能够抑制血液凝固,具有更好的血液相容性。在镁及镁合金血管支架上载药进行局部治疗不仅是未来发展的趋势,而且是整个植入性医疗器械的发展趋势。
2.2 血管缝合线
血管缝合线是用来结扎血管伤口、缝合止血的一种特殊用线。目前在临床上使用的主要为人工合成高分子血管缝合线,而镁及镁合金血管缝合线应用的较少[70]。在二十世纪初,国外研究学者曾尝试使用镁丝进行血管缝合手术。然而,因为技术问题导致镁丝的延展性达不到要求,妨碍了其用作可降解的缝合线的研究进程[71]。Seitz等[72]将镁钙合金通过拉拔成形工艺,制造直径为0.1 mm~0.5 mm的缝合线,这些缝合线符合手术缝合线所需的各个参数,相对于传统缝合线,镁及镁合金血管缝合线具有良好的力学性能和可降解性。付婧怡[73]利用室温冷拉拔和中高温退火的工艺将高纯度镁直径从5.0 mm拉拔至0.9 mm,获得符合各种手术参数的血管缝合线,发现晶粒细化可提高缝合线的强度和硬度,并可以提高耐腐蚀性。
2.3 国内外临床应用现状
在心血管临床应用方面,应用最多的是高分子聚合物可降解支架,其次是镁合金降解支架[74]。在镁及镁合金降解支架领域,国外最具代表性的是德国的Biotronik公司采用镁合金WE43研制的全降解血管支架,其开展工作最早,临床应用也最成熟[75]。至今,其生产的镁合金血管支架经历了裸支架(AMS-1)到紫杉醇药物洗脱支架(DREAMS 1G)再到雷帕霉素药物洗脱支架(DREAMS 2G)不同阶段的发展,支架植入部位也从风险较小的下肢动脉发展到风险较高的冠状血管,其中雷帕霉素药物洗脱支架(DREAMS 2G)已于2016年获CE认证[76-77]。在国内,我国自主研究的镁合金血管支架主要有上海交通大学袁广银教授组[78]采用自主研发的镁合金(Mg-2.5Nd-0.2Zn-0.4Zr)制备的血管支架和北京大学奚廷斐研究员[79]采用镁合金(Mg-2.0Zn-0.5Y-0.5Nd)制备的血管支架。其中袁广银教授制备的镁合金血管支架在临床上已经证明具有良好的生物相容性、优异的力学性能和耐腐蚀性能。
3 存在问题与未来发展趋势
3.1 存在问题
从21世纪初开始,应用镁及镁合金作为植入性医疗器械的材料是国内外的研究热点,但是由于相关技术难度大、人体内环境复杂等原因,现阶段镁及镁合金植入性医疗器械仍存在许多不足。
(1)耐腐蚀较差。在体内复杂的环境中,由于体液富含Cl-,并且在腐蚀过程中伴随着pH的不断变化,镁及镁合金的腐蚀情况复杂的多。其在模拟体液中的腐蚀主要以电偶腐蚀、点蚀、疲劳腐蚀和磨损腐蚀等局部腐蚀为主,其中以电偶腐蚀和点蚀对镁及镁合金的损坏最为巨大。
(2)降解速度未得到有效的控制。由于降解过快,无法提供长期有效的固定支撑功能,再加上其降解过程中短时间内产生大量的气体,造成皮下气肿;其腐蚀产物为Mg(OH)2,会导致局部体液碱化,从而造成组织损伤。
(3)植入性医疗器械容易造成局部感染。一方面,植入性医疗器械植入后对机体来说是异物,机体会产生免疫排斥反应;另一方面,在手术过程中,通过其本身带入感染源,常常诱发感染的发生,导致手术失败。
(4)虽然有大量的实验证明镁及镁合金植入医疗器械具有良好的生物相容性和新骨诱导性,但是大部分实验都是小规模、简单的随机实验,得到的数据不足以说明镁及镁合金植入性医疗器械具有良好的远期临床效果,而且可能存在着尚未发现的不良反应。
(5)目前研究的医用镁合金大部分都是商用镁合金,设计之初并没有考虑生物的相容性。例如铝元素是镁合金常用的合金元素,由于镁合金AZ31降解,产生的Al离子可能会对神经造成伤害,从而引发老年痴呆等症状。
3.2 未来发展趋势
为了解决目前镁及镁合金植入性医疗器械存在的问题,未来主要从以下个方面进行入手:
(1)利用冶金技术研制新型医用镁合金。通过添加Ca、Zn、Re、Sr、Mn等元素或者调整合金元素的含量,来提高镁合金的抗腐蚀性能及生物相容性。例如Mg-Re系合金,其中稀土元素具有固溶强化和沉淀强化的作用,可以改善镁合金的高温拉伸和蠕变性能,同时有利于提高耐蚀性。
(2)开发低成本、环保、适应性广的表面处理技术,提高镁及镁合金的耐腐蚀性能并控制降解速度。其方法包括超声微弧氧化、激光表面改性、冷喷涂等,这些方法可以使镁及镁合金表面具有的单层防护性能的膜层结构转变为复杂多层的膜层结构。
(3)利用新型的热处理及塑性加工工艺增强镁及镁合金的塑性变形能力,调整微观结构组织,从而提高其强度和改善其耐腐蚀性。例如激光熔覆、氢化处理、化学热处理等。其中经过化学热处理后可以得到表面均匀平整、无污染、耐腐蚀性能优于传统工艺的防护膜。
(4)研制具有抗感染作用的新型镁及镁合金植入性医疗器械,以减少植入感染的发生,改善临床疗效。例如原位多孔纳米涂层储运聚维酮碘内固定器械、药物洗脱镁合金支架。其中原位多孔纳米涂层储运聚维酮碘内固定器械不但能够满足内固定的需求,而且又能减少感染的发生。
(5)建立标准的实验体系,使镁及镁合金的腐蚀和降解速度获得更加可靠的科学依据,从而了解其在体内的力学性能和降解速度,避免出现尚未发现的不良反应,建立可降解金属的体内风险评估标准。
4 结论
综上所述,镁及镁合金植入性医疗器械由于具有优异的力学相容性、良好的生物相容性、可自主完全降解并且资源丰富、易于加工成型等优势,在骨科和心血管领域得到了广泛的应用。随着科学技术的发展和研究的不断深入,镁及镁合金植入性医疗器械将表现出巨大的应用前景。而且,我国已将镁及镁合金植入性医疗器械的研发及制备列入了国家“十三五”计划[80]中,相信在不久的将来,我国自主研发的镁及镁合金植入性医疗器械能够在临床上得到广泛应用。
参考文献:
[1]郑凯,于秀淳,郭征,等.生物金属材料在骨科的应用及发展[J].生物骨科材料与临床研究,2013,10(2): 31-33.
[2]王昌,王岚,宇森,等.可降解镁及镁合金作为骨植入材料的研究进展[J].广东化工,2016,43(15): 124-126.
[3]《中国组织工程研究与临床康复》杂志社学术部.医用金属材料相关产品的应用现状和发展趋势[J].中国组织工程研究,2010,14(51): 9621-9622.
[4]PERSAUD-SHARMA D,McGORON A.Biodegradable magnesium alloys:a review of material development and applications [J].Journal of Biomimetics Biomaterials & Tissue Engineering,2011,12: 25-39.
[5]ZHANG X,PENG X,ZHANG S W.7-Synthetic biodegradable medical polymers:polymer blends [EB/OL].[2017-11-23].https://www.sciencedirect.com/science/article/pii/B9780081003725000076.
[6]张涛,武肖娜,尹庆水,等.镁合金AZ31B材料表性与成骨细胞的黏附[J].中国组织工程研究,2013,17(12): 2123-2130.
[7]殷正正,曾荣昌,崔蓝月,等.医用可降解镁合金表面磷酸盐涂层研究进展[J].山东科技大学学报(自然科学版),2017,36(2): 57-69.
[8]李涛,张海龙,何勇,等.生物医用镁合金研究进展[J].功能材料,2013,44(20): 2913-2918.
[9]WANG J,TANG J,ZHANG P,et al.Surface modification of magnesium alloys developed for bioabsorbable orthopedic implants: a general review [J].Journal of Biomedical Materials Research Part B: Applied Biomaterials,2012,100(6): 1691-1701.
[10]ZHENG Y F,GU X N,WITTE F.Biodegradable metals [J].Mater Sci Eng,2014,77: 1-34.
[11]LI R W,KIRKLAND N T,TRUONG J,et al.The influence of biodegradable magnesium alloys on the osteogenic differentiation of human mesenchymal stem cells [J].Journal of Biomedical Materials Research Part A,2014,102(12): 4346-4357.
[12]成翔宇,纪斌,庞金辉.骨折的生物学内固定及内固定材料性能分析[J].中国组织工程研究,2012,16(22): 4121-4124.
[13]LAMBOTTE A L.L'utilization du magnesium comme matériel perdu dans l'ostéosynthèse [J].Bull Mém Soc Nat Cir,1932,28: 1325-1334.
[14]McBRIDE E D.Absorbable metal in bone surgery [J].Journal of the American Medical Association,1938,111(27): 2464-2467.
[15]TROITSKII V V,TSITRIN D N.The resorbing metallic alloy 'Osteosinthezit' as material for fastening broken bone [J].Khirurgiia,1944,8: 41-44.
[16]刘宣勇,彭峰.医用可降解镁合金表面改性研究进展[J].硅酸盐学报,2017,45(10): 1421-1431.
[17]王新印.纯镁腐蚀行为研究[D].杭州:浙江大学,2015.
[18]QIAO Z,SHI Z,HORT N,et al.Corrosion behaviour of a nominally high purity Mg ingot produced by permanent mould direct chill casting [J].Corrosion Science,2012,61: 185-207.
[19]李智,周世杰,赵炯.生物医用纯镁的腐蚀性能研究[J].热加工工艺,2012,41(16): 53-56.
[20]HAN P,CHENG P F,ZHANG S X,et al.In vitro andinvivostudies on the degradation of high-purity Mg (99.99wt.%) screw with femoral intracondylar fractured rabbit model [J].Biomaterials,2015,64: 57-69.
[21]CHAYA A,YOSHIZAWA S,VERDELIS K,et al.Invivostudy of magnesium plate and screw degradation and bone fracture healing [J].Acta Biomaterialia,2015,18: 262-269.
[22]WANG H,SHI Z.Invitrobiodegradation behavior of magnesium and magnesium alloy [J].Journal of Biomedical Materials Research Part B Applied Biomaterials,2011,98 (2):203-209.
[23]ATRENS A,LIU M,ABIDIN N I Z,et al.3-Corrosion of magnesium (Mg) alloys and metallurgical influence [EB/OL].[2017-11-09].http://linkinghub.elsevier.com/retrieve/pii/B9781845697082500032.
[24]NAUJOKAT H,SEITZ J M,AÇIL Y,et al.Osteosynthesis of a cranio-osteoplasty with a biodegradable magnesium plate system in miniature pigs [J].Acta Biomaterialia,2017,62: 434-445.
[25]ZHANG B P,HOU Y L,WANG X D,et al.Mechanical properties,degradation performance and cytotoxicity of Mg-Zn-Ca biomedical alloys with different compositions [J].Mater Sci Eng C,2011,31(8): 1667-1673.
[26]FEYERABEND F,FISCHER J,HOLTZ J,et al.Evaluation of short-term effects of rare earth and other elements used in magnesium alloys on primary cells and cell lines [J].Acta Biomaterialia,2010,6(5): 1834-1842.
[27]张广道.AZ31B生物可降解镁合金植入兔下颌骨生物学行为的实验研究[D].沈阳:中国医科大学,2009.
[28]WU Y F,WANG Y M,JING Y B,et al.Invivostudy of microarc oxidation coated biodegradable magnesium plate to heal bone fracture defect of 3mm width [J].Colloids & Surfaces B Biointerfaces,2017,158: 147-156.
[29]SCHALLER B,SAULACIC N,IMWINKELRIED T,et al.Invivodegradation of magnesium plate/screw osteosynthesis implant systems: Soft and hard tissue response in a calvarial model in miniature pigs [J].Journal of Cranio -Maxillo -Facial Surgery,2016,44 (3): 309-317.
[30]WANG H X,GUAN S K,WANG X,et al.Invitrodegradation and mechanical integrity of Mg-Zn-Ca alloy coated with Ca-deficient hydroxyapatite by the pulse electrodeposition process [J].Acta Biomater,2010,6(5): 1743-1748.
[31]曲立杰.镁合金表面超声微弧氧化生物涂层的组织结构与性能[D].哈尔滨:哈尔滨工业大学,2015.
[32]张玉,黄晓锋,马振铎,等.热处理工艺对Mg-6Zn-2Sm-0.4Zr镁合金显微组织和力学性能的影响[J].中国有色金属学报,2017,27(10): 1961-1969.
[33]王尔德.镁合金塑性加工产业技术研究进展[J].精密成形工程,2014,6(6): 22-30.
[34]ZHANGG H,CHEN J H,YAN H G,et al.Effects of artificial aging on microstructure and mechanical properties of the Mg-4.5Zn-4.5Sn-2Al alloy [J].Journal of Alloys and Compounds.2014,592: 250-257.
[35]GU X N,LI N,ZHENG Y F,et al.Invitrodegradation performance and biological response of a Mg-Zn-Zr alloy [J].Materials Science and Engineering: B,2011,176(20): 1778-1784.
[36]KUWAHARA H,ALABDULLAT Y,MAZAKI N,et al.Precipitation of magnesium apatite on pure magnesium surface during immersing in Hank’s solution[J].Materials Transactions,2001,42(7):1317-1321.
[37]CANCEDDA R,GIANNONI P,MASTROGIACOMO M.A tissue engineering approach to bone repair in large animal models and in clinical practice [J].Biomaterials,2007,28(29): 4240-4250.
[38]SOMMAR P,PETTERSSON S,NESS C,et al.Engineering three-dimensional cartilage- and bone-like tissues using human dermal fibroblasts and macroporous gelatine microcarriers [J].Journal of Plastic Reconstructive & Aesthetic Surgery,2010,63(6): 1036-1046.
[39]WITTE F,ULRICH H,RUDERT M,et al.Biodegradable magnesium scaffolds Part 1: appropriate inflammatory response [J].Journal of Biomedical Materials Research Part A,2007,81 (3): 748-756.
[40]ZHANG X,LI X W,LI J G,et al.Preparation and mechanical property of a novel 3D porous magnesium scaffold for bone tissue engineering [J].Materials Science & Engineering: C,2014,42: 362-367.
[41]牛丽媛.医用多孔镁基合金材料制备技术的研究进展[J].热加工工艺,2010,39(4): 1-3.
[42]KANG M,JUNG H,KIM S,et al.Production and bio-corrosion resistance of porous magnesium with hydroxyapatite coating for biomedical applications [J].Materials Letters,2013,108: 122-124.
[43]LI Y,ZHOU J,PAVANRAM P,et al.Additively manufactured biodegradable porous magnesium [J].Acta Biomaterialia,2017,67:378-392.

[45]张赞,陈晓伟,夏兴川,等.多孔镁合金的研究现状[J].特种铸造及有色合金,2015,35(6): 580-585.
[46]YU W,ZHAO H,DING Z,et al.Invitroandinvivoevaluation of MgF2 coated AZ31 magnesium alloy porous scaffolds for bone regeneration [J].Colloids & Surfaces B Biointerfaces,2017,149: 330-340.
[47]YAZDIMAMAGHANI M,RAZAVI M,VASHAEE D,et al.Surface modification of biodegradable porous Mg bone scaffold using polycaprolactone/bioactive glass composite [J].Materials Science & Engineering C,2015,49(4): 436-444.
[48]沈剑,凤仪,王松林,等.多孔生物镁的制备及其表面改性[J].中国机械工程,2007,18 (10): 1230-1235.
[49]谯波,蒋电明.接骨板材料的研究现状[J].重庆医科大学学报,2017,42(2):180-184.
[50]阿迪亚提·阿不拉提,艾合买提江·玉素甫.生物可吸收内固定材料及其在掌骨干骨折治疗中的应用[J].国际骨科学杂志,2017,38(6):357-359.
[51]李晓,刘京,吴强,等.接骨板用材料的研究现状及发展前景[J].生物医学工程学杂志,2016,33(6):1214-1219.
[52]SEITZ J M,LUCAS A,KIRSCHNER M.Magnesium-based compression screws: A novelty in the clinical use of implants [J].JOM,2016,68(4): 1177-1182.
[53]LEE J W,HAN H S,HAN K J,et al.Long-term clinical study and multiscale analysis of in vivo biodegradation mechanism of Mg alloy [J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(3): 716-721.
[54]谭丽丽,陈军修,于晓明,等.生物可降解MgYREZr合金的研究进展[J].金属学报,2017,53(10): 1207-1214.
[55]佚名.中科院金属研究所研发出新型可降解镁铜合金[J].中国有色冶金,2016,37(5): 36.
[56]王祝堂.宜安科技镁合金骨钉可于2014年年底临床试验[J].轻金属,2016(1): 62.
[57]袁广银,牛佳林.可降解医用镁合金在骨修复应用中的研究进展[J].金属学报,2017,53(10): 1168-1180
[58]谭志刚,周倩,蒋宇钢.生物可降解镁合金血管支架:缺点及未来研究趋势[J].中国组织工程研究,2015,19(8): 1284-1288.
[59]LI J L,ZHENG F,QIU X,et al.Finite element analyses for optimization design of biodegradable magnesium alloy stent [J].Mater Sci Eng:C,2014,42: 705-714.
[60]ERBEL R,Di MARIO C,BARTUNEK J,et al.Temporary scaffolding of coronary arteries with bioabsorbable magnesium stents: a prospective,non-randomised multicentre trial [J].Lancet,2007,369(9576): 1869-1875.
[61]WAKSMAN R.Metallic bioabsorbable stents: Concepts,experimental findings,early clinical results,and the future [J].Acc Current Journal Review,2005,14(10): 36-43.
[62]孙建红.镁合金心脏血管支架结构设计及性能[D].沈阳:沈阳工业大学,2015.
[63]张小农,左敏超,张绍翔,等.医用可降解血管支架临床研究进展[J].金属学报,2017,53(10): 1215-1226.
[64]LU P,FAN H N,LIU Y,et al.Controllable biodegradability,drug release behavior and hemocompatibility of PTX-eluting magnesium stents [J].Colloids & Surfaces B Biointerfaces,2011,83(1): 23-28.
[65]LIU X L,ZHEN Z,LIU J,et al.Multifunctional MgF2/polydopamine coating on Mg alloy for vascular stent application [J].Journal of Materials Science & Technology,2015,31(7): 733-743.
[66]毛琳,MINSUK K,陈佳慧,等.氟化钾化学转化涂层提高镁合金血管支架耐蚀性和生物相容性[J].中国医药导刊,2015,17(增刊): 1-8.
[67]SHI Y J,PEI J,ZHANG L,et al.Understanding the effect of magnesium degradation on drug release and anti-proliferation on smooth muscle cells for magnesium-based drug eluting stents [J].Corrosion Science,2017,123: 297-309.
[68]GU X Z,MAO Z W,YE S H,et al.Biodegradable,elastomeric coatings with controlled anti-proliferative agent release for magnesium-based cardiovascular stents [J].Colloids Surf B Biointerfaces,2016,144: 170-179.
[69]ZHANG E L,FENG S.Blood compatibility of a ferulic acid (FA)-eluting PHBHHx system for biodegradable magnesium stent application [J].Materials Science & Engineering: C,2015,52: 37-45.
[70]KUMAR R S,SUNDARESAN S,宫庆双.手术缝合线[J].国际纺织导报,2014,42(11):46-48.
[71]汪园园,马爱斌,李玉华,等.可吸收医用镁合金缝合线的研究进展[J].功能材料,2015,46(s2): 32-37.
[72]SEITZ J M,DURISIN M,GOLDMAN J,et al.Recent advances in biodegradable metals for medical sutures: a critical review [J].Advanced Healthcare Materials,2015,4(13): 1915-1936.
[73]付婧怡.纯镁丝材拉拔工艺及在模拟体液中的腐蚀行为研究[D].哈尔滨:哈尔滨工业大学,2009.
[74]郑玉峰,杨宏韬.血管支架用可降解金属研究进展[J].金属学报,2017,53(10):1227-1237.
[75]SERRUYS P W,CHEVALIER B,SOTOMI Y,et al.Comparison of an everolimus- eluting bioresorbable scaffold with an everolimuseluting metallic stent for the treatment of coronary artery stenosis (ABSORB II): A 3 year,randomised,controlled,single-blind,multicentre clinical trial [J].Lancet,2016,388(10059): 2479-2491.
[76]HAUDE M,ERHEL R,ERNE P,et al.Three-year clinical data of the Biosolve-I study with the paclitaxel-eluting bioabsorbable magnesium scaffold (Dreams) and multi-modality imaging analysis [J].Journal of the American College of Cardiology,2013,62(18): B13.
[77]HAUDE M,INCE H,ABIZAID A,et al.Safety and performance of the second- generation drug- eluting absorbable metal scaffold in patients with de- novo coronary artery lesions (BIOSOLVE- II): 6 month results of a prospective,multicentre,non-randomised,firstin-man trial [J].Lancet,2016,387(10013): 31-39.
[78]袁广银,章晓波,牛佳林,等.新型可降解生物医用镁合金JDBM的研究进展[J].中国有色金属学报,2011,21(10): 2476-2488.
[79]奚廷斐,魏利娜,刘婧,等.镁合金全降解血管支架研究进展[J].金属学报,2017,53(10): 1153-1167.
[80]国务院.“十三五”国家科技创新规划[EB/OL].[2017-10-23].http://www.gov.cn/zhengce/content/2016-08/08/content_5098072.htm.
