多花黄精组培苗快速繁殖体系建立研究△
2018-05-03莫勇生卢拓方邱展鸿张红岩孙文波
莫勇生,卢拓方*,邱展鸿,张红岩,孙文波
(1.广西科学院生物研究所,广西 南宁 530007;2.广西华泰生物科技有限公司,广西 昭平 546800)
多花黄精PolygonatumcyrtonemaHua为百合科黄精属多年生草本植物,野生资源主要分布于广西贺州境内昭平、八步县区,根茎形状呈姜型。其生长环境多处于山坡背阳面小灌木丛中,植株高约30~40 cm,叶片呈长弧形。
成熟后的多花黄精其干燥根茎入药。据传统医药经典记载,黄精属于名贵中药,具有宽中益气、益肾填精、滋阴润肺,生津补脾之功效[1-2]。 对治疗心血管疾病、结核病、慢性肝炎以及在抗菌、解毒、抗疲劳、抗衰老、降血糖、降血脂抗肿瘤等方面均有较好作用。黄精既可入药,又可作为保健食品的原料。随着市场对黄精药材需求量的增加和野生资源的急剧减少,采集野生黄精不但不能满足市场需求,反而可能破坏生态环境和多花黄精野生资源。由此人们逐渐开始对多花黄精的野生变家种栽培技术、高产栽培技术等加以实践。目前多花黄精的人工种植主要依靠根茎繁殖和种子繁殖,但根茎繁殖方法繁殖系数低,种根茎用量大,既不经济,又限制了多花黄精的产量潜力,不便栽植管理推广。多花黄精种子繁殖的繁殖系数比较高,但用时比较久,一般种子繁殖移栽苗需要3年时间。因此说,目前多花黄精种苗问题成为制约黄精人工大规模种植的瓶颈[3]。利用植物组织培养技术建立起多花黄精组培苗规模化生产体系是生产优质多花黄精种苗有效的途径。
多花黄精为多年生植物,地下根茎常附着太多土壤微生物,若用根茎作为外植体进行组织培养,在消毒灭菌环节很难把控。本试验曾多次用根茎作为外植体,污染率高,很难获得无菌培养组织,所以最终采取用成熟种子来萌发芽获得无菌外植体材料。本研究对黄精的繁殖从种子到组培种苗过程进行研究,为多花黄精种苗规模化生产提供科学依据,以达到短期内生产出大量优质种苗的目标,可以应用到黄精的人工种植产业。
1 材料和方法
1.1 材料
1.1.1 黄精种子 多花黄精生长于贺州市昭平县广西华泰生物科技有限公司生产基地,种子植株花白色,花期5~6月,果期8~10月,地下根茎呈姜状。成熟的多花黄精种子采收于2016年10月,清洗并浸水30 min后用纱袋包裹放置于26 ℃恒温干燥培养箱催芽待用。
1.1.2 培养基 MS培养基为基本培养基[3-4],建立多花黄精组织培养的三种培养基配方:
诱导培养基:

配方培养基种类激素浓度/mg·L-16⁃BANAAGA3A1MS1 00 20 0A2MS1 00 20 5A3MS1 50 20 0A4MS1 50 20 5A5MS2 00 20 0A6MS2 00 20 5
增殖培养基:

配方培养基种类激素浓度/mg·L-16⁃BANAAB1MS0 50 2B2MS1 00 2B3MS1 50 2B4MS2 00 2B5MS2 50 2B6MS3 00 2
生根培养基:
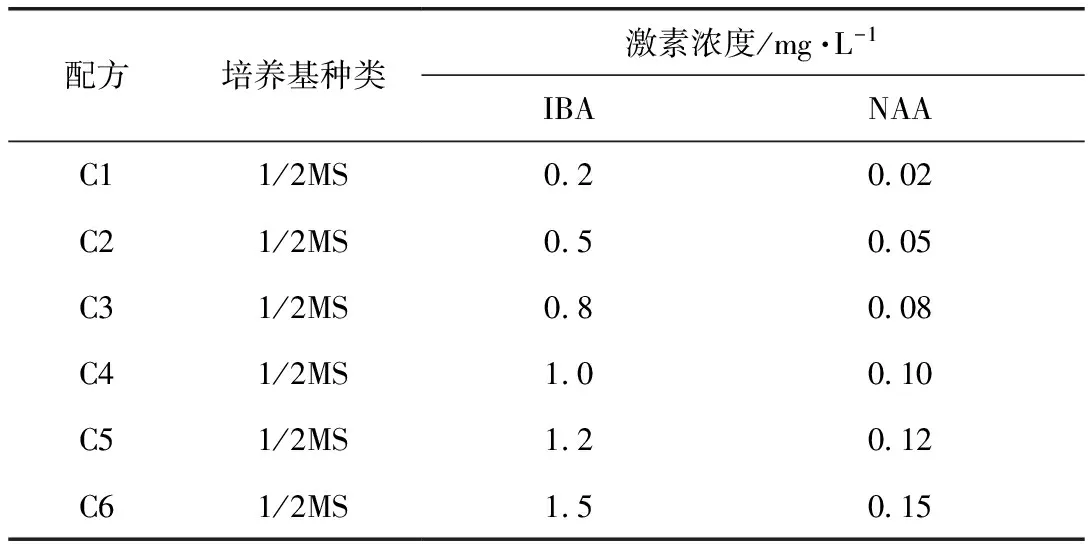
配方培养基种类激素浓度/mg·L-1IBANAAC11/2MS0 20 02C21/2MS0 50 05C31/2MS0 80 08C41/2MS1 00 10C51/2MS1 20 12C61/2MS1 50 15
以上培养基均为添加蔗糖20 g·L-1,琼脂粉4 g·L-1,PH值为5.8~6.0。
1.2 方法
黄精组织培养过程均在超净工作台内进行无菌操作。培养房环境温度为(26±2)℃,光照强度为2000 Lx,时间12 h·d-1。
1.2.1 种子消毒与萌芽 将培养箱中催芽待用的种子,浸水去掉漂浮的种子用自来水漂洗三次。在超净工作台内进行消毒处理:将种子放入玻璃瓶内,用无菌水冲洗3次用75% 酒精漂洗30 s,倒掉酒精,用0.13% 的氯化汞溶液表面灭菌4~6 min后,再用无菌水冲洗4~5次,取出种子用无菌纱布沥干。将种子接至诱导培养基上,每瓶接3颗种子,每个配方接20瓶,放在培养室培养。启动诱导前阶段(5~10 d),种子萌发形成小球茎,继续培养5~10 d,小球茎组织形成生长点而萌发出芽,接种25 d后,观察各个配方的萌芽情况。

1.2.2 继代增殖培养 萌芽的小球茎继续培养,球茎基部继续膨大,长到1 cm左右大小时,将球茎切成0.2~0.3 cm的小块接种至继代增殖培养基中。每瓶只接入5个点,每个配方接种20瓶。放置培养房内培养25 d,小球茎继续萌发出芽,观察和统计各自增殖情况,重复三次试验。

1.2.3 生根壮苗 在继代增殖培养过程中,选取株型较好,植株粗壮的继代苗,接种于生根培养基中。每瓶接入4株苗,每个配方接种20瓶。放置培养室先暗培养20 d转光照培养20 d,观察和统计各自生根情况。

1.2.4 室外炼苗移栽 生根培养40 d后,搬出培养房,放置自然环境7 d,选取有3条以上正常根系的生根苗,清洗掉根系附着的培养基,栽植于(沙子∶泥炭土=1∶1)的炼苗基质中,每10 d喷施1次营养液,30 d后统计成活率。

2 结果与分析
2.1 无菌外植体的获得
种子处理接种培养第10 d,观察发现有的种子开始萌发芽(图1),25 d后观察发现萌芽基部膨大分化成球茎(图2)。

图1 接种的种子

图2 发芽的种子
试验过程中记录和统计数据得出表1。由表1可以看出,启动培养基配方当中,BA浓度升高,其萌芽率也随之提高。在试验过程中观察发现当BA浓度提高到2.0 mg·L-1(A5、 A6)浓度时,其萌芽率虽然较高,可是基部出现较多愈伤组织(图3),这可能是由于激素浓度过高造成的。因此启动培养诱导芽阶段BA浓度不宜超过1.5 mg·L-1。在实验过程中还发现,添加GA3的A2、 A4、A6配方均在培养10 d左右就开始萌芽,没有添加GA3的A1、 A3、A5均在15 d后才开始萌发,结合试验统计数据还看出在相同BA浓度基础上,GA3对萌发率影响不大,但是对萌发速度有明显加快(10 d左右萌发)。
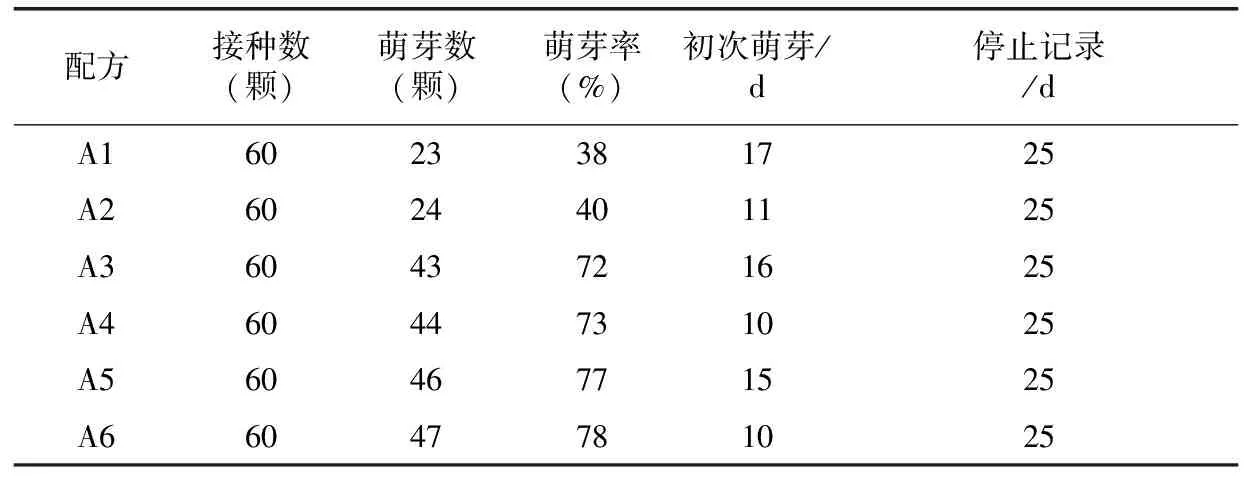
表1 不同激素配方组合对诱导萌芽的影响

注:上.形成愈伤组织;下.正常萌发图3 在培养基上萌发的种子
2.2 不同激素浓度对黄精的继代增殖影响
在继代增殖过程中,主要考虑细胞分裂素(6-BA)对芽增殖影响,生长素NAA固定浓度0.2 mg·L-1配合使用。在启动获得无菌外植体成功后,将带有萌芽的球茎切成0.2 cm左右大小接种于设计的6组继代增殖培养基中,25 d后均可以产生丛生芽以达到增殖目的(图4)。

图4 多花黄精继代苗
根据实验过程的观察和记录,此培养过程中做的三次重复试验,每次接种芽数均为100个,(三次试验新芽数B1:133、128、135;B2:159、163、156;B3:202、205、198;B4:251、255、246;B5:256、261、266;B6:303、309、300;)每组激素浓度配方的三次新芽数相差均在±10个以内,可以看出各组激素浓度对增殖影响的相对稳定性,由此综合统计得出表2。

表2 不同激素浓度对继代增殖的影响
由表2可以看出,在黄精继代增殖过程中,6-BA浓度相对提高,其增殖系数也相应提高,当浓度超过2.0时,表2中B5和B6配方增殖系数分别为2.6和3.0,均比B4(增殖系数为2.5)高,但在继代过程中观察发现B5和B6组别继代苗长势弱小明显,不利于后面的生根壮苗培养,达不到优质种苗要求。
2.3 不同激素浓度对生根影响
在生根壮苗过程中,为更好促进壮苗生根,培养基采用1/2MS,激素调节主要考虑生长素对生根的影响,IBA和NAA均属于生长素,对生根有促进作用,本次试验中,设计IBA/NAA比值为10∶1的6个不同梯度的生根壮苗配方(C1-C6)。接种培养40 d,根据试验过程观察和记录数据,结果见表3。

表3 不同浓度激素对生根影响
由表3可以看出,IBA浓度低于1.0,生根状态良好,但是生根率较低。IBA浓度在1.0时,其生根率和生根状态处于一个较佳状态(图5),当超出1.0浓度时候,生根率虽然略有提高,但每株根数太多,根须细小(图5),炼苗时候根须太多且过长不方便移栽,根须弱导致吸附营养能力不强,不利于提高室外炼苗的成活率。

注:上.正常生根苗;下.根须多细长图5 生根培养的组培苗
2.4 组培苗室外炼苗
在清洗好的生根苗(图6),选取3~8条根一组移栽100株,9条根以上一组移栽100株,移栽到炼苗杯中(沙子∶泥炭土=1∶1),每10 d喷施1次营养液,30 d后生长稳定(图6),通过观察和统计数据得出表4。

注:上.生根苗;下.炼苗图6 黄精组培苗的炼苗移栽

根须数移栽株数成活株数成活率4~810095959条以上1007171
由表4看出,根数太多,不但在移栽过程中不方便操作,且其移栽成活率相对较低,为2.3中最佳生根配方选择提供了佐证。
3 结论
在利用多花黄精根茎进行离体组织培养过程中,其无菌体系建立存在困难,主要原因是地下根茎中微生物多,根茎本身也存在内生菌[4]。因此,如何建立无菌培养体系是多花黄精快速繁殖系统首先要解决的难题。在研究中,成功的利用多花黄精种子作为外植体,通过种子表面灭菌,在提供几种植物生长激素的情况下,建立了多花黄精的增殖诱导、快速扩增及生根培养和炼苗移栽体系。
在继代增殖和生根过程中,添加的外源激素浓度与多花黄精组培快繁之间存在一定的关系,选择合适的外源植物生长激素的配比是关键。这与许多植物组培相关文章中提到的激素浓度对植物组培生产影响相一致[5-6]。本文试验中,得出多花黄精组培过程中,无菌培养诱导和继代增殖的最佳培养基分别为:MS基本培养基附加6-BA(1.5 mg·L-1),NAA(0.2 mg·L-1),GA3(0.5 mg·L-1)和MS基本培养基附加6-BA(2.0 mg·L-1),NAA(0.2 mg·L-1);生根壮苗阶段的最佳培养基为1/2 MS基本培养基附加IBA(1.0 mg·L-1),NAA(0.1 mg·L-1)。多花黄精组培瓶苗不能直接下地移栽种植,必须先经过瓶外炼苗阶段,用炼苗基质进行装杯进行炼苗30 d后才可以大田种植,本文试验中炼苗成活率达95%以上。本试验结果直接应用于组培企业生产,可为规模化生产优质多花黄精种苗提供依据。
[1] 郑云峰,李松涛.黄精的应用与栽培[J].特种经济动植物,2002(5):25.
[2] 国家药典委员会.中华人民共和国药典:一部[S].北京:化工工业出版社.2005.1:232.
[3] 周建金,罗晓峰,叶炜,等.多花黄精组织培养技术.三明农业科技.2012(3):124.
[4] 万学锋,陈菁瑛.多花黄精组培技术初探.中国现代中药,2013,15(10):850.
[5] 徐红梅,赵东利.植物生长调节剂对多花黄精芽体外发生过程中性状的影响[J].中草药,2003(9):855-858.
[6] 徐忠传,何俊蓉,周静亚,等.6-BA浓度对多花黄精不定芽增殖的影响[J].安徽农业大学学报,2006,33(1):105-107.
