胰腺实性假乳头状瘤伴肝转移一例
2018-04-27郑星泸秀玲
郑星泸,秀玲
胰腺实性假乳头状瘤(SPT),发病率低,极少转移。本院接收1例患者,3年前于本院肿瘤切除手术,现发现肝脏转移,报道如下。
1 病例
患者女,38岁,进食后上腹部饱胀不适,自觉上腹部有肿块。入院行腹部增强CT,提示“右中上腹巨大占位伴胰头受压、胰管扩张;消化道来源间质瘤可能大”;实验室检查血液糖类抗原 125(CA125)+癌胚抗原(CEA)+糖类抗原CA199无异常。患者于2014年3月行胰头十二指肠切除术。肉眼观察胰头处见有巨大肿块,粘连十二指肠,直径约12 cm;切面部分灰白,部分暗红,实性,切面质软,部分区有包膜。镜下显示肿瘤细胞近圆形,显示轻度异型,核分裂少见,胞质丰富,嗜酸性,肿瘤细胞围绕血管,似乳头结构(图1),远离血管处肿瘤细胞变性。免疫组化:PR、Vimentin、-catenin(图 2)、CD56、Syn、CD10 均阳性,CK7、ER、CK20、CD117、CD34、EMA、WT-1、CgA均阴性,Ki-67约5%阳性。经过本院病理科及温州医科大学附属第一医院病理科一致诊断为(胰头)胰腺实性假乳头状瘤。随访3年,增强CT显示肝内多发类圆形低密度影,最大者位于Ⅷ段径约 60 mm,呈囊实性。实验室检查CA125+CEA+A199均无异常。患者于2017年7月行超声引导下右肝占位穿刺活检。镜下显示肿瘤细胞一致,偏小,温和,可见核内包含体和透明小体;免疫组化CD10、Syn、-catenin强阳性,CK灶区弱阳性,最后结果诊断为(肝穿刺标本)胰腺实性假乳头状瘤转移。

图1 肿瘤异型较小,胞质嗜酸性,肿瘤细胞围绕血管,似乳头结构(HE,×100)
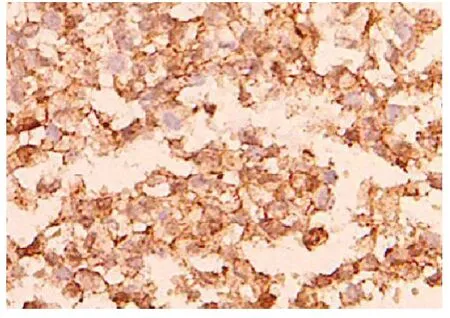
图2 肿瘤细胞核浆弥漫表达 -catenin(Eli-Vision,×200)
2 讨论
SPT占胰腺原发肿瘤的1%~2%,主要见于年轻女性,本例即为年轻女性。患者难以发现肿瘤,大部分患者CA125、CEA及CA199均正常,本例不管是在术前还是此次肝转移后,CA125、CEA及CA199均未出现升高现象,实验室检查意义不大。增强CT检查意义重大[1],可发现SPT的影像学特征。李阔等[2]一组SPT的CT分析,表现为位于胰腺包膜完整的膨胀性生长的低密度包块;内部表现为囊实混合密度;增强后病灶强化低于周围组织且分界清,囊性部分无强化。
SPT大体上肿块界限较清楚,直径常常可达10cm;本例肿瘤直径达到12cm。黄褐色到红褐色,多质脆,较软,有些亦可有明显的纤维化和囊变区。光镜下SPT的基本结构为细胞丰富的实性巢,其间有丰富的小血管。远离血管的细胞出现退变,而小血管周的多层细胞围绕小血管形成所谓的假乳头状排列,细胞核浆比较一致,常有纵沟,胞浆中等,嗜酸性,典型的瘤细胞浆内可见嗜酸性透明小滴。粗大的纤维血管轴心常呈明显的黏液变性,这也是诊断的一个重要特征。
SPT有独特的免疫组化特点。神经内分泌标志物(Syn、CD56)呈阳性表达,说明具有神经内分泌分化倾向,但特异性最好的神经内分泌标记物CgA总是阴性的[3]。有研究表明SPT的发生与激活 -catenin基因突变有关,故免疫组化表现为细胞核浆 -catenin染色阳性;PR、Vimentin、和 CD10 常呈阳性,1-抗胰蛋白酶局灶可阳性表达,PAS特殊染色透明小滴阳性,角蛋白(CAM5.2和AE1/AE3)表达缺失或局灶弱表达,CEA、CA199 通常为阴性[4]。
SPT淋巴结转移未见报道,偶见肝转移,可能通过肠系膜上静脉和门静脉转移到肝脏[5]。本例患者术后3年出现肝转移。Law等[6]分析了1961—2012年收治的2 744例接受手术治疗的SPT患者资料,发现4.4%(86例)的患者出现复发,复发的中位时间为50.5个月,然而即便是恶性的SPT患者病死率亦不到1.5%。
SPT需要与以下疾病进行鉴别诊断:(1)胰腺内分泌肿瘤。小圆形一致的细胞,伴有细胡椒盐样染色质,小梁状,腺泡状以及实性结构,缺少退行性改变和假乳头状结构,CK及CgA可以阳性表达,Vimentin、-catenin 阴性。(2)胰母细胞瘤。通常发生在年幼儿童,腺泡结构伴有鳞状小体,缺少假乳头状结构,可以有软骨样或骨样组织成分。(3)腺泡细胞癌。界限不清的结节或多囊性肿块,小梁状或腺泡状结构,但没有假乳头状区域,1-抗胰蛋白酶阳性,CK阳性,Vimentin阴性,神经内分泌均不表达。
手术是SPT的首选治疗方法,具体术式取决于肿瘤的部位、大小、是否有邻近侵犯及远处转移等。大多肿瘤完整切除,预后多较好[7-8]。在完整切除肿瘤的同时应尽可能地保留正常组织,从而保存胰腺内外分泌功能及消化道的完整性,减少手术并发症,改善患者生活质量。对于合并肝转移的患者,可在切除原发灶的同时,行解剖性或不规则性肝脏切除术或肝脏肿瘤射频术。即使患者已经出现局部侵犯或远处转移,在接受手术治疗后仍能获得良好的预后[9-10]。Sumida等[11]报道1例行肝移植治疗多发肝转移的SPT患者,2年随访期间未见复发及转移,预后较好。
有研究表明,直径≤5 cm的SPT其预后好于直径>5 cm的SPT,特别是在无瘤生存方面,肿瘤直径越大,其术后复发或转移的风险越大[12]。本例原发肿瘤达12 cm,应视为高风险案例。总之,SPT缺乏特异性临床特征及实验室检查方法,增强CT检查诊断意义较大,确诊需靠病理诊断。
参考文献:
[1] 高春涛,赵天锁,郝继辉.50例胰腺实性假乳头状瘤的临床诊治分析[J].中国肿瘤临床,2017,44(4):173-176.
[2] 李阔,盛伟伟,周建平,等.CT对胰腺实性假乳头状瘤的临床诊断价值:26例病例报告[J].中国医科大学学报,2017,44(4):375-378.
[3] 刘彤华.诊断病理学[M].3版.北京:人民卫生出版社,2013:366-367.
[4] 杨含,李宁,邓文英,等.胰腺实性假乳头状肿瘤的临床特征手术策略及预后[J].中华肿瘤杂志,2017,39(3):211-215.
[5] Reddy S,Wolfgang CL.Solid pseudopapillary neoplasms of the pancreas[J].Adv Surg,2009,43(1):269-282.
[6]Law JK,Ahmed A,Singh VK,et al.A systematic review of solid pseudopapillary neoplasms:are these rare lesions[J].Pancereas,2014,43(3):331-337.
[7] 宋禾,董明,周建平,等.胰腺实性假乳头状瘤临床诊治分析[J].中华普通外科志,2016,31(1):1-3.
[8] Campanile M,Nicolas A,LeBel S,et al.Frantz’s tumor:Is mutilating surgery always justified in young patients[J].Surg Oncol,2011,20(2):121-125.
[9] Kim MJ,Choi SH,et al.Surgical treatment of solid pseudopapillary neoplasms of thepancreasand risk factorsfor malignancy[J].Br JSurg,2014,101(10):1266-1271.
[10]Wang WB,Zhang TP,Sun MQ,etal.Solid pseudopapillary tumor of the pancreas withliver metastasis:Clinical featuresand management[J].Eur JSurg Oncol,2014,40(11):1572-1577.
[11]Sumida W,Kaneko K,Tmnaka T,et al.Liver transplantation for muhiple liver metastases from solid pseudopapillary tumor of the pancreas[J].Pediatr Surg,2007,42(12):27-31.
[12]徐明月,史宪杰,何蕾,等.直径≤5 cm与直径>5 cm的胰腺实性假乳头状瘤的临床病理特点及预后比较[J].南方医科大学学报,2016,36(6):780-784.
