急性间质性肾炎临床特点及尿α1-MG和NAG水平与病情严重程度关系
2018-04-27纪星星程霞梅玉秀
纪星星 程霞 梅玉秀
上海交通大学附属上海市第六人民医院肾内科,上海 200233
急性间质性肾炎(AIN)患者以肾小球及肾间质炎症反应为主要病理改变,肾功能下降有发生肾衰竭的可能[1]。经早期治疗,多数AIN患者可恢复,控制不佳将进展至慢性肾功能不全[2]。肾组织活检是早期发现肾小管间质病变的重要方法,但属有创检查,无法作为常规监测手段。既往研究发现,尿α1微球蛋白(α1-MG)和N-乙酰-β-D-葡萄糖苷酶(NAG)水平变化与肾功能损害程度具有密切关联[3]。本文在过往研究的基础上,就AIN的临床特点及尿α1-MG和NAG水平与病情严重程度的关系进行了分析。
1 资料与方法
1.1 研究对象
分析2014年5月—2016年7月我科153例AIN患者资料,入选患者均经肾脏穿刺活检明确诊断[4],病历资料完整且随访时间≥3个月,排除既往有肾小球病史者,合并梗阻性肾病、其他严重系统性疾病者,以及入院前2周内血压>160/90 mmHg、24 h尿蛋白>3 g者。
1.2 研究方法
按照患者预后转归,治疗3个月后各项肾功能指标均恢复至正常范围者纳入恢复组,血清肌酐水平仍高于正常上限者纳入慢性化组[5],对两组患者临床特征与病理特征进行比较。以散射比浊法检测尿α1-MG,正常参考值0~12 mg/L;尿NAG以手工比色法检测,正常参考值0~18.5 U/L[6-7]。
统计分析软件为SPSS19.0,对不同肾小管间质病理改变程度患者尿α1-MG、NAG阳性率进行比较,采用χ2检验,以P<0.05为差异有统计学意义。运用非参数秩相关分析,计算尿α1-MG和NAG水平与肾小管间质病变程度的相关性。肾小管间质病理改变程度评估标准[8]:0级:肾小管间质无变化;1级:肾小管间质基本正常,但可见轻度小管变性、扩张;2级:肾小管间质纤维化,小管萎缩<20%,可见散在炎性细胞浸润;3级:肾小管间质纤维化,小管萎缩20%~40%,可见散在或(和)弥漫性炎性细胞浸润;4级:肾小管间质纤维化,小管萎缩>40%,可见散在或(和)弥漫性炎性细胞浸润。
2 结果
2.1 临床特征
患者临床表现以消化道症状、少尿、发热为主,腰痛、水肿、肉眼血尿发生率两组间差异无统计学意义。153例患者中,114例恢复,39例转为慢性肾功能不全,AIN慢性化率为25.49%。恢复组年龄(42.96±8.42)岁,就诊时间(13.26±3.35)d;慢性化组年龄(43.36±8.25)岁,就诊时间(19.82±4.68)d。恢复组就诊时间小于慢性化组,差异有统计学意义(P<0.05)。
患者发病原因以药物导致为主,占83.66%,其中抗生素占比最高,为44.44%,恢复组、慢性化组病因分布组间比较,差异无统计学意义(P>0.05),见表1。
恢复组贫血、视黄醇结合蛋白升高、免疫球蛋白E升高率及视黄醇结合蛋白水平均低于慢性化组,差异有统计学意义(P<0.05),见表2。
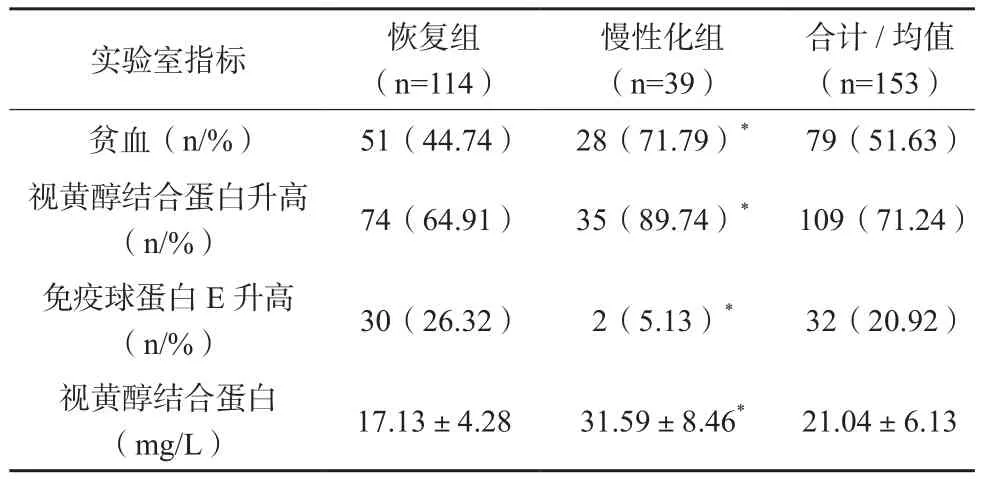
表2 153例患者实验室指标比较(x±s)
2.2 病理特征
患者病理特征以刷状缘脱落、小管炎为主,恢复组间质弥漫细胞浸润、间质水肿、嗜酸细胞发生率及CD4计数、CD8计数均低于慢性化组,差异有统计学意义(P<0.05),见表3。
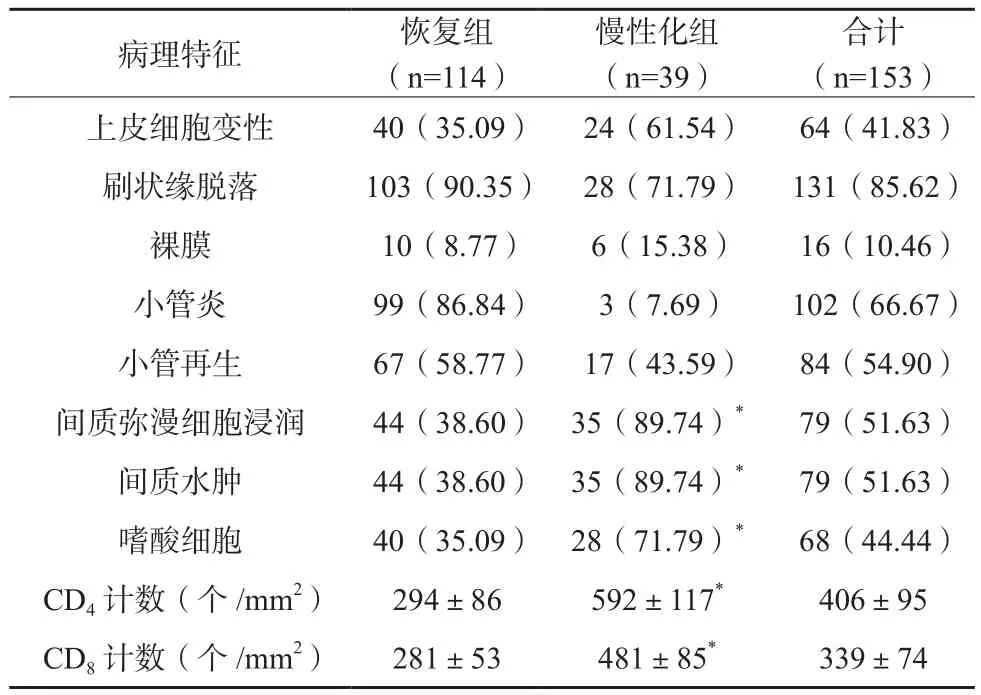
表3 153例AIN患者病理特征(n/%)
2.3 尿α1-MG和NAG分析
153例AIN患者尿α1-MG、NAG阳性率分别为86.27%、82.35%,恢复组与慢性化组的尿α1-MG、NAG阳性率为82.46%VS97.44%、79.82%VS89.74%,恢复组均低于慢性化组,差异有统计学意义(P<0.05)。
入选患者无肾小管间质病变4级,随着AIN患者肾小管间质病变程度由0级向3级进展,其尿α1-MG阳性率分别为52%、80.56%、97.75%、100%;NAG阳性率为56%、58.33%、98.88%、100%,阳性率均逐渐提高。非参数秩相关检验结果示,尿α1-MG(r=0.681)和NAG(r=0.549)阳性率和肾小管间质病变程度呈正相关(P<0.05)。
3 讨论
近年来,随着各类新药的临床应用,药物所致AIN呈逐年上升趋势,而抗生素一直是造成AIN的重要因素[9]。本研究药物导致者占83.66%,原因与药物及其代谢产物作为半抗原,与肾小管基膜组分结合介导的细胞免疫有关[10]。此外,药物的代谢产物还可作为种植性抗原,沉积于肾小管及间质内,造成肾间质损伤,而抗原抗体反应激活所致非抗体特异性免疫释放某些蛋白溶解酶,加剧AIN进展[11-12]。
通过就诊时机的比较可以发现,发病后就诊不及时患者,其慢性化风险较高,考虑与病变时间增加所致肾组织损伤加剧、更易进入慢性化病程有关[13]。
尿视黄醇结合蛋白升高是肾小管损伤的重要标志,恢复组、慢性化组尿视黄醇结合蛋白异常率分别为64.91%、89.74%,说明AIN患者普遍处于肾小管损伤状态[14]。与此同时,AIN患者免疫球蛋白E异常率亦高达20.92%,考虑与药物引发的AIN往往伴随着过敏反应有关。慢性化组病理特征表现出间质弥漫细胞浸润、间质水肿表明其治疗已相对延迟,此时间质浸润细胞释放大量转化生长因子,是造成基质增生、纤维化及慢性化病变的主要原因[15-16]。
α1-MG在血液内以游离、结合两种形式存在,其中游离的α1-MG可自由通过肾小球,且约99%可被肾小管重吸收或代谢,其排出量增加表明肾小管重吸收功能障碍。由于α1-MG不受酸碱度、尿路感染等因素影响,在反映肾小管间质早期损害方面,α1-MG较β2-MG具有更为明显的优势[17]。NAG是一种高分子量溶酶体酶,正常情况下无法自由通过肾小球基膜,故尿液NAG含量升高意味着近端肾小管细胞受损严重。α1-MG、NAG可分别自肾小管重吸收功能、肾小管实质细胞角度,反映肾小管间质病变程度,故能够有效评估AIN患者病情严重程度[18]。
总之,AIN患者具有较高的慢性肾功能不全转化风险,这与其临床特征及病理特征均具有一定关联,而监测尿α1-MG和NAG有助于评估患者病情严重程度,为治疗方案的调整与预后判断提供参考。
[1] KATSUMA A, SHIBATA M, KATSUKI T, et al. A case of acute interstitial nephritis and granulomatous hepatitis induced by ingesting quinine[J]. CEN Case Rep, 2015, 4(1): 76-80.
[2] A R A I H, H AYA SH I H, TA K A H A SH I K, e t a l.Tubulointerstitial fi brosis in patients with IgG4-related kidney disease: pathological findings on repeat renal biopsy[J].Rheumatol Int, 2015, 35(6): 1093-1101.
[3] 黄琼莲, 覃西, 李浩,等. 尿α_1-MG检测对肾损害早期诊断的应用价值[J]. 临床误诊误治, 2014,27(7):87-89.
[4] INOUE R, FUJIGAKI Y, KOBAYASHI K, et al. Clinical Presentation of Tubulointerstitial Nephritis Caused by Amyloid Light-chain Amyloidosis in a Patient with Sjögren’s Syndrome[J]. Intern Med, 2017, 56(4): 419-423.
[5] SUZUKI T, IYODA M, YAMAGUCHI Y, et al. A case of sporadic medullary cystic kidney disease type 1 (MCKD1) with kidney enlargement complicated by IgA nephropathy[J]. Pathol Int, 2015, 65(7): 379-382.
[6] NOIRI C, SHIMIZU T, TAKAYANAGI K, et al. Clinical significance of fractional magnesium excretion (FEMg) as a predictor of interstitial nephropathy and its correlation with conventional parameters[J]. Clin Exp Nephrol, 2015, 19(6):1071-1078.
[7] NEESH PANNU, XIAOYAN WEN, JOHN A. KELLUM,et al. N-Acetyl-β-(d)-Glucosaminidase[M]. Springer Berlin Heidelberg, 2012.
[8] ASANUMA K. Podocyte Injury and Significance of Urinary Podocalyxin and Megalin[M]. Springer Japan, 2016: 89-96.
[9] QIAO X, WANG L, WANG C, et al. IgG4-related tubulointerstitial nephritis associated with only lymphadenopathy and without elevated serum IgG4 or renal imaging abnormalities: a case report and literature review[J]. Int J Clin Exp Med, 2015, 8(10): 19548.
[10] 章倩莹, 潘晓霞, 张文,等. 肾小球肾炎合并急性间质性肾炎的临床病理分析[J]. 中华肾脏病杂志, 2008, 24(5):319-323.
[11] BAZZI C, RIZZA V, OLIVIERI G, et al. Tubular reabsorption of high, middle and low molecular weight proteins according to the tubulo-interstitial damage marker N-acetyl-β-dglucosaminidase in glomerulonephritis[J]. Am J Nephrol, 2015,28(5): 541-548.
[12] 安海倩. 老年人急性间质性肾炎研究进展[J]. 国际泌尿系统杂志 , 2016, 36(3): 467-469.
[13] CARTER J L, PARKER C T, STEVENS P E, et al. Biological variation of plasma and urinary markers of acute kidney injury in patients with chronic kidney disease[J]. Clin Chem, 2016,62(6): 876-883.
[14] 邵晓珊, 江超, 李宇红, 等. 不同血液净化模式对急性肾损伤患儿血清β2微球蛋白的清除效果及安全性研究[J]. 国际儿科学杂志 , 2015, 42(1): 106-109.
[15] BAZZI C, STIVALI G, RACHELE G, et al. Arteriolar hyalinosis and arterial hypertension as possible surrogate markers of reduced interstitial blood flow and hypoxia in glomerulonephritis[J]. Nephrology, 2015, 20(1): 11-17.
[16] GOBE G C, COOMBES J S, FASSETT R G, et al. Biomarkers of drug-induced acute kidney injury in the adult[J]. Expert Opin Drug Metab Toxicol, 2015, 11(11): 1683-1694.
[17] PALLET N, CHAUVET S, CHASSÉ J F, et al. Urinary retinol binding protein is a marker of the extent of interstitial kidney fi brosis[J]. PloS one, 2014, 9(1): e84708.
[18] RACZKIEWICZ A, NOWAK Z, TŁUSTOCHOWICZ W. Renal involvement in rheumatoid arthritis[J]. Reumatologia, 2014,52(5): 311-318.