非酒精性脂肪肝及肥胖与代谢综合征的相关性
2018-04-27汪菲孙亚丽戴建业曾强
汪菲 孙亚丽 戴建业 曾强
中国人民解放军总医院健康管理研究院,北京 100853
代谢综合征(MS)是由高血糖、向心性肥胖、脂代谢异常等多种异常代谢疾病组成的临床综合征,与胰岛素抵抗、应激系统失衡、炎症反应、过量脂肪组织紊乱等因素相关[1-2]。近年来,有研究指出,非酒精性脂肪肝(NAFLD)常引发肝脏酶学升高,可能是MS的肝脏表现之一[3]。此外,也有学者认为,肥胖、胰岛素抵抗所致一次打击是诱发MS的主要原因,而NAFLD引发的肝脏脂质沉积可形成二次打击,加剧代谢紊乱状态[4]。为了解NAFLD、肥胖与MS的关系,本研究选取971名受试者进行了对照分析。
1 对象与方法
1.1 对象与分组
此次临床研究资料均来源于我院健康管理研究院2014年3月至2017年3月成年体检人群,在排除合并慢性病毒性肝炎、进展性致命性疾病者以及合并引起继发性脂肪肝因素者的基础上,共有971名受试者纳入此次研究。
按照检查结果进行分组,将合并NAFLD、肥胖者纳入NO组,将单纯NAFLD患者纳入N组,将单纯肥胖者纳入O组,将未检出NAFLD、肥胖者纳入对照组。体质量指数(BMI)≥28 kg/m2为肥胖;参照2002年中华医学会肝脏病学分会脂肪肝和酒精性脂肪肝学组制定的诊断标准,在符合影像学诊断依据的基础上,合并易患因素、无饮酒史或每周酒精摄入量<40 g、存在脂肪肝症状、血清转氨酶升高表现,即可明确NAFLD诊断[5]。
1.2 研究方法
比较各组受试者MS患病率,MS诊断标准参照2005年国际糖尿病联盟MS定义[6]:男性/女性腰围超过90 cm/80 cm,同时满足以下指标中任意2项及以上:1)甘油三酯(TG)>1.7 mmol/L或已接受相关治疗;2)男性高密度脂蛋白胆固醇(HDL-C)<0.9 mmol/L,女性HDL-C<1.3 mmol/L ;3)收缩压(SBP)≥130 mmHg和(或)舒张压≥85 mmHg,或明确高血压诊断,或已接受相关治疗;4)空腹血糖(FPG)≥5.6 mmol/L,或明确2型糖尿病诊断,或已接受相关治疗。此外,对4组受试者进行两两分组,比较各组受试者基本特征(年龄、性别、BMI),以及SBP、收缩压(DBP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、TG、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、HDL-C及FPG水平,分析其代谢紊乱状态以及NAFLD、肥胖与MS的相关性。
统计分析使用SPSS18.0,以P<0.05为差异有统计学意义。
2 结果
971名受试者中,对照组724名,NO组142例,N组34例,O组71例。
4组受试者年龄、性别比较,差异无统计学意义(P>0.05);对照组、N组BMI低于NO组、O组,差异有统计学意义(P<0.05);对照组、O组、N组、NO组MS患病率依次升高,差异有统计学意义(P<0.05)。见表1。
NO 组 SBP、DBP、ALT、AST、TG、TC、LDL-C、FPG均高于O组,其HDL-C低于后者,差异有统计学意义(P<0.05),见表2。NO组与N组代谢状态比较,差异无统计学意义(P>0.05),见表3。N组SBP、DBP、ALT、AST、TG、TC、LDL-C、FPG均高于对照组,其HDL-C低于后者,差异有统计学意义(P<0.05),见表4。O组与对照组代谢状态比较,差异无统计学意义(P>0.05),见表5。
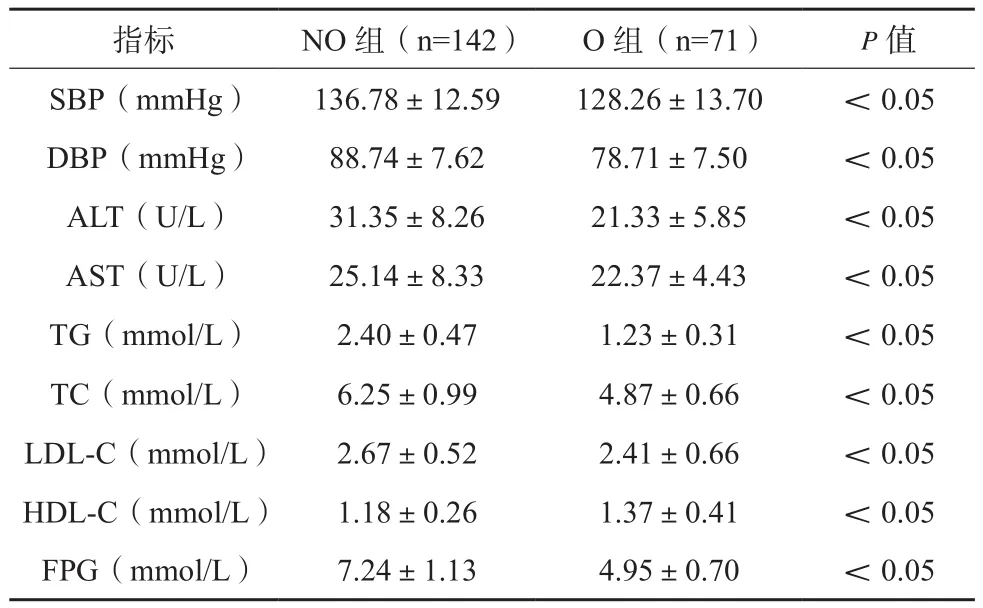
表2 NO组与O组代谢状态比较(x±s)
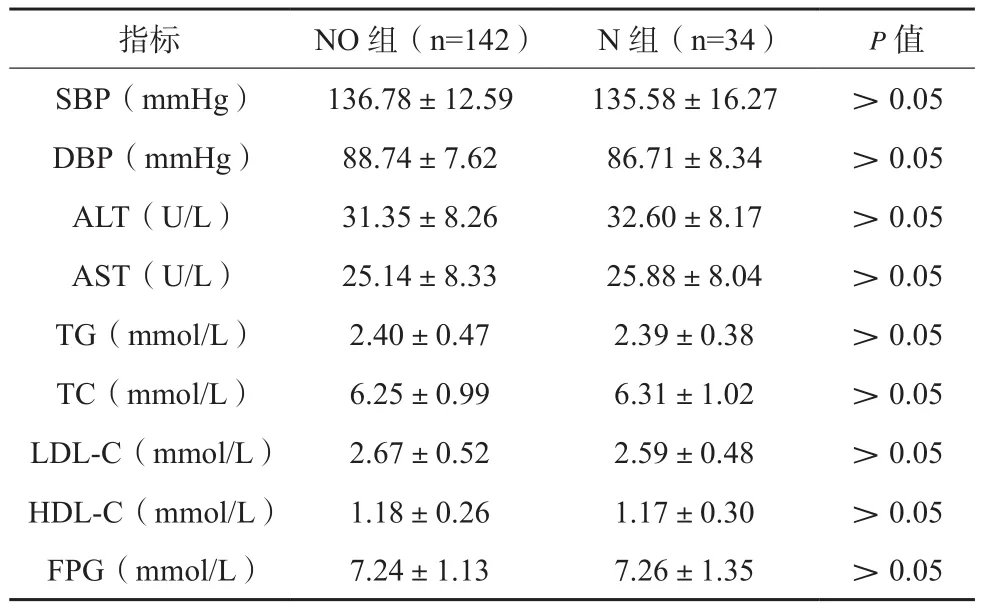
表3 NO组与N组代谢状态比较(x±s)

表4 N组与对照组代谢状态比较(x±s)
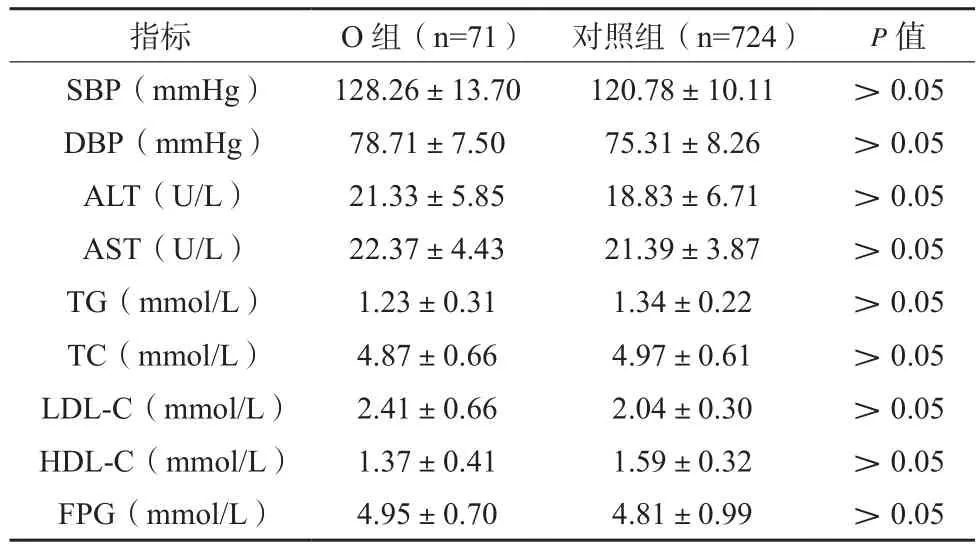
表5 O组与对照组代谢状态比较(x±s)
3 讨论
随着我国肥胖人群迅速增加,肥胖相关的血脂代谢异常以及MS升高趋势备受关注。越来越多的研究发现,脂肪不仅仅是组织器官间的充填物、被动的燃料储存库,也是一种重要的内分泌、自分泌、旁分泌组织,其中,激素蛋白脂联素的分泌,被认为与胰岛素抵抗和2型糖尿病的发生发展密切相关[7-8]。NAFLD患者肝脏的代偿性增大、处理脂肪能力的下降,也可造成脂肪异位沉积,引发肥胖、血压、血糖紊乱的发生[9]。 此次研究体检者NAFLD患病率为18.13%,肥胖患病率达21.94%,且NAFLD合并肥胖者占比亦高达14.62%,印证了我国高NAFLD、肥胖患病率的现状[10]。我国城市居民日常饮食高油高脂、活动量偏少,均使得NAFLD、肥胖发生率不断上升[11-12]。
然而,当前临床仍存在大量超重或正常体重患者罹患MS,故有学者对NAFLD、肥胖与MS的关系存在争议,并认为肥胖并非是MS的必要前提条件[13-14]。本研究对照组患者MS患病率为9.81%,O组为11.27%,均低于NO组的22.54%,与上述结论一致。为明确其具体机制,此次研究按照患者NAFLD、肥胖患病情况进行了分组对比,结果显示,O组BMI明显高于对照组,但两组受试者各项代谢指标比较,差异无统计学意义,说明单纯肥胖并不足以导致明显代谢紊乱的发生。与之相比,N组、NO组患者均存在明显代谢紊乱症状,且其MS患病率分别高达17.65%、22.54%,说明NAFLD在MS发生发展中的地位至关重要,且合并肥胖的NAFLD患者有着更高的MS发生风险,故也有学者认为,NAFLD是MS的肝内表现[15]。
目前临床关于NAFLD引发MS的机制尚无明确解释,通常NAFLD患者脂肪组织增生能力下降、线粒体功能低下以及组织内脂肪酸β氧化减少所致异位脂肪沉积,是造成脂肪组织大量分泌炎症因子、细胞因子并引发代谢紊乱的主要原因[16-17]。也有学者指出,异位脂肪细胞可吸引巨噬细胞、免疫细胞进入间质血管组织内,形成炎症级联反应并影响脂肪细胞分化与脂解,也是导致MS的重要环节[18]。
总体而言,与肥胖相比,NAFLD在MS的发生发展中发挥了更为重要的作用,对于明确NAFLD诊断的患者,即便未检出代谢紊乱也应予以早期干预,以预防MS以及MS相关心血管系统病变的发生。关于肥胖与MS的相关性,有待日后大样本研究或基础研究进一步探索。
[1] FURUKAWA S, FUJITA T, SHIMABUKURO M, et al.Increased oxidative stress in obesity and its impact on metabolic syndrome[J]. J Clin Invest, 2017, 114(12): 1752-1761.
[2] DIETRICH P, HELLERBRAND C. Non-alcoholic fatty liver disease, obesity and the metabolic syndrome[J]. Best Pract Res Clin Gastroenterol, 2014, 28(4): 637-653.
[3] 吕霞霞, 孙建光. 代谢综合征与非酒精性脂肪肝的相关性分析[J]. 现代预防医学 , 2015, 42(22): 4218-4220.
[4] LONARDO A, BALLESTRI S, MARCHESINI G, et al.Nonalcoholic fatty liver disease: a precursor of the metabolic syndrome[J]. Dig Liver Dis, 2015, 47(3): 181-190.
[5] ESSER N, LEGRAND-POELS S, PIETTE J, et al. Inf l ammation as a link between obesity, metabolic syndrome and type 2 diabetes[J]. Diabetes Res Clin Pract, 2014, 105(2): 141-150.
[6] 魏文志, 常广, 李海生, 等. 健康体检人群脂肪肝与代谢综合征的相关性研究[J]. 中华保健医学杂志, 2015, 17(4): 311-312.
[7] AL RIFAI M, SILVERMAN M G, NASIR K, et al. The association of nonalcoholic fatty liver disease, obesity,and metabolic syndrome, with systemic inflammation and subclinical atherosclerosis: the Multi-Ethnic Study of Atherosclerosis (MESA)[J]. Atherosclerosis, 2015, 239(2): 629-633.
[8] JUNG U J, CHOI M S. Obesity and its metabolic complications:the role of adipokines and the relationship between obesity,inf l ammation, insulin resistance, dyslipidemia and nonalcoholic fatty liver disease[J]. Int J Mol Sci, 2014, 15(4): 6184-6223.
[9] DUMAS M E, KINROSS J, NICHOLSON J K. Metabolic phenotyping and systems biology approaches to understanding metabolic syndrome and fatty liver disease[J]. Gastroenterology,2014, 146(1): 46-62.
[10] USSAR S, GRIFFIN N W, BEZY O, et al. Interactions between gut microbiota, host genetics and diet modulate the predisposition to obesity and metabolic syndrome[J]. Cell Metab, 2015, 22(3): 516-530.
[11] 黄春明. 非酒精性脂肪性肝病流行病学及脂联素基因多态性对其的影响-4年追踪研究[D]. 广州:广州医学院, 2010.
[12] BIRKENFELD A L, SHULMAN G I. Nonalcoholic fatty liver disease, hepatic insulin resistance, and type 2 diabetes[J].Hepatology, 2014, 59(2): 713-723.
[13] BALLESTRI S, ZONA S, TARGHER G, et al. Nonalcoholic fatty liver disease is associated with an almost twofold increased risk of incident type 2 diabetes and metabolic syndrome.Evidence from a systematic review and meta-analysis[J]. J Gastroenterol Hepatol, 2016, 31(5): 936-944.
[14] YOUNOSSI Z M, KOENIG A B, ABDELATIF D, et al. Global epidemiology of nonalcoholic fatty liver disease—Metaanalytic assessment of prevalence, incidence, and outcomes[J].Hepatology, 2016, 64(1): 73-84.
[15] 蒋静, 张杰. 代谢综合征与脂肪肝发病率的关系研究[J]. 肝胆外科杂志 , 2015, 23(5): 355-358.
[16] SHEN J, WONG G L H, CHAN H L Y, et al. PNPLA3 gene polymorphism accounts for fatty liver in community subjects without metabolic syndrome[J]. Aliment Pharmacol Ther, 2014,39(5): 532-539.
[17] HONG H C, HWANG S Y, CHOI H Y, et al. Relationship between sarcopenia and nonalcoholic fatty liver disease: the Korean Sarcopenic Obesity Study[J]. Hepatology, 2014, 59(5):1772-1778.
[18] NOBILI V, CUTRERA R, LICCARDO D, et al. Obstructive sleep apnea syndrome affects liver histology and inf l ammatory cell activation in pediatric nonalcoholic fatty liver disease,regardless of obesity/insulin resistance[J]. Am J Respir Crit Care Med, 2014, 189(1): 66-76.