铁炭微电解法去除电解锰废水中Mn2+试验研究
2018-04-25高昭伟王海峰赵平源
高昭伟,王海峰,赵平源
(1.贵州大学 材料与冶金学院,贵州 贵阳 550025;2.贵州省冶金工程与过程节能重点实验室,贵州 贵阳 550025)
重金属污染废水主要来源于工业生产,常见的重金属污染物主要有汞、镉、铅、铬及砷等离子[1]。目前,常见的重金属污染废水处理方法多为中和沉淀法、硫化物沉淀法或其他化学沉淀法。这些方法工艺复杂,处理流程长,处理成本高,操作控制难度大,实用性较差,难以推广应用。试验主要针对贵州省内当前重金属污水及治理现状,以含Mn2+的电解锰生产废水[2]为对象,研究铁炭微电解法处理重金属污水的机制及工艺条件,以期为此法的工业应用及工艺设计提供基础及理论依据。
1 试验部分
1.1 废水
电解锰废水中主要含有重金属Mn2+。试验所用废水为模拟的电解锰生产废水,pH为6.0~7.5,Mn2+质量浓度为150 mg/L。
1.2 试剂及设备
氢氧化钠、硫酸、硫酸锰等,均为分析纯;刚果红试纸,铁屑,工业椰壳活性炭。
主要设备:电子天平、恒温水浴锅、PHS-25型酸度计、电磁振动式空气泵等。
铁炭微电解反应器:直径136 mm、高度1 200 mm 的有机玻璃柱(自制),底部分层装入φ12 mm及φ6 mm的玻璃球作为承托层及大阻力配水层。铁炭微电解反应器示意如图1所示。
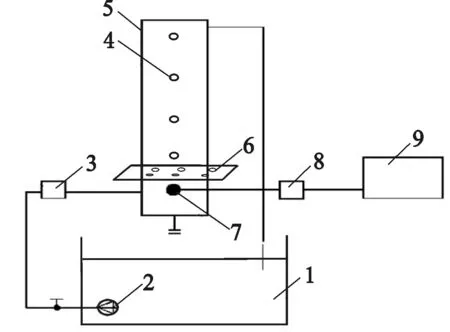
1—水槽;2—水泵;3—液体流量计;4—接水口;5—有机玻璃柱;6—法兰;7—曝气头;8—气体流量计;9—鼓风机。
1.3 铁炭微电解反应机制
铁炭微电解法采用不同电极电位的两种金属或金属与非金属直接连接在一起,浸泡在具有传导性的电解质溶液中,由于电池效应形成无数微小腐蚀原电池[3]。金属阳极发生电化学腐蚀而被消耗,同时引发絮凝、吸附、电沉积、电化学还原等一系列协同作用[4]。铁炭微电解是多种作用综合的结果,其中,铁屑为阳极,炭粒或碳化铁为阴极。
电极反应[5]:
阳极,

(1)

(2)
阴极,
中性碱性条件下,

(3)
酸性条件下,

(4)
酸性富氧条件下,

(5)
1.4 试验方法
原料预处理:采用20目筛筛分铁屑,剔除杂质。铁屑先用10%NaOH溶液浸泡15 min,再用3%H2SO4溶液浸泡5 min使其活化,并冲洗干净;对所选椰壳活性炭在废水中浸泡24 h,去除其对目标溶液的吸附作用[6]。
室温下,配制6 L Mn2+质量浓度为150 mg/L的废水溶液,用3%H2SO4溶液调节pH。将均匀混合的铁屑与活性炭填入有机玻璃柱内,高度为50 cm;通入废水,采用恒温水浴加热、空气泵曝气;反应完毕后取样过滤,采用高碘酸钾分光光度法分析Mn2+质量浓度,计算Mn2+去除率。
2 试验结果与讨论
2.1 溶液pH对Mn2+去除率的影响
试验条件:曝气量160 L/min,液固体积质量比1∶1,反应温度20 ℃,铁炭质量比1∶1,反应时间180 min。溶液pH对Mn2+去除率的影响试验结果如图2所示。可以看出:pH=2时,H+浓度较高,氧化还原反应产生的氢气泡较多,并包裹吸附在铁、炭粗糙表面,降低了固液接触面积,使得原电池数量减少,Mn2+去除率较低;pH在2~4之间,电极反应(1)起主要作用;pH=4时,Mn2+去除率达最大;pH在4~6之间,微电解反应起主导作用,随pH增大,微电解电动势E降低,Mn2+去除率降低[7]。综合考虑,确定溶液pH以4为最佳,此时Mn2+去除率达93.45%。
2.2 温度对Mn2+去除率的影响
试验条件:曝气量160 L/min,液固体积质量比1∶1,溶液pH为4,铁炭质量比1∶1,反应时间180 min。温度对Mn2+去除率的影响试验结果如图3所示。
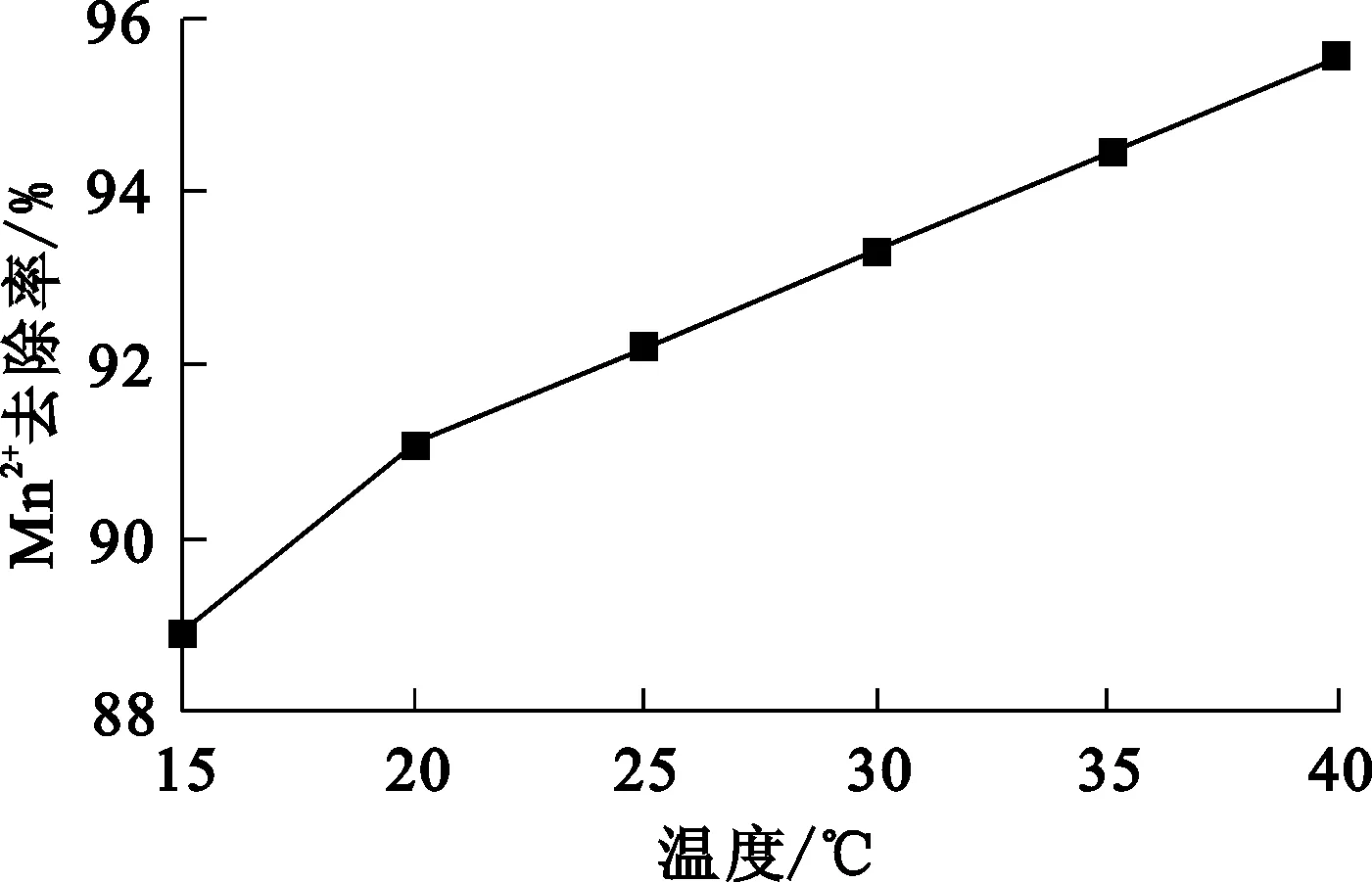
图3 温度对Mn2+去除率的影响
由图3看出,随温度升高,Mn2+去除率逐渐提高。温度升高对溶液对流、扩散有利,电解质溶液电阻减小,阴阳极间的电子转移速度加快,所以,体系反应速率加快,从而使Mn2+去除率提高。但对于有氧去极化电极反应参加的过程来说,并非温度越高反应速度越快,因为随温度升高,氧分子扩散速率加大,其溶解度下降,这会导致反应速度出现一定变化。因此,确定温度以20 ℃为宜,此时Mn2+去除率为91.11%。
2.3 反应时间对Mn2+去除率的影响
试验条件:曝气量160 L/min,液固体积质量比1∶1,溶液pH=4,温度20 ℃,铁炭质量比1∶1。反应时间对Mn2+去除率的影响试验结果如图4所示。可以看出:随反应进行,Mn2+去除率提高;反应初期,Mn2+浓度较高,去除率提高明显;但随反应进行,Mn2+浓度降低,其去除率增幅变小。综合考虑,确定反应时间以150 min为宜,此时Mn2+去除率为90.0%。

图4 反应时间对Mn2+去除率的影响
2.4 铁炭质量比对Mn2+去除率的影响
试验条件:曝气量160 L/min,液固体积质量比1∶1,溶液pH=4,温度20 ℃,反应时间150 min。铁碳质量比对Mn2+去除率的影响试验结果如图5所示。
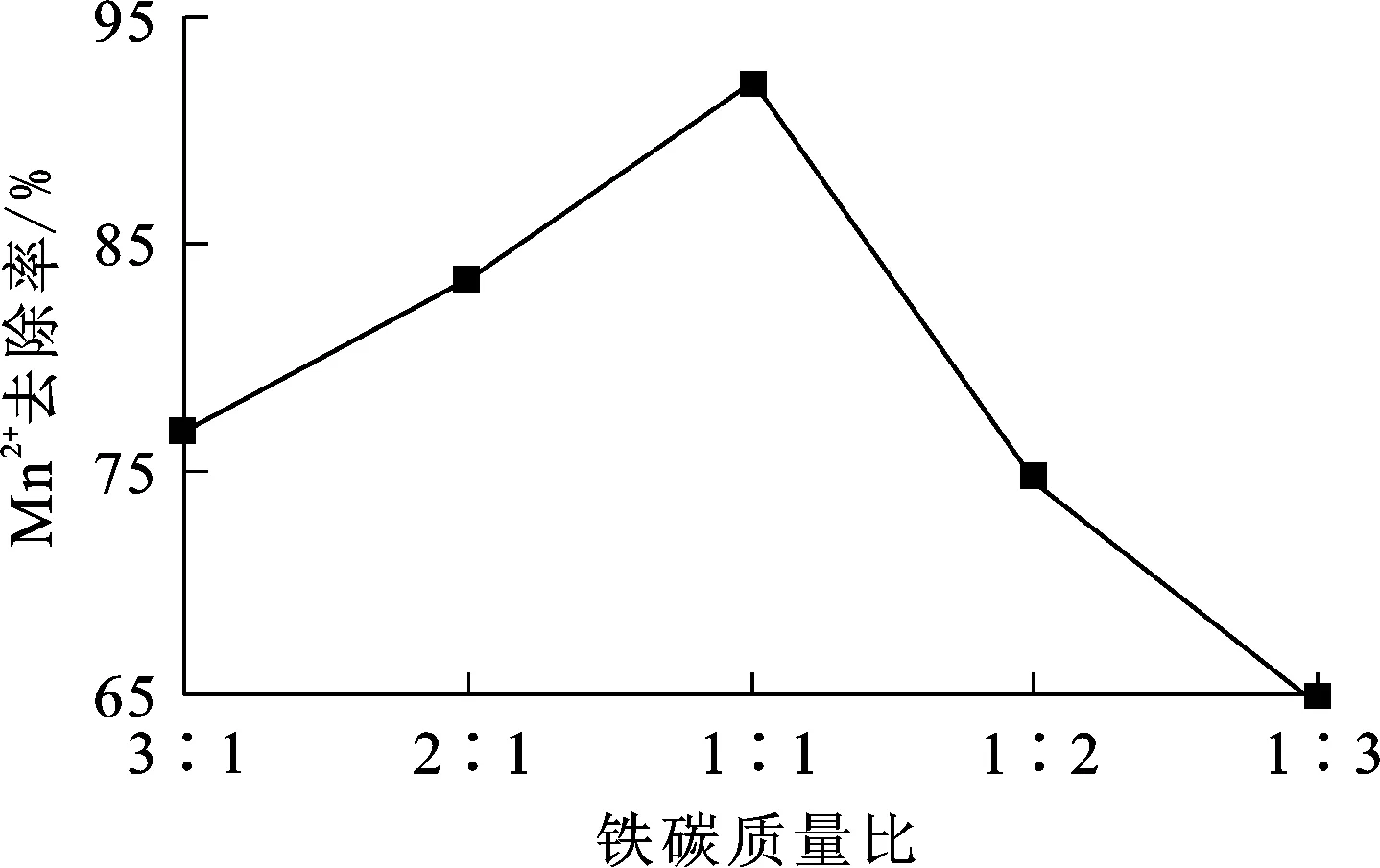
图5 铁炭质量比对Mn2+去除率的影响
由图5看出,铁炭质量比对Mn2+去除率有较大影响:铁炭质量比为1∶1时,Mn2+去除率最大;铁炭质量比逐渐减小到1∶3时,Mn2+去除率快速下降;铁炭质量比由1∶1增至3∶1,铁屑相对于活性炭的比例增大,铁屑与铁屑之间接触面积增大,导致填料结块可能性变大,Mn2+去除效果变差。综合考虑,铁炭质量比以控制在1∶1为宜,此时Mn2+去除率为92.22%。
2.5 加碱混凝进一步去除Mn2+
在上述试验条件下,经微电解反应,废水中Mn2+大幅降低,去除率达92.22%,残留质量浓度为11.67 mg/L,但Fe2+含量增加,出水色度加深。为解决此问题,对上述条件下处理后的出水水样进行加碱混凝沉淀。用10%NaOH溶液调节出水pH至10.5,搅拌15 min后静置,完全沉淀后,取上清液分析其中Fe2+质量浓度,与污水排放标准(GB8978—1996)[8]进行对比,结果见表1。

表1 加碱混凝沉淀试验结果
由表1看出,经加碱混凝沉淀,铁离子基本去除完全,出水几乎无色,Mn2+进一步降低,出水水质达到国家标准要求。
碱性条件下,Fe3+与OH-发生反应,形成含有羟基的单核配离子[9]:
[Fe(H2O)5(OH)]2++H3O+。
(6)
铁的单核配合物离子再相互结合生成复合配离子:

[(H2O)5Fe—O—Fe(H2O)5]4++H2O,
(7)

(8)
进一步发生高分子缩聚反应形成以羟基架桥联结的带有高电荷的多核配离子
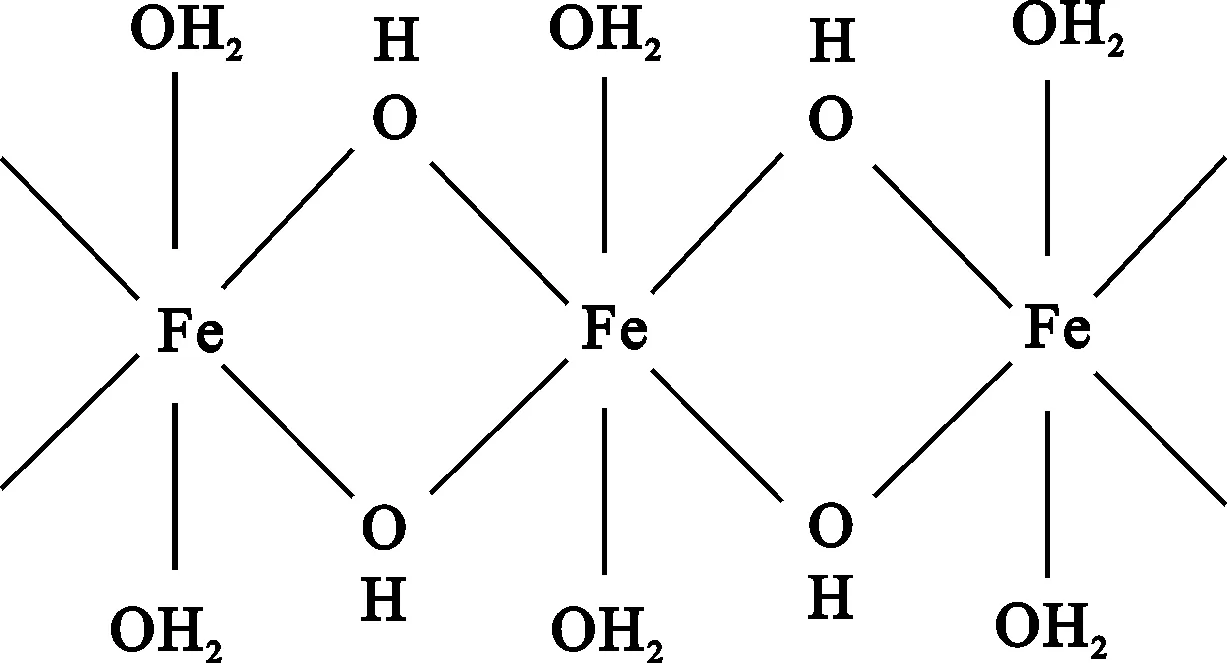
并向胶体态转化,最终形成大颗粒、具较高活性的Fe(OH)3沉淀。这一过程中,多核配离子对胶粒产生电性中和作用,降低了ε电位;其链状线性结构对已经中和的胶粒起粘结架桥作用,使胶粒快速凝聚,加速沉淀。宏观表现为:

(9)

(10)
Fe(OH)3沉淀为Mn(OH)2提供活性粘附体,将吸附的Mn2+通过网捕卷带除去,使得Mn2+去除率进一步提高。
3 结论
采用铁炭微电解反应去除电解锰生产企业废水中的Mn2+是可行的,适宜条件下,Mn2+去除率达92.22%,溶液中残留Mn2+质量浓度为11.67 mg/L。处理后的出水经加碱混凝沉淀,调pH为10.5,其中的Fe3+沉淀完全,出水色度降低,Mn2+进一步得到去除,残留质量浓度为1.67 mg/L,符合国家污水排放要求。
参考文献:
[1] 常学秀,文传浩,王焕校.重金属污染与人体健康[J].云南环境科学,2000,19(1):59-61.
[2] 汪启年,王璠,徐东耀,等.电解锰工艺废水全过程控制工艺中试研究[J].云南环境科学,2012,31(3):179-183.
[3] 蓝连贺.内电解法处理印染废水的效果研究与分析[J].工业水处理,2004,24(7):24-27.
[4] 孟刚,邹小兵,郑泽根,等.铁炭微电解-亚铁还原氧化法处理花菁废水的研究[J].感光科学与光化学,2002,20(4):303-312.
[5] 张春永,沈迅伟,张静,等.铁炭微电解法处理混合农药废水的研究[J].江苏化工,2003,31(4):47-51.
[6] 乔瑞平,孙承林,于永辉,等.铁炭微电解法深度处理制浆造纸废水的研究[J].安全与环境学报,2007,7(1):57-59.
[7] 钟琼,廖德祥,李小明,等.电解金属锰生产废水处理技术的研究进展[J].中国锰业,2005,23(4):7-9.
[8] 国家环境保护总局.污水综合排放标准:GB8978—1996[S].北京:中国标准出版社1998.
[9] 陈凌.铁炭微电解法处理镀锌废水[J].四川化工,2008,37(5):519-521.
