无溶剂,超声波辅助Zn催化炔丙基溴与芳香醛的区域加成反应研究
2018-04-25杓学蓓李清寒杨学军
张 刚,杓学蓓,李清寒,杨学军,陈 峰
(西南民族大学 化学与环境保护工程学院,四川 成都 610041)
炔丙基醇类化合物是一类非常重要的有机合成中间体,同时在一些具有生物活性的天然产物中也含有炔丙基醇类结构单元[1-2]。因此,近年来该类化合物的合成引起了广大有机化学家的兴趣和关注。目前该类化合物的合成可通过羰基化合物与炔丙基溴在有效的催化剂催化、或水相反应[3]、或超声波[3]或微波辐射[4]的方法来实现。许多金属如Sb[5],Cr[6],Mn[7],In[1],Mg[8],Sn[9],Pb[10],Ti[11],Zn[12]和Ga[13]均可以有效催化炔丙基卤和羰基化合物的加成反应而有效制得相应的单一炔丙基醇化合物。然而,这些方法的反应时间长,并且需要大量的有机溶剂,如THF,DMSO,DMF来提高目标化合物的收率。而大量的使用有机溶剂会造成潜在的一些环境污染。2009年,王进贤教授报道了使用Zn-Cu合金作为催化剂,在无溶剂条件下可有效的催化炔丙基溴与羰基化合物的区域加成反应而高收率得到单一的炔丙基醇化合物[5]。虽然区域控制合成单一的炔丙基醇化合物得到了广泛的研究,并且取得了一些进展,但是仍然缺乏令人满意的选择性炔丙基化反应合成方法。因此,这就需要发展更多有效的,选择性好的选择性炔丙基化反应方法。虽然已有使用超声波及锌催化炔丙基卤和羰基化合物的加成反应的文献报道[12],但在该反应体系中使用了大量的THF及有毒化合物1,2-二碘乙烷,且催化剂用量较大,不符合绿色化学的发展。为此,需要对该反应方法进行改进。本文利用超声波辐射技术,在无溶剂条件下,通过活化锌催化炔丙基溴和羰基化合物的区域选择性加成反应,在短时间里高收率合成了12个炔丙基醇化合物3(a~l),合成的目标化合物通过质谱、红外光谱、核磁共振氢谱对其结构进行确证。合成路线见图1。
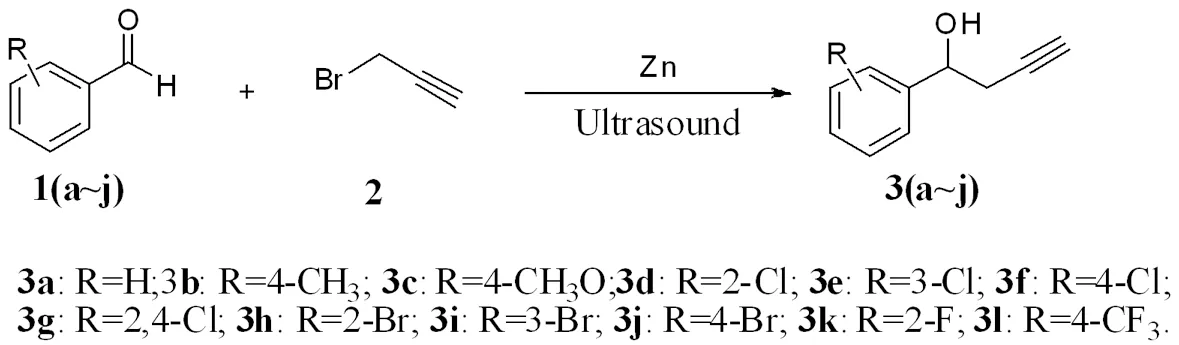
图1 化合物3(a~l)的合成路线
Fig.1 Synthetic route of compounds 3(a~l)
1 实验部分
1.1 主要试剂与仪器
XRC1显微熔点仪测定(温度未校正);Varian400MHz核磁共振仪(Me4Si为内标,CDCl3为溶剂);Finnigan-MAT4510型质谱仪;FT-IR169 型红外光谱仪(固体用KBr压片,液体用液膜法);KQ-250E型250W 超声波清洗仪(频率为40kHz)。所用试剂均为市售化学纯或分析纯。除特别注明外,未经进一步处理。
1.2 炔丙基溴和羰基化合物的区域加成反应
在20 mL反应试管中加入2.0 mmol (130.0 mg) 活化锌粉,1.0 mmol 芳香醛,2.0 mmol 3-溴丙炔,将所得的混合物放于超声波洗涤仪中间歇振荡1.0~3.0 h,反应进程用TLC监测。反应完毕,加入5 mLNH4Cl溶液,水层用乙醚(3×15 mL)萃取,合并有机层,无水Na2SO4干燥。过滤除去Na2SO4,将有机层浓缩,剩余物进行柱层析(展开液为EA/Hexane=1/6),得炔丙基醇化合物3(a~j)。
3a:无色油状液体。1H NMR (400 MHz,CDCl3,ppm) δ: 7.42~7.26 (m,5H),4.87 (t,J= 6.4 Hz,1H),2.64 (q,J= 6.4,2.8 Hz,2H),2.41 (s,1H),2.08 (t,J= 2.8 Hz,1H); IR(KBr)v: 3395,3293,3031,2913,2117,1955,1685,1602,1452,863,757,702,644 cm-1;MS(EI)m/z(%): 46.08 (M+)。
3b:无色油状液体。1H1 NMR (400 MHz,CDCl3,ppm) δ: 7.25~7.21 (m,2H),7.19~7.11 (m,2H),4.86 (t,J= 6.4 Hz,1H),2.64 (q,J= 6.4,2.8 Hz,2H),2.50 (s,1H),2.43 (s,3H),2.07 (t,J= 2.4 Hz,1H); IR(KBr)v: 3398,3291,2913,2118,1955,1655,1612,1453,1247,1033,857,646 cm-1;MS(EI)m/z(%):160.10 (M+)。
3c:无色油状液体。1H NMR(400 MHz,CDCl3,ppm)δ: 7.34~7.27(m,2H),6.91~6.88(m,2H),4.84 (q,J=6.4,2.8 Hz,1H),3.81 (s,3H),2.64~2.62 (m,2H),2.35 (s,1H),2.06 (t,J= 2.8 Hz,1H);IR (KBr) v: 3424,3293,2914,2835,2116,1643,1614,1516,1245,1031,836,645 cm-1;MS(EI)m/z(%):176.11 (M+)。
3d:无色油状液体。1H NMR (400 MHz,CDCl3,ppm) δ: 7.65~7.23 (m,4H),5.27 (q,J= 6.4 Hz,1H),2.85~2.81 (m,2H),2.56 (s,1H),2.12 (t,J= 2.8 Hz,1H);IR (KBr) v: 3397,3296,3065,2922,2123,1961,1622,1597,1473,1441,1041,866,758,645 cm-1;MS(EI)m/z (%):180.06 (M+)。
3e:无色油状液体。1H NMR(400 MHz,CDCl3,ppm) δ: 7.46~7.27 (m,4H),4.87 (q,J= 6.4 Hz,1H),2.68~2.56 (m,2H),2.46 (s,1H),2.10 (t,J= 2.8 Hz,1H); IR (KBr) v: 3392,3297,3064,2912,2121,1945,1696,1574,1473,1426,1053,884,786,694 cm-1;MS(EI)m/z(%):180.05(M+)。
3f:无色油状液体。1H NMR(400 MHz,CDCl3,ppm)δ: 7.35~7.26 (m,4H),4.86 (t,J=6.4 Hz,1H),2.63~2.58 (m,2H),2.44 (s,1H),2.08 (t,J= 2.8 Hz,1H); IR (KBr) v: 3394,3298,3065,2913,2122,1956,1904,1652,1597,1492,1414,1058,867,826,644 cm-1;MS(EI)m/z (%):180.11 (M+)。
3 g:白色固体。M.p.49~50℃ (lit[14]: m.p.48~49℃)。1H NMR (400 MHz,CDCl3,ppm)δ:7.58~7.26(m,3H),5.24 (q,J= 6.4 Hz,1H),2.86~2.77 (m,1H),2.55~2.49 (m,2H),2.12 (t,J=2.8 Hz,1H); IR (KBr) v: 3297,2931,2118,1913,1645,1588,1473,1385,1044,863,821;MS(EI)m/z (%):214.03 (M+)。
3 h:无色油状液体。1H NMR(400 MHz,CDCl3,ppm)δ: 7.62~7.14(m,4H),5. 24 (q,J= 6.8 Hz,1H),2.84 (d,J= 2.8 Hz,1H),2.57~2.51 (m,2H),2.12 (t,J= 2.4 Hz,1H); IR (KBr) v: 3395,3294,3065,2917,2120,1952,1648,1567,1518,1468,1434,1025,863,755,645cm-1;MS(EI)m/z(%):224.02(M+)。
3i:无色油状液体。1H NMR (400 MHz,CDCl3,ppm)δ:7.57~7.22 (m,4H),4.84(q,J= 6.8 Hz,1H),2.67~2.62 (m,2H),2.44 (s,1H),2.11 (t,J= 2.4 Hz,1H); IR (KBr) v: 3394,3295,3062,2913,2118,1953,1643,1568,1424,1060,884,786,649;MS(EI)m/z(%):224.05(M+)。
3 j:无色油状液体。1H NMR(400 MHz,CDCl3,ppm) δ: 7.51~7.44 (m,2H),7.28~7.22 (m,2H),4.85 (q,J= 6.4 Hz,1H),2.67~2.55 (m,2H),2.38 (s,1H),2.09 (t,J= 2.8 Hz,1H); IR (KBr) v: 3394,3293,3063,2912,2116,1902,1594,1484,1405,1065,1010,866,827,645 cm-1;MS(EI)m/z(%):224.03(M+)。
3k:黄色油状液体。1H NMR (400 MHz,CDCl3,ppm) δ: 7.56 (t,J=6.0 Hz,1H),1.89~2.23 (m,1H),7.30~7.41 (m,1H),7.17 (t,J=6.6 Hz,1H),7.05 (t,J=8.7 Hz,1H),5.21 (br,1H),4.88 (t,J=6.3 Hz,1H),2.61~2.80 (m,2H),2.48 (d,J=4.5 Hz,1H); IR (KBr) v: 3405,3311,2925,2136,1621,1487,1261,1110,1016,799,757 cm-1;MS (EI)m/z(%):164.11(M+)。
3l:黄色油状液体。1H NMR (400 MHz,CDCl3,ppm) δ: 7.48(d,J=7.0 Hz,2H),7.41 (d,J=7.1 Hz,2H),4.86~4.96,(m,1H),2.58~2.71 (m,2H),2.45 (d,J=2.6 Hz,1H),2.10 (t,J= 2.8 Hz,1H); IR (KBr) v: 3331,3233,2839,2368,1615,1328,1123,1064,845,792 cm-1;MS (EI)m/z (%):214.11 (M+)。
2 结果与讨论
本文合成的12个丙炔基醇化合物中,3 g是固体,其余目标化合物均为油状液体,其结构组成均经过MS、IR和1H NMR分析得到确证,合成的产物即为目标化合物。并以芳香醛(1 mmol),反应时间1h为标准反应(Scheme1)来考察催化剂,炔丙基溴及催化剂量对该反应的影响。
2.1 催化剂对反应的影响
在反应中,我们分别考察了Mg,Zn,Sn等催化剂对反应的影响。结果表明,当用活化Zn (4.0 mmol) 为催化剂时,可以在1h以70%的收率得到目标化合物(表1,entry3),远远高于其它几种催化剂的结果。因此在接下来的研究中,以Zn为催化剂来考催化剂量对反应的影响。
2.2 催化剂用量对反应的影响
在反应中,以Zn为催化剂,考察了催化剂Zn的用量对反应的影响。结果表明,当催化剂的用量为2.0 mmol时,可在1h以85%的收率得到目标化合物(表1,entry5),而当催化剂的用量降为1.0 mmol时,在相同的反应时间里,只能得到65%的目标化合物(表1,entry6)。因此在接下来的研究中,以2.0 mmol的Zn来考察炔丙基溴的用量对反应的影响。
2.3 炔丙基溴的用量对反应的影响
在反应中,以2.0 mmol的Zn为催化剂,考察了炔丙基溴的量对反应的影响。结果表明,当炔丙基溴的用量为2.5 mmol时,对目标物的收率并没有提高(表1,entry7),而当炔丙基溴的用量为1.5 mmol时,目标物的收率有所降低(表1,entries 8)。因此,即以芳香醛(1.0 mmol),炔丙基溴(2.0 mmol),活化 Zn(2.0 mmol)为催化剂来合成目标化合物。
表1 催化剂及炔丙基溴对该反应的影响
Table 1 Effect of catalysts and propargyl bromide on the reactions a
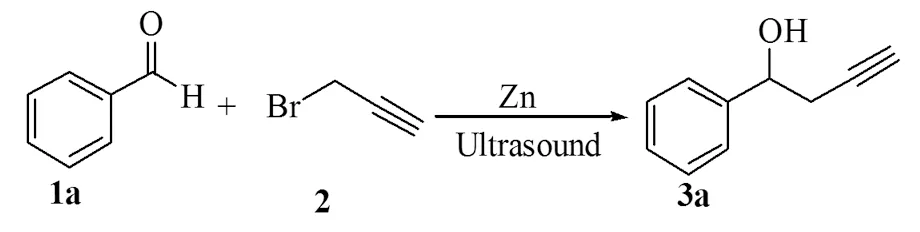
EntryCatalystCatalystLoading/mmolPropargylbromide/mmolYield/%b1Mg4.01.0582Sn4.01.0623Zn4.01.0704Zn3.02.0765Zn2.02.0856Zn1.02.0657Zn2.02.5848Zn2.01.580
注:abenzaldehyde (1 mmol),1 h;bIsolated yield。
2.4 目标化合物3a~3l的合成
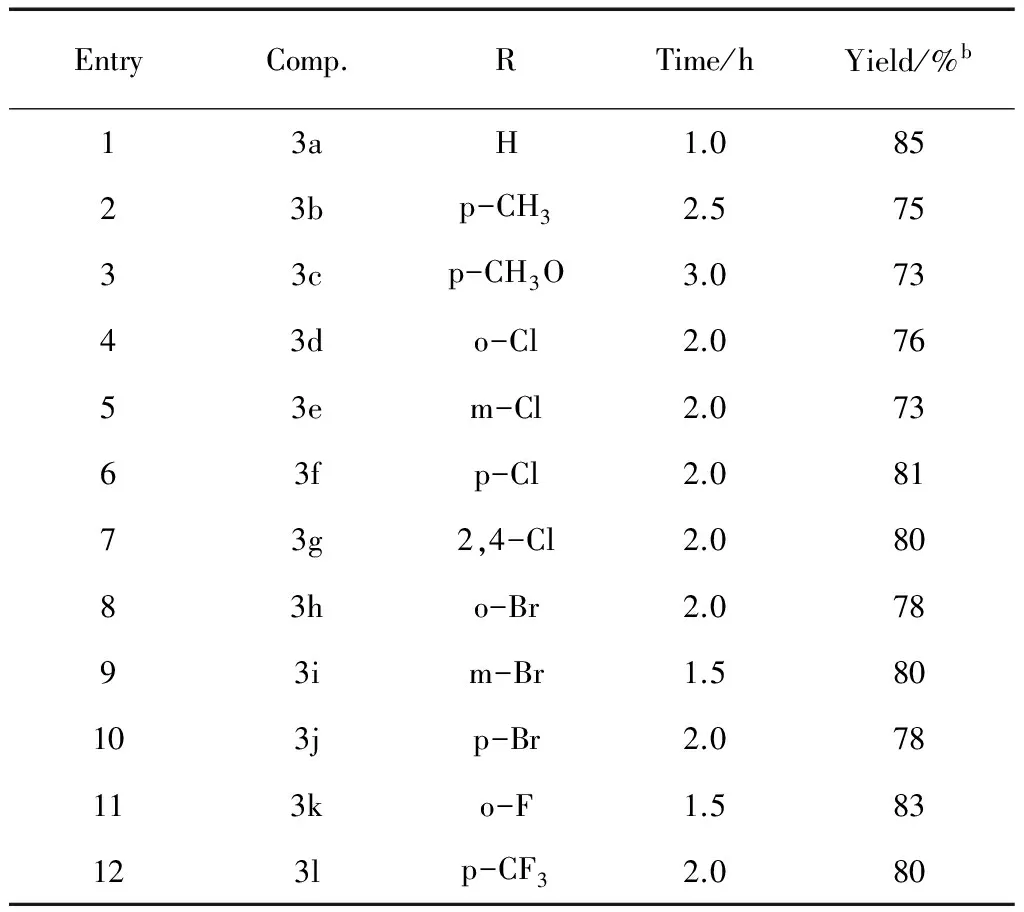
室温下以活化Zn(2.0 mmol)为催化剂,芳香醛(1 mmol)及炔丙基溴(2 mmol)为原料,在无溶剂超声波辅助条件下一步合成了目标物化合物3a~3l,其收率为73%~85%。该合成方法与传统的方法相比,目标产物的收率高,反应时间短,区域选择性高,不使用对环境有害的有机溶剂,反应过程趋于绿色化,对环境友好。这一合成方法还可以用于一些具有生物活性的化合物和天然产物的合成中。
表2 无溶剂,超声波辅助Zn催化炔丙基溴与芳香醛的区域加成反应
Table 2 Solvent-free regioselective addition reactions of propargyl bromide to aromaticaldehyde compounds mediated by Zn underultrasound-irradiateda
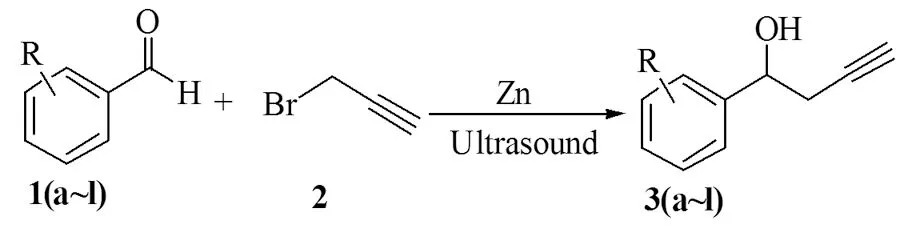
EntryComp.RTime/hYield/%b13aH1.08523bp-CH32.57533cp-CH3O3.07343do-Cl2.07653em-Cl2.07363fp-Cl2.08173g2,4-Cl2.08083ho-Br2.07893im-Br1.580103jp-Br2.078113ko-F1.583123lp-CF32.080
注:aReaction conditions: benzaldehyde (1.0 mmol),propargyl bromide (2.0 mmol), cat.amount Zn (2.0 mmol),ultrasound-irradiated;bIsolated yield。
[1]Lee A S Y,Cheng R Y,Pan O G.A simple and highly efficient synthesis of β-amino-α,β-unsaturated ester via sonochemical Blaise reaction[J].Tetrahedron Letters,1997,38:443-446.
[2]Nicolaou K C,Skokotas G,Furuya S,et al.A novel designed molecule with DNA-cleaving properties and antitumor activity[J].Angewandte Chemie International Edition,1990,29:1064-1067.
[3]Jin S K,Pae A N,Choi K I,et al.Indium mediated allylation and propargylation reactions of dimethyl acetals anketals[J]. Cheminform,2001,42(10):1957-1959.
[4]Li Q R,Gu C Z,Yin H. Tin-indium mediated and microwave assisted propargylation of aldehydes with propargyl bromide[J].Chinese Journal of Chemistry,2006,24(1):72-78.
[5]Ma Xiaofang,Wang JinXian,Li Shunxi,et al. One-pot,solvent-free regioselective addition reactions of propargyl bromide to carbonyl compounds mediated by Zn-Cu couple [J].Tetrahedron,2009,65:8683-8689.
[6]Makoto Hojo,Rie Sakuragi,Satoru Okabe,et al.Allyl- and propargylchromium reagents generated by a chromium(III) ate-type reagent as a reductant and their reactions with electrophiles[J].Chemical Communications,2001,32:357-358.
[7]Katsuhiko Iseki,Yoshichika Kuroki,Yoshiro Kobayashi.Asymmetric allenylation of aliphatic aldehydes catalyzed by a chiral formamide [J].Tetrahedron: Asymmetry,1998,9:2889- 2894.
[8]Akira Yanagisawa,Shigeki Habaue,Hisashi Yamamoto. Propargyl and allyl grignard and zinc reagents. Regioselective alkylation and its application to the synthesis of PGE3 and F3.alpha. methyl ester[J]. The Journal of Organic Chemistry,1989,54:5198-5200.
[9]Takashi Nakagawa,Aleksandr Kasatkin,Fumie Sato. Highly efficient synthesis of propargyl- and allenyltitanium reagents from propargyl halides or propargyl alcohol derivatives. Practical synthesis of allenyl and homopropargyl alcohols[J]. Tetrahedron Letters,1995,36:3207-3210.
[10]Makoto Hojo,Hajime Harada.A new type of allyl- and prop-2-ynyl-manganese species: generation and reactions with electrophiles[J]. Chemical Communications,1997:2077-2078.
[11]Masaharu Ishiguro,Nobuo Ikeda,Hisashi Yamamoto. Propargylic titanium reagents. Regio- and stereocontrolled synthesis of allenic and acetylenic alcohols[J].The Journal of Organic Chemistry,1982,47:2225-2227.
[12]Adam Shih-Yuan Lee,Shu-Fang Chu,Yu-Ting Chang,et al. Synthesis of homopropargyl alcohols via sonochemicalBarbier-type reaction[J].Tetrahedron Letters,2004,45:1551-1553.
[13]Han Ying,Chi Zhengfa,Huang Yaozeng. Gallium-mediated highly regioselective reaction of allyl-type bromide and propargyl-type bromide with aldehyde[J]. Synthetic Communications,1999,29:1287-1296.
[14]Wang Jinxian,Jia Xuefeng,Meng Tuanjie. Rapid and solvent-free synthesis of homoallyl or homopropargyl alcohols mediated by Zinc powder[J].Synthesis,2005,37(13):2838-2844.
(本文文献格式:.张刚,杓学蓓,李清寒,等.超声波辅助Zn催化炔丙基溴与芳香醛的区域加成反应研究[J].山东化工,2018,47(7):1-3.)
