高浓度壳聚糖溶液酶解条件优化
2018-04-25吴健锋张立彦
吴健锋,张立彦
(华南理工大学食品科学与工程学院,广东广州 510640)
壳寡糖具有抑菌[1]、抑制肿瘤生长[2]、抗氧化[3]、抗过敏性炎症[4]、提高植物免疫力[5]等多种生物活性,在日化、食品、医药、临床治疗等方面有广泛的应用前景。生产壳寡糖的方法众多[6-7],其中利用专一性壳聚糖酶对壳聚糖进行水解的方法条件温和、产物分子量相对容易控制且绿色环保[8],在工业上已得到广泛应用。在工业上由于要节约时间和缩减能耗,往往会对质量浓度高达8%的壳聚糖溶液进行酶解来生产壳寡糖,这种反应体系粘度高,酶解效率低,与低浓度的反应体系有明显的差别。至今工业生产还未实现在高浓度底物条件下,高效酶解生产壳寡糖,而且,目前绝大多数研究围绕着2%以下浓度的壳聚糖溶液来展开[9-10]。
鉴于此,本文探讨壳聚糖酶的酶解稳定性,在保持酶活稳定的基础上研究溶解和水解过程中不同加酶方式对水解效率及产物的影响,以达到提高酶解效率和产物得率的效果。
1 材料与方法
1.1 材料与仪器
壳聚糖 DD89.98%,118132 Da,山东莱州市海力生物制品有限公司;壳聚糖粗酶液 酶活为10 U/mL,广东惠州长龙生物科技有限公司;壳寡糖标准品(DP 2-6)及氨基葡萄糖盐酸盐标品 上海甄准生物有限公司;其他化学试剂 均为分析纯。
PHS-25型pH计 上海雷磁仪器厂;TGL-16型超速离心机 上海安科仪器有限公司;JK-WB-4A型电热恒温水浴锅 上海精学科学仪器有限公司;Model752型紫外-可见分光光度计 上海现科分光仪器有限公司;SNB-1A型数显旋转粘度计 上海方瑞仪器有限公司;Agilent1100型高效液相色谱仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 壳聚糖溶液的配制 准确称取4.00 g壳聚糖,加入50 mL去离子水,恒温20 min并不断搅拌以充分分散壳聚糖粉末,每5 min加入0.5 mL 6 mol/L的盐酸,在40 min内共加入4 mL,以使壳聚糖溶解,配制成浓度为8%的壳聚糖溶液。在加酸0、5、10、15、20、25、30、35、40 min时,相应的盐酸浓度分别约为0.00、0.06、0.12、0.17、0.23、0.29、0.34、0.39、0.44 mol/L[11]。
1.2.2 还原糖浓度的测定
1.2.2.1 氨基葡萄糖盐酸盐标准曲线的制作 准确称取192.00 g酒石酸钾钠,用500 mL左右的热水将其溶解,接着加入6.3 g 3,5-二硝基水杨酸,21.00 g氢氧化钠,搅拌溶解,最后再加入5.00 g苯酚,5.00 g亚硫酸钠,待其充分溶解,冷却至室温后,用去离子水定容至1000 mL,贮存于棕色瓶中,放置1周得到DNS试剂。将氨基葡萄糖盐酸盐配制成浓度为1 mg/mL的溶液,分别取该标准液0、200、400、600、800、1000 μL于具塞比色管中,然后用蒸馏水分别补足至1 mL,再加入3 mL DNS试剂,摇匀加塞,放入沸水浴反应15 min后,立即流水冷却,用蒸馏水定容到10 mL,摇匀显色稳定数分钟,在波长520 nm下,以零管作为空白对照,测定吸光值,并以氨基葡萄糖盐酸盐含量为横坐标,以相应吸光值为纵坐标绘制线性标准曲线,如下图所示。

1.2.2.2 壳聚糖溶液还原糖浓度的测定 取1 mL的壳聚糖的水解液,加入3 mL 3,5-二硝基水杨酸(DNS试剂),摇匀加塞,放入沸水浴反应15 min后,立即流水冷却,用蒸馏水定容到10 mL,摇匀显色稳定数分钟,在波长520 nm下,以1 mL蒸馏水加入3 mL DNS试剂作为空白对照,测定吸光值,对照标准曲线计算还原糖含量。平行实验三次,取平均值。
1.2.3 壳聚糖酶稳定性的研究
1.2.3.1 壳聚糖酶温度稳定性研究 将配制好的壳聚糖溶液分别在45、50、55、60 ℃水浴准备酶解反应,按5 U/g壳聚糖加入壳聚糖酶液。每小时搅拌15 min,酶解反应12 h,每隔60 min测定还原糖含量,平行实验三次,取平均值。
1.2.3.2 壳聚糖酶pH稳定性研究 用乙酸-乙酸钠缓冲液分别配制pH为3.5、4.5、5.0、5.5、6.0,浓度为2%的壳聚糖溶液,然后分别在55 ℃下,按5 U/g 壳聚糖加入壳聚糖酶液,每小时搅拌15 min,酶解反应12 h。定时测定还原糖浓度方法,平行实验三次,取平均值。
1.2.4 壳聚糖溶液pH及粘度的测定 在1.2.1壳聚糖溶解过程中,在15、20、25、30、35、40 min时使用数显粘度计测定溶液粘度;每隔5 min使用数显pH计测定溶液pH,平行实验三次,取平均值。
1.2.5 高浓度壳聚糖溶液酶解条件的改进研究
1.2.5.1 溶解过程中一次性加酶处理 不加酶方案:加酸溶解30 min,加酸结束后按5 U/g壳聚糖加酶;方案1:加酸溶解0 min,按5 U/g壳聚糖加酶;方案2:加酸溶解10 min时,按5 U/g壳聚糖加酶。各方案中壳聚糖加酸溶解过程同1.2.1,并在10、20、30、60 min时对以上两种加酶方案的溶液测定粘度。
1.2.5.2 溶解过程中分批加酶处理 法1:加酸溶解10 min时,按照1 U/g壳聚糖加入酶液,溶解30 min后,按照4 U/g壳聚糖补加酶液;法2:加酸溶解10 min时,按照2 U/g壳聚糖加入酶液,溶解30 min后,按照3 U/g壳聚糖补加酶液;法3:加酸溶解10 min时,按照3 U/g壳聚糖加入酶液,溶解30 min后,按照2 U/g壳聚糖补加酶液。各方法中壳聚糖加酸溶解过程同1.2.1,并对以上三种加酶方案的溶液定时测定粘度及还原糖含量。
1.2.6 薄层色谱 按以下两种方式进行加酶:a.加酸溶解30 min 后加入5 U/g壳聚糖的壳聚糖酶进行水解;b.按1.2.5.2中法2进行操作。定时取一定量的酶解液进行薄层色谱分析。用毛细管在硅胶平板上点样,同时用浓度为10 mg/mL的氨基葡萄糖盐酸盐和DP2~6的壳寡糖标准溶液做对照。展开剂为异丙醇∶水∶氨水=60∶30∶4(V/V/V),显色剂为浓度为0.5%的茚三酮溶液。
1.2.7 HPLC分析 同1.2.6两种方式进行加酶,定时对溶液取样进行HPLC分析。采用装备Agilent示差检测器的髙效液相色谱仪对壳寡糖的含量及分布情况进行检测分析,并选择Shodex的Asahipak NH2P 50-4E(4.6 mm×250 mm)氨基柱作为实验色谱柱。参考董惠宗等[12-13]的方法,主要的色谱条件为:流动相乙腈∶水=70∶30,流速0.9 mL/min,柱温30 ℃,进样量为10 μL。以10 mg/mL的氨基葡萄糖和壳寡糖水溶液作为标准样,利用面积归一法对壳寡糖的含量进行计算[14]。
1.2.8 数据处理 使用Office 2007中的Excel软件和GraphPad Prism进行图表整理,以及采用SPSS 23.0软件的单因素方差分析方法对数据进行显著性分析。
2 结果与讨论
2.1 壳聚糖酶温度和pH稳定性研究
本文研究了壳聚糖酶的温度及pH稳定性,结果见图1和图2所示。

图1 温度对壳聚糖酶解液还原糖浓度的影响Fig.1 Effect of temperature on reducing sugar concentration in hydrolysate solution hydrolyzed by chitosanase

图2 pH对壳聚糖酶酶解液还原糖浓度的影响Fig.2 Effect of pH on reducing sugar concentration in hydrolysate solution hydrolyzed by chitosanase
由图1可知,在45、50、55 ℃、酶解720 min内,随温度升高,还原糖浓度增加,酶解效率提高。该壳聚糖酶在55 ℃以下具有较好的热稳定性,而60 ℃或者更高的温度能使壳聚糖酶酶活迅速丧失。对于高浓度壳聚糖粘性溶液来说,提高温度可以有效降低溶液粘度,但溶液温度不能超过60 ℃,否则壳聚糖酶失活严重。
由图2可知,在pH4.5、5.0、5.5范围内产生的还原糖浓度较高,而pH6.0和3.5时产生的还原糖明显减少,说明壳聚糖酶在pH4.5~5.5范围内较稳定,超出这个范围酶活性急剧下降。
2.2 壳聚糖溶解过程中溶液粘度及pH的变化

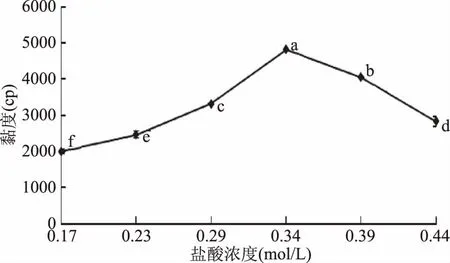
图3 55 ℃下壳聚糖溶液粘度随盐酸浓度的变化(壳聚糖浓度6%,w/w)Fig.3 Changes in viscosity of chitosan solution with HCl concentration at 55 ℃(6% chitosan solution,w/w)注:不同小写字母表示差异显著(p<0.05),图4~图9同。
图4为壳聚糖加盐酸溶解过程中溶液pH的变化情况。图中显示,壳聚糖溶液在盐酸浓度为0~0.39 mol/L的范围内,pH缓慢降低;而当加酸量超过0.39 mol/L之后,溶液pH则急剧下降。这是因为盐酸加量较少时,H+主要参与氨基质子化反应,至壳聚糖分子完全质子化,即壳聚糖溶解后,加入的H+以自由离子形式存在,使溶液pH骤降,这也与溶液中的电导率变化相对应[11]。在溶液粘度减低前溶液的pH处于5.5~5.8左右,根据2.1可知此时酶活损失少,此阶段加入壳聚糖酶比较可行。

图4 55 ℃下壳聚糖溶液pH随盐酸浓度的变化(壳聚糖浓度为6%)Fig.4 Changes in pH of chitosan solution with HCl concentration at 55 ℃(6% chitosan solution,w/w)
2.3 高浓度壳聚糖溶液酶解条件的改进研究
依据上述,探索在溶解过程中不同加酶时间和加酶量对降低粘度的效果。
2.3.1 溶解过程一次性加酶处理的研究 依据上述结果及讨论,研究采用两种方式加入壳聚糖酶,加酶量为酶解时所需全部酶量,用量为5 U/g壳聚糖,溶液的粘度变化见图5。

图5 溶解过程中不同加酶方式对溶液粘度的影响(壳聚糖浓度8%)Fig.5 Effect of adding enzyme methods on viscosity of chitosan solution in the process of dissolution(8% chitosan solution,w/w)
由图5可知,在加酸溶解过程中添加壳聚糖酶确实起到了降低溶液粘度的作用。当加酸溶解30 min后,与不加酶组相比,采取方案1与方案2加酶方法均使溶液的粘度显著下降(p<0.05),与不加酶样相比分别降低了约68.5%、74.9%,有效抑制了溶液粘度上升。而且方案2降粘效果更好,这可能是因为未加酸溶解前溶液pH近中性,按方案1加酶后酶活有损失,而且由于加酶较早,在不断加酸过程中溶液局部过酸也导致一部分酶分子活性损失。总的来说,边溶解边加酶可以有效降低壳聚糖溶液的粘度,方案2效果最好。
2.3.2 溶解过程中分批加酶的研究
2.3.2.1 不同加酶时间和用量对壳聚糖溶液粘度的影响 据2.3.1的结果,在加酸溶解10 min时加酶具有较好的降粘作用。但是据图5推测可知,在溶解过程中,过早的加入壳聚糖酶降粘效果不佳是由于滴加酸过程中造成局部过酸,酶活部分损失。因此,考虑在溶解过程中只加入一部分酶来降低溶液粘度,壳聚糖充分溶解后,再补添加剩余的酶,如图6中的法1~3。
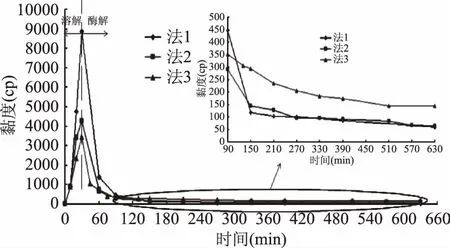
图6 不同加酶方法对溶液粘度的影响Fig.6 Effect of adding enzyme methods on viscosity of chitosan solution
由图6知,在加酸溶解10 min后加入的酶量越大,溶液的粘度越低。从图6的放大图可知,按法1和法2加酶后溶液的最终粘度十分相近,而按法3实验的溶液的最终粘度较高。这是因为按法3壳聚糖溶解过程中加入的酶量相对较多,不断加酸过程中局部过酸使酶活损失较大。据上述溶液粘度变化分析可知,按法1溶液在溶解过程中的降粘效果较差,而按法3溶液在酶解过程中粘度值相对较高,所以按法2降粘效果相对较好。
2.3.2.2 不同加酶时间和用量对酶解溶液中还原糖含量的影响 由图7可知,三种方案在酶解过程中溶液中还原糖变化趋势大致相同,开始阶段增长较快,后来增长速度逐渐变慢,最终还原糖含量趋于稳定。法1中虽然前30 min内溶液中还原糖浓度较低,但之后随水解进行还原糖浓度较快增加,直至240 min后水解速度逐渐变缓,480 min后还原糖浓度则基本不变;法2及法3在水解前120 min差别不大,之后法3水解速度减慢。对酶解720 min后溶液中还原糖浓度进行显著性分析,发现按法1溶液中还原糖浓度显著高于法2、法3(p<0.05),法2显著高于法3(p<0.05)。这可能是因为溶解过程中加入壳聚糖酶确实丧失了部分活性,使水解效率下降。综合来说,既要降低溶液粘度,又要保证酶解效率,采取法2较好。因此接着对按法2进行优化前后的壳寡糖产物进行检测,考察优化过程对产物的影响。

图7 不同加酶方法对酶解溶液中还原糖含量的影响 Fig.7 Effect of different adding enzyme methods on reducing sugar concentration
2.4 不同酶解方式下酶解过程中目标壳寡糖组成及产量变化
2.4.1 薄层色谱分析 由图8a可知,没有在溶解过程中加酶时,随着水解时间的延长,酶解液在GlcN~(GlcN)6相应显色位置显色逐渐加深,含量逐渐增加,但是在整个水解过程中各种寡糖相应显色位置显色都很浅,产生的壳寡糖普遍较少。
由图8b可知,在酶解第0.5~4 h,发现酶解液在GlcN~(GlcN)6相应显色位置显色很浅,仅有一定量的壳三糖和壳四糖产生;在酶解第4~12 h,可以看到2~6个聚合度的壳寡糖显色越来越深。对比图8a,相同水解时间下各种寡糖在对应显色位置的显色明显加深,产生的寡糖含量明显增加,说明按照法2在溶解过程中加酶可以有效提高目标壳寡糖的产量。为了进一步证实以上结论,对酶解液进行HPLC分析。

图8 水解过程中的反应产物的TLC分析图Fig.8 Analysis of chitooligosaccharides in the process of hydrolysis by TLC注:谱带S:壳寡糖标样,从上到下依次为GlcN2~GlcN6;谱带0.5~12 h:表示相应酶解时间的产物;(a)加酸溶解30 min 后加入5 U/g壳聚糖的壳聚糖酶进行水解(b)按法2进行操作。
2.4.2 高效液相色谱分析 由图9a可知,聚合度为2~6的目标壳寡糖总量随时间不断上升,并在12 h后趋于稳定,达到12.3 mg/mL左右;最具功能特性及经济价值的壳五糖和壳六糖在反应时间12 h,两者均达到最大值,分别为3.1和3.0 mg/mL。

图9 各种聚合度的壳寡糖含量随时间变化图Fig.9 Changes of chitooligosaccharides content in the process of hydrolysis analyzed by HPLC 注:(a)加酸溶解30 min 后加入5 U/g壳聚糖的壳聚糖酶进行水解;(b)按法2进行操作。
由图9b可知,随着反应的进行,聚合度为2~6的目标壳寡糖总量也是不断上升,并在6 h后趋于稳定,能达到40 mg/mL左右;在整个水解过程中单糖和壳二糖的含量始终较低;水解产物中壳三糖的含量始终保持最高,而聚合度相对较大的4~6糖均经历了先增加后减少的过程,这是由于这些聚合度相对较大的壳寡糖在一定时间内逐渐积累,随着反应继续进行又降解为更小分子的糖或发生转糖基作用而使含量减少。目标壳寡糖的组成及产量与壳聚糖酶的水解规律有关。Fukamizo等[18]提出源自Streptomycessp. N174的壳聚糖酶与底物形成的结合缝可以容纳6个GlcN残基,键裂解倾向于发生在结合缝的中间部位,而且对于4糖及以下的寡糖的降解率很小,所以产物中单糖、壳二糖的含量很少。
对比图9a和图9b可知,按照法2在溶解过程中加酶,水解过程中聚合度为2~6的壳寡糖的总量以及壳五糖、壳六糖的最大含量均显著增加(p<0.05),在反应时间10 h时,分别能达到42.7、5.5、3.9 mg/mL,比此前的报道都要高[9-10,19-21],大大提高了生产效率以及节约浓缩成本。
3 结论
实验所用壳聚糖酶在45~55 ℃及pH4.5~5.5范围内保持稳定。对于浓度为8%的壳聚糖溶液体系,通过在溶解过程中分批加酶可有效降低体系粘度并保持酶活性,最佳方案如下:壳聚糖在滴加盐酸浓度达到0.17 mol/L(10 min)时,加入2 U/g壳聚糖的酶液,当盐酸浓度达到0.48 mol/L溶解30 min后,再补加3 U/g壳聚糖的酶液。薄层色谱和高效液相色谱分析结果表明,通过以上方式的优化,产物中的聚合度2~6的壳寡糖总含量显著增加(p<0.05),达到42.7 mg/mL;产物中的壳五糖和壳六糖的含量也显著增加(p<0.05),分别达到5.5和3.9 mg/mL,大大提高了生产效率、节约成本。
[1]Kulikov S,Tikhonov V,Blagodatskikh I,et al. Molecular weight and pH aspects of the efficacy of oligochitosan against methicillin-resistantStaphylococcusaureus(MRSA)[J]. Carbohydrate Polymers,2012,87(1):545-550.
[2]Ngo D H,Ngo D N,Vo T S,et al. Protective effects of aminoethyl-chitooligosaccharides against oxidative stress and inflammation in murine microglial BV-2 cells[J]. Carbohydrate Polymers,2012,88(2):743-747.
[3]Fernandes J C,Eaton P,Nascimento H,et al. Antioxidant activity of chitooligosaccharides upon two biological systems:ErythrocytesandBacteriophages[J]. Carbohydrate Polymers,2010,79(4):1101-1106.
[4]Chung M J,Park J K,Park Y I. Anti-inflammatory effects of low-molecular weight chitosan oligosaccharides in IgE-antigen complex-stimulated RBL-2H3 cells and asthma model mice[J]. International Immunopharmacology,2012,12(2):453.
[5]Deng L,Zeng K,Zhou Y,et al. Effects of postharvest oligochitosan treatment on anthracnose disease in citrus(CitrussinensisL. Osbeck)fruit[J]. European Food Research and Technology,2015,240(4):795-804.
[6]Sinha S,Chand S,Tripathi P. Recent progress in chitosanase production of monomer-free chitooligosaccharides:Bioprocess strategies and future applications[J]. Applied Biochemistry and Biotechnology,2016,180(5):883-899.
[7]Wei C,Liang J T,Yue W,et al. Continuous preparation of low-molecular-weight chitosan by the combination of ozone treatment and membrane separation[J]. Applied Mechanics & Materials,2012,189:16-20.
[8]Chang C T,Lin Y L,Lu S W,et al. Characterization of a chitosanase from Jelly Fig(Ficus awkeotsang Makino)Latex and its application in the production of water-soluble low molecular weight chitosans[J]. Plos One,2016,11(3):e150490.
[9]Sinha S,Chand S,Tripathi P. Production,purification and characterization of a new chitosanase enzyme and improvement of chitosan pentamer and hexamer yield in an enzyme membrane reactor[J]. Biocatalysis and Biotransformation,2014,32(4):208-213.
[10]Jung W J,Park R D. Bioproduction of chitooligosaccharides:present and perspectives[J]. Marine Drugs,2014,12(11):5328.
[11]牛培阳,张立彦. 壳聚糖溶解行为及溶液特性的探究[J].食品工业科技,2017(6):84-89.
[12]董惠忠. 聚合度6-8壳寡糖的制备关键技术研究[D]. 上海:华东理工大学,2014.
[13]Dong H,Wang Y,Zhao L,et al. Purification of DP 6 to 8 chitooligosaccharides by nanofiltration from the prepared chitooligosaccharides syrup[J]. Bioresources and Bioprocessing,2014,1(1):1-12.
[14]Izume M,Nagae S,Kawagishi H,et al. Action pattern ofBacillussp. no. 7-M chitosanase on partially N-acetylated chitosan[J]. Biosci Biotechnol Biochem,1992,56(3):448-453.
[15]李星科,纵伟,章银良,等. 脱乙酰度、pH和离子强度对壳聚糖溶液流变性质的影响[J]. 现代食品科技,2013(1):11-14.
[16]李海涛,王美玲,张友玉,等. 壳聚糖在稀溶液中的聚集行为[J]. 应用化学,2004,21(2):159-163.
[17]吴迪,蔡伟民. 壳聚糖-盐酸溶液中温度敏感的相分离行为[J]. 物理化学学报,2002,18(6):554-557.
[18]Fukamizo T,Honda Y,Goto S,et al. Reaction mechanism of chitosanase fromStreptomycessp. N174[J]. Biochemical Journal,1995,311(Pt 2):377-383.
[19]Kuroiwa T,Izuta H,Nabetani H,et al. Selective and stable production of physiologically active chitosan oligosaccharides using an enzymatic membrane bioreactor[J]. Process Biochemistry,2009,44(3):283-287.
[20]Lin Y W,Yichien H,Beenhuang C. Production of high degree polymerized chitooligosaccharides in a membrane reactor using purified chitosanase fromBacilluscereus[J]. Food Research International,2009,42(9):1355-1361.
[21]Ming M,Kuroiwa T,Ichikawa S,et al. Production of chitosan oligosaccharides at high concentration by immobilized chitosanase[J]. Food Science and Technology Research,2006,12(2):85-90.
