体外模拟胃肠消化过程中山楂的活性成分及抗氧化性规律
2018-04-24封易成牟德华
封易成,牟德华*
在中国,山楂长期以来被作为一种药食两用的核果类水果,具有促进消化和缓解食物瘀滞的功效。在欧洲,山楂果、树叶、花朵则被用于止血、利尿和治疗心血管疾病等[1]。山楂的化学成分主要包括黄酮、多糖、多酚、有机酸等物质。这些物质具有很好的生物活性功能,其中黄酮类物质具有抗氧化、抗炎、降血脂等功能[2];多糖生物活性功能众多,包括抗肿瘤、抗病毒、免疫调节等[3];植物多酚广泛存在于植物体内,具有抗肿瘤、抗老化、抗辐射等多种生物活性[4];有机酸具有抑菌、促消化等生物学活性[5-6]。
植物中活性成分的摄入与整个胃肠道的生物利用率是评估其对人类健康的生物学意义的关键因素。萃取的活性成分含量可能会和胃肠消化过程中活性成分含量有所不同,这是受食品基质、胃肠环境pH值和温度、抑制剂或增强剂、酶和其他相关因素的影响[7]。体外消化后的食物,活性物质在各种酶的干扰下,转化成不同的结构形式,因此具有不同的化学性质[8]。营养素和植物化学物质在体内消化吸收受食物基质的物理性质、酶和身体的化学消化效率等因素的影响[9]。经胃肠消化后,食物中的抗氧化活性成分及其活力可能会发生变化,这些结果在以前的报道中均有研究[10]。生物活性物质在体内的消化吸收和代谢过程非常复杂,国内外已经有许多体内外研究。体内的研究是直接分析人体或动物的尿液、血液或粪便中的生物活性物质[11];但是分析物浓度非常低,环境干扰较大,体内研究既费时又困难,所以采用体外模拟胃肠消化模型评价食物的抗氧化性。但是迄今鲜见有关通过山楂的体外模拟消化评价其抗氧化活性的研究报道。为此,本实验旨在通过体外模拟胃肠消化方法全面评价山楂的抗氧化性,以期为消费者膳食提供更合理的指导。
本实验以山楂为原料,用体外模拟胃肠消化的方法对山楂果的多酚、黄酮、有机酸、多糖以及抗氧化活性进行研究,以了解山楂果肉在模拟胃肠消化过程中生物活性成分及其抗氧化能力的变化规律,为山楂更广泛地应用于新型营养保健食品开发提供理论依据[12]。
1 材料与方法
1.1 材料与试剂
山楂来自河北省承德兴隆县,为新鲜的大果山楂,筛选直径范围为2.3~2.8 cm,每个鲜果质量为9.3~11.3 g之间,平均含水质量分数为74.6%。
α-淀粉酶(酶活力≥2 000 U/g)、胃蛋白酶(酶活力≥3 000 U/g)、胰酶力(酶活力≥4 000 U/g)、猪胆汁、儿茶素(纯度≥90.0%)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulphonate),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度≥97.0%)、10 000 Da透析袋(直径22 mm,宽度34 mm,溶剂3.8 mL/cm) 上海宝曼生物科技有限公司;乙腈(色谱纯) 天津星马克科技发展有限公司;磷酸、苯酚、硝酸铝试均剂为分析纯。
1.2 仪器与设备
LC-20AT高效液相色谱仪 日本岛津公司;THZ-82A水浴恒温振荡器 常州荣华仪器制造有限公司;EPOCH2全波长酶标仪 美国博腾仪器有限公司;Adventurer分析电子天平 美国奥豪斯仪器有限公司;DEL7A320 pH计 上海展仪仪器设备有限公司。
1.3 方法
1.3.1 样品制备
1.3.1.1 模拟口腔消化液
模拟唾液:1.195 g Na2HPO4、0.095 g KH2PO4、4.00 g NaCl和0.050 g α-淀粉酶溶于500 mL去离子水中形成模拟唾液,用磷酸缓冲溶液调节pH值至6.75。
口腔消化过程:准确称取40 g新鲜去核山楂肉,置于500 mL的锥形瓶中,并加入200 mL的模拟唾液,用研杵使样品充分破碎,用封口膜封口后放入水浴恒温振荡器中37 ℃振荡10 min。取出样品后4 500 r/min离心15 min,取上清液中的一半在100 ℃下灭酶,另一半未灭酶,得口腔消化液,-20 ℃下保存。
1.3.1.2 模拟胃消化液
模拟胃液:取0.8 g胃蛋白酶、4.375 g NaCl溶于250 mL去离子水中,用3 mol/L盐酸溶液调节至pH 1.2备用。
胃消化过程:重复口腔消化过程,水浴摇床中37 ℃振荡10 min后取出水浴恒温振荡器中的全部样品,3 mol/L盐酸调节溶液体系至pH 1.5后加入200 mL模拟胃液,置于40 ℃水浴摇床中振摇60 min。反应结束后,样品4 500 r/min离心15 min,取上清液中的一半于70 ℃水浴锅中灭酶,另一半未灭酶,得到胃消化液,-20 ℃下保存。
1.3.1.3 模拟肠道消化液
模拟肠液:0.143 g胰蛋白酶和0.857 g胆汁溶于100 mL 0.1 mol/L的NaHCO3溶液。
肠道消化过程:重复口腔消化和胃消化过程,取未灭酶的经过模拟胃部消化的消化液15 mL,用 0.1 mol/L NaHCO3溶液调节溶液体系至pH 6,加入90 mL模拟肠液,再分别加入15 mL 1 mol/L NaCl溶液和15mL 1 mol/L KCl溶液,置于37 ℃水浴中振荡120 min模拟肠道消化,取其中一半于70 ℃水浴锅中灭酶,另一半未灭酶,得到肠消化液,-20 ℃保存备用。每个样品重复3 次。
1.3.1.4 模拟肠道透析液
重复口腔消化和胃消化过程,取未灭酶的经过模拟胃部消化的消化液60 mL转移到30 cm长的透析袋中,并将透析袋置于装有200 mL的磷酸盐缓冲液(phosphate buffered saline,PBS)的烧杯中,37 ℃水浴振荡 4 h。将PBS转移到离心管中,其中一半于70 ℃水浴锅中灭酶,另一半未灭酶,得到肠透析液,-20 ℃保存备用,每个样品重复3 次。
1.3.1.5 山楂生物活性成分粗提液的制备
山楂黄酮粗提液的制备参考李宁豫等[13]对黄酮的最优提取工艺稍作修改。取山楂5 g,用80%乙醇进行提取,固液质量比为1∶20,超声功率为60 W,温度为60 ℃,提取30 min,重复提取3 次,合并提取液,定容到100 mL。样品保存在-20 ℃下备用。
山楂多糖粗提液的制备:参考NY/T 1676—2008《食用菌粗多糖含量的测定》[14]中的方法。样品保存在-20 ℃下备用。
山楂多酚粗提液的制备:参考任宇鹏等[15]对多酚的最优提取工艺稍作修改,取5 g山楂,体积分数50%乙醇做提取剂,固液质量比1∶40、超声功率160 W、提取时间20 min、提取温度55 ℃,提取30 min,重复提取3 次,合并提取液,定容到100 mL。样品保存在-20 ℃下备用。1.3.2 生物活性物质含量测定
1.3.2.1 黄酮含量测定
黄酮含量测定采用NaNO2-Al(NO)3比色法。以儿茶素为标准品,黄酮含量以每100 g鲜质量中所含儿茶素当量(catechin equivalents,CE)表示,单位为mg CE/100 g。
1.3.2.2 多酚含量测定
多酚含量测定采用福林-酚法。以没食子酸为标准品,多酚含量以每100 g鲜质量中所含没食子酸当量(gallic acid equivalents,GAE)表示,单位为mg GAE/100 g。
1.3.2.3 多糖含量测定
多糖含量测定采用苯酚硫酸法,以葡萄糖为标准品,多糖含量以每100 g鲜质量中所含葡萄糖当量(glucose equivalent,GE)表示,单位为mg GE/100 g 。
1.3.2.4 有机酸含量测定
采用高效液相色谱法测定各个样品中的有机酸含量,具体参考韩晓鹏等[16]的方法,使用Platisil ODS C18(250 mm×4.6 mm,5 μm)色谱柱,0.02 mol/L NH4H2PO4(pH 2.9)与乙腈(98∶2,V/V)缓冲溶液为流动相,控制流速为0.5 mL/min,柱温30 ℃,检测波长213 nm,进样量为20 μL。主要检测了其中的草酸、酒石酸、丙酮酸、L-苹果酸、乳酸、乙酸、柠檬酸、D-苹果酸、琥珀酸含量。
1.3.3 抗氧化能力测定
1.3.3.1 ABTS+·清除能力的测定
取2 mL ABTS工作液(140 mmol/L K2S2O8溶液与7 mmol/L ABTS溶液的体积比为62.5∶1.0),加入不同体积的5 种样品,混合反应6 min,在734 nm波长处测定吸光度(Ai);空白对照组以等体积去离子水代替山楂模拟消化试样(A0);样品本底对照组以等体积去离子水代替ABTS工作液(Aj);用去离子水调零。实验重复3 次。取平均值计算相应的ABTS+·的清除率,并用1 mg/mL VC溶液做对照。计算如公式(1)所示。

用ABTS+·清除率为50%时所消耗的样品体积表示相对ABTS+·清除率,以便比较样品之间的差异。
1.3.3.2 DPPH自由基清除能力的测定
取1 mL 0.2 mmol/L DPPH溶液,加入不同体积的5 种样品,用去离子水补至6 mL,摇匀后避光放置30 min后,于517 nm波长处测定吸光度(Ai),空白对照组以等体积去离子水代替山楂模拟消化试样(A0),样品本底对照组以等体积去离子水代替DPPH溶液(Aj)。用去离子水调零。并用1 mg/mL VC溶液做对照。计算如公式(2)所示。

用DPPH自由基清除率为50%时所消耗的样品体积表示相对DPPH自由基清除能力,以便比较样品之间的差异。
1.3.3.3 铁离子还原能力的测定
吸取1 mL pH 6.6的PBS、1 mL 0.03 mol/L铁氰化钾溶液以及不同体积的5 种样品,用去离子水补至3 mL,充分混匀。50 ℃下水浴20 min后快速冷却,加1 mL 0.6 mol/L三氯乙酸混匀,3 000 r/min离心10 min,取上清液1 mL,加入1 mL 0.006 mol/L氯化铁溶液,反应10 min后在700 nm波长处测定吸光度(Ai),吸光度越高,还原能力越强。样品本底对照组以等体积去离子水代替氯化铁溶液(Aj)。空白对照组(A0)以等体积去离子水代替山楂模拟消化试样,用去离子水调零。每个样品平行测定3 次,取平行值。并用1 mg/mL VC溶液做对照。计算如公式(3)所示。

用得铁还原能力为50%时所消耗的样品体积表示相对铁还原能力,以便比较样品之间的差异。
1.3.3.4 羟自由基清除能力的测定
参考张艳等[17]的实验方法,分别取不同体积的5 种样品置于离心管中,在其中依次加入2 mL 6 mmol/L FeSO4溶液、2 mL 6 mmol/L水杨酸溶液、2 mL 6 mmol/L H2O2溶液室温反应10 min,在510 nm波长处测其吸光度(Ai);用去离子水代替水杨酸测其吸光度(Aj),用去离子水代替山楂模拟消化试样,测其吸光度(A0)。并用1 mg/mL VC溶液作对照。计算如公式(4)所示。
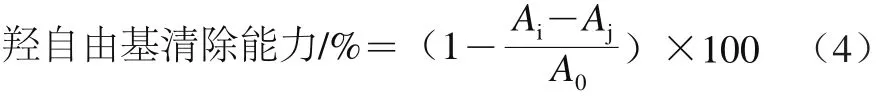
用羟自由基清除能力为50%时所消耗的样品体积表示相对羟自由基清除能力,以便比较样品之间的差异。
1.4 数据统计分析
用SPSS 17.0软件进行统计分析,组间数据比较采用单因素方差分析(One-way ANOVA),所得数据以 ±s表示。
2 结果与分析
2.1 生物活性物质含量分析
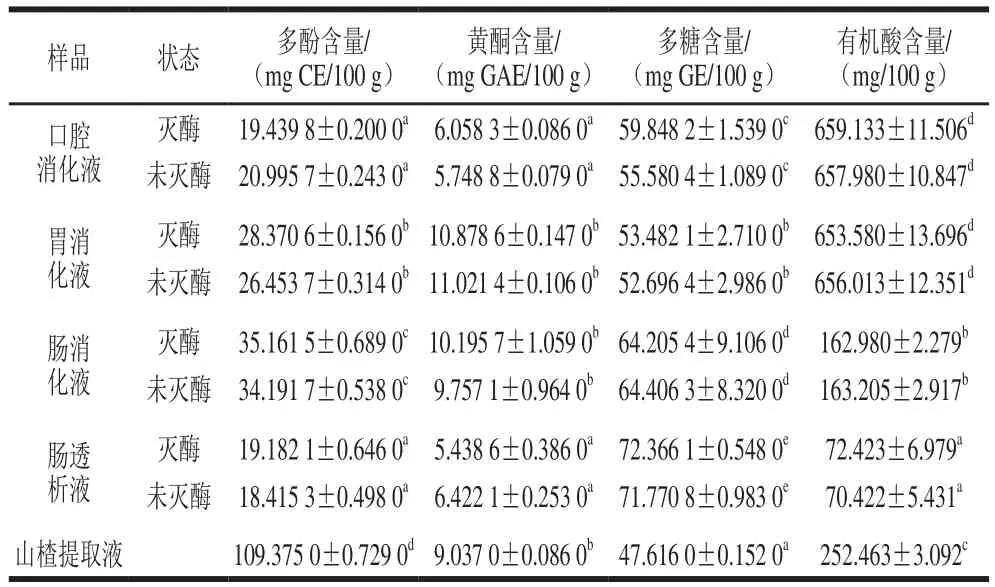
表1 消化液及提取液中活性物质含量Table 1 Contents of substances in hawthorn digests and extract
通过对山楂口腔消化液、胃消化液、肠消化液、肠透析液及山楂提取液5 种样品中活性成分进行对比,具体结果见表1。其中有机酸含量最高,其次为多糖,含量最少的为多酚类物质。多酚在口腔消化液、肠透析液和山楂提取液中含量较少,而在胃消化液和肠消化液中含量较高。多糖在肠透析液中含量最高,而有机酸在口腔和胃消化液中含量最高,且与其他样品有显著性差异。
经模拟口腔、胃消化后山楂中多糖、有机酸的释放量都显著提高,可能是因为α-淀粉酶使山楂中的淀粉分解转化为糖,从而使得多糖含量升高[18]。胃蛋白酶催化蛋白质水解,使得与蛋白质结合的酚类物质游离,结合酸转化为游离酸,从而使得有机酸含量升高。Li Qian[19]和Tarko[20]等的研究中也得到了类似的结果。肠道消化的化学环境呈弱碱性,而多酚对碱性条件比较敏感,容易在碱性条件下降解为酚醛或其他化合物,因此多酚类物质在肠消化液中的含量与胃消化液相比有所减少[21]。肠消化液中的活性物质透过透析袋游离于肠透析液中,这些游离的活性物质可以被小肠吸收[22],被吸收的黄酮、有机酸含量低于未处理的样品,这一结果在Pérez-Vicente等[22]的研究中也得到证实。山楂提取液中黄酮含量比其他样品高,可能的原因是山楂提取液采用超声辅助提取,且提取时间长、温度高。其他测定山楂黄酮的文献,均使用芦丁建立标准曲线,而芦丁是水不溶的物质,本实验模拟胃肠消化,均为水体环境,本实验采用儿茶素为标准品做标准曲线,所以与其他文献中山楂黄酮含量无法进行对比。
研究过程中通过灭酶终止消化反应,但考虑到灭酶对生物活性物质的影响,做了对比实验加以验证,实验结果显示样品灭酶和未灭酶测定的活性物质成分含量没有显著性变化,且样品灭酶前和灭酶后活性物质含量没有规律性变化。这一现象值得更深入的研究探讨。
2.2 有机酸含量分析

表2 消化液中各种有机酸含量Table 2 Contents of organic acids in hawthorn digests mg/100 g
通过高效液相色谱法检测5 种样品中的有机酸,结果如表2所示。口腔消化液、胃消化液、肠透析液和山楂提取液中柠檬酸含量均最高,其次为L-苹果酸,张峻松[23]、金高娃[24]和孙学谦[25]等也得到了相似的结果。肠消化液中琥珀酸含量最高,其次为乙酸,其他含量较少,均无显著性差异。其中草酸、酒石酸、丙酮酸、L-苹果酸、乳酸、柠檬酸6 种有机酸在口腔消化液和胃消化液中含量较高,在肠消化液中含量较少;但乙酸和琥珀酸变化趋势与其相反,在肠消化液中含量最高。
口腔和胃消化液中的有机酸含量最高,可能是在山楂各种酶的催化作用下结合酸转化为游离酸[19],从而导致这两种消化液中大部分有机酸含量普遍偏高。有机酸是小分子亲水化合物,在体外消化时较容易得到释放,但是可能由于模拟消化液中缺少细胞壁降解酶,从而可能使得有机酸含量没有达到释放的最大值。亲和力不同的有机酸矿物质(钾和钙)的细胞壁基质或其他化合物(例如果胶)可能对有机酸的释放有一定的影响。在植物食品中钾、钙和镁是有机酸螯合离子,对果蔬的碱化发挥了重要的作用。有机酸释放的差异也可能受到其他体外条件的影响,即温度、pH值以及其他组分(如果胶或纤维素)等。以这种依据为理论基础,则有机酸的释放应集中在大肠消化阶段,因为大肠内有大量的微生物及微生物酶等物质,但是在大肠的环境下食品基质无氧发酵,引起有机酸成分及含量变化[26]。
山楂提取液中柠檬酸和L-苹果酸含量最高,与支国[27]的研究结果相同。但山楂提取液中乙酸和琥珀酸含量较低,乙酸可以通过许多微生物发酵而产生,琥珀酸是三羧酸循环的中间产物,同时也是厌氧代谢的发酵产物之一,这两种有机酸在新鲜的水果中应不存在或含量极低,而在肠消化液中乙酸和琥珀酸含量较高,可能是在胃肠中无氧发酵导致含量升高,与本实验结果相符合。
2.3 抗氧化活性分析
2.3.1 DPPH自由基清除能力

图1 不同消化液的DPPH自由基清除能力Fig. 1 DPPH radical scavenging capacity of different digestive juices
从图1中可看出,DPPH自由基清除率为50%时所消耗5 种样品的体积有显著性差异。其中肠消化液所消耗的体积最多,为0.253 mL,即肠消化液清除DPPH自由基的能力最弱,与其他4 组样及VC对照组比较均有显著性差异。口腔消化液和胃消化液清除DPPH自由基的能力最强,与VC对照组比较无显著性差异。
DPPH自由基结构中含有3 个苯环,1 个N原子上有一个孤对电子,向DPPH自由基溶液中加入具有抗氧化活性的生物活性物质,自由基上的孤对电子被配对,深紫色的DPPH自由基被还原成黄色的非自由基形式[28-29]。许芳溢等[12]的研究结果显示,样品中的多酚含量与DPPH自由基的清除率成正相关关系,而且呈极显著关系。虽然酚类物质可能与蛋白质消化产生的肽相互作用,但仍具有较高的清除自由基的能力[30]。陶鑫等[31]的研究结果表明,有机酸也具有较强的抗氧化活性,由表1可知,口腔消化液和胃消化液中有机酸总量含量最高,多酚类物质含量也较高,所以口腔消化液与胃消化液清除DPPH自由基的能力较强,两组结果相对应。
2.3.2 ABTS+·清除能力
图2中ABTS+·清除率为50%时所消耗5 种样品的体积有显著性差异,其中口腔消化液和胃消化液对ABTS+·清除能力最强,与其他组比较具有显著性差异,肠透析液的效果最差。与VC对照组相比,口腔和胃消化液都具有很好的清除ABTS+·的能力。
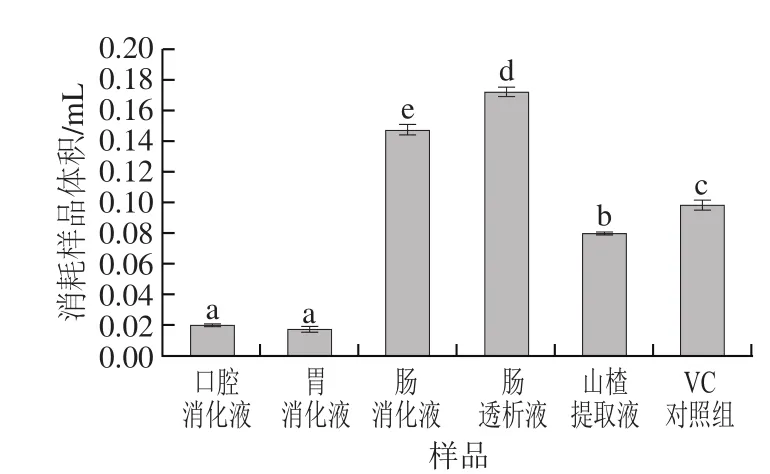
图2 不同消化液对ABTS+·清除能力Fig. 2 ABTS+· scavenging capacity of different digestive juices
ABTS法测定总抗氧化能力的原理是:ABTS在适当的氧化剂作用下氧化成绿色的ABTS+·,在抗氧化物存在时ABTS+·的产生会被抑制,在734 nm或405 nm波长处测定反应物的吸光度即可测定并计算出样品的总抗氧化能力。口腔消化液和胃消化液具有较强的清除ABTS+·的能力,因为这两种样品中的活性物质含量最高,而ABTS+·在具有供氢能力的抗氧化剂的存在下,变成无色的ABTS[32]。模拟唾液为弱酸性(pH 6.75)条件,模拟胃液为强酸性(pH 1.5)条件,酸性条件会提高对ABTS+·的清除能力,并且酸性环境有利于促进抗氧化物质的释放,而弱碱性环境下,抗氧化物质可能会发生降解,所以在口腔和胃消化液中有较强的抗氧化性[33]。
2.3.3 羟自由基清除能力

图3 不同消化液羟自由基清除能力Fig. 3 Hydroxyl radical scavenging capacity of different digestive juices
由图3可知,肠透析液清除羟自由基的能力最弱,肠消化液与山楂提取液清除羟自由基的能力相似。5 种消化液与VC进行对比,清除羟自由基的能力较弱,且与VC对比均具有显著性差异。
羟自由基是一个具极强氧化能力的基团。它可通过电子转移、加成以及脱氢等方式与生物体内的多种分子作用,造成糖类、氨基酸、蛋白质、核酸和脂类等物质的氧化性损伤,使细胞坏死或突变,羟自由基还与衰老、肿瘤、辐射损伤和细胞吞噬等有关[34]。模拟胃液属于强酸环境,酸性条件破坏了氢键的稳定性,从而使酚类物质释放。通过模拟体外消化能够准确地反映活性物质的稳定性及生物活性,与脂质、蛋白质结合的酚类物质、结合酸能够得到释放,从而具有更好的抗氧化活性,而胰酶可以促进多酚类物质和黄酮的释放及总抗氧化活性的提升[35],所以胃消化液具有较强的清除羟自由基的能力。但是与肠消化液相比,胃消化液清除羟自由基能力较弱,是因为羟自由基通过电子转移、加成以及脱氢等方式与生物体内的多种分子作用,胃消化液中的强酸环境影响羟自由基与生物活性物质的电子转移,削弱了胃消化液中活性成分清除羟自由基能力,在从彦丽等[36]的研究中也能得出相似的结论。图3与表1的结果相结合可以看出,肠透析液中的活性成分与其他3 种透析液比较含量最少,尤其是多酚含量最少,Gawlik-Dziki等[18]的研究中多酚和总黄酮的线性关系表明,多酚和总黄酮的含量与抗氧化能力有极显著的正相关关系。
2.3.4 铁离子还原能力
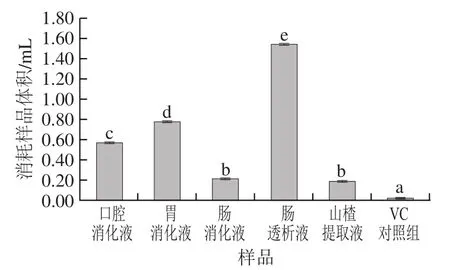
图4 不同消化液铁离子还原能力Fig. 4 Ferric ion reducing power of different digestive juices
由图4可知,口腔和胃消化液还原铁离子的能力较强,与VC对照组比较无显著性差异,经过模拟消化后的样品具有较好的抗氧化活性。其他3 种样品还原铁离子的能力较弱,与VC对照组比较具有显著性差异。铁离子还原能力反映地不是样品针对某一种自由基的清除活性,而是样品总还原能力[33],该法原理是2,4,6-三(2-吡啶基)-1,3,5-三嗪可被样品中还原物质还原为二价铁形式[37],而口腔消化液和胃消化液中总的活性物质的含量最多,所以铁离子还原能力最强,肠透析液中总的活性成分含量最少,所以铁离子还原能力最弱。
3 讨 论
实验结果证明,山楂模拟体外消化后的产物具有较好的抗氧化活性,5 种样品在模拟消化过程中活性成分具有相似的变化趋势,其中经口腔和胃消化后多糖和有机酸比消化前含量显著增加,经过肠消化后有机酸含量降低。5 种样品清除DPPH自由基、ABTS+·及还原铁离子能力的变化趋势相似,其中口腔和胃消化液抗氧化能力最强,肠透析液抗氧化能力最弱。
样品抗氧化活性可能与活性成分含量有一定的相关性,胃肠消化液中有机酸含量较高,从程勇杰等[38]的研究中可以看出有机酸具有较强的抗氧化性。李志洲等[39]测定大枣多糖的抗氧化性中,多糖具有较强的抗氧化性,本实验样品中多糖含量较多,提高了样品的抗氧化活性。彭梦雪等[40]测定苹果模拟胃肠消化后的抗氧化活性,发现模拟胃消化阶段,多酚、黄酮和抗氧化活性之间存在显著正相关;Gawlik-Dziki等[18]研究的模拟体外消化对小麦面包生物活性的影响中也得到了多酚和总黄酮的含量与抗氧化能力有极显著的正相关关系的结论,本实验样品中含有一定量的多酚和黄酮,对抗氧化活性也有一定的作用。
由于目前大多数研究关注有机溶剂提取的活性成分含量,而忽略了生物活性在人体内的消化吸收过程中生物活性的稳定性及利用度。本研究通过体外模拟胃肠消化,分析山楂的黄酮、多酚、多糖及有机酸含量以及抗氧化活性的变化规律,从而反映人体内代谢情况,为评价山楂的营养价值及开发新型保健品提供理论依据。
参考文献:
[1] ZUO Z, ZHANG L, ZHOU L M, et al. Intestinal absorption of hawthorn flavonoids: in vitro, in situ and in vivo correlations[J]. Life Sciences, 2006, 79(26): 2455-2462. DOI:10.1016/j.lfs.2006.08.014.
[2] 杨楠, 贾晓斌, 张振海, 等. 黄酮类化合物抗肿瘤活性及机制研究进展[J]. 中国中药杂志, 2015, 40(3): 373-381. DOI:10.3969/j.issn.1004-2725.2011.04.007.
[3] 林俊, 李萍, 陈靠山. 近5 年多糖抗肿瘤活性研究进展[J]. 中国中药杂志, 2013, 38(8): 1116-1125. DOI:10.4268/cjcmm20130802.
[4] 李昊阳, 夏继桥, 杨连玉, 等. 植物多酚的抗氧化能力及其在动物生产中的应用[J]. 动物营养学报, 2013, 25(11): 2529-2534.DOI:10.3969/j.issn.1006-267x.2013.11.004.
[5] 吴建华, 孙净云. 山楂有机酸部位对胃肠运动的影响[J]. 陕西中医,2009, 30(10): 1402-1403. DOI:10.3969/j.issn.1000-7369.2009.10.104.
[6] 张军, 田子罡, 王建华, 等. 有机酸抑菌分子机理研究进展[J]. 畜牧兽医学报, 2011, 42(3): 323-328.
[7] LIANG L H, WU X Y, ZHAO T, et al. In vitro bioaccessibility and antioxidant activity of anthocyanins from mulberry (Morus atropurpurea Roxb.) following simulated gastro-intestinal digestion[J]. Food Research International, 2012, 46(1): 76-82. DOI:10.1016/j.foodres.2011.11.024.
[8] RYAN L, PRESCOTT S L. Stability of the antioxidant capacity of twenty-five commercially available fruit juices subjected to an in vitro digestion[J]. International Journal of Food Science & Technology,2010, 45(6): 1191-1197. DOI:10.1111/j.1365-2621.2010.02254.x.
[9] HSU C L, HURANG S L, CHEN W L, et al. Qualities and antioxidant properties of bread as affected by the incorporation of yam flour in the formulation[J]. International Journal of Food Science and Technology,2004, 39(2): 231-238. DOI:10.1046/j.0950-5423.2003.00770.x.
[10] BOUAYED J, HOFFMANN L, BOHN T. Total phenolics, flavonoids,anthocyanins and antioxidant activity following simulated gastrointestinal digestion and dialysis of apple varieties: bioaccessibility and potential uptake[J]. Food Chemistry, 2011, 128(1): 14-21.DOI:10.1016/j.foodchem.2011.02.052.
[11] OLTHOF M R, HOLLMAN P C, BUIJSMAN M N, et al. Chlorogenic acid, quercetin-3-rutinoside and black tea phenols are extensively metabolized in humans[J]. Journal of Nutrition, 2003, 133(6): 1806-1814.
[12] 许芳溢, 李五霞, 吕曼曼, 等. 苦荞芽粉馒头体外消化后抗氧化能力研究[J]. 中国粮油学报, 2014, 29(12): 16-22.
[13] 李宁豫, 韩秋菊, 曹月坤. 超声辅助提取山楂黄酮的研究[J]. 陕西农业科学, 2013, 59(3): 91-93. DOI:10.3969/j.issn.0488-5368.2013.03.033.
[14] 农业部. 食用菌粗多糖含量的测定: NY/T 1676—2008[S]. 北京: 中国标准出版社, 2008: 1-2.
[15] 任宇鹏, 刘加艳, 范乃胤. 超声辅助提取山楂总酚的因素分析[J]. 广州化工, 2015, 43(15): 122-123; 143. DOI:10.3969/j.issn.1001-9677.2015.15.046.
[16] 韩晓鹏, 牟德华, 赵英莲, 等. HPLC法检测树莓果汁和果酒中的有机酸[J]. 酿酒科技, 2015(5): 107-110. DOI:10.13746/j.njkj.2014426.
[17] 张艳, 段雪芹, 高刚, 等. 响应面法优化姜黄素的提取工艺及其抗氧化活性的研究[J]. 食品工业科技, 2015, 36(6): 269-273; 278.DOI:10.13386/j.issn1002-0306.2015.06.051.
[18] GAWLIK-DZIKI U, DZIKI D, BARANIAK B, et al. The effect of simulated digestion in vitro on bioactivity of wheat bread with Tartary buckwheat flavones addition[J]. LWT-Food Science and Technology,2009, 42(1): 137-143. DOI:10.1016/j.lwt.2008.06.009.
[19] LI Qian, CHEN Jun, LI Ti, et al. Impact of in vitro simulated digestion on the potential health benefits of proanthocyanidins from Choerospondias axillaris peels[J]. Food Research International, 2015,78: 378-387. DOI:10.1016/j.foodres.2015.09.004.
[20] TARKO T, DUDA-CHODAK A, ZAJAC N. Digestion and absorption of phenolic compounds assessed by in vitro simulation methods. a review[J]. Roczniki Państwowego Zakładu Higieny, 2013, 64(2): 79-84.
[21] FRONTELA C, ROS G, MARTÍNEZ C, et al. Stability of Pycnogenol(R) as an ingredient in fruit juices subjected to in vitro gastrointestinal digestion[J]. Journal of the Science of Food and Agriculture, 2011,91(2): 286-292. DOI:10.1002/jsfa.4183.
[22] PÉREZ-VICENTE A, GIL-IZQUIERDO A, GARCÍA-VIGUERA C.In vitro gastrointestinal digestion study of pomegranate juice phenolic compounds, anthocyanins, and vitamin C[J]. Journal of Agricultural &Food Chemistry, 2002, 50(8): 2308-2312.
[23] 张峻松, 贾春晓, 张文叶, 等. 山楂中有机酸的定量分析研究[J]. 中州大学学报, 2003, 20(3): 119-121. DOI:10.3969/j.issn.1008-3715.2003.03.049.
[24] 金高娃, 章飞芳, 薛兴亚, 等. 反相高效液相色谱法测定山楂中的有机酸[J]. 分析化学, 2006, 34(7): 987-990. DOI:10.3321/j.issn:0253-3820.2006.07.021.
[25] 孙学谦. 高效液相色谱测定山楂中的有机酸[J]. 大连轻工业学院学报, 1997(1): 20-23.
[26] SABBOH-JOURDAN H, VALLA F, EPRILIATI I, et al. Organic acid bioavailability from banana and sweet potato using an in vitro digestion and Caco-2 cell model[J]. European Journal of Nutrition,2011, 50(1): 31-40. DOI:10.1007/s00394-010-0112-0.
[27] 支国. 山楂中主要成分HPLC测定方法的研究[D]. 秦皇岛: 河北科技师范学院, 2013: 19-20. DOI:10.7666/d.Y2373730.
[28] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J].食品科学, 2014, 35(9): 317-322. DOI:10.7506/spkx1002-6630-201409062.
[29] FLOEGEL A, KIM D O, CHUNG S J, et al. Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidantrich US foods[J]. Journal of Food Composition and Analysis, 2011,24(7): 1043-1048. DOI:10.1016/j.jfca.2011.01.008.
[30] APEA-BAH F B, MINNAAR A, BESTER M J, et al. Sorghumcowpea composite porridge as a functional food, Part Ⅱ:antioxidant properties as affected by simulated in vitro gastrointestinal digestion[J]. Food Chemistry, 2016, 197: 307-315. DOI:10.1016/j.foodchem.2016.02.024.
[31] 陶鑫, 许枬, 王秀兰, 等. 兴安毛连菜中有机酸化学成分及其抗氧化活性的研究[J]. 中草药, 2016, 47(4): 544-548. DOI:10.7501/j.issn.0253-2670.2016.04.003.
[32] 柳嘉, POPOVICH D G, 景浩. 山楂黄酮提取物的抗氧化活性和对癌细胞生长抑制作用[J]. 食品科学, 2010, 31(3): 220-223.
[33] KUMARI K M,PADMAJA V. Evaluation of the total antioxidant capacity of the selected plant extracts using ferric reducing antioxidant power (FRAP) assay[J]. International Journal of Pharmacological Research, 2012, 201(1): 81-86. DOI:10.7439/ijpr.v2i1.4229.
[34] 盛伟, 方晓阳, 吴萍. 白灵菇、杏鲍菇、阿魏菇多糖体外抗氧化活性研究[J]. 食品工业科技, 2008, 29(5): 103-105; 109.
[35] CORREABETANZO J, ALLEN-VERCOE E, MCDONALD J, et al.Stability and biological activity of wild blueberry (Vaccinium angustifolium) polyphenols during simulated in vitro gastrointestinal digestion[J]. Food Chemistry, 2014, 165(20): 522-531.
[36] 从彦丽, 彭梦雪, 王慧清, 等. 梨体外模拟胃肠消化过程中多酚、黄酮及抗氧化活性的变化规律[J]. 现代食品科技, 2016, 32(6): 29-34; 84.
[37] 郭长江, 杨继军, 李云峰, 等. FRAP法测定水果不同部分抗氧化活性[J]. 中国公共卫生, 2003, 19(7): 841-843. DOI:10.3321/j.issn:1001-0580.2003.07.038.
[38] 程勇杰, 陈小伟, 王珍珍, 等. 树莓酵素与蓝莓酵素有机酸分析及其体外抗氧化性能[J]. 食品工业科技, 2017, 38(20): 141-145; 146.DOI:10.13386/j.issn1002-0306.2017.20.026.
[39] 李志洲, 陈均志. 大枣多糖的抗氧化性研究[J]. 食品工业科技, 2007,28(4): 115-117. DOI:10.13386/j.issn1002-0306.2007.04.025.
[40] 彭梦雪, 从彦丽, 刘冬. 模拟胃肠消化评价苹果多酚、黄酮及抗氧化活性的相关性[J]. 现代食品科技, 2016, 32(1): 122-128.DOI:10.13982/j.mfst.1673-9078.2016.1.020.
