凝胶油基人造奶油质地和流变性能
2018-04-24韩立娟齐玉堂张维农贺军波
韩立娟,陈 浩,刘 胜,齐玉堂*,张维农,贺军波,王 琦,齐 创
随着生活水平和食品加工技术的提高,人造奶油在日常饮食消费中所占的比重越来越大。相较于天然奶油,人造奶油成本相对较低,产量也更大,更能够满足市场化需要。但是,人造奶油含有过多不利于消费者健康的饱和脂肪酸,且在其传统生产过程中还存在反式脂肪酸(trans fatty acids,TFA)的问题,也会引起消费者心血管疾病[1-2],上述不利因素严重制约了人造奶油的生产和销售[3]。
近年来,凝胶油作为一种有望取代传统氢化方式获得固态油脂的新方法,在国内外得到广泛的研究与发展[4-6]。凝胶油也叫油脂凝胶,主要是由油脂与小分子有机凝胶剂组成。凝胶剂可以是单一的,也可以是2 种或者2 种以上复合的,它们通过在植物油中进行分子自组装(带状、纤维状等)或者结晶等多种形态结构单元,继而形成三维网络结构,阻止液态油的流动,从而使整个体系凝胶化[7-8]。制备凝胶油的基料油可以选择高不饱和性的植物油,因此如果采用凝胶油来制备人造奶油,会含有大量有益的不饱和脂肪酸和必需氨基酸,且不会存在TFA的问题。目前,国外已经有研究者尝试将凝胶油应用于食品行业,如生产人造奶油、起酥油、糖果产品以及肉糜制品等[9-12]。
有研究者证明凝胶剂之间可以通过氢键作用形成凝胶纤维网络结构,进而将液态油脂包裹在该网络内,例如β-谷甾醇和γ-谷维素的复合凝胶剂[13],通过自组装形成中空管状结构(直径约10 μm)而构筑有机凝胶网络[14]。
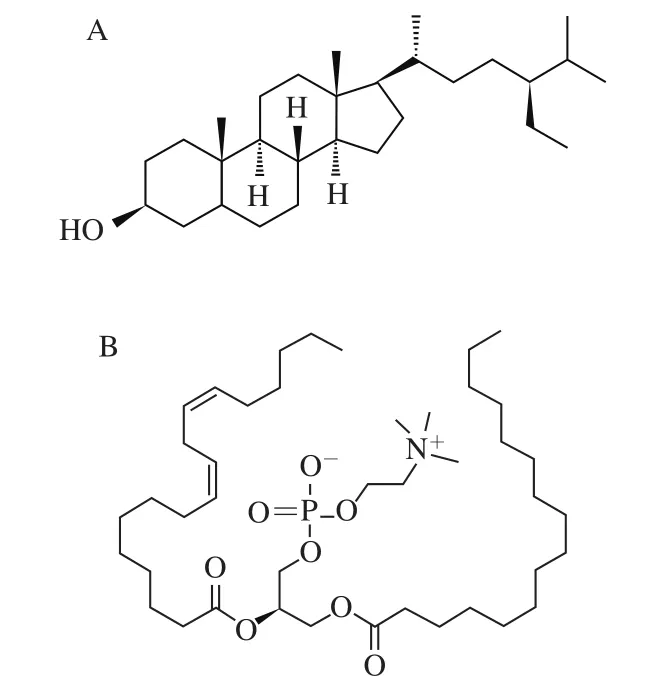
图1 β-谷甾醇(A)和磷脂酰胆碱(B)的结构Fig. 1 Structures of β-sitosterol (A) and phospholipid (B)
本研究选取β-谷甾醇和卵磷脂作为复合凝胶剂制备凝胶油基人造奶油,2 种原料凝胶剂中主要成分的结构式如图1所示,磷脂酰胆碱为大豆卵磷脂中主要成分[15]。从形成氢键所需官能团的角度分析,β-谷甾醇分子中带有一个羟基,卵磷脂分子中带有电负性较强的羰基,因此凝胶剂分子之间或凝胶剂分子与水之间都可能会形成氢键,从而形成牢固的有机凝胶网络,将油-水两相包裹在里面[16]。此外,从安全性和营养性方面分析,选取的这2 种凝胶剂均为可食用性的。β-谷甾醇具有预防动脉粥样硬化[17]和降低血清胆固醇的作用[18],卵磷脂也可以有效的降低胆固醇、血脂[19]和冠心病[20-21]的发病率。因此,以β-谷甾醇和卵磷脂制备得到的凝胶油基人造奶油具有低饱和脂肪酸和零TFA的特点,对人体健康有利,具有非常广阔的市场发展和应用前景。
1 材料与方法
1.1 材料与试剂
一级精炼大豆油 中粮集团有限公司;β-谷甾醇(纯度>75%,色谱纯) 阿拉丁控股集团有限公司;大豆卵磷脂 美国嘉吉公司;氢氧化钠(分析纯)、甲醇、正己烷(均为色谱纯) 国药集团药业股份有限公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、尼罗红(Nile red,NR) 百灵威科技有限公司。
1.2 仪器与设备
7890A-5975C气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪美国Agilent公司;TA.XT plus质构仪 英国Stable Micro Systems公司;Kinexus pro+多功能流变仪 英国马尔文公司;FV1200-OSR激光共聚焦显微镜(confocal laser scanning microscopy,CLSM) 日本奥林巴斯公司;X射线衍射(X-ray diffraction,XRD)仪 荷兰锐影公司。
1.3 方法
1.3.1 凝胶油基人造奶油的制备
β-谷甾醇和卵磷脂以等比例混合,复合凝胶剂质量分数为4%~8%;水分体积分数分别为24%、32%、40%;熟化温度为25 ℃。
称取一定质量的复合凝胶剂溶于80 ℃大豆油中,再将该油相缓慢倒入提前预热的蒸馏水(80 ℃)中,并且以450 r/min搅拌30 min,得到不同的人造奶油样品。
1.3.2 脂肪酸组成测定
采用GC-MS分析大豆油的脂肪酸组成。样品甲酯化用三氟化硼甲酯化法处理,然后进行分析。GC条件:SUPELCO SP-2560石英毛细管柱(100 m×0.25 mm,0.2 μm),高纯氦气为载气,采用恒压模式。MS条件:GC-MS接口温度280 ℃,电子轰击离子源,电离能量70 eV。通过标准质谱数据对脂肪酸组成进行定性分析,并采用面积归一化法对各脂肪酸进行定量分析[22]。
1.3.3 硬度测定
将人造奶油样品趁热转移至铝盒(65 mm×35 mm)中,样品深度约15 mm,然后将样品置于25 ℃恒温培养箱中熟化5 d后进行硬度测试。硬度测试条件为P5探针,下压模式,测前速率2 mm/s,测中速率1 mm/s,测后速率2 mm/s,触发力2 g,下压深度8 mm。
1.3.4 流变性能测定
1.3.4.1 应变扫描
样品线性黏弹区(linear viscoelastic region,LVR)扫描测试条件:频率1 Hz,应变范围0.001%~100.000%,数据采集点20 个,测试温度25 ℃;锥板直径40 mm,角度4°,测试间隙0.149 mm。
1.3.4.2 频率扫描
测定条件:测试温度25 ℃;扫描范围0.1~100.0 Hz;数据采集点10 个;应变0.01%;锥板直径40 mm,角度4°,测试间隙0.149 mm。
1.3.5 人造奶油微观网络结构分析
人造奶油微观网络结构分析采用CLSM观察。染色液为5 g/L的NR染液,5 g/L的FITC染液。
移取不同条件下制备的液态人造奶油样品约20 μL,置于预热好的载玻片上,盖上盖玻片,形成均匀的薄片,之后分别放在25 ℃恒温培养箱内熟化5 d后观察。放大倍数为200 倍。
1.3.6 晶型分析
通过XRD对样品进行晶型和结晶度分析。取适量的样品平铺在检测片上,测试条件:Cu-Kα放射源(波长λ=1.540 56 Å),工作电压45 kV,工作电流40 mA,发射狭缝1/8°,防反射狭缝1/2°,2θ角扫描范围为1°~30°,扫描步长0.026°。通过布拉格公式2dsin θ=nλ计算晶距d值,其中θ为衍射半角,λ为入射波长,n取1。样品结晶度的计算采用Jade 5软件进行,计算公式如下[23]。

2 结果与分析
2.1 基料油的脂肪酸组成
基料大豆油的主要不饱和脂肪酸为亚油酸(44.5%)、油酸(26.1%)和亚麻酸(7.0%),占脂肪酸总量的77.6%。传统的人造奶油虽然以植物油为主,但生产过程中还是产生部分氢化,氢化油含有大量TFA,增加了心血管和代谢综合疾病的发病概率[24]。新型人造奶油具有低饱和脂肪酸和零TFA的特点,比较符合消费者的健康饮食习惯,具有很好的发展前景。
2.2 人造奶油的硬度分析

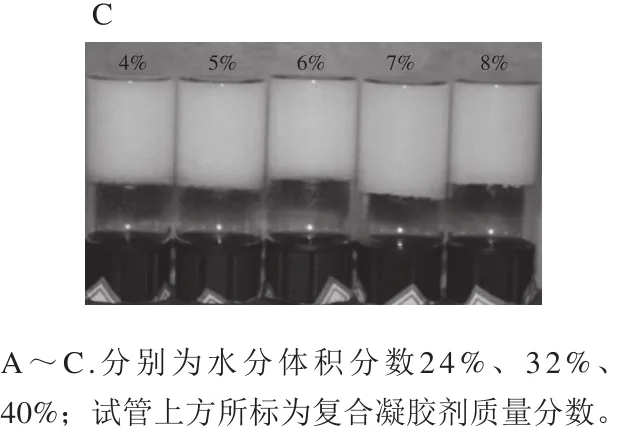
图2 不同水分体积分数和复合凝胶剂质量分数的人造奶油Fig. 2 Margarine samples with different water contents and gelling agent concentrations
从图2可以看出,水分体积分数为32%和40%时,形成人造奶油所需的复合凝胶剂临界质量分数均为4%,而水分体积分数为24%时复合凝胶剂临界质量分数为5%,复合凝胶剂质量分数4%样品出现了油-水两相分层。这说明当体系的水分体积分数提高时,形成均相人造奶油体系所需要的凝胶剂质量分数降低,这也从侧面反映了体系内凝胶剂分子与水之间的相互作用对体系稳定性的影响要大于凝胶剂分子之间的相互作用。
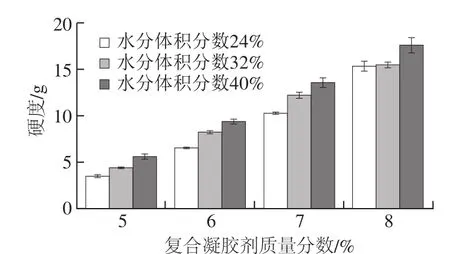
图3 水分体积分数和复合凝胶剂质量分数对人造奶油硬度的影响Fig. 3 Effects of water content and gelling agent concentration on the hardness of margarine
由于水分体积分数24%、复合凝胶剂质量分数4%的人造奶油样品的硬度值未达到硬度测试的最小触发力,因此,复合凝胶剂质量分数4%系列样品的硬度值不在图3中显示。图3结果表明,随着水分体积分数或凝胶剂质量分数的增加,硬度值都会增大。在选取的熟化温度(25 ℃)下,原料大豆油中甘油三酯分子不能形成晶体,因此本研究中人造奶油样品的硬度值与甘油三酯分子结晶无关。之前的研究结果显示,β-谷甾醇和卵磷脂可形成具有一定硬度的凝胶油[16]。据此不难理解,在人造奶油体系中,复合凝胶剂质量分数与人造奶油硬度呈正相关。而相同凝胶剂质量分数下,水分体积分数的增加会促使体系内水与凝胶剂之间形成更多的氢键[25],加强了体系结构的稳定性,从而使人造奶油硬度增大。
2.3 人造奶油的流变学行为研究
LVR是指样品在变化的应力或者应变下,弹性模量G’和黏性模量G”保持不变的区域。通常情况下选择样品的G’为最大G’的90%的应变点为线性黏弹区的终点[26]。
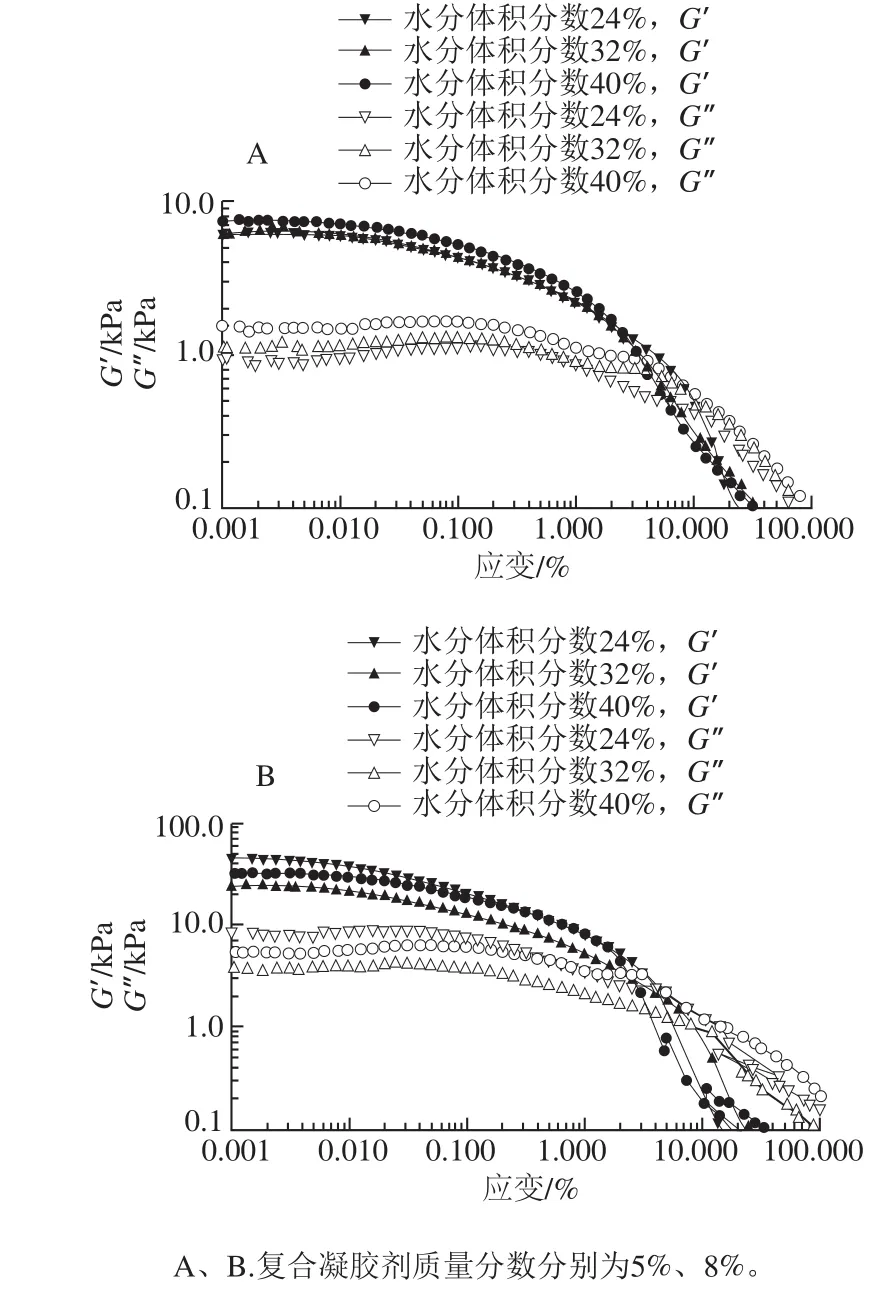
图4 不同人造奶油的线性黏弹区Fig. 4 Linear viscoelastic areas of different margarine samples
从图4可以看出,凝胶剂质量分数和水分体积分数的变化对样品人造奶油的LVR无显著影响,LVR大约在0.001%~0.100%。选取应变值为0.01%进行后续样品的频率扫描。频率扫描测试得到的G’和G”的相对大小关系可以反映样品的弹性特征和黏性特征:当G’>G”时,样品表现为胶体(固体状态);当G’<G”,样品表现为流体[27]。
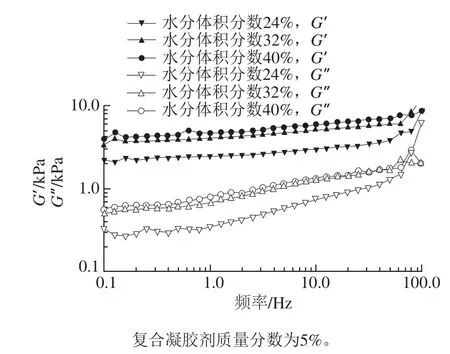
图5 不同人造奶油频率扫描Fig. 5 Frequency sweeping of different margarine samples
图5 结果表明,G’和G”与频率相互独立,体系中微粒相互作用强,所有样品均表现出了良好的固体(凝胶)状态(G’>G”)。从图4、5还可以看出,凝胶剂质量分数相同时,样品的水分体积分数越高,其G’值(应变0.01%)也越高,也就是说样品弹性随着体系水分体积分数的增加而增大。
2.4 人造奶油微观网络结构分析

图6 不同人造奶油样品的微观网络结构Fig. 6 Microstructure of different margarine samples
从图6可以看出,在人造奶油样品中存在双连续相结构,即油-水两相分布相对均匀(图中红色为基料大豆油,绿色为水与卵磷脂)。β-谷甾醇和卵磷脂通过自组装结合而逐渐形成纤维网络结构并聚集延伸,所以图中显示的部分纤维状晶体已经被结合上绿色荧光。在图6A1、B1中,晶体细小且分布无规则;图6A2、B2中是以一点为中心向四周扩散的纤维状结晶体,如同一个球形;图6A3、B3中晶体变为无定向延伸的纤维状结晶体。相比于相应的图6A系列,图6B系列人造奶油样品具有更加完整的三维网络结构,且油-水两相分布更加均匀,具有更大的油-水两相接触面积。
有研究认为,在凝胶油三维网络中结构单元的表面积-体积比值的升高可引起凝胶油强度的增大[16];此外在典型的超分子自组装凝胶网络中,发生相互作用的超分子自组装体主要是通过表面张力使微区内的液体呈现非流动状态[28]。因此,随着凝胶剂质量分数或水分体积分数的增加,人造奶油样品中微观三维网络结构构筑单元的表面积-体积之比越高,则其表面张力也越大,对大豆油和水的限制作用也就越强,从而能固定的油、水两相也越多,人造奶油的网络结构也更加稳定,因此最终表现出来的硬度和弹性也更大。
2.5 人造奶油XRD图谱分析

图7 卵磷脂、基料油、β-谷甾醇和不同人造奶油的XRD图谱Fig. 7 XRD patterns of lecithin, base oil, β-sitosterol and various margarine sples
从图7可以看出,原料β-谷甾醇的强衍射峰比较多,其中15°(5.90 Å)为无水β-谷甾醇的结晶峰,而17.5°(5.07 Å)、18°(4.86 Å)可能为水合或半水合β-谷甾醇的结晶峰[29];卵磷脂和基料油在扫描范围内仅在20°附近出现一个非晶峰,所以凝胶油基人造奶油所形成的结晶都来自β-谷甾醇以及β-谷甾醇与卵磷脂自组装体。样品人造奶油几个比较强的衍射峰分别出现在2θ为15°、17.5°、18°和19°处。
XRD图谱可以得到样品的结晶峰与非结晶峰的面积与强度,从而计算出结晶度大小[30]。32%水分体积分数下,复合凝胶剂质量分数5%、7%的人造奶油结晶度分别为(30.10±0.07)%和(32.80±0.14)%;40%水分体积分数下,复合凝胶剂质量分数5%、7%的人造奶油结晶度分别为(36.00±1.34)%和(43.90±1.83)%。可以看出,随着凝胶剂质量分数和水分体积分数的升高,人造奶油的结晶度呈上升趋势,这与在CLSM中观察到的微观结构结果是相符的。同时这一结果也进一步证实了随着水分体积分数的增加,人造奶油样品内部网络结构构筑单元数目增加,从而造成样品硬度和弹性的增加。
3 结 论
以大豆油为基料油,采用β-谷甾醇和卵磷脂可成功制备凝胶油基人造奶油,其中低饱和脂肪酸和零TFA都对消费者健康具有积极的作用。当体系的水分体积分数提高时,形成均相人造奶油体系所需要的凝胶剂质量分数降低。人造奶油样品的硬度和弹性均受到凝胶剂质量分数和水分体积分数的影响,凝胶剂质量分数和水分体积分数越高硬度越大,体系结构也越稳定。微观网络结构分析结果表明,β-谷甾醇通过结晶或与卵磷脂进行自组装的形式与油脂共同形成了三维网络结构,并且凝胶剂质量分数和水分体积分数越高,网状结构将油-水两相固定得越牢固,最终形成均匀稳定的体系。通过XRD图谱分析可知,人造奶油样品的结晶度随着凝胶剂质量分数和水分体积分数的提高而增大。
参考文献:
[1] ADHIKARI P, ZHU X M, GAUTAM A, et al. Scaled-up production of zero-trans, margarine fat using pine nut oil and palm stearin[J]. Food Chemistry, 2010, 119(4): 1332-1338. DOI:10.1016/j.foodchem.2009.09.009.
[2] ALHASAWI F M, ROGERS M A. Ternary phase diagram of β-sitosterol-γ-oryzanol-canola oil[J]. Journal of the American Oil Chemists’ Society, 2013, 90(10): 1533-1540. DOI:10.1007/s11746-013-2302-4.
[3] SANTOS L A T, CRUZ R, CASAL S. Trans, fatty acids in commercial cookies and biscuits: an update of portuguese market[J]. Food Control,2015, 47: 141-146. DOI:10.1016/j.foodcont.2014.06.046.
[4] MARANGONI A G. Organogels: an alternative edible oil structuring method[J]. Journal of the American Oil Chemists’ Society, 2012, 89(5):749-780. DOI:10.1007/s11746-012-2049-3.
[5] ÖĞ Ü T C Ü M, ARIFOĞLU N. Preparation and characterization of virgin olive oil-beeswax oleogel emulsion products[J]. Journal of the American Oil Chemists’ Society, 2015, 92(4): 459-471. DOI:10.1007/s11746-015-2615-6.
[6] CHI D D, PATEL A R, TAVERNIER I, et al. The feasibility of wax-based oleogel as a potential co-structurant with palm oil in low-saturated fat confectionery fillings[J]. European Journal of Lipid Science & Technology, 2016, 118(12): 1903-1914. DOI:10.1002/ejlt.201500172.
[7] YILMAZ E, ÖĞ Ü T C Ü M. The texture, sensory properties and stability of cookies prepared with wax oleogels[J]. Food & Function, 2015, 6(4):1194-1204. DOI:10.1039/C5FO00019J.
[8] 钟金峰, 覃小丽, 刘雄. 凝胶油及其在食品工业中的应用研究进展[J]. 食品科学, 2015, 36(3): 272-279. DOI:10.7506/spkx1002-6630-201503051.
[9] PEHLIVANOGLU H, DEMIRCI M, TOKER O S, et al. Oleogels,a promising structured oils for decreasing saturated fatty acid concentrations: production and food-based applications[J]. Critical Reviews in Food Science and Nutrition, 2017: 1-12. DOI:10.1080/104083 98.2016.1256866.
[10] STORTZ T A, ZETZL A K, BARBUT S, et al. Edible oleogels in food products to help maximize health benefits and improve nutritional profiles[J]. Lipid Technology, 2012, 24(7): 151-154. DOI:10.1002/lite.201200205.
[11] LEE W L, MCCARTHY M J, MCCARTHY K L. Oil migration in 2-component confectionery systems[J]. Journal of Food Science, 2010,75(1): E83-E89. DOI:10.1111/j.1750-3841.2009.01454.x.
[12] ZETZL A K, MARANGONI A G, BARBUT S. Mechanical properties of ethylcellulose oleogels and their potential for saturated fat reduction in frankfurters[J]. Food & Function, 2012, 3(3): 327-337. DOI:10.1039/C2FO10202A.
[13] SAWALHA H, VENEMA P, BOT A, et al. The phase behavior of γ-oryzanol and β-sitosterol in edible oil[J]. Journal of the American Oil Chemists’ Society, 2015, 92(11): 1651-1659. DOI:10.1007/s11746-015-2731-3.
[14] SAWALHA H, MARGRY G, ADEL R D, et al. The influence of the type of oil phase on the self-assembly process of γ-oryzanol + β-sitosterol tubules in organogel systems[J]. European Journal of Lipid Science &Technology, 2013, 115(3): 295-300. DOI:10.1002/ejlt.201100395.
[15] 翟崇铭. 离子液体法制备高纯度大豆卵磷脂的研究[D]. 南京: 南京工业大学, 2015: 68.
[16] HAN L J, LI L, LI B, et al. Structure and physical properties of organogels developed by sitosterol and lecithin with sunflower oil[J]. Journal of the American Oil Chemists’ Society, 2014, 91(10): 1783-1792.DOI:10.1007/s11746-014-2526-y.
[17] SCHOLZ B, GUTH S, ENGEL K, et al. Phytosterol oxidation products in enriched foods: occurrence, exposure, and biological effects[J]. Molecular Nutrition & Food Research, 2015, 59(7): 1339-1352. DOI:10.1002/mnfr.201400922.
[18] 魏金婷, 刘文奇. 植物药活性成分β-谷甾醇研究概况[J]. 莆田学院学报, 2007, 14(2): 38-40. DOI:10.3969/j.issn.1672-4143.2007.02.009.
[19] 李贞. 卵磷脂的生物学功能及其应用[J]. 畜牧与饲料科学, 2016,37(2): 94-95. DOI:10.3969/j.issn.1672-5190.2016.02.038.
[20] WOJCIECHOWSKI K, ORCZYK M, TRAPP M, et al. Effect of triterpene and steroid saponins on lecithin bilayers[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016, 510: 150-158. DOI:10.1016/j.colsurfa.2016.04.065.
[21] KLEBER M E, DELGADO G E, STEFANLORKOWSKI, et al. Transfatty acids and mortality in patients referred for coronary angiography:the ludwigshafen risk and cardiovascular health study[J]. European Heart Journal, 2016, 37(13): 175-181. DOI:10.1093/eurheartj/ehv446.
[22] 王靖, 胡志雄, 许春芳, 等. 冷冻结晶法富集藻油DPA和DHA甘油酯的研究[J]. 中国油脂, 2015, 40(7): 69-72. DOI:10.1093/eurheartj/ehv446.
[23] 黄继武, 李周. 多晶材料X射线衍射[M]. 长沙: 冶金工业出版社,2012: 245.
[24] ARO A, JAUHIAINEN M, PARTANEN R, et al. Stearic acid, trans fatty acids, and dairy fat: effects on serum and lipoprotein lipids, lipoprotein (a),and lipid transfer proteins in healthy subjects[J]. The American Journal of Clinical Nutrition, 1997, 65(5): 1419-1426. DOI:10.1093/ajcn/65.5.1419.
[25] BOT A, AGTEROF W G M. Structuring of edible oils by mixtures of γ-oryzanol with β-sitosterol or related phytosterols[J]. Journal of the American Oil Chemists’ Society, 2006, 83(6): 513-521. DOI:10.1007/s11746-006-1234-7.
[26] MORALES-RUEDA J A, DIBILDOX-ALVARADO E,CHARALONSO M A, et al. Rheological properties of candelilla wax and dotriacontane organogels measured with a true-gap system[J].Journal of the American Oil Chemists’ Society, 2009, 86(8): 765-772. DOI:10.1007/s11746-009-1414-3.
[27] SAWALHA H, VENEMA P, BOT A, et al. The Influence of concentration and temperature on the formation of γ-oryzanol +β-sitosterol tubules in edible oil organogels[J]. Food Biophysics,2011, 6(1): 20-25. DOI:10.1007/s11483-010-9169-9.
[28] ABDALLAH D J, WEISS R G. n-Alkanes gel n-Alkanes (and many other organic liquids)[J]. Langmuir, 2000, 16(2): 352-355.DOI:10.1021/la990795r.
[29] CHRISTIANSEN L I, RANTANEN J T, VON BONSDORFF A K,et al. A novel method of producing a microcrystalline beta-sitosterol suspension in oil[J]. European Journal of Pharmaceutical Sciences,2002, 15(3): 261-269. DOI:10.1016/S0928-0987(01)00223-8.
[30] KALNIN D, SCHAFER O, AMENITSCH H, et al. Fat crystallization in emulsion: influence of emulsifier concentration on triacylglycerol crystal growth and polymorphism[J]. Crystal Growth & Design, 2004,4(6): 1283-1293. DOI:10.1021/cg030071k.
