QuEChERS-超高效液相色谱-串联质谱法同时测定蔬果中34 种植物生长调节剂的残留量
2018-04-20孙晓冬杨丽梅张朝晖崔凤云
郝 杰,姜 洁,*,毛 婷,孙晓冬,杨丽梅,张朝晖,崔凤云
植物生长调节剂(plant growth regulators,PGRs)是一类人工合成的,具有和植物内源激素具有相似生理功效和相似化学结构的化学合成物[1]。根据发挥的生理功效的作用不同,可以分为生长促进剂、生长抑制剂、生长延缓剂[2]。已有科学研究表明,PGRs的使用可使蔬果产量增加5%~30%,国际上已把PGRs作为21世纪农业实现超产的主要措施之一[3]。但PGRs本身也属于农药的一类,某些化合物也具有明显的慢性毒性[4],需要规范其使用。随着PGRs的使用日益广泛,盲目或过量使用的情况时有发生,影响到了农产品的品质安全,例如2011年爆发的“西瓜爆炸”事件和“激素黄瓜”事件,特别是各种反季节蔬菜水果的出现尤为突出,个头增大、颜色改变、味道平淡、果体畸形等现象加重了人们对食品安全问题的担忧[5]。各国在PGRs的使用上均制定了相关法规,我国在即将实施的GB 2763—2016《食品中农药最大残留量》[6]中将作为PGRs使用的农药范围扩大到了14种,使用范围涉及10余种产品。各国部分植物生长调节剂的限量值对比见表1。

表1 各国植物生长激素限量值对比Table 1 Comparison of maximum residue limits for plant growth regulators among different countries mg/kg
植物生长调节剂的测定目前主要方法有酶联免疫法[10]、气相色谱法[11]、气相色谱-质谱法[12-13]、液相色谱法[14]、液相色谱-质谱法[15-19]。其中液相色谱-串联质谱法作为分析领域最有力的技术手段,具有前处理灵活简便、无需衍生化反应、能够达到较低检出限和强大的定性能力等优点,成为PGRs残留分析中常见的方法,国内外已有采用液相色谱-串联质谱法测定PGRs残留量的报道[15-18],但这些报道涉及化合物种类不多,极少能够涵盖3大类PGRs。前处理技术上,已有包括液液微萃取[20]、低温液液分配[21]、微波辅助萃取[22]、固相萃取法[23]等。QuEChERS法最初用于果蔬中农药残留检测,后被推广至更大的检测范围和基质中,成为农药残留快速前处理技术的首选[24-29]。本实验通过优化QuEChERS(quick, easy, cheap, effective, rugged, safe)各类填料的不同配比,优化超高效液相色谱-质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)条件,考察精密度、灵敏度、回收率等指标,建立了QuEChERS-UPLC-MS/MS法同时测定蔬果中34 种植物生长调节剂残留的方法。本方法快速、灵敏,可满足高通量测定水果中多种植物生长调节剂的残留,可为建立其他基质中相关化合物残留检测提供参考。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈、甲酸、甲苯(均为色谱纯)美国Fisher公司;三键键合硅胶C18粉末、石墨化炭黑(graphitized carbon black,GCB)粉末 美国Waters公司;N-丙基乙二胺(primary secondary amine,PSA)、增强型基质去除EMR(enhanced matrix remove)粉末 美国Agilent公司;氧化锆包覆硅胶(Z-sep)粉末 美国Sulpeco公司;无水硫酸镁、醋酸钠、氯化钠、二水合柠檬酸钠、三水合二柠檬酸二钠、硫酸钠(均为分析纯) 北京化学试剂厂。
34 种植物生长调节剂标准品:吲哚乙酸(CAS:87-51-4)、吲哚丁酸(CAS:133-32-4)、α-萘乙酸(CAS:86-87-3)、2,4-二氯苯氧乙酸(CAS:94-75-7)、2,4-二氯苯氧乙酸乙酯(CAS:533-23-3)、4-氯苯氧乙酸(CAS:122-88-3)、2-萘氧乙酸(CAS:120-23-0)、6-苄基腺嘌呤(CAS:1214-39-7)、吲熟酯(CAS:27512-72-7)、氯吡脲(CAS:68157-60-8)、环丙酸酰胺(CAS:113136-77-9)、玉米赤霉烯酮(CAS:17924-92-4)、赤霉素(CAS:77-06-5)、玉米素(CAS:1637-39-4)、马来酰肼(CAS:123-33-1)、脱落酸(CAS:14375-45-2)、噻苯隆(CAS:51707-55-2)、2,3,5-三碘苯甲酸(CAS:88-82-4)、莠去津(CAS:1912-24-9)、西玛津(CAS:122-34-9)、灭草松(CAS:25057-89-0)、水杨酸(CAS:69-72-7)、三唑酮(CAS:43121-43-3)、胺鲜酯(CAS:10369-83-2)、矮壮素(CAS:999-81-5)、缩节胺(CAS:24307-26-4)、多效唑(CAS:76738-62-0)、丁酰肼(CAS:1596-84-5)、烯效唑(CAS:83657-22-1)、抗倒胺(CAS:82211-24-3)、抗倒酯(CAS:95266-40-3)、抑芽唑(CAS:76608-88-3)、增甘磷(CAS:2439-99-8)、戊唑醇(CAS:107534-96-3)(纯度均大于95%) 德国Dr. Erenstofer公司。
1.2 仪器与设备
Xevo TQ-S三重四极杆质谱仪(配有Acquity UPLC仪及电喷雾离子源) 美国Waters公司;Thermo X1R高速冷冻离心机 美国Thermo Fisher公司;Milli Q超纯水系统 美国Millipore公司;GM200刀式研磨仪 德国Retsch公司;ENVI-氮吹仪 美国OA公司。
1.3 方法
1.3.1 标准溶液配制
称取适量标准品,分别用乙腈配制成1 000 μg/mL的标准储备液,存放在-20 ℃环境中,可保存6 个月。根据实验需要用乙腈稀释成标准工作液或混合标准工作液。
1.3.2 样品前处理
称取5 g均质后的样品于聚四氟乙烯离心管中,根据样品含水量情况,加入适量水,充分涡旋混匀后,加入10 mL乙腈,涡旋提取1 min,加入除水剂(4 g无水硫酸镁+1 g氯化钠+1 g二水合柠檬酸钠+0.5 g三水合二柠檬酸二钠),剧烈振摇1 min,如样品板结,则视情况加入陶瓷均质子。在4 ℃、8 000 r/min离心10 min,取上清液7.5 mL,根据样品状态,加入不同净化管中,具体如下:常规样品:净化管含150 mg C18、900 mg MgSO4;高叶绿素样品:净化管含150 mg C18、900 mg MgSO4、50 mg GCB,涡旋混匀后加入700 μL甲苯;高花色苷样品:净化管含300 mg Z-sep、900 mg MgSO4;高油脂样品:净化管含400 mg EMR;净化管涡旋振摇2 min后,于4 ℃、10 000 r/min离心10 min,取4 mL上清液,在40 ℃条件下用微弱氮气流吹至近干,用1 mL初始流动相溶液复溶后,经0.22 μm滤膜过滤后,上机测定。
1.3.3 UPLC-MS/MS条件
色谱条件:色谱柱:Waters Acquity HSS T3(100 mm×2.1 mm,1.8 μm);柱温:45 ℃;流动相:A相为乙腈,B相为水;流速:0.4 mL/min;进样量:5 μL。梯度洗脱程序如表2所示。
质谱条件:采用电喷雾离子源;正负离子切换模式;多反应监测分段扫描模式(其中第1段正离子模式0.0~3.0 min,第2段正离子模式3.0~5.5 min,第3段正离子模式7.8~10.0 min,第4段正离子模式5.5~7.8 min,第5段负离子模式0.0~3.5 min,第6段负离子模式3.5~6.5 min,第7段负离子模式6.5~10.0 min);毛细管电压3.00 kV(+)及2.00 kV(-),锥孔气流量150 L/h;脱溶剂气温度450 ℃;脱溶剂气流量800 L/h;雾化气压力0.7 MPa;34 种植物生长调节剂的定量、定性离子对、锥孔电压和碰撞电压见表3。

表2 梯度洗脱程序Table 2 Gradient elution program

表3 34 种植物生长调节剂的质谱参数Table 3 Mass spectrometric parameters for 34 plant growth regulators

续表3
2 结果与分析
2.1 质谱条件的优化
用甲醇分别配制30 ng/mL的标准品,通过蠕动泵以10 μL/min注入持续进样,与0.05 mL/min的流动相共同进入质谱仪中。化合物进入电喷雾离子源后,均能够形成稳定的母离子,在一级质谱模式下,调节锥孔电压使得母离子的丰度最大。开启二级质谱后,逐渐增大碰撞能量,观察记录离子碎片,选择相对丰度较高,出峰稳定的碎片,微调碰撞能量,使得碎片离子的丰度最大。各化合物质谱参数的优化结果见表3,34 种植物生长调节剂在各自优化的锥孔电压下,能够得到最强的母离子响应,同时在优化的碰撞电压下,可以得到稳定、响应较强的子离子,对比得到的两个碎片离子,选择干扰较小、丰度较高的碎片作为定量离子,另一个作为定性离子。
2.2 色谱条件的优化
2.2.1 色谱柱的选择
实验对比Waters Acquity BEH C18(100 mm×2.1 mm,1.7 μm)、Waters Acquity HSS T3(100 mm×2.1 mm,1.8 μm)、Waters Acquity CORTECS C18(50 mm×2.1 mm,1.6 μm)、Waters Acquity CSH C18(100 mm×2.1 mm,1.7 μm)、Thermo Hypersil Gold(100 mm×2.1 mm,1.9 μm)色谱柱对待测组分分离的效果。由于多组分分析方法的建立中需要兼顾极性差异较大的各种化合物,其中,HSS T3可以耐受更高比例的水相,在98%比例的水相条件下可以使得强极性化合物(丁酰肼、矮壮素等)保留更好(表4),同时在全时间段上可以均匀出峰,因此,选取Waters Acquity HSS T3色谱柱作为分析柱。

表4 强极性化合物在不同色谱柱上保留时间对比Table 4 Comparison of retention time of compounds with high hydrophobicity on different columns min
2.2.2 流动相的选择
由于采取正负切换离子模式采集,在选择流动相的条件时,不仅要关注正离子电离化合物的响应,更重要的是负离子电离化合物在流动相影响下的峰形及响应情况。实验选择了乙腈、甲醇及二者的比例溶液作为强洗脱相;水、含0.1%甲酸溶液、含5 mmol/L乙酸铵溶液、含5 mmol/L甲酸铵溶液作为弱洗脱相,对其不同搭配进行了对比。
对比甲醇和乙腈作为流动相对分离的影响,明显在使用乙腈作为有机相时,分离度更好。同时乙腈作为前处理QuEChERS法的提取溶剂,更有兼容性。对比不同酸度调节剂下的水溶液作为弱洗脱相时的分离情况,在使用含0.1%甲酸溶液(pH值约为3.6)时,包括水杨酸、4-氯苯氧乙酸等负离子电离化合物的定性离子出峰情况均不理想,虽然正离子的电离被增强,但是已经超出了检测所需的必要度。对比含有5 mmol/L乙酸铵及甲酸铵溶液及纯水作为流动相时的情况,可以看到含有缓冲盐的情况下,各峰之间的分离度较好,但某些负离子电离化合物定性离子的出峰情况仍不理想(如水杨酸)。采用乙腈-水作为流动相各峰分离度好,负离子电离化合物也能够保证定性离子有足够响应,能够满足实验设计所需。图1为34 种植物生长调节剂的总离子流色谱图。

图1 34 种植物生长调节剂总离子流图Fig. 1 Total ion current chromatograms of 34 plant growth regulators
2.3 提取溶剂的选择
乙腈作为QuEChERS法最常用的提取溶剂,具有对农药优良的溶解性,实验考察不同提取溶剂对目标化合物提取效率的影响,包括乙腈、0.1%甲酸-乙腈、2%甲酸-乙腈、0.1%氨水-乙腈。如图2所示,乙腈具有较好的提取效率。这是由于目标化合物中具有酸性及碱性化合物,采用中性提取溶液可以更好地兼顾二者的提取。根据样品状态不同,加入适量水可以形成饱和盐溶液,促进化合物的分配平衡向有机相移动,从而提高提取效率。

图2 提取溶剂对34 种植物生长调节剂平均回收率的影响Fig. 2 Effect of extraction solvents on average recoveries of 34 PGRs
2.4 脱水剂及配比的选择
QuEChERS法经过诸多应用,已经被证明为农药残留检测的首选前处理方法之一[18-19]。在QuEChERS方法发展的过程中,提取步骤所用到的除水剂种类不断变化,配比也不断调整,以达到最优的除水效果和盐析后的最佳提取效率。本实验考察了5 种不同的脱水剂及配比对34 种植物生长调节剂的提取效率,分别为:A. 4 g无水硫酸镁+1 g氯化钠(原始QuEChERS法)[30];B. 6 g无水硫酸镁+1.5 g乙酸钠(AOAC 2007.01法)[31];C. 4 g无水硫酸镁+1 g氯化钠+1 g柠檬酸钠+0.5 g三水合二柠檬酸二钠(CEN 15662法)[31];D. 4 g无水硫酸钠+1 g氯化钠(兽药QuEChERS法)[32];E. 1.6 g无水硫酸镁+0.4 g氯化钠(QuEChERS EMR)。在提取管中分别加入0.5 mL 1 μg/mL的混合标准溶液,加入10 mL乙腈和1 mL水(QuEChERS EMR管由于容量限制,加入0.25 mL标准溶液,5 mL乙腈和0.5 mL水),剧烈振摇2 min,涡旋5 min后,离心取上清液0.5 mL与0.5 mL水混匀进样。

图3 脱水剂对34 种植物生长调节剂平均回收率的影响Fig. 3 Effect of different dehydration agents on average recoveries of 34 PGRs
对比各化合物在不同脱水剂作用下的提取效率(图3),结果表明,CEN 15662法的提取效率最优,这可能是因为柠檬酸盐的存在形成了稳定的缓冲体系,使得某些对pH值敏感的植物生长调节剂能够被有效提取出来。故选择4 g无水硫酸镁+1 g氯化钠+1 g柠檬酸钠+0.5 g三水合二柠檬酸二钠作为脱水剂。
2.5 净化填料及配比的选择
PSA、C18和GCB是QuEChERS法中最常用的净化填料,随着研究的进步,不断有更有针对性的新型填料被开发应用于QuEChERS方法中。例如Supelco公司的Z-sep(氧化锆包覆硅胶)、Z-sep+(C18键和氧化锆硅胶)填料[33],Agilent公司的EMR(增强型基质去除)填料[34]等。实验对比了净化填料不同组成和配比对实验回收率的影响。具体选择及配比见表5。
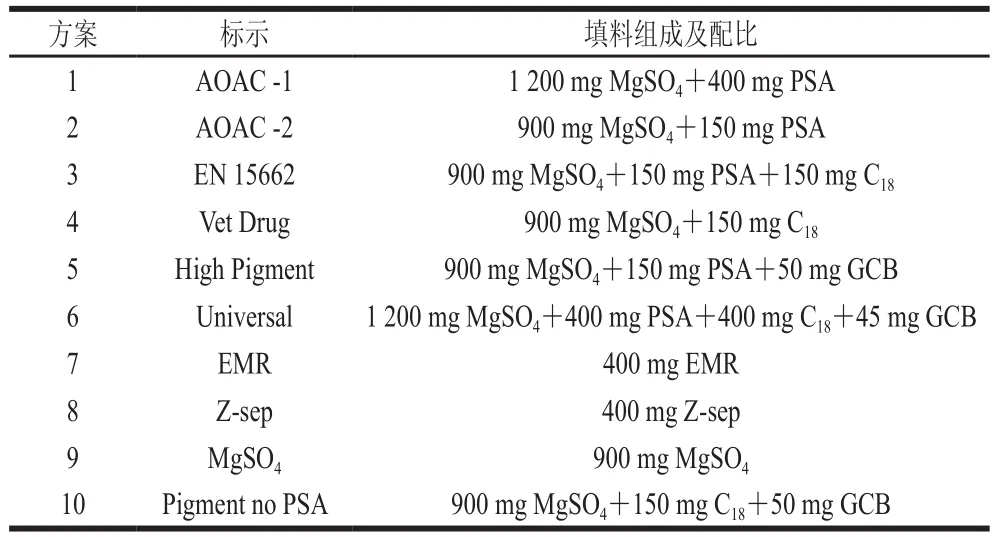
表5 净化方法优化过程中尝试的不同组成和配比Table 5 QuEChERS absorbents tested in this study
表5表明,由于目标化合物中α-萘乙酸、水杨酸等酸性PGR的存在,因此PSA不适合用于净化策略当中,对比方案4、7、8、9、10等,虽然都能达到较好的回收率,但对于不同状态的果蔬基质,去除杂质干扰的能力依然有不同,且可为互补。方案9仅有除水用MgSO4,对各类杂质均没有理想的清除效果;对于菠菜等叶绿素含量较高的基质,方案10中的GCB可以有效清除杂质,但对萘乙酸、吲熟酯、6-BA等平层结构化合物的回收率会有较大影响,在净化过程中加入适量甲苯可以改善回收率;对于提子、草莓等花色苷含量较高的基质,方案8中,氧化锆包覆硅胶Z-sep基质可有效去除花色苷,清除效果非常明显,且对回收率无较大影响;对于特殊含油脂较高的鳄梨基质,EMR粉末可以用于清除其中的脂质杂质,也可达到较为满意的净化效果;其余常规的水果蔬菜,如黄瓜、苹果、豆芽、梨等不含有较多色素、蜡质、脂肪等杂质的基质,使用MgSO4清除水分、C18填料清除低极性杂质后即可测定。在菠菜、梨、提子、牛油果等典型基质中34 种植物生长调节剂使用不同净化方案的平均回收率见图4。

图4 不同净化方案的平均回收率Fig. 4 Average recoveries of plant growth regulators by different purification methods
2.6 基质效应的评价

图5 植物生长调节剂在不同基质中的基质效应范围Fig. 5 Matric effect ranges of plant growth regulators in different matrixes
根据GB 2763—2016[6]中对水果类别的分类,本方法选取了常规样品、高叶绿素样品、高花色苷样品、高油脂样品的代表性基质进行了方法验证。基质效应根据空白加标基质响应值与溶剂标样响应值的比值进行评价。基质效应大于0时为基质增强效应,小于0为基质抑制。对于基质效应过强的样品,应采取相应的处理手段以减小其对测定的干扰。图5为菠菜(高叶绿素样品)、梨(常规样品)、提子(高花色苷样品)、牛油果(高油脂样品)等典型基质中,测定得到的34 种化合物基质效应的范围。可以看出,各基质对于植物生长调节剂的基质效应均较明显,并且多表现出基质抑制效应,为消除基质效应带来的影响,采取基质加标曲线进行校正。
2.7 标准曲线、检出限和定量限实验结果
在空白梨样品中添加5、10、20、50、80、100 μg/kg系列水平的混合标准溶液,按前处理步骤处理后上机测定,按信噪比3∶1得到目标化合物的检出限,10∶1得到目标化合物的定量限。以质谱响应值为纵坐标,添加量为横坐标,绘制基质加标工作曲线,得到本方法的线性范围,回归曲线方程及相关系数,结果见表6。

表6 34 种植物生长调节剂的标准曲线、相关系数、线性范围、检出限及定量限Table 6 Standard curves, linear ranges, correlation coefficients, LODs and LOQs for 34 plant growth regulators
2.8 回收率和精密度实验结果
分别取典型基质的空白样品,包括菠菜(高叶绿素样品)、梨(常规样品)、提子(高花色苷样品)、牛油果(高油脂样品),添加低、中、高3 个水平的34 种植物生长调节剂混合标准溶液,进行前处理,测定目标化合物。每个水平进行6 次实验,结果见表7,34 种植物生长调节剂的平均回收率为70.6%~118.3%,相对标准偏差为0.3%~14.9%。

续表7

表7 典型基质中34 种植物生长调节剂的回收率和相对标准偏差(n=6)Table 7 Average recoveries and RSDs of 34 plant growth regulators in typical matrix (n= 6)

续表7
2.9 方法稳定性的考察结果

变异系数/%吲哚乙酸 81.47 0.79 84.50 12.28 91.53 1.18 6.02吲哚丁酸 84.97 4.73 91.73 10.58 91.90 1.99 4.42 α-萘乙酸 79.33 2.46 94.47 9.00 83.37 5.94 9.14 2,4-D 84.83 5.29 92.43 9.94 88.93 4.49 4.29 2,4-D乙酯 93.03 2.13 93.43 8.51 92.03 5.33 0.78 4-氯苯氧乙酸 86.87 0.47 92.83 9.77 83.33 3.07 5.48 2-萘氧乙酸 84.37 3.57 91.27 2.69 91.60 5.87 4.58 6-苄基腺嘌呤 92.30 7.35 96.63 10.22 90.10 4.90 3.57吲熟酯 88.00 3.25 75.47 11.78 86.00 10.09 8.10氯吡脲 101.67 5.57 75.87 6.93 89.72 6.39 14.49环丙酸酰胺 96.57 1.65 88.70 8.98 85.43 4.64 6.34玉米赤霉烯酮 96.10 6.65 95.57 12.70 94.53 3.88 0.83赤霉素 93.67 6.69 99.93 6.43 90.57 2.14 5.04玉米素 89.60 3.03 97.87 8.98 93.10 4.19 4.44马来酰肼 89.30 3.05 91.97 7.55 79.60 8.88 7.48脱落酸 87.37 3.21 86.23 0.87 93.50 5.55 4.39噻苯隆 92.93 6.27 94.47 1.86 91.70 7.52 1.49 2,3,5-三碘苯甲酸 88.63 2.01 83.60 3.19 85.80 3.88 2.93莠去津 96.73 7.10 95.03 7.40 90.87 1.23 3.20西玛津 93.40 1.02 93.13 7.23 90.13 3.43 1.97灭草松 87.40 5.97 85.10 9.11 94.70 6.85 5.63水杨酸 82.37 0.67 100.07 7.72 75.90 3.69 14.53三唑酮 100.83 7.45 100.00 11.54 84.03 2.94 9.97胺鲜酯 89.63 5.92 94.73 9.69 89.27 1.79 3.35矮壮素 92.13 6.96 87.17 13.45 85.57 1.28 3.88缩节胺 95.40 4.41 86.57 7.18 78.83 3.19 9.54多效唑 88.47 6.70 96.17 12.20 87.67 4.38 5.17丁酰阱 90.17 2.44 77.73 10.92 89.40 2.47 8.12烯效唑 92.33 7.98 96.23 10.80 85.97 3.37 5.66抗倒胺 88.97 3.56 87.27 14.17 77.33 4.25 7.43抗倒酯 101.37 6.23 95.13 6.93 91.60 4.32 5.15抑芽唑 80.20 2.94 94.73 14.00 89.37 5.14 8.34增甘膦 99.93 1.71 92.63 6.13 81.10 2.83 10.41戊唑醇 86.27 4.77 75.63 7.50 93.03 4.09 10.32化合物 平均回收率/%实验室1 实验室2 实验室3 批间变异系数/%变异系数/%平均回收率/%变异系数/%平均回收率/%
通过将该方法在3 家技术机构进行应用,得到在不同条件下实验结果的批内及批间变异系数(表8),评价方法的稳定性。每个实验室均采用3 个水平的加标样品进行6 个水平的测定。从得到的结果可以看出,批内及批间变异系数均小于15%,符合GB/T 27404—2008《实验室质量控制规范食品理化检测 实验室质量控制规范食品理化检测》中关于方法变异系数的要求。
2.1 0 实际样品测定结果
随机选取市售水果蔬菜150 个,包括菠菜、芹菜、桃、苹果、青椒、桑葚、葡萄、牛油果、柑橘等样品。 应用建立的方法对样品进行34 种植物生长调节剂快速筛查,结果如图6所示,小油菜在样品中检出多效唑(27.8 μg/kg),在油桃样品中检出脱落酸(18.16 μg/kg)等药物。

图6 样品中检出多效唑、脱落酸的提取离子流图Fig. 6 Extracted ion chromatograms of paclobutrazol and abscisic acid in positive samples
3 结 论
利用基质分散固相萃取技术结合UPLC-MS/MS技术建立了常见水果、蔬菜中植物生长调节剂多指标同步定量检测技术,该方法使用QuEChERS技术,针对不同的样品基质,选取不同的净化填料进行样品净化,使用超高效液相色谱分离,电喷雾串联四极杆质谱测定,基质匹配外标峰面积法定量。得到了良好的方法灵敏度及回收率。相比于已有方法,扩大了化合物监测范围,有针对性进行净化策略的选择,也能够有效降低测定中的干扰。经方法学验证,该方法满足残留检测的技术要求,可应用于食品安全日常监测及突发事件应急处置工作当中。
参考文献:
[1] THIMANN K V. 植物生长剂的过去、现在和未来[J]. 植物生理学通讯, 1964(5): 51-57.
[2] 潘瑞炽. 重视植物生长调节剂的残毒问题[J]. 生物学通报, 2002,37(4): 4-7.
[3] 郭潇, 赵文. 植物生长调节剂的安全性分析[C]//中国中部地区农产品加工产学研研讨会. 保定: 中国农业工程学会农产品加工及贮藏工程分会, 2007: 233-236.
[4] 张峰, 潘康标, 田子华. 植物生长调节剂研究进展及应用对策[J]. 现代农业科技, 2012(1): 193-195.
[5] 郝杰, 冯楠, 姜洁, 等. 水果蔬菜中常见植物生长调节剂分析检测方法研究进展[J]. 食品科学, 2015, 36(21): 303-309. DOI:10.7506/spkx 1002-6630-201521056.
[6] 国家卫生和计划生育委员会, 农业部. 食品中农药最大残留量: GB 2763—2016[S]. 北京: 中国标准出版社, 2016.
[7] European Commission. EU Pesticide database[EB/OL]. (2017-04-28)[2017-05-31]. http://ec.europa.eu/food/plant/pesticides/eu-pesticidesdatabase.
[8] US Environment Protection Agency. Tolerances and exemptions for pesticide chemical residues in food[EB/OL]. (2017-05-30)[2017-05-31]. https://www.ecfr.gov/cgi-bin/text-idx?SID=56686e48f30b308e 60d0c9b0135691c9&mc=true&tpl=/ecfrbrowse/Title40/40cfr180_main_02.tpl.
[9] Minister of Health, Labor and Welfare. Positive list system for agricultural chemical residues in foods[EB/OL]. The Japan Food Chemical Research Foundation, (2017-04-18)[2017-05-30]. http://www.ffcr.or.jp/zaidan/FFCRHOME.nsf/pages/MRLs-p.
[10] WATANABE E, TSUDA Y, WATANABE S, et al. Development of an enzyme immunoassay for the detection of plant growth regulator inabenfide in rice[J]. Analytica Chimica Acta, 2000, 424(2): 149-160.DOI:10.1016/S0003-2670(00)01076-X.
[11] LEE S M, KIM J Y, LEE H J, et al. Establishment of analytical method for 6-benzylaminopurine residue, a plant growth regulator for brown rice, mandarin, pepper, potato, and soybean by using GC/NPD[J].Journal of the Korean Society for Applied Biological Chemistry, 2014,57: 83-89. DOI:10.1007/s13765-013-4251-x.
[12] 吴平谷, 谭莹, 张晶, 等. 分级净化结合气相色谱-质谱联用发测定豆芽中10 种植物生长调节剂[J]. 分析化学, 2014, 42(6): 866-871.DOI:10.3724/SP.J.1096.2014.40105.
[13] 徐宜宏, 蒋驰, 付海滨, 等. 苹果、番茄、玉米中7 种植物生长调节剂的气相色谱-串联质谱检测方法[J]. 农药, 2014, 53(2): 113-115.
[14] HU J Y, DENG Z B, QIN D M. Determination of diacylhdrazines-type insect growth regulator JS-118 residues in cabbage and soil by high performance liquid chromatography with DAD detection[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 83: 803-807.DOI:10.1007/s00128-009-9831-4.
[15] HERNANDEZ F, POZO O J, SANCHO J V F, et al. Multiresidue liquid chromatography tandem mass spectrometry determination of 52 non gas chromatography-amenable pesticides and metabolites in different food commodities[J]. Journal of Chromatography A, 2006,1109(2): 242-252. DOI:10.1016/j.chroma.2006.01.032.
[16] MA L Y, ZHANG H Y, XU W T, et al. Simultaneous determination of 15 plant growth regulators in bean sprout and tomato with liquid chromatography-triple quadrupole tandem mass spectrometry[J]. Food Analytical Methods, 2013, 6(3): 941-951. DOI:10.1007/s12161-012-9505-4.
[17] XUE J Y, WANG S, YOU X W, et al. Multi-residue determination of plant growth regulators in apple and tomatoes by liquid chromatography/tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2011, 25(21): 3289-3297. DOI:10.1002/rcm.5225.
[18] 张莹. HPLC法和HPLC-MS/MS法检测果蔬中植物生长促进剂残留[D].乌鲁木齐: 新疆大学, 2012.
[19] AKIYAMA Y, MATSUOKA T, MITSUHASHI T. Multi-residue screening method of acidic pesticides in agricultural products by liquid chromatography/time of flight mass spectrometry[J]. Journal of Pesticide Science, 2009, 34(4): 265-272. DOI:10.1584/jpestics.G09-29.
[20] GUPTA V, KUMAR M, BRAHMBHATT H, et al. Simultaneous determination of different endogenetic plant growth regulators in common green seaweeds using dispersive liquid-liquid microextraction method[J]. Plant Physiology and Biochemistry, 2011, 49(11): 259-263.DOI:10.1016/j.plaphy.2011.08.004.
[21] CHO S K, EL-ATY A A, PARK K H, et al. Simple multiresidue extraction method for the determination of fungicides and plant growth regulators in bean sprouts using low temperature partitioning and tandem mass spectrometry[J]. Food Chemistry, 2013, 136(3/4): 1414-1420. DOI:10.1016/j.foodchem.2012.09.068.
[22] MAO X J, TANG L J, TAN T, et al. Determination of plant growth regulators in pears by microwave-assisted extraction and liquid chromatography with electrospray ionization mass spectrometry[J].Journal of Separation Science, 2014, 37(11): 1352-1358. DOI:10.1002/jssc.201301291.
[23] TAKENAKA S. New method for ethephon ((2-chloroethyl) phosphonic acid) residue analysis, and detection of residual levels in the fruit and vegetables of western Japan[J]. Journal of Agricultural and Food Chemistry, 2002, 50(26): 7515-7519. DOI:10.1021/jf025823h.
[24] VALVERDE A, ARUILERA A, FERRER C, et al. Analysis of forchlorfenuron in vegetables by LC/TOF-MS after extraction with the buffered QuEChERS method[J]. Journal of Agricultural and Food Chemistry, 2010, 58(5): 2818-2823. DOI:10.1021/jf904465s.
[25] 黄何何, 张缙, 徐敦明, 等. QuEChERS-高效液相色谱-串联质谱法同时测定水果中21 种植物生长调节剂的残留量[J]. 色谱, 2014,32(7): 707-716. DOI:10.3724/SP.J.1123.2014.03003.
[26] 陈溪, 程磊, 曲世超, 等. QuEChERS-液相色谱-质谱法快速筛查和确证大米中205 种农药残留[J]. 色谱, 2015, 33(10): 1080-1089.DOI:10.3724/SP.J.1123.2015.05015.
[27] 徐娟, 陈捷, 王岚, 等. QuEChERS提取与超高效液相色谱-电喷雾电离串联质谱联用法检测果蔬中的230 种农药残留[J]. 分析测试学报, 2013, 32(3): 293-301.
[28] XUE J Y, WANG S L, YOU W X, et al. Multi-residue determination of plant growth regulators in apples and tomatoes by liquid chromatography/tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2011, 25(21): 3289-3297. DOI:10.1002/rcm.5225.
[29] SHI X M, JIN F, HUANG Y T, et al. Simultaneous determination of five plant growth regulators in fruits by modified quick, easy,cheap, effective, rugged, and safe (QuEChERS) extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2012, 60(1): 60-65. DOI:10.1021/jf204183d.
[30] ANASTASSIADES M, LEHOTAY S, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction partitioning and dispersive solid-phase extraction for the determination of pesticide residues in produce[J]. Journal of AOAC International,2003, 86(2): 412-431.
[31] LEHOTAY S, SON K A, KWON H, et al. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables[J]. Journal of Chromatography A, 2010, A1217:2548-2560. DOI:10.1016/j.chroma.2010.01.044.
[32] KANG J, FAN C L, CHANG Q Y, et al. Simultaneous determination of multi-class veterinary drug residues in different muscle tissues by modified QuEChERS combined with HPLC-MS/MS[J]. Analytical Methods, 2014, 6: 6285-6293. DOI:10.1039/c4ay00589a.
[33] Introducing Supel QuE Z-Sep Sorbents for QuEChERS[EB/OL].(2017-05-31) [2017-05-31]. http://www.sigmaaldrich.com/chinamainland/zh/video/analytical/quechers.html.
[34] ZHAO L M, STEVEN J, JUCK M. Benefits of using the agilent EMR-lipid polish pouch protocol[EB/OL]. (2017-05-31)[2017-05-31]. http://cn.agilent.com/cs/library/technicaloverviews/public/5991-6897EN.pdf.
