心电图T波改变对慢性肾脏病患者高钾血症的预测价值
2018-04-20李晴富春刘鸣
李晴 富春 刘鸣
慢性肾脏病(chronic kidney disease,CKD)是威胁现代人类健康的沉默杀手,随着肾功能衰竭加重,肾脏排水、排钾能力逐渐下降,发生高钾血症的风险增加。高钾血症可以导致患者出现乏力、心悸等症状,严重者可出现恶性心律失常,甚至心脏骤停猝死,属于内科急症。心电图出现特征性的高尖“帐篷状”T波改变是诊断高钾血症的依据之一。然而,临床工作中典型高尖“帐篷状”T波出现率并不高,大约54%[1],部分文献报道更低,只有17%的患者心电图出现高尖“帐篷状”T波表现[2]。对于CKD高钾血症患者,因其往往合并心肌病及低血钙等多种电解质紊乱,心电图表现更不典型,往往呈低振幅的波峰变尖、基底部变窄/双支对称的T波改变,因此利用心电图出现高尖“帐篷状”T波诊断高钾血症并不可靠。本文通过对CKD患者体表心电图出现低振幅、波峰变尖、基底部变窄或双支对称的T波改变与血钾浓度的比较,探讨两者之间的关系。
1 资料和方法
1.1 研究对象
收集2015年1月至2016年9月于我院就诊的各种病因导致的体表心电图表现为T波波峰变尖、基底部变窄/双支对称,且振幅<0.8 mV的CKD患者为观察组。同时选取同期体表心电图无此形态改变的CKD患者为对照组。排除急性冠脉综合征、急性脑梗死、脑出血、起搏器植入及心电图具有完全性左/右束支阻滞等患者。
1.2 采用标准
1.2.1高钾血症采用机型:贝克曼AU5400,测定方法:离子选择电极法(间接法),我院血清钾参考值3.5~5.3 mmol/L,血清钾>5.3 mmol/L为高钾血症。对临床常规生化检查,以及临床可疑高钾血症的患者,抽血化验发现血钾升高者,均经重复测定,并复查核实,排除体外溶血情况。降钾治疗后均复查血钾浓度。
1.2.2心电图采图采用GE MAC 1200 ST型12导全自动心电图诊断仪,定准电压10 mm/mV,走纸速度25 mm/s,频响范围0.05~100 Hz。均于降钾治疗前采集心电图,降钾治疗后复查心电图。并收集患者基础心电图(3个月前心电图)。由两名有5年以上阅图经验的主治医师,在不清楚患者血钾的情况下,筛选至少有两个相邻导联出现T波波峰变尖、基底部变窄或双支对称的形态改变,并且振幅<0.8 mV(T波≥0.8 mV的为高尖“帐篷状”T波[3])的心电图,然后收集其血钾及临床资料。
1.2.3慢性肾脏病符合临床诊疗指南肾脏病学分册慢性肾脏病定义[4]。
1.3 统计学处理
应用SPSS 16.0软件进行统计学分析。计量资料以中位数(25%,75%)表示,采用秩和检验;计数资料以百分率表示,采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的临床资料
观察组135例,其中男69例、女66例、<65岁的患者31例,≥65岁的患者104例;糖尿病肾病71例,高血压肾损害36例,慢性肾炎12例,梗阻性肾病5例,痛风性肾病8例,老年性肾病2例,多囊肾1例。对照组135例,其中男68例、女67例,<65岁的患者53例,≥65岁的患者82例;糖尿病肾病64例,高血压肾损害40例,慢性肾炎17例,梗阻性肾病7例,痛风性肾病5例,多囊肾1例,间质性肾炎1例。两组患者在性别比例、基础疾病上差异无统计学意义(P>0.05)。见表1。因观察组老年患者入组较多,两组在年龄分布上存在差异。
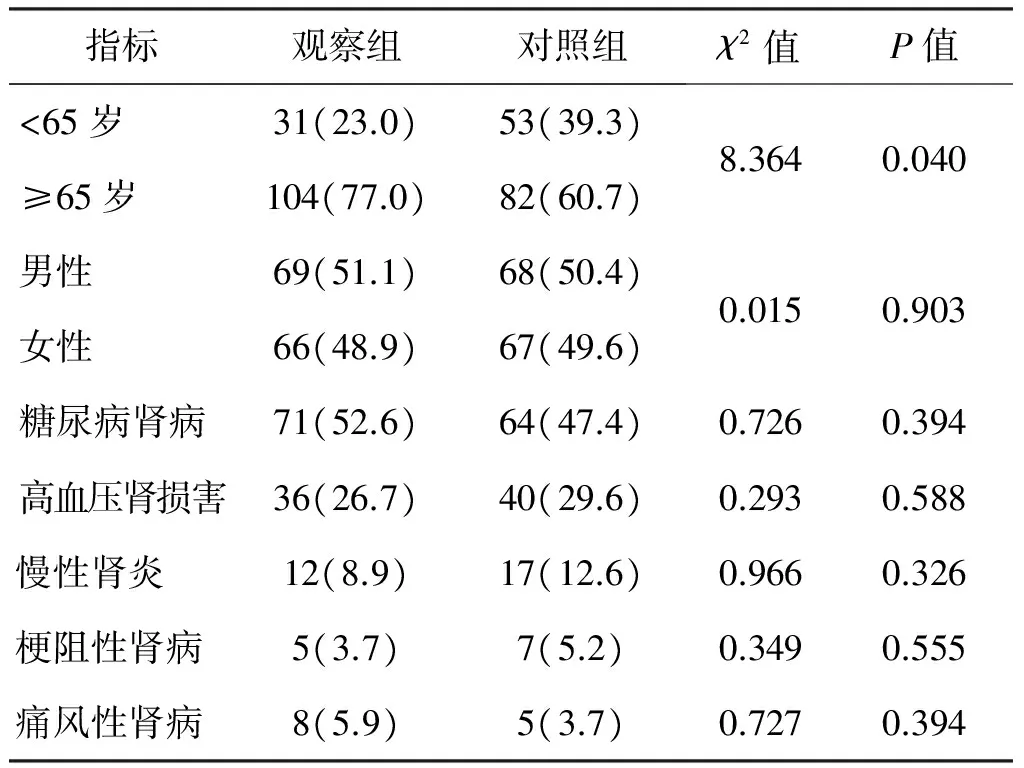
表1 两组患者基本资料比较 n(%)
2.2 两组血钾浓度及高钾血症发生率比较
观察组血钾浓度与对照组进行非参数秩和检验,差异有统计学意义(P<0.01);观察组高钾血症发生率71.4%,对照组高钾血症发生率7.4%,两组差异有统计学意义(P<0.01),见表2。

表2 两组患者血钾浓度及高钾血症发生率的比较
3 讨论
血钾升高是各期CKD患者最常见的电解质紊乱症状,且在同一患者可反复出现。实验室检测血钾需要抽血、送检、化验,等待时间长。体表心电图容易获得,利用体表心电图T波形态及振幅改变(而非单纯利用高尖T波)早期发现高钾血症意义重大,目前利用体表心电图各波段参数改变评估血钾浓度的研究非常多,有文献报道[5-6],利用T波下降支斜率、T波的重心位点、T波振幅、T/R振幅比预测透析患者血钾浓度,可检测到0.02 mmol/L的血钾变化。本文拟探讨CKD患者心电图T波出现波峰变尖或双支对称,但振幅<0.8 mV的形态改变与高钾血症的关系,以期为临床寻找出一种更便捷,且发生率较高的高钾血症相关的心电图改变评价指标。
T波形成的机制仍存在较大的争议,但是目前的研究结果提示,T波的形成与心室复极离散作用有关。心室肌分为心内膜、心外膜下心肌和中层M细胞,其动作电位曲线各不相同,同一层心肌、不同区域的动作电位曲线也存在差异,它们共同参与决定体表心电图上T波的形态、振幅、方向和时限。心肌动作电位是由细胞膜上的离子通道有规律的开放、关闭引起的。在正常的体表心电图上记录到的复极波方向与除极波主波方向一致,与单个心肌细胞不同,传统理论认为这是因为正常人心室的除极是从心内膜下心肌开始然后向心外膜推进,而复极则是从较晚除极的心外膜下心肌开始并向心内膜方向进行,即整个心室的除极复极顺序相反,因除极复极的电偶极性相反,故复极向量与除极向量同向。同时,传统观点认为是压力、温度和心肌供血等影响心室肌代谢的因素造成了这种改变:心内膜下心肌由于受到心室射血时的反作用力,压力较高;而心外膜下心肌由于周围受脂肪包绕,温度较高;且由于冠状动脉在心室肌内的走行是由外至内,外膜下心室肌供血较好。综上几点,心外膜下心肌的代谢状况较好,所以心内膜下心肌先除极但后复极,心外膜下心肌后除极却先复极。但是也有学者对复极波方向与除极波主波方向一致的原因给出不同解释,袁杰[7]从各部位心室肌细胞本身的电生理异质性理论出发,认为先除极的地方先复极,由于各处心室肌细胞的电生理异质性,先除极部位的动作电位时程更长,进入3相及复极结束晚于后除极部位,使整个心室的膜电位梯度与除极时同向,故T向量与QRS向量方向一致,或者概括为“后除极的地方复极快、结束早”。细胞内外正常的血钾浓度是维持心肌细胞动作电位的基础。高钾血症时,静息膜电位水平下降,0相除极速率下降;由于细胞膜对钾离子的通透性增高,2相和3相复极加速、坡度陡峭,复极以及整个动作电位时程缩短,因此心电图T波高耸、QT间期缩短。高钾血症引起心电图T波改变的细胞电生理机制是高血钾对动作电位2相和3相的影响。高钾血症时2相和3相复极斜率增加、复极时程缩短,主要负责离子流为快速延迟整流钾电流(IKr)。IKr对细胞外的钾水平非常敏感,当细胞外钾浓度增高时,IKr电流增加,同等时间流出细胞内的钾增多,IKr钾敏感性的确切机制尚不清楚。
本研究发现CKD患者体表心电图T波有波峰变尖、基底部变窄或双支对称的形态改变时,即使T波振幅无高耸的表现,也可能存在血钾升高的情况。经过收集资料分析发现,与对照组血钾值比较,这种T波改变确实与血钾升高有关,并且本研究中观察组有74.1%的CKD患者血钾达到高钾血症诊断标准,较以往研究[1-2]的心电图(以T波高尖改变为依据)表现为高钾血症的出现率高。为什么这部分CKD患者血钾升高时,心电图没有T波高耸表现呢?甚至出现这种T波形态改变的导联上T波的振幅仅有0.1 mV左右。这可能与尿毒症性心肌病(uremic cardiomyopathy,UCM)有关。慢性肾衰竭患者尿毒症毒素、高磷血症、氧化负荷等因素参与心肌病的发生发展过程,Kennedy等[8]研究发现纠正高血压并不能显著阻止左心室肥厚的进展,通过透析减轻容量负荷可以降低左心室容积指数,使室壁压力恢复正常,但并不能明显改善左室肥厚,可见尿毒症患者机体特殊内环境参与心肌病的发生发展过程。心肌间质纤维化是UCM的病理基础。Mall等[9]在尿毒症患者死亡后尸解的心肌组织中发现92%均有不同程度的心肌间质纤维化,并且尿毒症的心肌纤维化远比相同心脏的原发性高血压或
糖尿病患者严重。国内学者杜玉等[10]对31例尿毒症患者死后心肌病理检查发现,100%有心肌间质水肿和退行性变,90%有横纹肌结构不清,67.74%有区域性蜡样改变,74%有区域性间质纤维结缔组织增生改变。T波的形成与心室肌整体及跨壁复极离散有关。正常情况下,不同层的心室肌纤维的排列走行方向是不同的,心内膜下心肌纤维为右手螺旋走行,心外膜下心肌纤维为左手螺旋走行。UCM在超声心动图上主要表现为左心室肥厚、室腔扩大,舒张及收缩功能下降。UCM时由于心肌病变,心腔扩大,心内、外膜心肌纤维走行方向和复极能力均可能发生改变,其对心肌细胞膜复极方向和电位差的影响可能造成T波形态和振幅发生改变。目前因无病理情况干预下T波形成机制的研究,这种推测尚需构建UCM动物模型进一步证实。
本研究观察组中有部分患者血钾虽然没有超过5.3 mmol/L,心电图却有低振幅、波峰变尖,基底部变窄或双支对称的T波出现,降钾处理后可恢复至基础心电图形态。既往理论认为这其实是一种心脏记忆现象,即患者出现高钾血症性高耸T波,当血钾恢复正常后,心电图仍持续性表现高钾血症时的改变。相关的理论解释是血清钾不能反映心肌细胞内钾水平,心肌细胞内钾水平决定心电图改变,而影响心肌细胞内钾水平的并非单纯血钾一个因素。但是,这也可能和血钾参考值变化有关,有研究者报道,血钾离子的正常参考区间已与原参考区间有了很大变化,李雪梅等[11]研究提示老年人血钾参考值为(3.76±0.36)mmol/L。
综上所述,体表心电图出现波峰变尖、基底部变窄或双支对称,且振幅<0.8 mV的T波改变作为CKD患者高钾血症相关心电图改变的判断指标,对CKD患者高钾血症的预测有一定的临床价值,是一个值得推广的有临床实用价值的心电指标。
[1] 郑莉凡. 心电图诊断高钾血症的临床应用[J]. 中国社区医师, 2015, 31(15): 110-111.
[2] Raflque Z, Kosiborod M, Clark CL,et al. Electrocardiogram changes are not riliably assoclated with hyperkalemia or its severity[J]. Ann Emerg Med, 2017, 70(4):S25-S26.
[3] Green D, Green HD, New DI,et al. The clinical significance of hyperkalaemia-associated repolarization abnormalities in end-stage renal disease [J]. Nephrol Dial Transplant , 2013, 28(1): 99-105.
[4] 中华医学会. 临床诊疗指南肾脏病学分册[M]. 北京: 人民卫生出版社, 2009: 213-214.
[5] Dillon JJ,DeSimone CV,Sapir Y,et al.Noninvasive potassium determination using a mathematically processed ECG:proof of concept for a novel “blood-less, blood test”[J]. J Electrocardiol,2015, 48(1): 12-18.
[6] Yasin OZ,Attia Z,Dillon JJ,et al. Noninvasive blood potassium measurement using signal-processed, single-lead ecg acquired from a handheld smartphone[J]. J Electrocardiol,2017, 50(5):620-625.
[7] 袁杰. 关于心室复极顺序的错误表述——浅谈心室除复极过程与QRS-T同向机制[J].实用心电学杂志,2016,25(4):291-293,297.
[8] Kennedy DJ, Elkareh J, Shidyak A, et al. Partial nephrectomy as a model for uremic cardiomyopathy in the mouse[J].Am J Physiol, 2008,294(2): 450-454.
[9] Mall G,Huther W,Schneider J,et al.Diffuse intermyocardiocytic fibrosis in uraemic patients[J]. Nephrol Dial Transplant, 1990, 5(1):39-44.
[10] 杜玉, 徐景明. 尿毒症患者的心肌病理改变与心功能[J]. 前卫医药杂志, 1997,14(1):13-14.
[11] 李雪梅,蔡观良,叶彩丽. 采用离子选择性电极间接法检测血浆钾离子正常参考区间的建立与评价[J]. 实验与检验医学, 2011, 29(6): 597-599.
