多效唑和干旱胁迫对毛竹实生苗活力、光合能力及非结构性碳水化合物的影响
2018-04-19杨丽芝潘春霞邵珊璐陶晨悦应叶青
杨丽芝,潘春霞,邵珊璐,陶晨悦,王 威,应叶青,*
1 浙江农林大学省部共建亚热带森林培育国家重点实验室, 临安 311300 2 安吉县林业技术推广中心, 湖州 313300
随着全球气候变暖,世界范围内的干旱问题日益严重。植物因蒸腾作用导致失水量多于根系的吸水量时会产生干旱胁迫,引起植物生理生化过程的变化。目前干旱已经成为影响植物健康生长的主要逆境因子之一[1- 4]。根系是植物与土壤直接密切接触的重要器官,最先感知干旱胁迫,并迅速产生化学信号向上传递,促使叶片气孔关闭,以降低蒸腾作用,减少水分流失[5],其与地上部植株的生长及植株最终产量形成密切相关[6],已成为衡量植物抗旱能力的指标[7]。干旱胁迫使叶绿体形态结构发生改变,叶绿素含量下降[8],植物的光合作用被显著抑制,光合速率降低,影响光合电子传递等,进而影响碳同化[9]。有研究发现,植物的抗旱性与非结构性碳水化合物含量(NSC)有密切关系,NSC作为糖源为植物的生长发育提供能量,反应植物的碳供应状况,还能通过渗透调节作用平衡细胞的渗透势[10],从而调节植物生理来适应环境变化[11- 13]。
多效唑(paclobutrazol;PP333),不仅具有调节植物生长和抑菌的双重作用,又具有广谱、低毒,对人畜安全、施用方便等特点[14]。近十几年来,国内外对多效唑在果树、蔬菜、花卉、作物等植物上的调节作用[15],主要表现为:增强根系活力,促进叶绿素合成[16],增强植物抗逆性[17- 18],影响植物的光合作用、呼吸作用、矿质营养代谢、碳水化合物的的代谢与分配,延缓植物衰老等生理效应[19- 20]。王竞红等[21]研究认为,对黑麦草施加多效唑能明显提高草坪草的干旱适应性;Stephen发现高温和干旱双重胁迫下,PP333能显著提高匍匐剪股颖(Agrostisstolonifea)的叶片相对含水量和土壤含水量,降低匍匐剪股颖在胁迫下的蒸腾作用,在草地早熟禾上的研究得到了类似的结论[22- 23];在应对恶劣的生存环境时,狗牙根除了调整自身生存策略外,还可人为施加PP333来提高对逆境的适应能力[24]。
毛竹是禾本科(Gramineae)竹亚科(Bambusoideae)刚竹属植物,是我国最重要的生态经济竹种[25],主要分布在南方山地地区。近年来,毛竹主产区夏季持续高温导致季节性干旱频发,毛竹的正常生长受到严重威胁。多效唑作为一种植物生长调节剂能否提高毛竹抗旱性未见报道,其相关作用机制也尚不明确。本试验通过不同程度干旱胁迫条件下施加不同浓度的多效唑,研究毛竹实生苗光合特性及非结构性碳水化合物对干旱和多效唑及其互作的响应,以期为季节性干旱频发的背景下如何提高毛竹抗旱能力、科学管理毛竹林地提供理论依据。
1 材料与方法
1.1 试验材料
2016年1月6日将毛竹种子(于2015年10月份,从广西桂林生长健壮的单株毛竹上采集)播种于培养钵中,每盆播10颗种子,出苗率大约40%—50%,最终每盆保留4株实生苗。盆规格为上口直径15.5cm、下口直径11cm、高13.0cm。基质按泥炭∶珍珠岩∶蛭石按1∶1∶1比例混合,pH值在5.5—6.0之间,并混入复合肥为底肥,每20盆为一组。置于浙江农林大学智能实验楼的栽培室中进行培育(30°23′N,119°72′E),日温/夜温为(23±2)℃/(17±2)℃,湿度为45%—70%,进行常规的水肥管理。待毛竹生长健壮稳定后,于2016年7月9日选取生长一致(实生苗平均株高达到15cm)的盆栽实生苗进行试验。试验中所用的PP333(纯度99%),由上海生物工程有限公司生产,该处理溶液均现配现用。
1.2 试验设计
试验采用随机区组设计,试验设2个多效唑浓度,分别为0mg/L(P1)、40mg/L(P2);设3个水分梯度,分别为75%相对田间持水量(W1)、50%相对田间持水量(W2)、35%相对田间持水量(W3),共6个处理,分别记作P1W1(0mg/L,75%)、P1W2(0mg/L,50%)、P1W3(0mg/L,35%)、P2W1(40mg/L,75%)、P2W2(40mg/L,50%)、P2W3(40mg/L,35%),其中P1W1为对照组。盆栽毛竹幼苗于7月9日到7月12日每天下午17:00,分别用100mL浓度为40mg/L多效唑根施处理,对照加等量的水,每处理设5个重复,每重复4盆竹苗,共计120盆竹苗。通过称重法每天确定土壤含水量,7月19日盆栽苗基质含水量达到中度干旱(土壤含水量占相对田间持水量45%—50%),7月24日盆栽苗基质含水量达到重度干旱(土壤含水量占相对田间持水量30%—35%),采用称重法控制土壤水分,保持盆栽苗基质含水量在中度和重度干旱下,于每天的18:00对整盆竹苗进行称重并补充水分使之达到相应的处理标准。于8月14日测定毛竹幼苗叶片光合参数,8月15日7:00采集从上往下第2—3节位成熟叶片,测定叶绿素含量,根叶里的可溶性总糖、淀粉、氮、蔗糖、果糖含量等生理生化指标。9月15号8:00,每个处理选取5株未采集过叶片的完整植株测定全株的生物量。
1.3 测定方法
1.3.1叶绿素含量测定采用直接浸提法[26]
1.3.2光合参数的测定
选择晴朗的天气,采用Li- 6400XT便携式光合测定系统(美国Li-cor公司;测定毛竹叶片的气体交换参数),测定时选用标准叶室(表面积6cm2,含内置PAR传感器)。光合有效辐射(PAR)设定为1000μmol m-2s-1、CO2浓度(Ca)为450μmol/mol、流速为500μmol/s、温度设定为(29±1)℃。主要测定和计算指标:净光合速率Pn(μmol m-2s-1)、气孔导度Gs(mmol m-2s-1)、胞间CO2浓度Ci(mmol/mol)蒸腾速率Tr(mmol m-2s-1)、气孔限制值Ls、水分利用效率WUE(μmol/mmol)等。测定前用1000μmol m-2s-1光强对叶子进行光诱导,时间控制在15min左右,稳定后读数,重复五次,取平均值作为测定结果。
1.3.3根系活力测定采用TTC法[27]
1.3.4毛竹叶片和根系可溶性糖含量采用蒽酮比色法测定[28]、淀粉含量采用蒽酮比色法测定[29]
1.3.5碳氮比=(可溶性糖+淀粉含量)/全氮含量[30],N含量采用凯氏定氮法测定植株全氮含量[31]
1.3.6果糖含量、蔗糖含量,采用苏州科铭生物技术有限公司的试剂盒。
1.4 数据分析
采用Microsoft Office Excel 2007等软件进行试验数据的整理及计算,采用SPSS分析软件对数据进行统计分析,采用Sigmaplot 12.5作图。
2 结果与分析
2.1 多效唑对干旱胁迫下毛竹光合色素的影响
由表1可知,随着干旱程度的加深,光合色素含量显著下降(P<0.05),在重度干旱P1W3达到最小值,多效唑显著提高了其含量(P<0.05),在P2W1达到最大值。施加外源PP333显著增加了叶绿素a含量,P2W3较P1W1提高10.2%,P2W1较P1W1提高15.4%;显著增加了叶绿素b含量,P2W1比P1W1提高74.3%;显著增加了胡萝卜含量,P2W3较P1W3提高40.8%;显著增加了叶绿素总含量,P2W3较P1W3提高35.9%,P2W1较P1W1提高35.4%。干旱和多效唑对毛竹实生苗叶片的光合色素含量具有显著的交互作用,干旱提升了多效唑的效应。
2.2 多效唑对干旱胁迫下毛竹实生苗气体交换参数的影响
由表2可知,随着干旱程度的加深,气体交换参数值显著下降(P<0.05),在重度干旱P1W3达到最小值,多效唑显著提高了其含量(P<0.05)。施加外源PP333显著提高毛竹实生苗Pn,重度干旱下提高幅度最大,达到146.9%;显著提高Gs,P2W2较P1W2提高53.7%,P2W3较P1W3提高157.9%;显著提高Ci,P2W2较P1W2提高22.0%,P2W3较P1W3提高68.6%;显著提高Tr,P2W1较P1W1提高16.9%,P2W2较P1W2提高40.7%,P2W3较P1W3提高110.1%;显著提高WUE,在P2W1达到最大值,P1W3下最小值。多效唑显著降低Ls,在P2W1达到最小值,在重度干旱下P1W3达到最大值。干旱和多效唑对毛竹实生苗叶片的气体交换参数具有显著的交互作用,干旱提升了多效唑的效应。
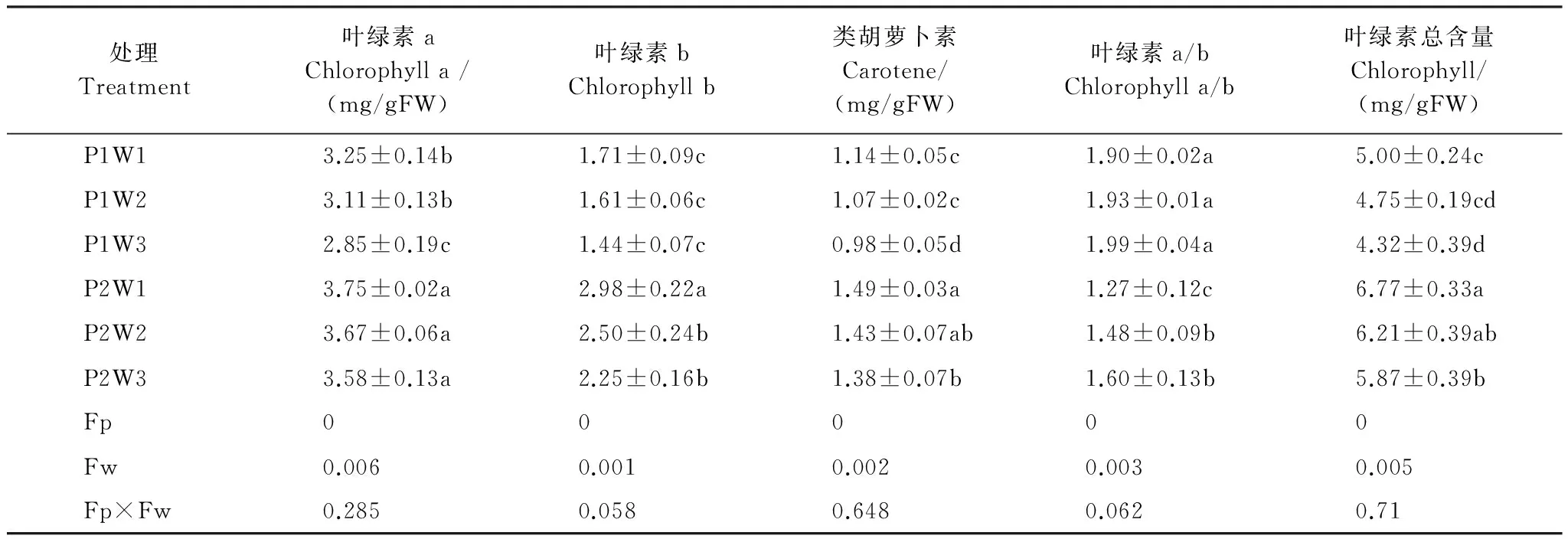
表1 多效唑对干旱胁迫下毛竹实生苗光合色素的影响
P1:0mg/L多效唑浓度,0mg/L level of PP333treatment;P2:40mg/L多效唑浓度,40mg/L level of PP333treatment;W1:75%相对田间持水量,well-watered with 75% field capacity;CK;W2:50%相对田间持水量,中度干旱water stress with 50% FC;W3:35%相对田间持水量,重度干旱water stress with 35% FC。表中误差值为平均值的标准差,n=5;小写字母表示该指标在同一次测定时不同处理之间是否具有显著差异(P<0.05)
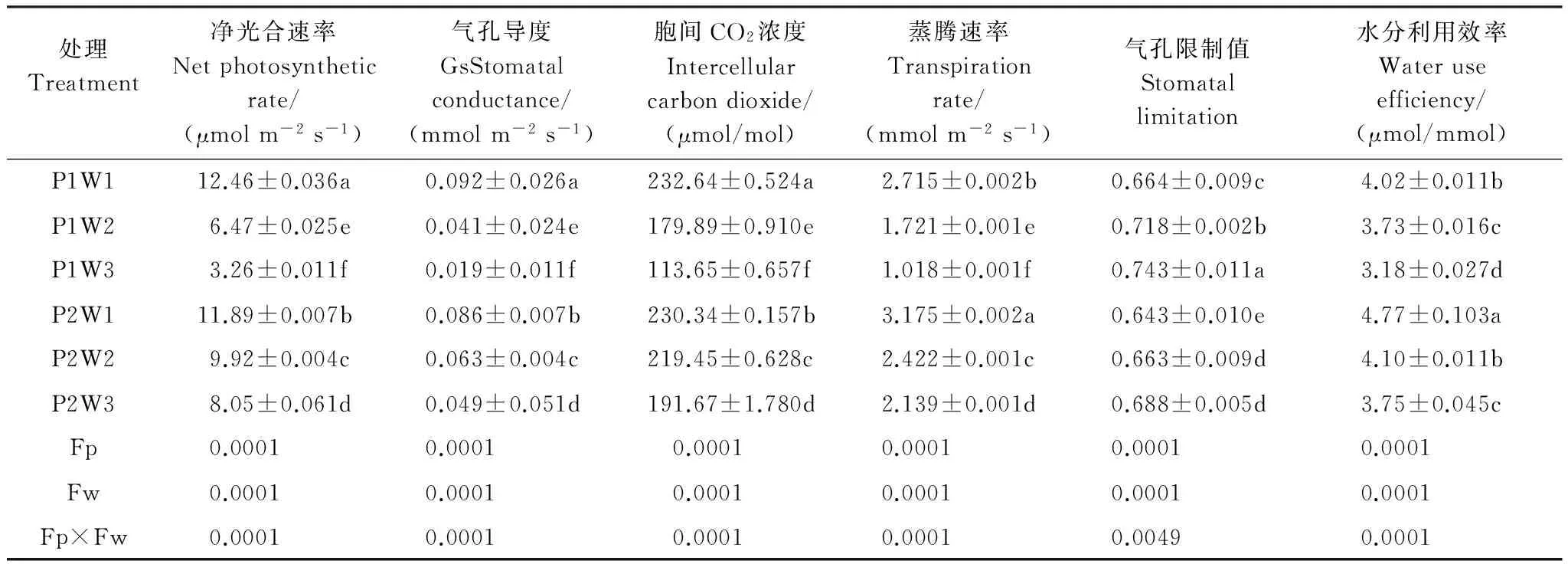
表2 多效唑对干旱胁迫下毛竹实生苗气体交换参数的影响
FP:多效唑处理间差异,differences in PP333treatment; Fw:干旱处理间差异,differences in drought treatment
2.3 多效唑对干旱胁迫下毛竹实生苗根系活力的影响
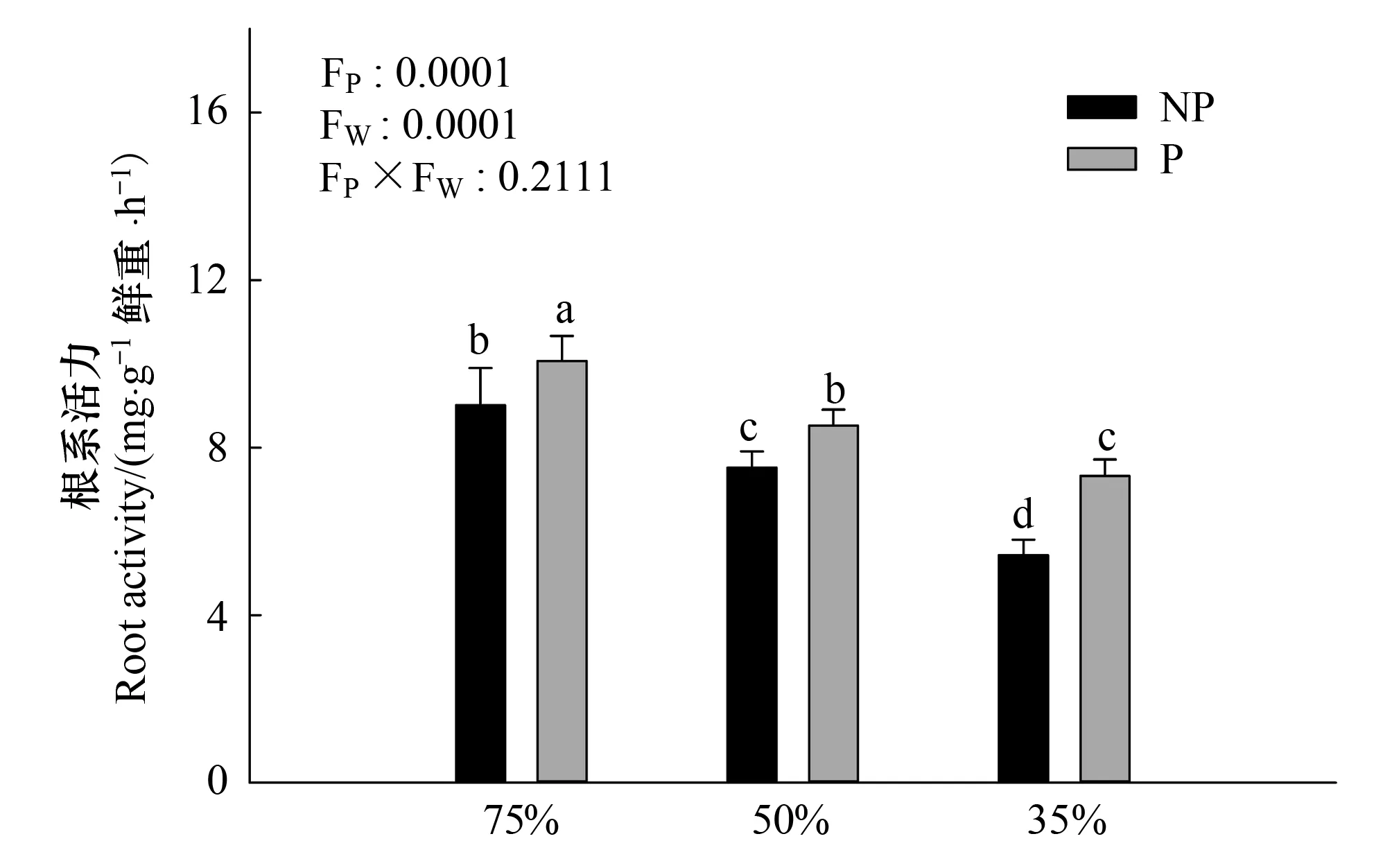
图1 多效唑对干旱胁迫下毛竹实生苗根系活力的影响 Fig.1 The influence of PP333 on root activity of Phyllostachys edulis′ seedlings under drought stressNP:不加多效唑处理,the treatment without PP333;P:加多效唑处理,the treatment with PP333;FP:多效唑处理间差异,differences in PP333 treatment; FW:干旱处理间差异,differences in drought treatment;图中小写字母表示该指标在同一次测定时不同处理之间是否具有显著差异(P<0.05)
由图1可知,随着干旱程度的加深,根系活力显著减弱(P<0.05),在重度干旱情况下,根系活力最弱。相对来说,施加PP333后,显著提高了根系活力,中度干旱情况下多效唑处理与正常供水处理差异不显著(P>0.05),重度干旱下,多效唑提高根系活力的幅度最大,达到34.8%。干旱和多效唑对毛竹实生苗叶片的根系活力的影响具有显著的交互作用,干旱提升了多效唑的效应。
2.4 多效唑对干旱胁迫下毛竹苗非结构碳水化合物的影响
碳水化合物在自然界中分布十分广泛,且含量丰富,是植物光合作用的主要产物,也是植物维持生命活动的基础物质[32],按照其存在形式,可分为结构性碳水化合物(structural carbohydrate,SC)和非结构性碳水化合物(non-structure carbohydrate,NSC),结构性碳水化合物主要包括木质素和纤维素,是植物形态建成的主要物质;非结构性碳水化合物主要包括果糖、蔗糖、淀粉、葡萄糖等参与植物生命代谢的重要物质。
2.4.1多效唑对干旱胁迫下毛竹苗可溶性总糖含量的影响
由图2可知,随着干旱程度的加深,毛竹叶片可溶性总糖含量显著增加(P<0.05),在重度干旱P2W3下达到最大值3.41mg/g,施加PP333显著增加溶性总糖的含量,在P1W1下达到最小值2.28mg/g;根系中可溶性总糖含量与叶片中变化趋势一致。干旱和多效唑对毛竹实生苗叶片以及根系中可溶性总糖含量具有显著的交互作用,干旱提升了多效唑的效应。
2.4.2多效唑对干旱胁迫下毛竹苗淀粉含量的影响
由图3可知,随着干旱程度的加深,毛竹叶片淀粉含量显著下降(P<0.05),在P1W3达到最小值,施加PP333显著提高了淀粉含量(P<0.05),在P2W1达到最大值31.36mg/g,在中度干旱下淀粉含量的下降幅度最大,达到26.9%;根系中淀粉含量与叶片中变化趋势一致。干旱和多效唑对毛竹实生苗叶片以及根系中淀粉含量具有显著的交互作用,干旱提升了多效唑的效应。
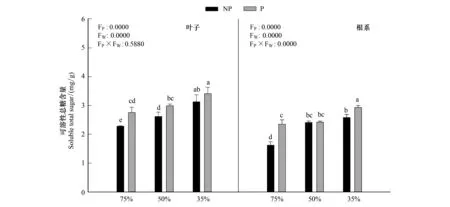
图2 多效唑对干旱胁迫下毛竹实生苗可溶性总糖含量的影响Fig.2 The influence of PP333 on soluble total sugar of Phyllostachys edulis′ seedlings under drought stress图中小写字母表示该指标在同一次测定时不同处理之间是否具有显著差异(P<0.05)
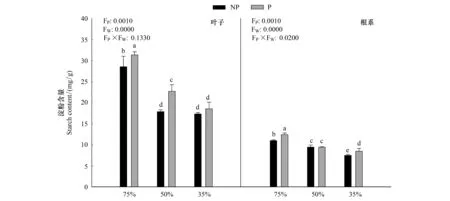
图3 多效唑对干旱胁迫下毛竹实生苗淀粉含量的影响Fig.3 The influence of PP333 on starch content of Phyllostachys edulis′ seedlings under drought stress
2.4.3多效唑对干旱胁迫下毛竹苗蔗糖含量的影响
根据图4可知,随着干旱程度的加深,叶片中蔗糖含量显著增加(P<0.05),在重度干旱下,施加PP333后,蔗糖含量显著增加(P<0.05),P2W3较P1W3上升24.0%,P2W3较P2W1增加40.1%,在重度干旱下,达到最大值P2W3为14.64mg/g;根系中蔗糖含量与叶片中变化趋势一致。干旱和多效唑对毛竹实生苗叶片以及根系中蔗糖含量具有显著的交互作用,干旱提升了多效唑的效应。

图4 多效唑对干旱胁迫下毛竹实生苗蔗糖含量的影响Fig.4 The influence of PPP333 on sucrose content of Phyllostachys edulis′ seedlings under drought stress
2.4.4多效唑对干旱胁迫下毛竹苗果糖含量的影响
由图5可知,随着干旱程度的加深,毛竹叶片中果糖含量显著上升(P<0.05),在重度干旱下达到最大值P2W3为8.16mg/g,施加PP333后,果糖含量显著增加(P<0.05),在重度干旱下上升幅度最大,P2W3较P2W1上升85.03%;根系中果糖含量与叶片中变化趋势一致。干旱和多效唑对毛竹实生苗叶片以及根系中果糖含量具有显著的交互作用,干旱提升了多效唑的效应。
2.5 多效唑对干旱胁迫下毛竹实生苗碳氮比的影响
由图6可知,随着干旱程度的加深,叶片中碳氮比值显著增加(P<0.05),在重度干旱P1W3下达到最大值0.35,施加PP333后,在中度干旱下,碳氮比值显著降低(P<0.05),其值达到了正常生长下的水平,重度干旱下,碳氮比差异不显著(P>0.05)。干旱和多效唑对毛竹实生苗叶片以及根系中碳氮比的影响具有显著的交互作用,干旱提升了多效唑的效应。
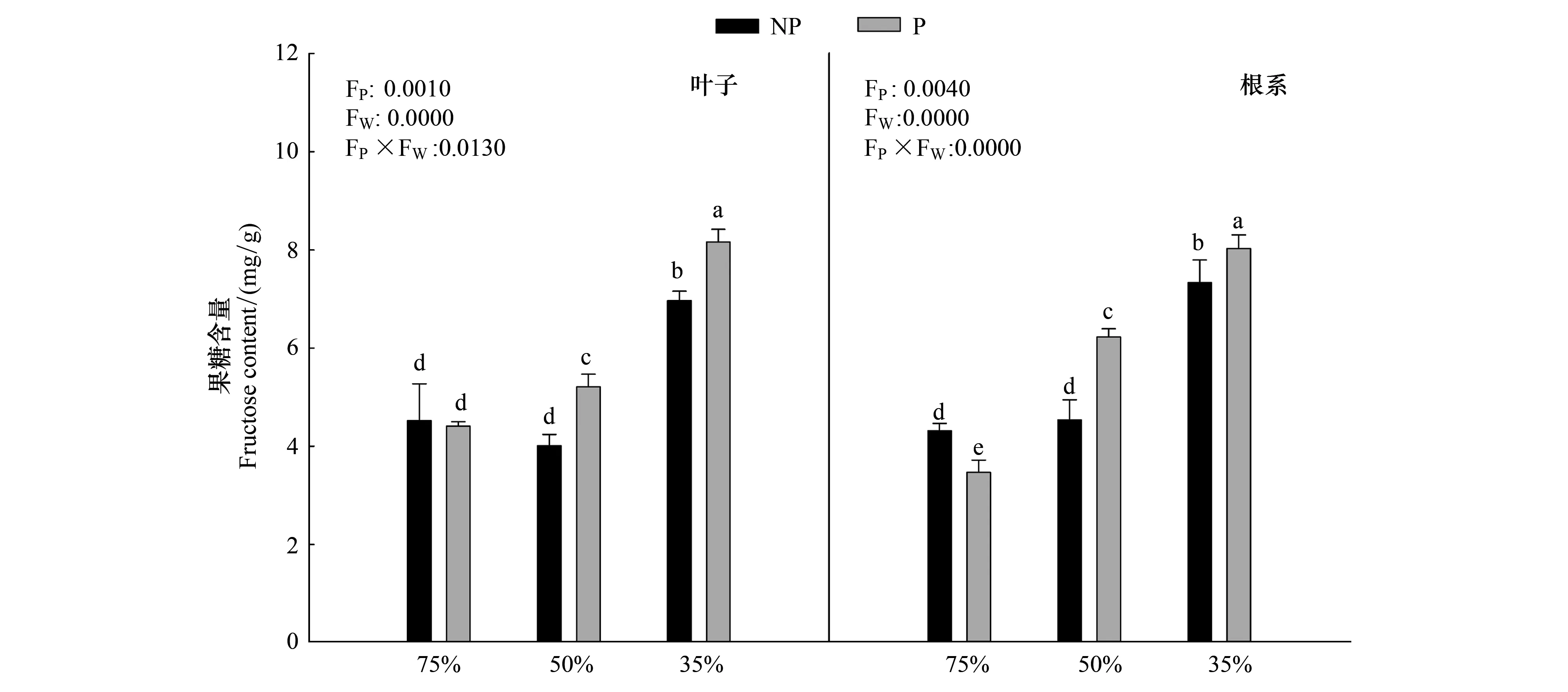
图5 多效唑对干旱胁迫下毛竹实生苗果糖含量的影响Fig.5 The influence of PPP333 on fructose content of Phyllostachys edulis′ seedlings under drought stress图中小写字母表示该指标在同一次测定时不同处理之间是否具有显著差异(P<0.05)
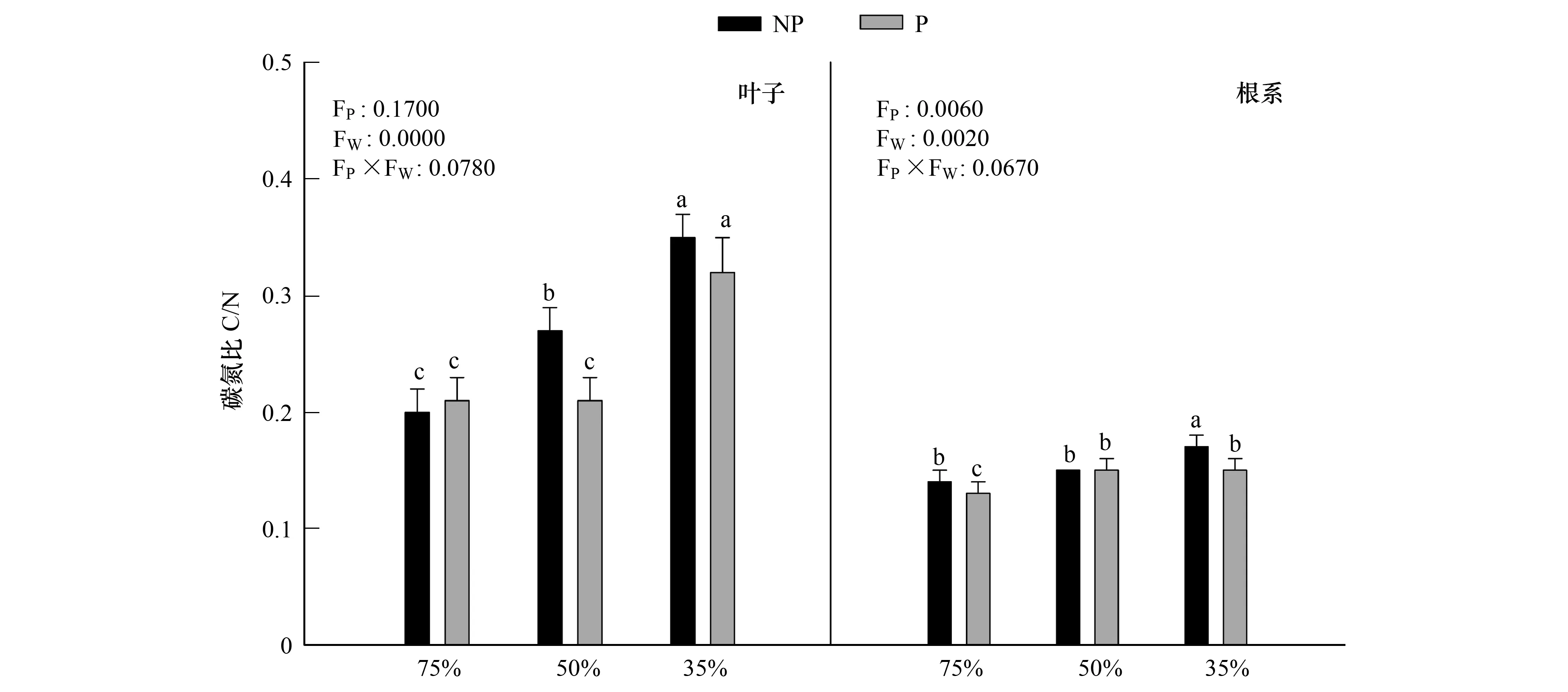
图6 多效唑对干旱胁迫下毛竹实生苗碳氮比的影响Fig.6 The influence of PP333 on C/N of Phyllostachys edulis′ seedlings under drought stress图中小写字母表示该指标在同一次测定时不同处理之间是否具有显著差异(P<0.05)
3 讨论与结论
3.1 多效唑对干旱胁迫下毛竹根系活力和光合特性的影响
植物根系对水分反应敏感,其活力大小直接影响植物对矿质营养和水分的吸收利用,从而对植物的生长发育起决定性作用[33- 35],干旱胁迫会不同程度地影响到作物的各个生理过程,其中光合作用是受到最显著影响的过程之一[36],绿色植物在进行光合作用时,主要通过叶绿体参与光合作用中光能的吸收、传递、分配和转化等过程[37]。在不施加PP333情况下,随着干旱程度加深,根系活力显著减弱,在重度干旱下,根系活力最弱,表明重度干旱胁迫严重影响了毛竹根系对矿质营养和水分的吸收能力,并导致植物内部代谢紊乱,与吴敏等在栓皮栎幼苗根系中的研究结果一致[38];叶绿素a、类胡萝卜素、总叶绿素含量显著下降,叶绿素b、叶绿素a/b无显著变化,Pn、Gs、Ci、Tr、WUE显著下降,Ls显著上升,表明由于气孔因素(气孔关闭引起CO2供应受阻)[39],干旱胁迫下Gs较小,通过气孔进入叶肉细胞的CO2减少,以至于Ls较高,这与李泽等在油桐幼苗上的研究结果一致[40]。在40mg/L的PP333处理下(P2),随着干旱程度加剧,根系活力显著减弱,但下降幅度显著缩小[38];叶绿素a无显著变化,叶绿素b、类胡萝卜素、叶绿素总含量显著下降,叶绿素a/b显著上升,Pn、Gs、Ci、Tr、WUE显著下降,Ls显著上升,表明多效唑缓解干旱下植物蒸腾速率的下降、气孔的收缩、气孔导度降低、保持CO2向叶绿体内输送,进而保持植物叶片正常的光合作用和蒸腾作用[14]。在不同干旱程度下,毛竹实生苗的根系活力、光合色素、气体交换参数对PP333的响应规律不同,在正常水分处理下(W1),PP333处理显著提高了根系活力,在P2W1下达到最大值;显著提高了光合色素,叶绿素a/b显著下降,叶绿素总含量在P2W1下达到最大值,Pn、Gs、Ci、Ls显著下降,Tr、WUE显著上升,表明说明多效唑能有效提高干旱胁迫下毛竹实生苗的光合同化能力,这与高玲等(2008)在草坪草的研究一致,水分利用效率是植物光合和蒸腾特性的综合反映,WUE提高,说明植物对水分利用比较充分、抗旱性较强,是植物在逆境环境下长期进化的一种自我保护机制[41]。在中度干旱处理下(W2),PP333处理显著提高了根系活力,提升幅度较小;显著提高了光合色素,叶绿素a/b显著下降,Pn、Gs、Ci、Tr、WUE显著上升,Ls显著下降,表明施加外源PP333显著增加了各参数水平。在重度干旱处理下(W3),PP333处理后,根系活力显著提高,提高幅度最大;光合色素显著提高,叶绿素a/b在P1W3处理下达到最大值,Pn、Gs、Ci、Tr、WUE显著上升,Ls显著下降,由于光合机构活性破坏降低叶肉细胞中的Ci未能及时同化固定,从而使叶肉细胞中的CO2浓度积累增加,因此Ls逐渐降低。
3.2 多效唑对毛竹干旱胁迫下NSC和C/N的影响
非结构性碳水化合物(NSC)主要包括蔗糖、淀粉、果糖等参与植物生命代谢的重要物质,是植物体内最主要的渗透调节物质[42],其分配格局是多种生态生理过程作用的综合结果[43],与植物的生存策略密切相关[44],氮是重要的非矿质元素,对维持叶绿素含量和提高叶片光合具有重要作用[45],碳氮代谢是植物最基本的代谢过程,氮代谢需要碳代谢提供能量,而碳代谢需要氮代谢提供光合色素(碳氮比是光合产物分配方向的重要指标)[10]。本研究发现,在PP333处理后,毛竹实生苗的非结构性碳水化合物含量、碳氮比对干旱程度加深的响应规律不同,在0mg/L的PP333处理下(P1),随着干旱程度加深,叶片和根系的可溶性总糖、蔗糖、果糖含量显著升高,蔗糖在P1W2、P1W3处理下差异不显著,果糖在P1W1、P1W2处理下差异不显著,叶片及根系里的淀粉含量显著下降,在P1W2、P1W3处理下差异不显著,表明淀粉转化为可溶性糖,生理代谢活动增强,来吸收和运输水分,用于生长需求;叶片及根系里的碳氮比显著上升,但在P1W2、P1W3处理下差异不显著,由于植物的光合同化能力降低,光合产物输出减少,形成了光合作用与呼吸作用之间碳源供应的不平衡,叶片中淀粉水解,糖类等有机物堆积[42],储存于毛竹实生苗体内NSC含量增加,来抵御逆境,导致碳过剩。在40mg/L的PP333处理下(P2),随着干旱程度加深,叶片及根系里的可溶性总糖和果糖含量显著上升,叶子里的蔗糖含量显著上升,根系里的蔗糖含量先下降后升高,叶片及根系里的淀粉含量显著下降,由于可溶性糖更多地参与到形态建成,淀粉发生水解,以补充植物体对可溶性糖的需求;叶片及根系里的碳氮比显著上升。在不同干旱程度下,毛竹实生苗的非结构性碳水化合物含量、碳氮比对PP333的响应规律不同,在正常水分处理下(W1),PP333处理后,叶片及根系里的可溶性总糖、淀粉、蔗糖显著上升,果糖在叶片中的含量差异不显著,在根系中显著下降,由于光合作用的提高,将可溶性糖转化为淀粉,NSC含量增加,施加外源PP333叶片淀粉含量显著增加,分解速度下降,叶片总糖含量显著上升,这结果与郑日如对百合研究[46],陈晓光等在甘薯上的研究一致[47];碳氮比在叶片中差异不显著,在根系中显著下降;在中度干旱处理下(W2),PP333处理后,叶子里的可溶性总糖、淀粉含量下显著增加,根系里无显著变化,果糖在叶片和根系中显著上升,碳氮比在叶片中显著下降,在根系中差异不显著,多效唑显著增加淀粉、糖含量,促进光合作用,提供光合色素含量,显著降低了碳氮比,在中度干旱下,使碳氮比达到正常生长下的毛竹,说明多效唑有利于维护干旱下毛竹实生苗的正常生长。这结果与陈炫等在荔枝上的研究一致[48];在重度干旱处理下(W3),PP333处理后,叶片里的可溶性糖、淀粉含量差异不显著,根系中的含量显著上升,叶片及根系里的蔗糖、果糖含量显著上升,叶片中碳氮比差异不显著,根系中显著下降,光合作用受到抑制,光合产物合成受阻,淀粉加速分解为糖为光合作用提供能量、参与渗透调节,碳升高,叶绿素含量下降,导致氮素含量下降,毛竹叶片以及根系中碳氮代谢显著上升,碳氮比失衡。
综上,干旱胁迫下毛竹实生苗幼苗生长受到显著抑制,主要表现为根系活力减弱,气孔导度降低导致光合能力下降。施加多效唑(PP333)可显著提高毛竹抗旱性,,具体表现为:根系活力显著提高,以获取更多的水分和矿物元素促进毛竹体内营养物质合成和生命活动调节;通过气孔导度调节提升光合能力和水分利用效率,协调碳同化,保持碳氮比平衡同时提高毛竹实生苗体内NSC的储存量进而提升其抗旱能力。
参考文献(References):
[1]Mueller B, Seneviratne S I. Hot days induced by precipitation deficits at the global scale. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(31):12398- 12403.
[2]Naika M, Shameer K, Mathew O K, Gowda R, Sowdhamini R. STIFDB2: an updated version of plant stress-responsive transcription factor database with additional stress signals, stress-responsive transcription factor binding sites and stress-responsive genes in Arabidopsis and rice. Plant and Cell Physiology, 2013, 54(2): e8.
[3]Athar H R, Ashraf M. Strategies for crop improvement against salinity and drought stress: an overview // Ashraf M, Ozturk M, Athar H R, eds. Salinity and Water Stress. Netherlands: Springer, 2008: 1- 16.
[4]Cramer G R, Urano K, Delrot S, Pezzotti M, Shinozaki K. Effects of abiotic stress on plants: a systems biology perspective. BMC Plant Biology, 2011, 11(1): 163.
[5]刘静, 魏开发, 高志晖, 李冰冰, 任慧波, 胡建芳, 贾文锁. 干旱胁迫下氮素营养与根信号在气孔运动调控中的协同作用. 植物学通报, 2008, 25(1): 34- 40.
[6]Paez-Garcia A, Motes C M, Scheible W R, Chen R J, Blancaflor E B, Monteros M J. Root traits and phenotyping strategies for plant improvement. Plants, 2015, 4(2): 334- 355.
[7]Ali M A, Abbas A, Niaz S, Zulkiffa M, Ali S. Morpho-physiological criteria for drought tolerance in sorghum (Sorghumbicolor) at seedling and post-anthesis stages. International Journal of Agriculture & Biology, 2009, 11(6): 674- 680.
[8]Bartels D, Sunkar R. Drought and salt tolerance in plants. Critical Reviews in Plant Sciences, 2005, 24(1): 23- 58.
[9]Zhang Y J, Xie Z K, Wang Y J, Su P X, An L P, Gao H. Effect of water stress on leaf photosynthesis, chlorophyll content, and growth of oriental lily. Russian Journal of Plant Physiology, 2011, 58(5): 844- 850.
[10]蒋思思, 魏丽萍, 杨松, 肖迪, 王晓洁, 侯继华. 不同种源油松幼苗的光合色素和非结构性碳水化合物对模拟氮沉降的短期响应. 生态学报, 2015, 35(21): 7061- 7070.
[11]李东胜, 史作民, 刘世荣,耿丽君. 南北样带温带区栎属树种种子化学组成与气候因子的关系. 生态学报, 2012, 32(24):7857- 7865.
[12]于丽敏, 王传宽, 王兴昌. 三种温带树种非结构性碳水化合物的分配. 植物生态学报, 2011, 35(12):1245- 1255.
[13]李娜妮, 何念鹏, 于贵瑞. 中国东北典型森林生态系统植物叶片的非结构性碳水化合物研究. 生态学报, 2016, 36(2):430- 438.
[14]高玲, 刘国道. 植物生长调节剂——多效唑在草坪草上的应用进展. 热带农业科学, 2008, 28(4): 98- 102.
[15]刘静雅, 李绍才, 孙海龙, 宋海凤, 陈艳华. 多效唑对紫穗槐生长及生理特性的影响. 植物科学学报, 2016, 34(2): 271- 279.
[16]杨忠义, 范春晖, 郭平毅. 氮肥与多效唑对冬小麦叶片生理功能的调控. 植物营养与肥料学报, 2008, 14(5): 947- 950.
[17]毛轶清, 郑青松, 陈健妙, 刘兆普, 刘国红, 姜超强. 喷施多效唑提高麻疯树幼苗耐盐性的生理机制. 生态学报, 2011, 31(15): 4334- 4341.
[18]唐凤德, 蔡天革, 韩士杰, 黄丽荣. 生物制剂对沙地樟子松苗木成活生长及生理特征的影响. 生态学报, 2009, 29(5): 2294- 2303.
[19]宋海凤, 李绍才, 孙海龙, 刘静雅, 陈艳华. 根施不同浓度多效唑对紫穗槐生长特性和相关生理指标的影响. 植物生理学报, 2015, 51(9): 1495- 1501.
[20]吕双庆, 李生秀. 多效唑对旱地小麦一些生理、生育特性及产量的影响. 植物营养与肥料学报, 2005, 11(1): 92- 98.
[21]王竞红, 多多. 多效唑对6种草坪草苗期抗旱性影响的研究. 草业学报, 2014, 23(6): 253- 258.
[22]McCann S E, Huang B R. Effects of Trinexapac-ethyl foliar application on creeping bentgrass responses to combined drought and heat stress. Crop Science, 2007, 47(5): 2121- 2128.
[23]McCann S E, Huang B R. Drought responses of Kentucky bluegrass and creeping bentgrass as affected by abscisic acid and Trinexapac-ethyl. Journal of the American Society for Horticultural Science, 2008, 133(1): 20- 26.
[24]Chan Z L, Shi H T. Improved abiotic stress tolerance of bermudagrass by exogenous small molecules. Plant Signaling & Behavior, 2015, 10(3): e991577.
[25]庄若楠, 金爱武. 施肥对毛竹秆型特征的影响. 中南林业科技大学学报, 2013, 33(1): 80- 84.
[26]邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2000.
[27]程兆伟, 邹应斌, 刘武. 水稻根系研究进展. 作物研究, 2006, 20(5): 504- 508.
[28]张振清. 植物生理学试验手册. 上海: 上海科学技术出版社, 1985: 134- 138.
[29]姜东, 于振文, 李永庚, 余松烈, 孔兰静. 高产小麦营养器官临时贮存物质积运及其对粒重的贡献. 作物学报, 2003, 29(1): 31- 36.
[30]Breeman A M. Relative importance of temperature and other factors in determining geographic boundaries of seaweeds: experimental and phenological evidence. Helgoländer Meeresuntersuchungen, 1988, 42(2): 199- 241.
[31]鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 1999.
[32]雷美玉, 李辉亮, 刘立元, 彭世清. 糖在植物中的感知与信号传导研究进展.西北植物学报, 2007, 27(10): 2118- 2127.
[33]卫星, 王政权, 张国珍,陈海波,王婧. 水曲柳苗木不同根序对干旱胁迫的生理生化反应. 林业科学, 2009, 45(6):16- 21.
[34]李香玲, 冯跃华.水稻根系生长特性及其与地上部分关系的研究进展. 中国农学通报, 2015, 31(6): 1- 6.
[35]Hu H H, Xiong L Z. Genetic engineering and breeding of drought-resistant crops. Annual Review of Plant Biology, 2013, 65: 715- 741.
[36]Hosseinzadeh S R, Amiri H, Ismaili A. Effect of vermicompost fertilizer on photosynthetic characteristics of chickpea (CicerarietinumL.) under drought stress. Photosynthetica, 2016, 54(1): 87- 92.
[37]张栋. 干旱胁迫对苹果光合作用和叶绿素荧光的影响及叶片衰老特性研究[D]. 杨凌: 西北农林科技大学, 2011.
[38]吴敏, 张文辉, 周建云,马闯,韩文娟. 干旱胁迫对栓皮栎幼苗细根的生长与生理生化指标的影响. 生态学报, 2014, 34(15):4223- 4233.
[39]裴斌, 张光灿, 张淑勇,吴芹,徐志强,徐萍. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响. 生态学报, 2013, 33(5):1386- 1396.
[40]李泽, 谭晓风, 卢锟,张琳,龙洪旭,吕佳斌,林青. 干旱胁迫对两种油桐幼苗生长、气体交换及叶绿素荧光参数的影响. 生态学报, 2017, 37(5):1515- 1524.
[41]李磊, 贾志清, 朱雅娟, 綦艳林. 我国干旱区植物抗旱机理研究进展. 中国沙漠, 2010, 30(5): 1053- 1059.
[42]熊炳霖. 干旱胁迫下氮素对玉米叶片衰老和叶片碳氮平衡的影响[D]. 北京: 中国科学院研究生院(教育部水土保持与生态环境研究中心), 2016.
[43]王凯, 雷虹, 夏扬,于国庆. 杨树幼苗非结构性碳水化合物对增加降水和氮添加的响应. 应用生态学报, 2017, 28(2):399- 407.
[44]Imaji A, Seiwa K. Carbon allocation to defense, storage, and growth in seedlings of two temperate broad-leaved tree species. Oecologia, 2010, 162(2): 273- 281.
[45]张立军, 刘新. 植物生理学(第二版). 北京: 科学出版社, 2011.
[46]郑日如. 生长延缓剂对东方百合植株生长和鳞茎养分代谢的影响研究[D]. 杭州: 浙江大学, 2011.
[47]陈晓光, 李洪民, 张爱君, 史新敏, 唐忠厚, 魏猛, 史春余. 不同氮水平下多效唑对食用型甘薯光合和淀粉积累的影响. 作物学报, 2012, 38(9): 1728- 1733.
[48]陈炫, 陶忠良, 吴志祥, 周兆德, 王令霞. 多效唑+乙烯利对妃子笑荔枝内源激素及碳氮营养的影响. 江西农业大学学报, 2012, 34(1): 27- 33.
