车前草干、鲜品提取物有效成分含量的对比研究*
2018-04-18李剑琦刘宇政余承欢曾飞冷红文杨慧郭新秀
李剑琦 ,刘宇政 ,余承欢 ,曾飞 ,冷红文 ,杨慧 ,郭新秀
(1、江西省医学科学院,南昌 330006;2、南昌大学第四附属医院,南昌 330003)
车前草为车前科植物车前 (Plantago asiatica L)或平车前(Plantago degresa Willd)干燥全草,车前草主要含有熊果酸、齐墩果酸、桃叶珊瑚苷、黄酮类化学成分,具有祛痰、止咳、利尿等作用,临床上常用于治疗水肿,淋病,肺热咳嗽[1],清下焦湿热[2]等症。在我国古今医学典著中均有药物鲜品治疗疾病的记载,如三鲜汤、四生丸等[3],车前草亦常以鲜品应用于中医临床,随着保鲜技术的发展,使得对中药鲜品的研究呈上升趋势,而中药鲜品和干品其有效成分和药理作用往往会有所不同[4],因此对于车前草鲜品有必要进行更深入的研究。熊果酸作为车前草的一个主要成分,具有护肝、抗肿瘤,可明显改善肝纤维化大鼠的肝功能[5];总黄酮作为已被认可的具有生物活性的物质。本文通过以车前草中主要成分熊果酸和总黄酮为指标,探讨车前草鲜品干品的成分差别,为进一步拓展车前草鲜品的利用,提高车前草制剂的质量提供参考。
1 材料与方法
1.1仪器和试药DIONEX UltiMate 3000型高效液相色谱仪 (美国赛默飞科技公司):DAD二极管阵列检测器;UV5800紫外分光光度计 (上海元析仪器有限公);KQ-500E型超声波清洗器 (昆山市超声仪器公司);RE-52AA型旋转蒸发仪 (上海亚荣生化仪器厂);芦丁对照品(批号:20161111,纯度98.0%,北京坛墨质检科技有限公司);熊果酸对照品(批号:20160705,纯度98.1%,北京坛墨质检科技有限公司);乙腈(色谱纯,美国Fishier试剂公司);其他试剂均为分析纯,液相用水为纯化水。车前草药材采集于赣州,鲜品到干品的质量比为5.02。
1.2提取物的制备[6,7]
1.2.1鲜品提取物的制备称取洗净晾干水分的新鲜车前草2kg,粉碎,第一次加4800ml的60%乙醇超声提取1h,过滤,药渣再加入3200ml的60%乙醇超声提取1h,过滤,合并两次提取液,旋转蒸发至干,放入60℃烘箱烘干,粉碎,即得。
1.2.2干品提取物的制备称取洗净晾干水分的新鲜车前草2kg,置于60℃烘箱中至干燥,粉碎药材,取药材粉末,提取方法同1.2.1。
1.3熊果酸含量的测定与结果
1.3.1色谱条件Kromasil C18(4.6mm×250mm,5μm)色谱柱;流动相:甲醇:乙腈:0.2%磷酸水(40:50:10);流速:1ml·min-1; 柱温:25℃; 检测波长:210nm;进样量:20μl。 在此色谱条件下,对照品及样品的色谱图如下:
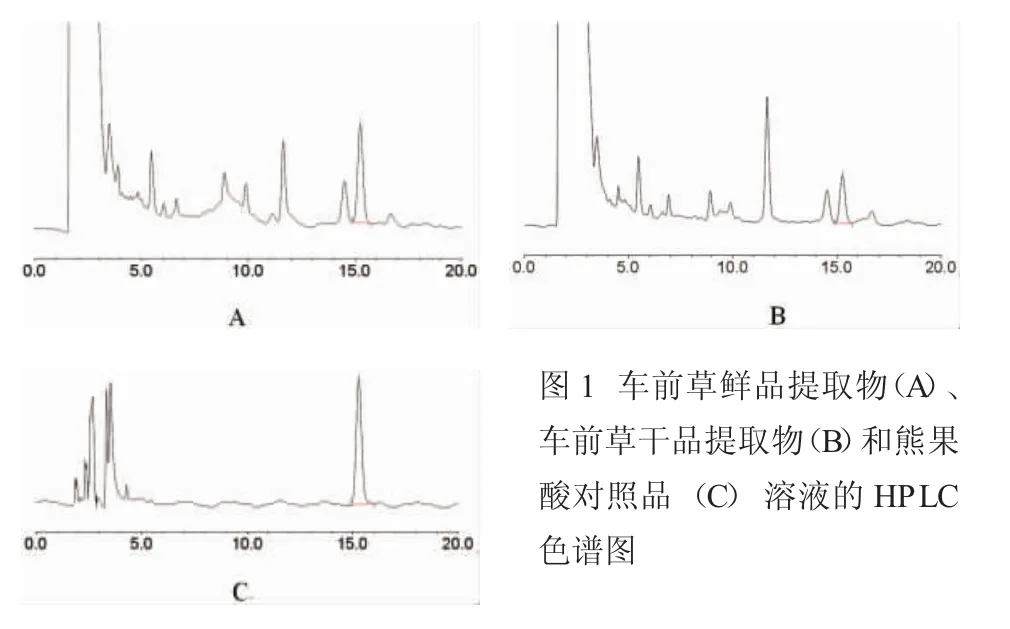
图1 车前草鲜品提取物(A)、车前草干品提取物(B)和熊果酸对照品(C)溶液的HPLC色谱图
1.3.2对照品溶液的制备精密称取熊果酸对照品溶液10.89mg,至10ml量瓶中,用甲醇稀释至刻度,摇匀;精密量取1ml,至10ml量瓶中,用甲醇稀释至刻度,摇匀,得每1ml含108.9μg的熊果酸对照品溶液。
1.3.3供试品溶液的制备精密称取车前草鲜药和干药提取物浸膏粉末各0.2g,置50ml量瓶中,加80%甲醇超声使溶解,用80%甲醇稀释至刻度,摇匀,过滤,取续滤液即得。
1.3.4线性关系考察分别精密量取对照品贮备液0.2、0.4、0.8、1.6、2.0ml,置 10ml量瓶中,加入 80%甲醇稀释至刻度,即得浓度为1.995、3.991、7.981、15.96、19.95μg·ml-1的熊果酸对照品溶液, 按“1.3.1”项色谱条件进行测定,以对照品浓度为横坐标(C),峰面积为纵坐标(A),进行回归分析,制定标准曲线,得回归方程为:A=0.1703C+0.0456(r=0.9999),表明熊果酸在 1.995-19.95μg·ml-1浓度范围内线性关系良好。
1.3.5精密度试验取15.963μg·ml-1熊果酸对照品溶液,按“1.3.1”项色谱条件连续进样6次,测定峰面积。计算的平均峰面积的RSD=0.95%,表明本条件精密度良好。
1.3.6重复性试验取同一批车前草鲜药提取物,平行制备6份供试品溶液,按“1.3.1”项色谱条件进行进样分析,测定峰面积,计算熊果酸的平均含量为 2.980mg·g-1,RSD=1.40%,表明该方法的重复性良好。
1.3.7稳定性试验取车前草鲜药提取物,制备供试品溶液,分别在 0、2、4、6、8、24h 时精密量取20μl注入液相色谱仪,计算峰面积的RSD=1.6%,表明该样品溶液在24h内稳定性良好。
1.3.8加样回收率试验精密称取已知含量的车前草鲜药提取物约0.1g,共6份,按1:1加入熊果酸对照品,按“1.3.3”项下方法制备供试品溶液并测定,计算回收率。熊果酸的平均加样回收率为99.09%,RSD为1.0%。结果表明,熊果酸回收率符合要求,测定方法可行。结果见表1。
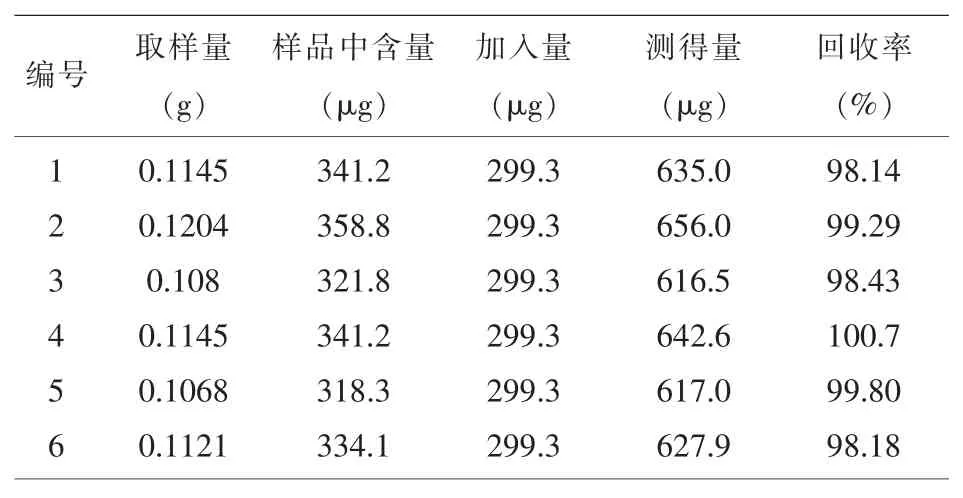
表1 熊果酸加样回收率试验结果
1.3.9样品的测定取车前草鲜药及干药提取物各0.2g,精密称定,制备供试品溶液,分别精密吸取对照品溶液与供试品溶液各 20μl,按““1.3.1”项色谱条件测定,采用标准曲线法计算样品中熊果酸的含量。结果:车前草鲜品提取物的含量为2.980mg·g-1;车前草干品提取物的含量为 1.479mg·g-1。
1.4总黄酮的含量测定与结果[8]
1.4.1芦丁对照品溶液的制备精密称取芦丁对照品12.51mg,置100ml量瓶中,加60%乙醇溶液使溶解并稀释至刻度,摇匀,即得0.1201mg·ml-1对照品溶液。
1.4.2供试品溶液的制备称取车前草鲜品或者干品提取物0.1g,精密称定,置100ml量瓶中,加60%乙醇超声15min使溶解,放冷,用60%乙醇稀释至刻度,摇匀,过滤,取续滤液,即得供试品溶液。
1.4.3供试品溶液的测定精密量取供试品溶液2ml,置10ml量瓶中,分别加入5%亚硝酸钠溶液0.3ml摇匀,静置6min;再加10%硝酸铝溶液0.3ml,摇匀,静置6min,再加入4%氢氧化钠溶液4ml,用60%乙醇稀释定容刻度,摇匀,静置12min,以60%乙醇溶液作空白,于510nm处测吸光度,计算浸膏中总黄酮的含量。
1.4.4标准曲线的制备精密量取对照品液0、0.5、1、2、3、4、5ml分别置于 10ml容量瓶中, 分别加入5%亚硝酸钠溶液0.3ml摇匀,静置6min;再加10%硝酸铝溶液0.3ml,摇匀,静置6min,再加入4%氢氧化钠溶液4ml,用70%乙醇稀释定容至10ml刻度线,摇匀,静置12min,以60%乙醇溶液作空白,于510nm处测吸光度。以吸光度(A)为纵坐标,对照品浓度(C)为横坐标,绘制标准曲线,得回归方程为 A=0.0121C+0.0094(r=9998),芦丁在 6.01-60.05 μg·ml-1与吸光度线性关系良好。
1.4.5精密度试验取对照品溶液3ml,置于10ml容量瓶中,照“1.4.4”项下方法,自“加入5%亚硝酸钠溶液0.3ml”起,依法测定吸光度,同份显色样品;连续测定6次,计算RSD=0.12%,结果显示精密度良好。
1.4.6重复性试验取车前草鲜品提取物0.1g,共称取6份,照“1.4.2”项下方法制备供试品溶液,精密量取2ml置10ml量瓶中,照“1.4.3”项下方法,测定吸光度,结果6份样品中总黄酮含量的RSD为1.58%,说明样品的重复性良好。
1.4.7稳定性试验取重复性项下的供试品溶液,在室温下分别放置0、30、60、120分钟,测定吸光度,计算各吸光度的相对标准偏差RSD=0.91%,说明样品的稳定性良好。
1.4.8加样回收率试验精密称取已知含量的车前草鲜药提取物约50mg,共6份按1:1加入芦丁对照品,按“1.4.2”项下方法制备供试品溶液,照“1.4.3”项下方法进行测定,计算回收率。芦丁的平均加样回收率为99.26%,RSD为1.4%。结果表明,芦丁的回收率符合要求。测定方法可行。结果见表2。
1.4.9样品的测定取车前草鲜品和干品提取物0.1g,精密称定,照“1.4.2”项下方法制备供试品溶液,照“1.4.3”项下方法进行测定,结果:车前草鲜品提取物的含量为167.8mg·g;车前草干品提取物的含量为 128.1mg·g。
2 讨论
本研究中车前草干品为鲜品经烘箱60℃干燥而来,干燥之前的鲜品与鲜品提取物所用鲜品为同一批采购,保证了原材料的一致性,从而保证最后结果的可靠性。对鲜品-干品-干品提取物,干品提取物的得膏率为5.667%;从鲜品-鲜品提取物,鲜品提取物的得膏率为5.769%,表明鲜品提取物和干品提取物的得膏率基本一致。
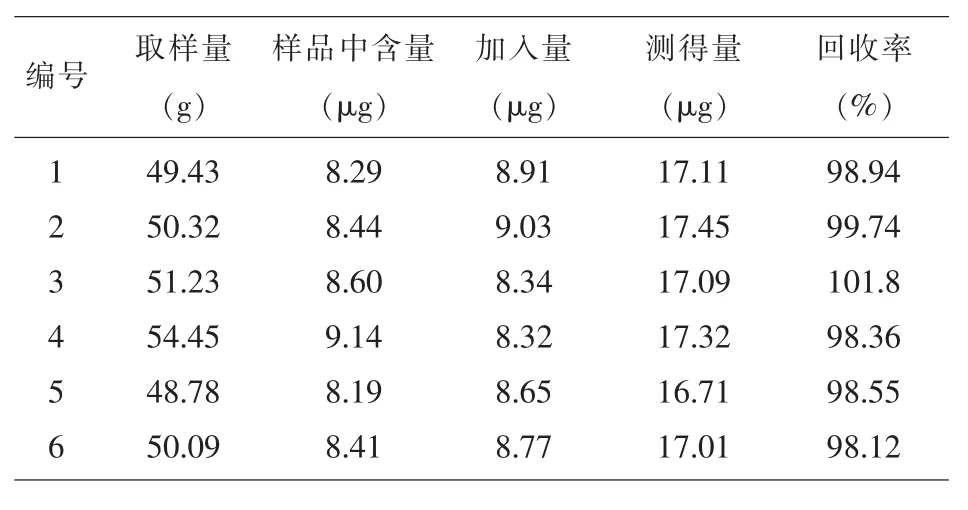
表2 芦丁加样回收率试验结果
在对车前草提取物中熊果酸的含量进行测定时,用纯甲醇处理提取物,提取物不易溶散,从而使熊果酸提取不完全,经过多次试验,采用80%甲醇作为提取溶剂效果较好,故采用80%甲醇处理提取物。
从实验结果看,采用相同的提取工艺,车前草鲜品提取物中熊果酸和总黄酮的含量均高于干品提取物,鲜品提取物中熊果酸含量比干品高了1倍多,鲜品提取物中总黄酮含量比干品高约30%。随着对车前草鲜品研究的深入,以及保鲜技术的发展,可以发掘出车前草鲜品的更多新用途,本实验为合理高效的利用车前草鲜品提供了一定的参考依据。
[1]国家药典委员会.中国人民共和国药典(Ⅰ部)[M].北京:中国医药科技出版社.2015.69.
[2]刘庆晶.龙胆泻肝汤临床应用4例体会[J].江西医药,2010,45(4):346.
[3]李栩筠,王莹,葛明立,等.鲜药、干药四生丸汤液促凝药效研究及成分对比[J].河南中医,2017,37(3):420-422.
[4]郭晓宇,杜捷.鲜药在临床应用优势中的探索[J].中国临床医生杂志,2015,43(9):91-93.
[5]戴颍,朱宣.熊果酸抗实验性大鼠肝纤维化作用机制的研究[J].江西医药,2008,43(5):414-417.
[6]孔涛,范杰平,胡小芳,等.响应面法优化超声辅助提取车前草中的熊果酸[J].食品科学,2015,32(6):80-84.
[7]童声,范杰平,徐薇,等.江西道地药材车前草中总黄酮超声辅助提取研究[J].时珍国医国药,2012,23(3):553-555.
[8]喻帅,李明娟,周娜,等.车前草细粉与超微粉总黄酮提取率的比较[J].广州化工,2015,43(8):74-76.
