218例抗菌药物致药品不良反应报告Δ
2018-04-17郭丽萍陈永妍张寒娟
郭丽萍,陈永妍,张寒娟
(郑州市第七人民医院药学部,河南 郑州 450016)
*药师。研究方向:临床药学。E-mail:guolp882@qq.com
#通信作者:主管药师。研究方向:临床药学。E-mail:zhanghj5605@163.com
抗菌药物是临床应用较为广泛的一类药物,通常用于感染性疾病的治疗及围术期预防性用药。但随着抗菌药物在临床的使用率不断升高,尤其是不合理用药情况,其所致药品不良反应(adverse drug reaction,ADR)的报道也日益增多[1-2]。现对近年来郑州市第七人民医院(以下简称“我院”)上报的抗菌药物致ADR报告进行回顾性分析,总结其发生特点及影响因素,为临床合理使用抗菌药物提供参考依据。
1 资料与方法
2014—2016年我院成功上报至国家ADR监测中心的ADR报告共508例,其中涉及抗菌药物的有218例。采用回顾性分析方法,利用Excel软件分别对218例抗菌药物致ADR报告中患者的性别与年龄、ADR发生时间、给药途径、涉及药品、累及器官和(或)系统、临床表现及临床转归情况等数据进行统计分析,并依照国家ADR监测中心制定的ADR因果关系判断标准进行关联性评价。
2 结果
2.1 ADR报告级别及转归
218例抗菌药物致ADR报告中,新的、严重的ADR 8例,已知、严重的ADR 16例,新的、一般的ADR 37例,已知、一般的ADR 157例。其中,痊愈147例,好转65例,未好转1例,不详5例,未出现死亡病例。
2.2 不同年龄段发生ADR患者的性别分布
218例发生ADR的患者中,男性102例(占46.79%),女性116例(占53.21%),男女比例约为1 ∶1.14;年龄2个月~88岁,各年龄段均有分布,≥60岁者所占比例最高,见表1。

表1 不同年龄段发生ADR患者的性别分布Tab 1 Distribution of patients’ genders at different age groups in ADR cases
2.3 抗菌药物致ADR的发生时间及给药途径分布
218例ADR报告中,发生于用药后>10~30 min的最多,其次为用药后1~24 h内,发生于用药后>7 d的最少;主要给药途径为静脉滴注,其次为口服给药,见表2。
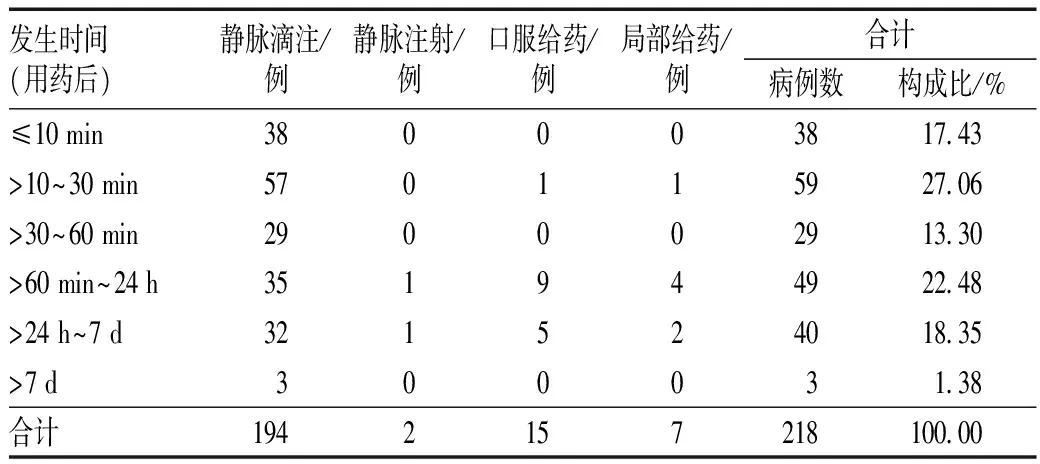
表2 抗菌药物致ADR发生时间及给药途径分布Tab 2 Distribution of occurrence time and administration routes of ADR induced by antibiotics
2.4 ADR涉及抗菌药物种类分布及累及器官和(或)系统
218例ADR涉及抗菌药物共11大类28个品种,主要为氟喹诺酮类,其次为头孢菌素类;引发ADR病例数排序居前3位的药品依次为左氧氟沙星(101例)、阿奇霉素(22例)和头孢曲松(21例);抗菌药物致ADR的临床表现多样,以皮肤及其附件损害最为常见(125例,占57.34%),其次为注射部位损害(51例,占23.39%),见表3。
2.5 严重的ADR涉及的药品、临床表现及转归
218例ADR中,严重ADR 24例(占11.01%)。引起严重的ADR病例数最多的抗菌药物为左氧氟沙星(6例),其次为利奈唑胺(4例);严重的ADR的临床表现主要有血小板计数降低、肝功能异常及过敏性休克等;经停药和对症处理后,痊愈12例,好转12例,见表4。

表3 ADR涉及抗菌药物种类分布及累及器官和(或)系统Tab 3 ADR involved antibiotics categories, organs and(or)systems
3 讨论
3.1 关注抗菌药物致ADR的个体差异
本研究结果显示,218例抗菌药物致ADR报告中,男性患者与女性患者所占比例基本持平,提示性别因素对ADR的发生无显著影响,与相关文献报道基本一致[3-4]。由表1可见,任何年龄段的患者均可出现ADR,≥60岁老年患者数最多,这可能是由于随着年龄的增长,肝肾功能均会出现不同程度的衰退,使药物的代谢速度、排泄过程减慢,容易出现药物蓄积中毒;老年患者脂肪组织增多,血浆蛋白含量减少,血中游离药物浓度升高,更易导致药效过强而出现ADR[5-6]。此外,儿童患者数仅次于老年患者,这可能由于儿童正处于生长发育阶段,机体的各项生理功能还未完全发育成熟,代谢、排泄功能相比于成年人略差,并且儿童的药动学及药效学也有其自身的规律,相较于成人更容易发生ADR[7-8]。因此,应充分考虑儿童和老年患者的个体差异,根据其生理学及药理学特点选择对肝肾功能影响较小的抗菌药物,根据病情适时调整药物剂量,尽量减少和避免严重的ADR发生。

表4 严重的ADR涉及的药品、临床表现及转归Tab 4 Severe ADR involved antibiotics, clinical features and prognoses
3.2 加强患者用药监护及用药教育
由表2可见,218例ADR中,使用抗菌药物后30 min内出现的ADR病例数居首位,57.34%患者的ADR临床表现为皮肤及其附件损害,23.39%的患者出现注射部位静脉炎。调查发现,相当一部分患者出现皮肤及注射部位损害的原因在于用药过程中自行调快静脉滴注速度、未提前告知药物过敏史及护士在使用抗菌药物前后未进行冲管处理等。因此,医护人员应在使用抗菌药物前详细询问患者过敏史及家族史,合理配伍抗菌药物,用药过程中加强巡视观察和药学监护,发现ADR及时处理。针对一些特殊抗菌药物,如具有光敏毒性的氟喹诺酮类药物,应对患者进行耐心、详细的用药教育,告知患者用药期间应避免紫外线照射和长时间暴露于阳光下,减少和避免药物光敏反应的发生。
3.3 选择合适的给药途径,减少ADR的发生
本研究结果显示,我院静脉途径给予抗菌药物所致ADR的病例数最高。由于静脉输液使得药物直接进入血液参与体内循环,故相比于其他给药途径,其引发ADR的风险更高;另外,热原物质超标、不溶物量超标、药物温度过低或过高、药物溶剂的渗透压和pH对血管的刺激等因素均会引发ADR[9-10]。建议临床医师慎重选择静脉途径给予抗菌药物,遵循世界卫生组织倡导的“能口服不肌内注射,能肌内注射不静脉给药”的原则[11],优先选择口服制剂,对于必须静脉途径给药的抗菌药物,应给予合适的剂量、选择正确的溶剂及调节适当的滴注速度,加强对患者的监护,以降低静脉给药风险,提高药物治疗效果。
3.4 规范、合理应用抗菌药物,警惕严重的ADR
抗菌药物是临床上极为重要的治疗药物之一,但其在发挥治疗作用的同时出现的ADR却不容忽视。本研究结果显示,我院氟喹诺酮类和头孢菌素类抗菌药物致ADR病例数合计占比高达64.22%。氟喹诺酮类抗菌药物具有抗菌谱广、抗菌活性强及与其他抗菌药物无交叉耐药等优势,在临床上具有较高的使用率[12]。但由表3可见,我院47.25%的抗菌药物致ADR是由氟喹诺酮类抗菌药物引起的,尤其是左氧氟沙星,大多数患者的临床表现为荨麻疹、注射部位静脉炎及水肿等。研究结果表明,氟喹诺酮类抗菌药物主要采用合成法的制作工艺,容易引入大分子或半抗原,而有些制剂因为稳定性的问题,可能使用了特殊溶剂,这些物质或许更易引起皮肤及附件损害[13]。头孢菌素类抗菌药物引发ADR病例数排序居第2位,主要涉及头孢曲松。头孢曲松为非限制使用级抗菌药物,因其抗菌谱广且半衰期长而在临床上的使用频率较高,但由于头孢菌素类与青霉素类抗菌药物可能具有相同或相似的抗原决定簇,可能会导致交叉过敏现象;且头孢菌素类抗菌药物的内源性杂质如降解产物、自身聚合物等,包括生产过程中引入的外源性杂质,均可引起ADR,因此,随着头孢菌素类抗菌药物使用率的升高,其ADR发生率也日益升高[14]。
ADR虽然不属于不合理用药的范畴,但抗菌药物的不合理应用却是引起ADR的重要因素之一。经过调查,218例ADR报告中,患者原患疾病以上呼吸道感染和泌尿系统感染为主,而上呼吸道感染大多以病毒感染为主,在无充分用药依据的情况下过多地选择广谱抗菌药物,不仅无法达到治疗效果,还会大大增加细菌耐药性和ADR的发生概率[15-16]。我院泌尿系统感染的治疗普遍首选左氧氟沙星,且针对肝肾功能不全的老年患者并未降低给药剂量。由表4可见,左氧氟沙星致严重的ADR最多,共6例,其中3例患者表现为肝功能异常,此外还有呼吸困难、癫痫发作等。美国食品药品监督管理局针对全身使用氟喹诺酮类抗菌药物可能会产生严重的不良反应,要求生产厂家将其更新至药品说明书黑框警告中,对于急性细菌性鼻窦炎、慢性支气管炎急性加重及非复杂性尿路感染患者,使用氟喹诺酮类抗菌药物的严重不良反应风险通常超过患者的获益,仅在无其他治疗方案时方可使用[17]。因此,医护人员应高度警惕严重的ADR,严格把握抗菌药物适应证,避免滥用,根据患者个体差异制订合理的治疗方案,发现ADR及时干预处理,规范、合理应用抗菌药物,以降低ADR的发生风险。
综上所述,抗菌药物致ADR与药物自身因素、患者个体化差异、给药途径及不合理用药等多因素有着紧密联系。在今后的临床工作中,仍需严格执行抗菌药物分级管理制度,遵照《抗菌药物临床应用指导原则(2015年版)》,严格掌握抗菌药物使用指征,不断强化医师合理用药意识,进一步完善ADR监测上报制度,加强药学监护及患者用药教育,积极做好ADR的预防工作,促进合理用药,保障患者用药安全。
[1]杨茵梅,李坤浪,钟伟章,等.98例β-内酰胺类抗菌药物致不良反应[J].中国医院用药评价与分析,2016,16(7):994-996.
[2]李健梅.抗菌药不合理使用导致不良反应分析[J].北方药学,2016,13(9):154-155.
[3]徐国华,李庆,葛红星.我院169例抗菌药物不良反应报告回顾性分析[J].中国医药导报,2010,7(8):122-123.
[4]梁计林.抗菌药物不良反应458例调查[J].中国药物与临床,2016,16(12):1844-1845.
[5]孙言才,刘斌,苏丹,等.12 249例药品不良反应报告中年龄分布的分析评价[J].药物流行病学杂志,2014,23(1):29-34.
[6]吴坚,付瑛.老年临床药物不良反应临床分析及用药安全[J].临床合理用药杂志,2016,9(35):92.
[7]翁小红,尚尔宁.儿科用药不良反应特点研究[J].中国现代药物应用,2016,10(23):136-137.
[8]李洪燕,刘恩梅,谢晓虹.464例儿童药品不良反应/事件特点及其超说明书用药情况分析[J].儿科药学杂志,2017,23(2):29-33.
[9]俞孟洪,周学娟,陈妍.静脉输液中发生药物不良反应的因素及防治对策[J].转化医学电子杂志,2016,3(12):32-33.
[10]陈美清,赵爱真,刘爱平.抗菌药物急诊患者静脉输液用药致不良反应的原因分析与对策[J].抗感染药学,2016,13(5):1019-1021.
[11]朱斌,赵志刚.守护针尖上的安全——中国输液安全与防护专家共识[J].药品评价,2016,13(10):8-17.
[12]梁业飞.喹诺酮类抗菌药物的临床应用研究进展[J].中国现代医生,2015,53(33):153-155,160.
[13]石晖霞,李江华.氟喹诺酮类抗菌药物致不良反应综合性分析[J].中国医院用药评价与分析,2011,11(5):465-468.
[14]吕燕妮,温金华,魏筱华.头孢菌素类药物不良反应机制与化学结构的关系[J].中国医院药学杂志,2015,35(11):1050-1054.
[15]尚旭明,刘芸,王盛华.加强抗菌药物合理应用[J].中华医院感染学杂志,2013,23(1):147-149.
[16]张志强.抗生素所致不良反应及临床合理用药研究[J].医药论坛杂志,2016,37(12):156-157.
[17]国家药品不良反应监测中心.药物警戒快讯[J].中国药物警戒,2016,13(9):575-576.
