STAT3信号通路在人急性单核细胞白血病细胞向树突状细胞分化中的作用及机制探讨
2018-04-11施引朱肖肖张振郭强赵霖魏然孙琳琳尹训强张云虹姜国胜李霞
施引,朱肖肖,张振,郭强,赵霖,魏然,孙琳琳,尹训强,张云虹,姜国胜,李霞
(1济南大学 山东省医学科学院医学与生命科学学院,济南250200;2山东省医学科学院基础医学研究所)
信号转导与转录激活因子3(STAT3)位于人类基因组染色体17(17q21.1)上,为STAT蛋白家族成员。STAT3活化后以磷酸化STAT3(p-STAT3)的形式转移入细胞核调控靶基因的转录,与细胞增殖、分化和凋亡密切相关[1]。白血病患者存在树突状细胞(DC)功能缺陷,是特异性的肿瘤抗原不能有效激发机体特异性抗肿瘤细胞免疫应答的主要因素之一。因此,将白血病细胞诱导生成DC,白血病来源DC既具有抗原提呈功能又同时携带白血病肿瘤抗原,可以更加有效地激发传统细胞毒性T淋巴细胞的杀伤功能[2]。但是,目前细胞因子诱导白血病细胞向DC分化的方法存在诱导效率不高、体内转输效果不稳定等问题,且诱导机制尚不明确[3]。2016年10月~2017年10月,我们通过建立细胞因子诱导白血病细胞向DC分化模型,探讨STAT3信号通路在此过程中的作用,以期进一步阐释白血病来源DC诱导分化机制,为临床治疗提供新的靶点和途径。
1 材料与方法
1.1 材料
人急性单核细胞白血病THP-1细胞购自武汉普诺赛生命科技有限公司,RPMI1640培养液购自美国Biological Industries公司;人重组粒细胞巨噬细胞-集落刺激因子(rhGM-CSF)、人重组白细胞介素4(rhIL-4)购自美国R&D公司,脂多糖(LPS)购自美国Sigma公司,M-MLV购自美国Promega公司;抗人DC表面分子流式抗体: FITC-CD11c、PE-CD80、PECy5-HLA-DR 和APC-CCR7均购自美国eBioscience公司;内参照GAPDH、STAT3、DC分化转录因子E2-2引物由上海Biosune生物技术有限公司合成,引物序列见表1;STAT3、p-STAT3和GAPDH Western blotting抗体均购自美国Cell Signaling Technology公司。

表1 各基因引物序列及产物片段
1.2 实验方法
[1].2.1细胞培养THP-1细胞采用RPMI1640完全培养基(10%胎牛血清、1%双抗,1%丙酮酸钠,0.1%巯基乙醇),于37 ℃、5% CO2细胞培养箱中培养。
[1].2.2诱导分化模型建立取对数生长期的THP-1细胞,调整细胞密度为2.5×105/mL;接种于6孔平底培养板中,分为对照组和观察组,每组3个复孔。观察组培养于含25 ng/mL rhGM-CSF和10 ng/mL rhIL-4的RPMI1640完全培养基,隔日半量加液,第5天加入LPS(1 μg/mL);对照组培养于RPMI1640完全培养基。第7天分别收集两组细胞,用于形态学观察、流式细胞术分析、q-PCR、Western blotting检测。
[1].2.3细胞形态学观察将两组细胞分别置于倒置显微镜下,观察细胞形态变化。
[1].2.4DC表面分子检测收集两组细胞,1×PBS洗2遍(700 g×5 min),去上清;1×PBS重悬细胞至1×106/mL,按照说明书加入FITC-CD11c、PE-CD80、PE-Cy5.5-HLA-DR、APC-CCR7,4 ℃避光孵育30 min;PBS洗2遍,离心去上清;细胞重悬于100 μL 1×PBS,上流式细胞仪检测DC表面标志性分子CD11c及DC表面功能分子(共刺激分子CD80、组织相容性抗原HLA-DR、趋化因子CCR7)。
[1].2.5细胞STAT3、E2-2 mRNA检测采用q-PCR法。收集两组细胞,TRIzol法提取细胞总RNA,紫外分光光度计测定RNA的浓度及纯度;M-MLV反转录成cDNA,UltraSYBR Mixture PCR反应体系扩增,根据获得数据计算2-ΔΔCT值,以此表示STAT3、E2-2 mRNA相对表达量。
[1].2.6细胞STAT3、p-STAT3蛋白检测采用Western blotting法。收集两组细胞,1×PBS洗两遍(350 g×4 min);RIPA裂解液提取总蛋白,紫外分光光度计测定蛋白浓度;加入1/4体积5×loading buffer,100 ℃加热10 min;12% SDS-PAGE凝胶电泳,硝酸纤维素膜转膜;5% BSA封闭1 h,一抗4 ℃孵育过夜;PBST洗膜3次,二抗室温孵育1 h;PBST洗膜3次,化学发光仪中曝光成像。Quantity One软件分析蛋白条带灰度值,以目的条带与GAPDH灰度值比值作为目的蛋白相对表达量。
1.3 统计学方法
2 结果
2.1 两组细胞形态学变化
对照组细胞呈圆形,形态均匀;细胞因子诱导后观察组细胞可见明显的树突状突起,呈现DC形态学变化。见图1。
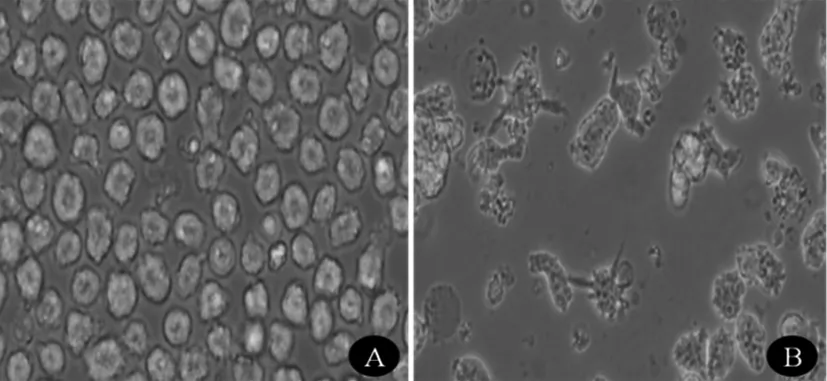
注:A为对照组细胞形态;B为细胞因子诱导后观察组细胞形态。
图1细胞形态变化(×200)
2.2 两组DC表面分子表达变化比较
与对照组比较,观察组DC表面标志性分子CD11c及DC表面功能分子(共刺激分子CD80、组织相容性抗原HLA-DR、趋化因子CCR7)均表达增加(P均<0.05)。见表2。
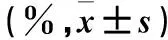
表2 两组DC表面标志性分子CD11c及DC表面功能分子表达变化比较
注:与对照组比较,*P<0.05。
2.3 两组细胞STAT3、E2-2 mRNA及STAT3蛋白、p-STAT3蛋白表达变化比较
与对照组比较,观察组细胞STAT3、E2-2 mRNA及STAT3蛋白、p-STAT3蛋白相对表达量均增加(P均<0.05)。见表3。
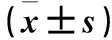
表3 两组细胞STAT3、E2-2 mRNA及STAT3蛋白、p-STAT3蛋白相对表达量比较
注:与对照组比较,*P<0.05。
3 讨论
STAT蛋白家族是一类由细胞因子、生长因子等多肽类配体激活的转录因子,有7个成员,包括STAT1、STAT2、STAT3、STAT4、STAT5(a/b)和STAT6[4]。STAT3是STAT家族重要成员之一,活化后形成二聚体,入核调控靶基因的转录,与细胞增殖、分化和凋亡密切相关。正常信号转导中STAT3的激活是快速而短暂的,而STAT3异常表达及活性状态在白血病细胞增殖失控、分化障碍及凋亡受阻中发挥了重要作用,参与了白血病的发生与发展[5, 6]。STAT3在髓源性DC分化中具有重要作用,髓源性DC分化高度依赖FMS样酪氨酸激酶3及其配体(Flt3-Flt3L)信号通路,STAT3被Flt3-Flt3L相结合后活化,入核促进DC分化特异性核转录因子E2-2转录,促进DC分化[7]。但是,STAT3信号通路在白血病细胞向DC分化过程中的作用尚不清楚。
DC起源于多功能造血干细胞,是体内功能最强大的抗原提呈细胞,目前已知的DC亚群包括存在于淋巴组织、血液和非淋巴组织的经典DC(cDC),以及分泌Ⅰ型干扰素的浆细胞样DC(pDC),它们在抗肿瘤、低抗病原微生物感染及维持机体内环境稳定中发挥着重要作用[8, 9]。白血病患者DC数量少、功能低以及伴有发育及成熟障碍,不能有效激发适应性免疫应答,杀伤白血病细胞能力减弱[10]。因此,将白血病细胞经诱导生成DC,诱导后的DC含白血病相关的特异性抗原,能够直接把白血病抗原呈递给T细胞,进而杀伤白血病细胞[11]。但是,目前诱导还存在诱导效率不高,DC功能不稳定等不足,因此明确其诱导分化机制是提高诱导效率与功能的突破口。
E2-2又称转录因子4(Tcf4),由Tcf4基因编码,属于E蛋白家族成员[12]。E2-2高表达于具有DC分化潜能的造血干细胞,通过结合靶基因上的调节性“E box”序列(CANNTG)促进靶基因转录[13~15]。E2-2通过调节DC祖细胞中Tlr7、Tlr9、Irf7及Irf8等DC分化基因促进DC发育分化,是DC分化发育过程中的关键转录因子[16]。研究显示,人和鼠的DC中均高表达E2-2,E2-2敲除小鼠的DC分化发育受阻[17]。编码E2-2的基因近端启动子区域含有STAT识别位点,但STAT 如何调节DC分化祖细胞中E2-2表达目前尚不十分清楚[16]。研究发现,在髓系DC分化发育过程中,Flt3L活化STAT3,进而激活E2-2转录;活化的E2-2通过“E box”序列与靶基因的启动子和增强子结合,调控一系列与DC分化发育相关的靶基因表达,进而促进髓系DC分化发育[18]。在细胞因子诱导白血病细胞向DC分化过程中,是否也存在STAT信号通路促进的E2-2转录尚未见报道。此方向的深入探索有望进一步阐释STAT信号通路在DC诱导分化中的作用,成为新的有效干预靶点。本研究发现,在GM-CSF联合IL-4诱导THP-1细胞向DC分化体系中,存在明显STAT3蛋白表达上调及活化,同时伴随E2-2转录水平显著升高,提示STAT3信号通路活化DC分化发育转录因子E2-2可能是细胞因子诱导白血病细胞THP-1向DC分化的重要机制。
本实验利用GM-CSF联合IL-4诱导白血病细胞THP-1向DC分化,探讨观察STAT3信号通路在此诱导分化模型中的作用。我们发现,GM-CSF联合IL-4诱导后,THP-1细胞呈现明显树突状改变,细胞表面DC标志性分子CD11c及DC功能性分子CD80、HLA-DR、CCR7表达增加,提示THP-1细胞在细胞因子作用下向DC分化。同时,我们发现细胞因子诱导后,STAT3总蛋白表达及磷酸化水平均升高,提示STAT3信号通路活化在细胞因子诱导THP-1向DC分化过程中发挥了重要作用。另外,我们发现细胞因子诱导THP-1向DC分化过程中,E2-2转录水平升高。提示细胞因子诱导THP-1细胞向DC分化过程中,STAT3信号通路活化DC分化特异性核转录因子E2-2,进而诱导THP1-1来源DC分化,但其具体机制仍需进一步深入研究。
参考文献:
[1] Villarino AV, Kanno Y, Ferdinand JR, et al. Mechanisms of Jak/STAT signaling in immunity and disease[J]. J Immunol, 2015,194(1):21-27.
[2] 郭丽香,罗跃娥.白血病细胞来源的树突状细胞治疗白血病[J].天津医药,2009,37(7):622-624.
[3] 袁长金,温培娥,任霞,等.A23187诱导K562细胞分化为树突细胞的实验研究[J].国际肿瘤学杂志,2011,38(4):307-310.
[4] Namanja AT, Wang J, Buettner R, et al. Allosteric communication across STAT3 domains associated with STAT3 function and disease-causing mutation[J]. J Mol Biol, 2016,428(3):579-589.
[5] Redell MS. A STAT3 decoy lures AML out of hiding[J]. Blood, 2016,127(13):1628-1629.
[6] Rezvani K, Barrett J. STAT3: the "Achilles" heel for AML[J]. Blood, 2014,123(1):1-2.
[7] Li HS, Watowich SS. Diversification of dendritic cell subsets: Emerging roles for STAT proteins[J]. JAKSTAT, 2013,2(4):e25112.
[8] Liu YJ, Kanzler H, Soumelis V, et al. Dendritic cell lineage, plasticity and cross-regulation[J]. Nat Immunol, 2001,2(7):585-589.
[9] Chen P, Denniston AK, Hirani S, et al. Role of dendritic cell subsets in immunity and their contribution to noninfectious uveitis[J]. Surv Ophthalmology, 2015,60(3):242-249.
[10] Mohty M, Jarrossay D, Lafage-Pochitaloff M, et al. Circulating blood dendritic cells from myeloid leukemia patients display quantitative and cytogenetic abnormalities as well as functional impairment[J]. Blood, 2001,98(13):3750-3756.
[11] Claxton DF, McMannis J, Champlin R, et al. Therapeutic potential of leukemia-derived dendritic cells: preclinical and clinical progress[J]. Crit Rev Immunol, 2001,21(1-3):147-155.
[12] Ma J, Yu H, Yin X, et al. E2-2, a novel immunohistochemical marker for both human and monkey plasmacytoid dendritic cells [J]. Biophys Rep, 2015,1(3):139-147.
[13] Grajkowska LT, Ceribelli M, Lau CM, et al. Isoform-specific expression and feedback regulation of E potein TCF4 control dendritic cell lineage specification[J]. Immunity, 2017,46(1):65-77.
[14] Watowich SS, Liu YJ. Mechanisms regulating dendritic cell specification and development[J]. Immunol Rev, 2010,238(1):76-92.
[15] Sepp M, Kannike K, Eesmaa A, et al. Functional diversity of human basic helix-loop-helix transcription factor TCF4 isoforms generated by alternative 5′ exon usage and splicing[J]. PLoS One, 2011,6(7):e22138.
[16] Li HS, Watowich SS. A STATus report on DC development[J]. J Leukoc Biol, 2012,92(3):445-459.
[17] Cisse B, Caton ML, Lehner M, et al. Transcription factor E2-2 is an essential and specific regulator of plasmacytoid dendritic cell development[J]. Cell, 2008,135(1):37-48.
[18] Li HS, Yang CY, Nallaparaju KC, et al. The signal transducers STAT5 and STAT3 control expression of Id2 and E2-2 during dendritic cell development[J]. Blood, 2012,120(22):4363-4373.
