2个慈竹bZIP基因的克隆、生物信息学分析及其诱导表达
2018-04-10龚道勇胡尚连卢学琴张庆波
龚道勇 胡尚连* 曹 颖 卢学琴 张庆波
(1.西南科技大学植物细胞工程实验室,绵阳 621010; 2.四川省生物质资源利用与改性工程技术研究中心,绵阳 621010)
竹子在我国种类多,分布广,具有生产周期短和易更新的特点,且是一种不可或缺的可再生资源,有着广阔的开发利用前景[1]。慈竹(Bambusaemeiensis)为丛生竹类,属于禾本科(Gramineae)竹亚科(Bambusoideae)慈竹属(Bambusaemeiensis),是西南地区的优势竹种,其节间长,纤维素含量多,纤维长径比较大,分子聚合度相对较高,是造纸的良好材料[2~3]。但是慈竹本身易受冷冻胁迫、土壤干旱等影响,从而造成慈竹大面积减产。因此,探究如何提高它对低温或干旱胁迫的抗性十分重要。
以往对慈竹的研究主要集中在基因的克隆[4]、生理生化[5]、遗传的多样性[6]等方面的研究,而有关慈竹bZIP基因克隆表达方面的研究鲜有报道。有研究表明,bZIP转录因子广泛参与植物的生长发育:例如在小麦的187个bZIP基因中,发现有48个与花药的发育有关[7];拟南芥中C/S1亚族的bZIP转录因子在能量不足或者环境胁迫下参与植株生长的重新分配[8];而G亚族的GIP1则参与到植株早期的生长发育[9]。光信号的转导:拟南芥中的GBF1在蓝光诱导下参与光形态的建成,如子叶扩张的正调控[10];而对于一些藻类植物,在bZIP转录因子参与下,它可以不利用光合通路,而完成光合作用[11]。种子的萌发:如分析蓖麻种子时,发现了49个RcbZIP基因与种子萌发和保藏相关[12];而水稻中OsABI5可以提高水稻种子的萌发率[13]。基因的表达:在西红柿中,进行了全基因组的系统鉴定,为蛋白质功能分析提供理论依据[14]。病虫害的防御:如对四种大豆的bZIP基因进行锈病胁迫实验,获得了新的基因型可以提高对锈病的抗性[15];在胡椒中,发现了一个CAbZIP1基因,它可以增强对胡椒病原体的抗性[16]。生物和非生物胁迫应答:如Atkinson等从基因的角度,分析了植物生物胁迫和非生物胁迫的相互作用是通过激素信号通路使之结合在一起[17];在小麦中bZIP转录因子是通过分子构象的不同来影响其结构与功能[18];依赖于ABA信号的bZIP转录因子通过Ser/Thr激酶参与到非生物胁迫中,如水稻ABF1对冷胁迫的响应[19]。以及ABA敏感性等各种信号的响应[20]。鉴于此,本次研究基于慈竹转录组数据库[21],利用克隆得到两条序列,对其进行生物信息学分析、组织表达以及非生物胁迫表达分析,为慈竹的抗冻、耐盐、抗旱等提供一定的理论依据。
1 材料和方法
1.1 植物材料
采自西南科技大学生命科学与工程学院竹类资源圃的慈竹笋(高100 cm)、当年生且完全抽枝的慈竹茎秆、展开叶和未展开叶作为试验材料,于液氮中冷冻后置于-80℃保存备用。
1.2 主要试剂和菌种
宝生物(大连)TaKaRa公司:DL2000 DNA Marker、LA-Taq聚合酶、pMD19-T载体、IPTG、PrimeScript® RT reagent Kit(Perfect DNA)反转录试剂盒、ApaⅠ、XbaⅠ、KpnⅠ等;天根公司:质粒小提试剂盒、X-Gal和胶回收试剂盒;OMEGA BIO-TEK公司:Plant RNA Kit试剂盒;BioBRK公司:Green View染料;GeneTech公司:酵母提取物、琼脂糖和胰蛋白胨;大肠杆菌(E.coli)DH5α为本试验室制备保存。
1.3 试验方法
1.3.1慈竹总RNA的提取和cDNA的合成
以-80℃超低温冰箱保存的慈竹笋(高100 cm)、茎秆、展开叶和未展开叶为材料,按照OMEGA公司Plant RNA Kit试剂盒说明书提取总RNA。按照宝生物公司的PrimeScript®RT reagent Kit(Perfect DNA)反转录试剂盒将RNA反转录合成cDNA。
1.3.2慈竹BebZIP2和BebZIP6的克隆
从慈竹笋转录组数据库中筛选出2条序列,采用Premier 5.10软件设计两对引物(BebZIP2-F和BebZIP2-R;BebZIP6-F和BebZIP6-R,表1),对其进行克隆。按照扩增反应程序:95℃预变性3 min,95℃变性30 s,55℃*BebZIP2基因退火温度为55℃,BebZIP6为58℃。退火30 s,72℃延伸1 min,30个循环,72℃延伸10 min,4℃保持。1.0%的琼脂糖凝胶电泳,回收后用大连宝生物T4ligase试剂盒进行pMD19-T载体连接,42℃热激转化E.coliDH5α,筛选阳性克隆酶切验证后送至上海英潍捷基公司进行测序,保留测序正确的质粒进行下一步实验。
1.4 生物信息学分析
从NCBI数据库(http://www.ncbi.nlm.nih.gov/guide/sequence-analysis/)中获得其它物种bZIP基因的功能性氨基酸和核苷酸序列,用DAMBE检测饱和度[22];为不饱和状态,适合建树。用DNAMAN软件和在线程序Clustal Omega(http://www.ebi.ac.uk/Tools/msa/clustalo)对基因序列及其编码的氨基酸序列进行多序列比对分析;用Mega7.0软件采用最大似然法(Maximum Likehood,ML)构建系统发育树。本次研究选择Models(Find Best DNA/Protein Models)为JTT+G+F,Bootstrap参数设为1 000 replicates;用MEME(http://meme-suite.org/index.html)、Phyre2.0(http://www.sbg.bio.ic.ac.uk/~phyre2/html/)等在线软件工具分别对bZIP蛋白序列进行保守基序和三级结构分析;用Yloc[23~24](http://abi.inf.uni-tuebingen.de/Services/YLoc/webloc.cgi)进行亚细胞定位预测分析(选择模型:Plants YLoc-HighRes)。将已克隆得到的慈竹2条BebZIP基因的编码框CDS序列提交至Selecton(http://selecton.tau.ac.il/)在线程序[25~26],设置模型为力学—经验型模型(MEC),对这2个基因进行选择性压力分析。
1.5 慈竹BebZIP基因组织表达模式分析
根据测序的慈竹BebZIP2和BebZIP6基因的全长序列,设计real-time PCR引物(BebZIP2-RT-F和BebZIP2-RT-R;BebZIP6-RT-F和BebZIP6-RT-R,表1)。分别提取慈竹各组织的总RNA并反转录合成cDNA;在iQ Multicolor Real-Time PCR自动扩增仪进行反应,每个样品重复3次,反应体系20 μL。以内参基因Tubulin为对照,用2-ΔΔCT计算法[27]计算其相对表达量。

表1 慈竹BebZIP2和BebZIP6基因克隆和Real-time PCR分析所用引物
1.6 慈竹BebZIP基因非生物胁迫表达分析
采用1/10 Hoagland营养液,将慈竹幼苗培养30 d左右,选择生长情况几乎一致且生长良好的幼苗作为试验材料。每个处理分别设置6个试验梯度:NaCl(0、50、100、150、200、250 mmol·L-1)、ABA(0、5、10、50、100、200 μmol·L-1)、PEG6000(0%、5%、10%、15%、20%、25%)进行预实验,每个处理重复3次(每个重复取3个独立植株)。
预实验结果显示:250 mmol·L-1NaCl处理3 d后,慈竹幼苗枯萎死亡,200 mmol·L-1NaCl处理的幼苗叶尖部位变黑,其他浓度的NaCl处理后,整株幼苗无明显变化;200 μmol·L-1ABA处理2 d后,幼苗的叶边缘的绿色明显变为黄色,而其他浓度的ABA处理的幼苗均无明显变化;20% PEG6000处理2 d后,可观察到幼苗叶呈卷曲状,25% PEG6000处理的幼苗叶卷曲比较严重且干瘪,其他浓度的PEG6000处理后,整株幼苗无明显变化。根据预实验结果最终确定以NaCl(0、200 mmol·L-1)、ABA(0、200 μmol·L-1)、PEG6000(0%、20%)进行后续的胁迫试验,每个处理重复3次(每个重复取3个独立植株),分别处理0(未处理的对照组)、6、12、24、48 h及7 d后,选取胁迫处理后的慈竹叶作为试验材料,液氮处理后于-80℃冰箱保存备用。提取RNA;合成cDNA;以内参基因Tubulin为对照,用2-ΔΔCT计算法计算其相对表达量。
2 结果与分析
2.1 慈竹BebZIP2和BebZIP6基因的克隆
用幼嫩的慈竹笋cDNA为模版,通过设计基因特异引物,经PCR扩增获得了2条DNA序列(图1),将其克隆到pMD19-T载体上,获得阳性克隆并测序。用NCBI在线工具Conserved分别对其进行保守结构预测并将这两条序列提交至NCBI数据库注册;保守结构预测属于bZIP超家族,命名为BebZIP2和BebZIP6(GenBank注册号分别为KU554693和KU560573)。其中BebZIP2和BebZIP6编码区长度分别为504 bp(编码167个氨基酸)和720 bp(编码239个氨基酸)。
2.2 慈竹BebZIP2和BebZIP6蛋白进化树分析及多序列比对分析
用慈竹转录组数据库中筛选出的bZIP(BebZIP1-BebZIP6)蛋白序列,结合单子叶植物:水稻(Oryzasativa:OsZIP-1a;OsZIP-2b;TRAB1;RF2a;RF2b;RISBZ1;RISBZ4;RISBZ5;RITA-1;OsBZ8);小麦(Triticumaestivum:EmBP-1;HBP-1a(1);HBP-1b(c1);HBP-1b(c38);HALF1;SPA);玉米(Zeamays:CPRF-2;DFL1;LG2;OHP1;OHP2;Maize O2;ZmGBF1;ZmBP-1a;OBF3.1;OBF3.2)和双子叶植物拟南芥(Arabidopsisthaliana:BZO2H1;BZO2H2;BZO2H3;BZO2H4);大豆(Glycinemax:HBF1)等已知功能的bZIP蛋白构建进化树,分析得知BebZIP2与玉米的CPRF-2置信度达到了65%;BebZIP2和BebZIP6与水稻C亚族的RISBZ5蛋白聚在一枝,置信度为90%(图2)。CPRF-2即bZIP17,它与光诱导相关[28]。RISBZ5即OsbZIP52,它参与水稻对胁迫的响应,在低温胁迫下其表达量可迅速提升,说明它可能是调控冷和渗透压胁迫途径中的一部分,同时相关研究表明,OsbZIP52基因的过表达可以提高水稻幼苗对冷和干旱胁迫的敏感程度[29]。因而,推测BebZIP2和BebZIP6基因的功能参与到慈竹对冷和干旱等非生物胁迫的响应。
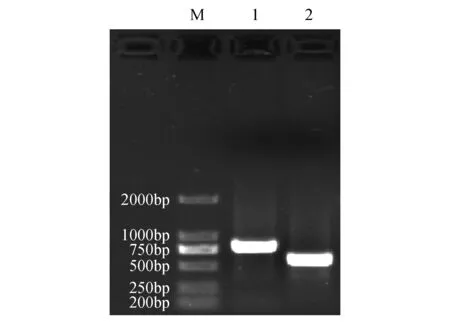
图1 慈竹bZIP基因PCR扩增产物 M.DL2000 Maker;1.BebZIP6 PCR扩增产物;2.BebZIP2 PCR扩增产物Fig.1 Electrophoresis of PCR products of bZIP genes in B.emeiensis M. DL2000 Maker; 1.Amplification products of BebZIP6 PCR; 2.Amplification products of BebZIP2 PCR
选取与BebZIP2和BebZIP6同源性较高的氨基酸序列,用DNAMAN软件和在线程序Clustal Omega进行多序列比对分析(图3)。可以发现它们存在典型的碱性亮氨酸拉链区域[N—X(7)—R/K—X(9)—L—X(6)—L—X(6)—L],图中黄色区域且该区域非常的保守。
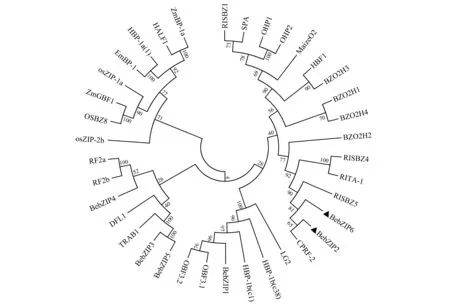
图2 不同物种bZIP蛋白的进化树分析Fig.2 Phylogenetic analysis of deduced amino acids of bZIP proteins from different plants
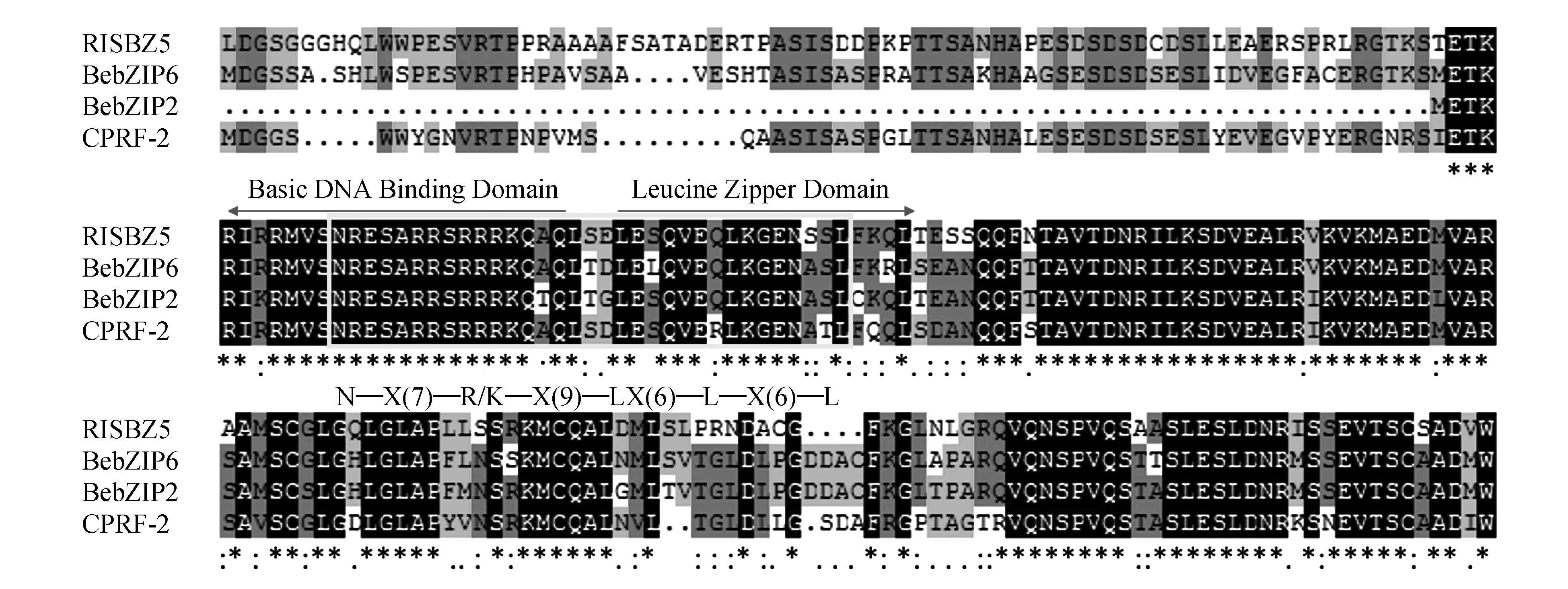
图3 BebZIP氨基酸序列与其他物种bZIP蛋白氨基酸序列多重比对结果 “*”表示保守氨基酸;“:”表示保守替换;“.”表示非保守替换Fig.3 Multiple alignment analysis of bZIP conservative structure domain in different plants “*” represents a conserved amino acid; “:” represents a conservative replacement; “.” represents non conservative replacement

图4 慈竹BebZIP2和BebZIP6蛋白保守基序分析Fig.4 The conserved motif analysis of BebZIP2 and BebZIP6 protein
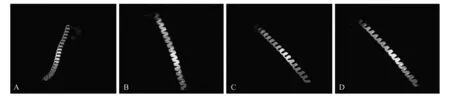
图5 bZIP蛋白质的三级结构预测 A. c2wt7B的三级结构;B. RISBZ5的三级结构;C. BebZIP2的三级结构;D. BebZIP6的三级结构Fig.5 bZIP protein tertiary structure prediction A. Tertiary structure of model c2wt7B; B. Tertiary structure of RISBZ5; C. Tertiary structure of BebZIP2; D. Tertiary structure of BebZIP6
2.3 慈竹BebZIP氨基酸保守基序分析
用MEME软件分析慈竹2条bZIP氨基酸序列的保守基序,设置基序数量为6个,宽度不限。结果显示,这些氨基酸序列均含有高度保守的motif1-motif5核心保守基序(图4)。其中,BebZIP6的结构与水稻RISBZ5蛋白的保守基序几乎完全相同,与进化分析结果一致。BebZIP2的motif2、motif4和motif5则组合在了一起。
2.4 慈竹BebZIP基因编码蛋白三级结构预测分析
蛋白质的三级结构是在二级结构的基础上进一步折叠盘绕而成。利用已经被X-Ray解析出晶体模型的c2wt7B(NDB:NA0777)为模型[30],c2wt7B具有典型的亮氨酸拉链结构。用Phyre 2.0对BebZIP2和BebZIP6进行三级结构进行预测。结果显示这两个蛋白与c2wt7B的三级构型高度相似,犹如一条拉链。如图5可以看出,BebZIP2和BebZIP6的三级结构主要由α-螺旋组成。Yloc亚细胞定位预测结果表明,BebZIP2主要集中于细胞核的概率为99.99%(置信度为1),BebZIP6主要集中于细胞核的概率为100.00%(置信度为1);实际情况需进一步实验去验证。
2.5 慈竹BebZIP基因的选择性进化分析
运用Selecton程序中的MEC模型在慈竹bZIP氨基酸序列上探测正选择位点。蛋白质一级结构位点的标注颜色大部分为白色到深紫色之间,表明这些位点经历了强的净化选择位点,而标注为黄色的位点,说明这些位点受到阳性选择压力。由图6可见在MEC模型下,慈竹bZIP基因中净化选择压力和阳性选择压力共同主导了它们的进化。
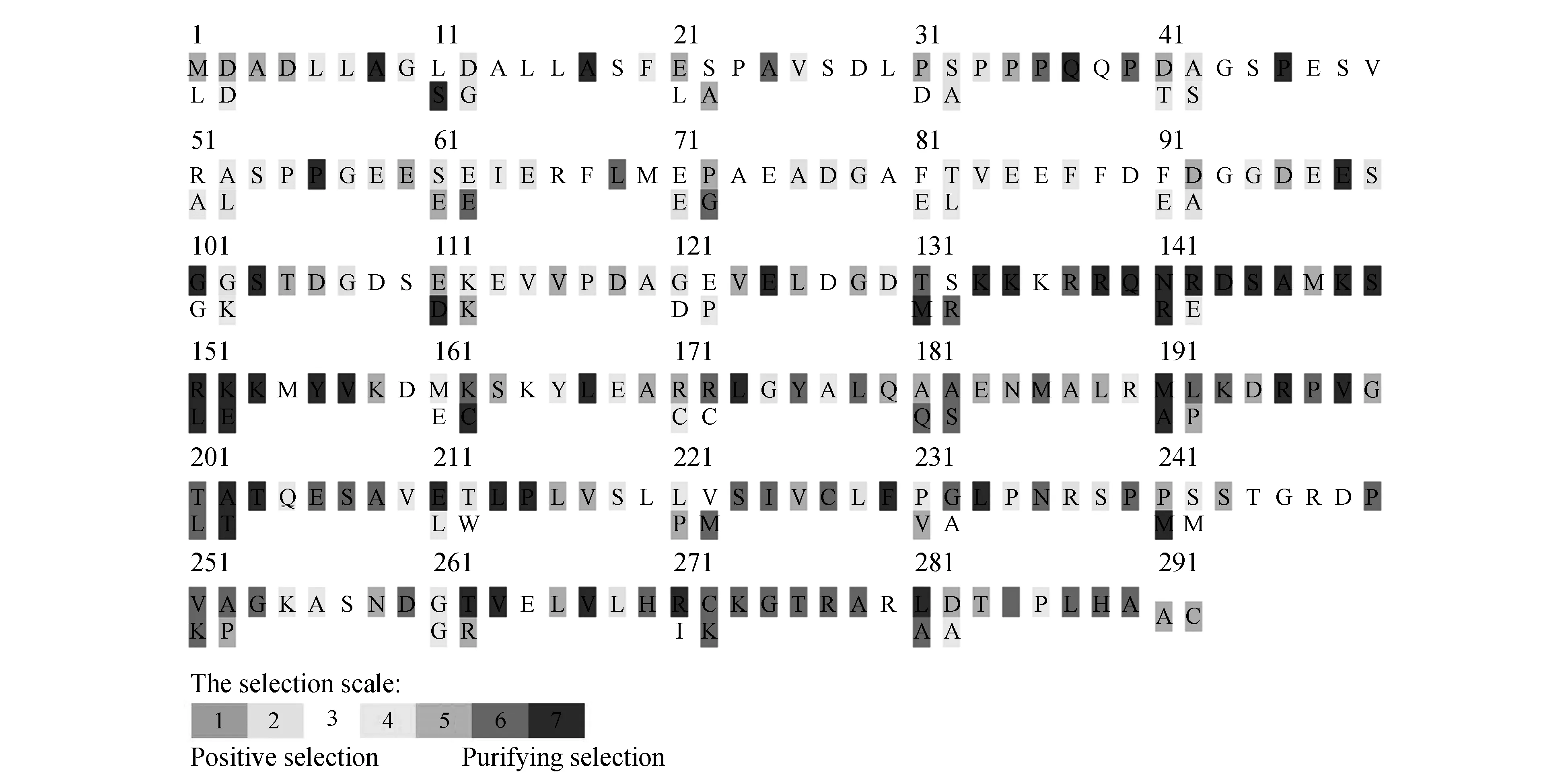
图6 慈竹bZIP基因选择性压力检测Fig.6 bZIP genes selective pressure detection in B.emeiensis
2.6 慈竹BebZIP基因的组织表达分析
组织表达分析结果显示,这2条BebZIP基因在慈竹笋、展开叶和未展开叶以及茎中均有表达,但其在各个部位的表达量有差异(图7)。总体上看,它们在不同组织中的表达趋势不尽相同,但均在未展开叶中表达量较高,在笋和茎中表达量的差异不大。同一基因在不同组织中的表达量差异较大,表达量的大小为未展开叶>展开叶>茎>笋。
2.7 慈竹BebZIP基因的非生物胁迫分析
经过胁迫处理后,观察预实验幼苗(图8),与CK比较,200 mmol·L-1NaCl处理2 d后,幼苗叶尖部位变黑;20% PEG-6000处理2天后,可观察到幼苗叶呈卷曲状;200 μmol·L-1ABA处理2 d后,幼苗的叶边缘的绿色明显变为黄色。
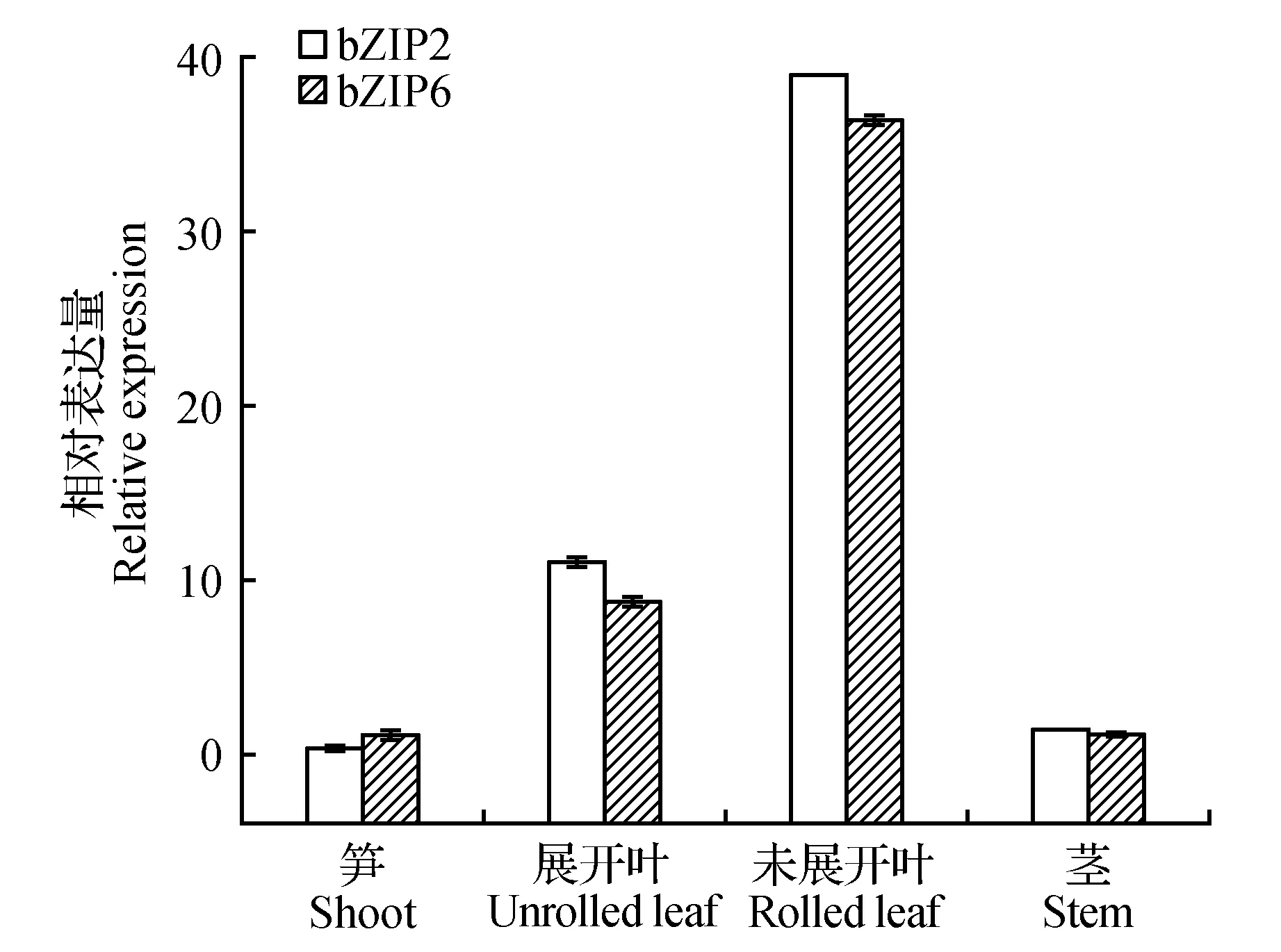
图7 实时定量PCR分析2个BebZIP基因在不同组织中的表达Fig.7 Quantitative real-time PCR analysis of the expression pattern of 6 BebZIP genes in different tissues

图8 胁迫处理后植株的变化Fig.8 The phenotype of the plant after treatments
在NaCl(200 mmol·L-1)、PEG6000(20%)和ABA(200 μmol·L-1)3种胁迫条件的处理下(图9),BebZIP2基因的表达情况基本一致,表现为先下降,后上升,最后再下降。在NaCl、PEG6000和ABA处理6 h后其表达量显著下降,但随着胁迫时间的延长,它的表达量缓慢上升,胁迫7天后BebZIP2的表达量又开始下降。
然而,BebZIP6在3种胁迫环境下的表达情况与BebZIP2明显不同,在NaCl和PEG处理条件下,大多数胁迫时间点下其表达水平与对照初始水平差异不大,且胁迫7天后其表达量均与对照基本持平。而在ABA处理条件下,BebZIP6基因的表达量呈现波浪线形状变化,依次表现为上升,下降,上升,下降,最后上升到与对照组水平基本持平。
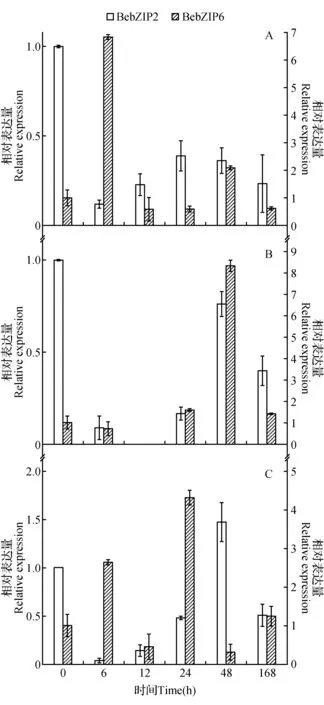
图9 BebZIP2和BebZIP6对胁迫处理下的表达变化A. NaCl处理;B. PEG6000处理;C. ABA处理Fig.9 Differential expression of BebZIP2 and BebZIP6 under the different stress treatments A. NaCl treatment; B. PEG6000 treatment; C. ABA treatment
3 讨论
bZIP转录因子家族在整个真核生物界中扮演着重要角色。在植物中,bZIP可以调控包括光形态建成、叶和种子的发育、能量平衡、以及生物和非生物胁迫响应等一系列重要的生物学过程[31]。由于慈竹的这两个基因属于C亚族。有研究表明大豆C亚族bZIP转录因子GmbZIP62在ABA信号传导中通过上调ABI1和ABI2等逆境相关基因的表达,从而可能在逆境胁迫中起作用[32];玉米C亚族的Opaque2通过和PBF蛋白的相互作用调控种子储存蛋白的产量[33];欧芹C亚族的CPFR-2和G/HBF-1可能还与对环境和病害侵袭的防御反应有关[34~35];在水稻中OsbZIP23的过表达能显著提高水稻的耐盐性、抗旱性和ABA敏感性;在对照植株中,水稻的耐盐性、抗旱性和ABA敏感性也随之降低比较明显,这表明OsbZIP23基因在水稻的耐盐和抗旱过程中起到了非常重要的作用[36]。
慈竹这两个基因与水稻C亚族的OsbZIP52同源性较高,而亚细胞定位表明OsbZIP52定位于细胞核[28];推测BebZIP2和BebZIP6也定位于为细胞核,这与Yloc亚细胞定位预测结果相一致,但需要进一步实验去验证。水稻中,OsbZIP52作为反式激活因子能与顺式作用元件G-Box特异性结合,提高对寒冷和干旱的敏感性[29]。在水稻中,通过Realtime PCR分析OsbZIP52的过表达,其非生物胁迫相关基因,如OsLEA3,OsTPP1,Rab25,gp1precursor,β-gal,LOC_Os05g11910和LOC_Os05g39250等基因都下调了;这暗示OsbZIP52/RISBZ5可能在寒冷和干旱中作为负调控因子[29]。同样推测慈竹的这两个基因也可能有类似功能。
在胁迫处理下,BebZIP2基因相对表达量下降的很快,很可能是由于它的启动更快,使得它对胁迫非常敏感能够迅速反馈给信号通路,从而减少它的表达量;而BebZIP6则相对滞后,使得它在初始条件下相对表达量较低,在胁迫处理下,对胁迫处理很敏感,为了适应环境的改变其相对表达量上升,待适应环境后又开始下降,为了稳定持续地适应环境,它需要多次的调控其表达,来回的上下波动最终趋于恒定,这有助于提高慈竹对多种非生物胁迫的适应能力。这些推断是否正确均需进一步实验去验证。
1.夏登云.慈竹组培快繁体系的研究[D].合肥:安徽农业大学,2009.
Xia D Y.Study on tissure cultule and rapid propagation system ofNeosinocalmusaffinis(Rendle) Keng F.[D].Hefei:Anhui Agricultural University,2009.
2.火树华.树木学:2版[M].北京:中国林业出版社,1992:456-459.
Huo S H.Dendrology:2nd ed[M].Beijing:China Forestry Publishing House,1992:456-459.
3.刘晓光,刘海英,张东远,等.竹子生物技术育种研究进展[J].河北农业大学学报,2002,25(S):151-154.
Liu X G,Liu H Y,Zhang D Y,et al.Advances of biotechnological approach on bamboo breeding[J].Journal of Agricultural University of Hebei,2002,25(S):151-154.
4.胡尚连,曹颖,黄胜雄,等.慈竹4CL基因的克隆及其生物信息学分析[J].西北农林科技大学学报:自然科学版,2009,37(8):204-210.
Hu S L,Cao Y,Huang S X,et al.Cloning and bioinformation analysis of 4CL gene inNeosinocalamusaffinis[J].Journal of Northwest A&F University:Natural Science Edition,2009,37(8):204-210.
5.胡尚连,蒋瑶,陈其兵,等.四川2种丛生竹理化特性及纤维形态研究[J].植物研究,2010,30(6):708-712.
Hu S L,Jiang Y,Chen Q B,et al.Physical and chemical properties of 2 species in bamboos from the different regions in sichuan province[J].Bulletin of Botanical Research,2010,30(6):708-712.
6.陈其兵,蒋瑶,卢学琴,等.四川不同地区慈竹的遗传多样性研究[J].西北农林科技大学学报:自然科学版,2009,37(6):187-193.
Chen Q B,Jiang Y,Lu X Q,et al.Assessment of genetic diversity inNeosinocalamusaffinisfrom different regions of Sichuan province[J].Journal of Northwest A&F University:Natural Science Edition,2009,37(6):187-193.
7.Li X Y,Gao S Q,Tang Y M,et al.Genome-wide identification and evolutionary analyses of bZIP transcription factors in wheat and its relatives and expression profiles of anther development related TabZIP,genes[J].BMC Genomics,2015,16:976.
8.Weltmeier F,Rahmani F,Ehlert A,et al.Expression patterns within theArabidopsisC/S1 bZIP transcription factor network:availability of heterodimerization partners controls gene expression during stress response and development[J].Plant Molecular Biology,2009,69(1-2):107-119.
9.Shaikhali J.GIP1 protein is a novel cofactor that regulates DNA-binding affinity of redox-regulated members of bZIP transcription factors involved in the early stages ofArabidopsisdevelopment[J].Protoplasma,2014,252(3):867-883.
10.Mallappa C,Yadav V,Negi P,et al.A basic leucine zipper transcription factor,G-box-binding factor 1,regulates blue light-mediated photomorphogenic growth inArabidopsis[J].Journal of Biological Chemistry,2006,281(31):22190-22199.
11.Takahashi F.Blue-light-regulated transcription factor,Aureochrome,in photosynthetic stramenopiles[J].Journal of Plant Research,2016,129(2):189-197.
12.Jin Z W,Xu W,Liu A Z.Genomic surveys and expression analysis ofbZIPgene family in castor bean(RicinuscommunisL.)[J].Planta,2014,239(2):299-312.
13.Zou M J,Guan Y C,Ren H B,et al.A bZIP transcription factor,OsABI5,is involved in rice fertility and stress tolerance[J].Plant Molecular Biology,2008,66(6):675-683.
14.Li D Y,Fu F Y,Zhang H J,et al.Genome-wide systematic characterization of the bZIP transcriptional factor family in tomato(SolanumlycopersicumL.)[J].BMC Genomics,2015,16:771.
15.Alves M S,Soares Z G,Vidigal P M P,et al.Differential expression of four soybean bZIP genes duringPhakopsorapachyrhiziinfection[J].Functional & Integrative Genomics,2015,15(6):685-696.
16.Lee S C,Choi H W,Hwang I S,et al.Functional roles of the pepper pathogen-induced bZIP transcription factor,CAbZIP1,in enhanced resistance to pathogen infection and environmental stresses[J].Planta,2006,224(5):1209-1225.
17.Atkinson N J,Urwin P E.The interaction of plant biotic and abiotic stresses:from genes to the field[J].Journal of Experimental Botany,2012,63(10):3523-3544.
18.Sornaraj P,Luang S,Lopato S,et al.Basic leucine zipper(bZIP) transcription factors involved in abiotic stresses:a molecular model of a wheat bZIP factor and implications of its structure in function[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2016,1860(1):46-56.
19.Banerjee A,Roychoudhury A.Abscisic-acid-dependent basic leucine zipper(bZIP) transcription factors in plant abiotic stress[J].Protoplasma,2017,254(1):3-16.
20.Tu M X,Wang X H,Huang L,et al.Expression of a grape bZIP transcription factor,VqbZIP39,in transgenicArabidopsisthalianaconfers tolerance of multiple abiotic stresses[J].Plant Cell,Tissue and Organ Culture(PCTOC),2016,125(3):537-551.
21.杨传凤,曹颖,胡尚连,等.基于慈竹转录组MYB基因的克隆及胁迫诱导表达[J].森林与环境学报,2015,35(1):60-66.
Yang C F,Cao Y,Hu S L,et al.Cloning of MYB gene based onBambusaemeiensistranscriptome and their induced expression under stresses[J].Journal of Forest and Environment,2015,35(1):60-66.
22.Xia X H,Lemey P.Assessing substitution saturation with DAMBE[M].//Lemey P,Salemi M,Vandamme A M.The phylogenetic handbook.2nd ed.Cambridge,UK:Cambridge University Press,2009:611-626.
23.Briesemeister S,Rahnenführer J,Kohlbacher O.Going from where to why-interpretable prediction of protein subcellular localization[J].Bioinformatics,2010,26(9):1232-1238.
24.Briesemeister S,Rahnenführer J,Kohlbacher O.YLoc-an interpretable web server for predicting subcellular localization[J].Nucleic Acids Research,2010,38(S2):W497-W502.
25.Stern A,Doron-Faigenboim A,Erez E,et al.Selecton 2007:advanced models for detecting positive and purifying selection using a Bayesian inference approach[J].Nucleic Acids Research,2007,35(S2):W506-W511.
26.张庆波,胡尚连,徐刚,等.毛竹bZIP转录因子的基因结构与进化分析[J].森林与环境学报,2016,36(1):54-61.
Zhang Q B,Hu S L,Xu G,et al.Analysis on gene structure and evolution of bZIP transcription factor ofPhyllostachysedulis[J].Journal of Forest and Environment,2016,36(1):54-61.
27.Pfaffl M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001,29(9):e45.
28.Schnable P S,Ware D,Fulton R S,et al.The B73 maize genome:complexity,diversity,and dynamics[J].Science,2009,326(5956):1112-1115.
29.Liu C T,Wu Y B,Wang X P.bZIP transcription factorOsbZIP52/RISBZ5:a potential negative regulator of cold and drought stress response in rice[J].Planta,2012,235(6):1157-1169.
30.Pogenberg V,Textor L C,Vanhille L,et al.Design of a bZip transcription factor with homo/heterodimer-induced DNA-binding preference[J].Structure,2014,22(3):466-477.
31.Corrêa L G,Riao-Pachón D M,Schrago C G,et al.The role of bZIP transcription factors in green plant evolution:adaptive features emerging from four founder genes[J].PLoS One,2008,3(8):e2944.
32.Liao Y,Zou H F,Wei W,et al.SoybeanGmbZIP44,GmbZIP62 andGmbZIP78 genes function as negative regulator of ABA signaling and confer salt and freezing tolerance in transgenicArabidopsis[J].Planta,2008,228(2):225-240.
33.Vicente-Carbajosa J,Moose S P,Parsons R L,et al.A maize zinc-finger protein binds the prolamin box in zein gene promoters and interacts with the basic leucine zipper transcriptional activator Opaque2[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(14):7685-7690.
34.Dröge-Laser W,Kaiser A,Lindsay W P,et al.Rapid stimulation of a soybean protein-serine kinase that phosphorylates a novel bZIP DNA-binding protein,G/HBF-1,during the induction of early transcription-dependent defenses[J].The EMBO Journal,1997,16(4):726-738.
35.Weisshaar B,Armstrong G A,Block A,et al.Light-inducible and constitutively expressed DNA-binding proteins recognizing a plant promoter element with functional relevance in light responsiveness[J].The EMBO Journal,1991,10(7):1777-1786.
36.陈祥福,潘阳露,魏娟娟,等.植物bZIP转录因子及其耐盐性调控研究进展[J].长江蔬菜,2014,(20):4-7.
Chen X F,Pan Y L,Wei J J,et al.Research progress of plant bZIP transcription factors and their regulation on salt resistance[J].Journal of Changjiang Vegetables,2014,(20):4-7.
