六糖基白头翁皂苷的酶法降解及其产物鉴定
2018-04-08李妍,刘春莹,金凤燮,鱼红闪
李 妍, 刘 春 莹, 金 凤 燮, 鱼 红 闪
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
白头翁(Pulsatillachinensis)系毛茛科白头翁属植物,古时常被用于清热解毒、凉血止痢[1]等。其重要的活性成分为白头翁皂苷[2],主要分为羽扇豆烷型与齐墩果烷型等数十种皂苷及皂苷元[3]。天然存在的含量丰富的白头翁皂苷大部分是多糖基皂苷,一般都含有4~6个糖基,其中以六糖基白头翁皂苷居多。研究表明,含量丰富的多糖基白头翁皂苷,口服后难以吸收或吸收率较低。GAO等[4]对低糖基白头翁皂苷(一般含有1~2个糖基)的研究表明,低糖基白头翁皂苷可以保护由氰化钠和缺乏葡萄糖而造成的受损PC-12 细胞免于凋亡,应用流式细胞技术测得低浓度的低糖基白头翁皂苷均可以对细胞起到保护作用。因此,若在体外将多糖基白头翁皂苷转化为低糖基白头翁皂苷,不仅能提高白头翁皂苷的生物利用度,还有望提高其药效价值。
本实验室在白头翁总皂苷的分离提取[5-7]及白头翁皂苷糖苷酶的生物转化[8]等方面进行大量的研究,发现了可水解多糖基白头翁的糖苷酶[9-11]。本实验就是在前期工作的基础上,采用硅胶柱层析法对白头翁总皂苷酶解产物进行分离纯化,并利用核磁共振法对产物结构进行鉴定。
1 材料与方法
1.1 材 料
白头翁总皂苷,实验室自制;菌种Absidiasp.P00r,大连工业大学生物工程学院菌种保藏所;硅胶,青岛海洋化工厂;薄层层析板(TLC),德国Merck公司;色谱仪,Waters 2695高效液相色谱分析仪;瑞士Bruke Avance 600核磁共振谱仪。
1.2 方 法
1.2.1六糖基白头翁皂苷的分离纯化
取一定量的白头翁总皂苷,用适量的甲醇溶解于3倍样品质量的80~100目硅胶,加热搅拌蒸干制成样品胶,以15倍样品质量的300~400目硅胶作分离胶。用一定量的纯氯仿通柱,按照氯仿与甲醇体积比9.5∶0.5、9.0∶1.0、8.5∶1.5、8.3∶1.7依次进行洗脱,分别收集洗脱液。
1.2.2六糖基白头翁皂苷的酶转化
根据文献[6]方法制备酶液,将底物用0.02 mol/L pH 5.0的HAc-NaAc缓冲液配成质量分数2%的溶液,与等体积的酶液混合后在40 ℃下反应24 h,95%乙醇溶液终止反应,离心取上清液,浓缩蒸干后加适量水溶解,将酶解产物用正丁醇萃取出来,蒸干待用。
1.2.3六糖基白头翁皂苷酶解产物的分离纯化
硅胶柱层析的装柱方法如“1.2.1”。用一定量的纯氯仿通柱,依次按氯仿与甲醇体积比9.5∶0.5、9∶1、8.8∶1.2、8.5∶1.5进行洗脱,分别收集洗脱液。
1.2.4高效液相色谱法(HPLC)检测产物纯度
色谱柱:Kromasil C18柱(5 μm,Φ4.6 mm×200 mm)。色谱条件:流动相为乙腈(A)和水(B),进行梯度洗脱:0~10 min,φ(A)=28%;10~15 min,φ(A)=28%~32%;15~30 min,φ(A)=32%~40%;30~45 min,φ(A)=40%~100%;进样量,10 μL;柱温,35 ℃;体积流量,1.0 mL/min;检测波长,205 nm。
1.2.5核磁共振法(NMR)检测产物纯度
将硅胶层析分离纯化的化合物1和化合物2,用核磁共振法检测分析并确定其化学结构。NMR波谱采用瑞士Bruke Avance 600超导核磁共振波谱仪进行测定;1H NMR谱的观测频率为600 MHz,13C NMR谱的观测频率为150 MHz;探头,5 mm BBO;溶剂,Pyridine-D5(氘代吡啶)。
2 结果与讨论
2.1 六糖基白头翁皂苷分离纯化及HPLC纯度鉴定
称取白头翁总皂苷40 g,利用硅胶层析进行不同比例的梯度洗脱,在氯仿与甲醇体积比为8.5∶1.5时,洗脱出一组分,暂命名白头翁皂苷化合物1,蒸干称重为5.72 g,得率为14.3%。经HPLC检测,其纯度为95%,结果如图1所示。

图1 白头翁皂苷化合物1的HPLC图
以六糖基白头翁皂苷为底物,利用Absidiasp.P00r菌产粗酶液进行酶催化反应,反应结束后TLC法检测六糖基白头翁皂苷和酶解产物,结果如图2所示。结果表明,Rf=0.1处的斑点在酶反应的通道上已经完全消失,说明底物六糖基白头翁皂苷在酶的催化下完全水解,产物是Rf=0.75处的斑点,即低糖基白头翁皂苷。
2.2 六糖基白头翁皂苷酶解产物的分离纯化及HPLC鉴定
称取以六糖基白头翁皂苷为底物酶转化的产物3 g,通过硅胶层析进行梯度洗脱,在氯仿与甲醇体积比为9∶1时,收集得到一种化合物,暂命名为白头翁皂苷化合物2,蒸干称重为0.45 g,计算得率为15.0%。TLC法检测结果如图3所示,HPLC检测其纯度为95%,结果如图4所示。
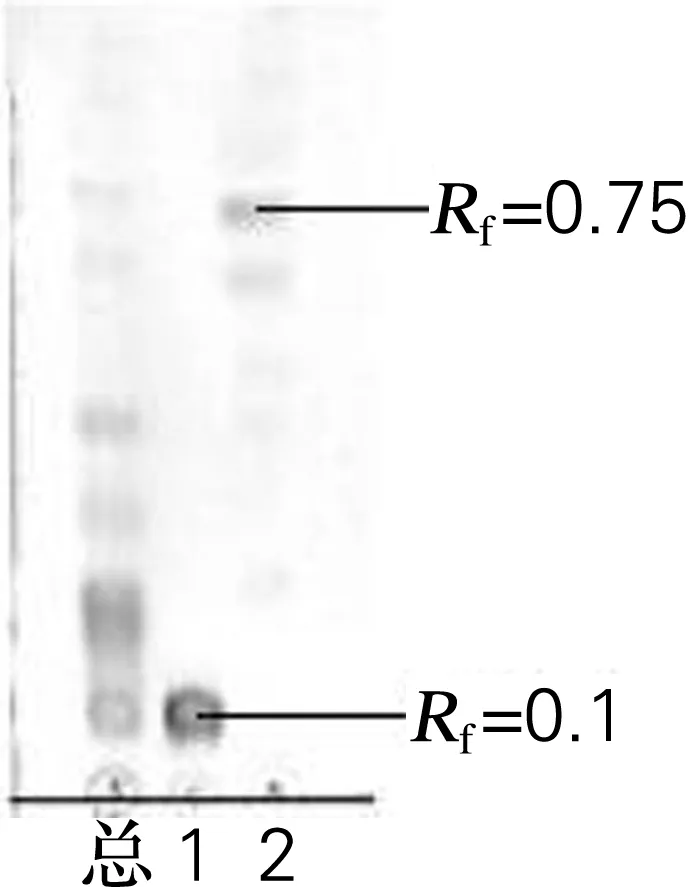
总,白头翁总皂苷;1,六糖基白头翁皂苷;2,低糖基白头翁皂苷。展开剂,体积比为6.5∶3.5∶0.5 的氯仿-甲醇-水溶液
图2六糖基白头翁皂苷和酶解产物的TLC检测图
Fig.2Six-glycosylation pulsatilla saponin and its enzymatic products detected by TLC

总,白头翁总皂苷;1,六糖基白头翁皂苷;2,白头翁皂苷化合物2。展开剂,体积比为6.5∶3.5∶0.5的氯仿-甲醇-水溶液
图3白头翁皂苷化合物2的TLC检测图
Fig.3TLC result of compound 2 of pulsatilla saponin

图4 白头翁皂苷化合物2的HPLC检测图
2.3 核磁共振法鉴定白头翁皂苷化合物的结构
1H NMR数据显示,1.57、1.54、1.05、1.00、0.97、0.85、0.75、0.75为甲基特征峰,其甲基位置与文献[12]中的白头翁皂苷结构相符。从表1可知,化合物1含有1个阿拉伯糖,2个鼠李糖,3个葡萄糖,共有6个糖基。位于13C NMR最低场的176.73、144.28、123.11三条谱线,为具有双键结构的碳,这3个位移峰分别为C-28、C-13、C-12,推断其分子式为C65H106O31。
与参考文献[12]中白头翁皂苷核磁数据对照,确定其结构为3-O-β-D-吡喃葡萄糖-(1→3)-α-L-吡喃鼠李糖-(1→2)-α-L-吡喃阿拉伯糖常春藤皂苷元28-O-α-L-吡喃鼠李糖-(1→4)-β-D-吡喃葡萄糖-(1→6)-β-D-吡喃葡萄糖酯苷,英文名称3-O-β-D-glucopyranosyl-(1→3)-α-L-rhamnopyr-anosyl-(1→2)-α-L-arabinopyranosyl hederagenin 28-O-α-L-rhamnopyranosyl-(1→4)-β-D-glucopyranosyl-(1→6)-β-D-glucopyranosyl ester,其结构如图5所示。
白头翁皂苷化合物2,1H NMR数据显示,1.51、1.10、0.94、0.90、0.88、0.82、0.82可确定化合物2中含有7个甲基,其甲基位置与文献[13]中白头翁皂苷结构相符。由表1可知,化合物2中含有1个鼠李糖,1个阿拉伯糖,共有2个糖基。位于13C NMR最低场的180.33、144.95、122.75三条谱线,为具有双键结构的碳,这3个位移峰分别为C-28、C-13、C-12,推断其分子式为C41H66O12。
与参考文献[13]中白头翁皂苷核磁数据对照,确定其结构为常春藤皂苷元3-O-α-L-吡喃鼠李糖基-(1→2)-α-L-吡喃阿拉伯糖苷,英文名称hederagenin 3-O-α-L-rhamnopyranosyl-(1→2)-α-L-arabinopyranoside,其结构如图6所示。
3 结 论
利用Absidiasp.P00r菌产粗酶液对六糖基白头翁皂苷进行酶法转化,使用硅胶层析法分离纯化酶转化产物,核磁共振法测定结果表明,酶转化产物主要是带有2个糖基的白头翁皂苷,系统名称是常春藤皂苷元3-O-α-L-吡喃鼠李糖基-(1→2)-α-L-吡喃阿拉伯糖苷。说明六糖基白头翁皂苷在酶的催化作用下,底物被彻底降解,侧链糖基能够被部分水解,产物主要是2个糖基的低糖基白头翁皂苷。TLC结果表明,酶转化产物有2个斑点,本实验分离纯化了其中含量高的化合物并进行了化学结构分析,另一个含量较低的化合物初步判断是含有3~4个糖基的白头翁皂苷,推断其为酶催化反应过程中的中间产物。
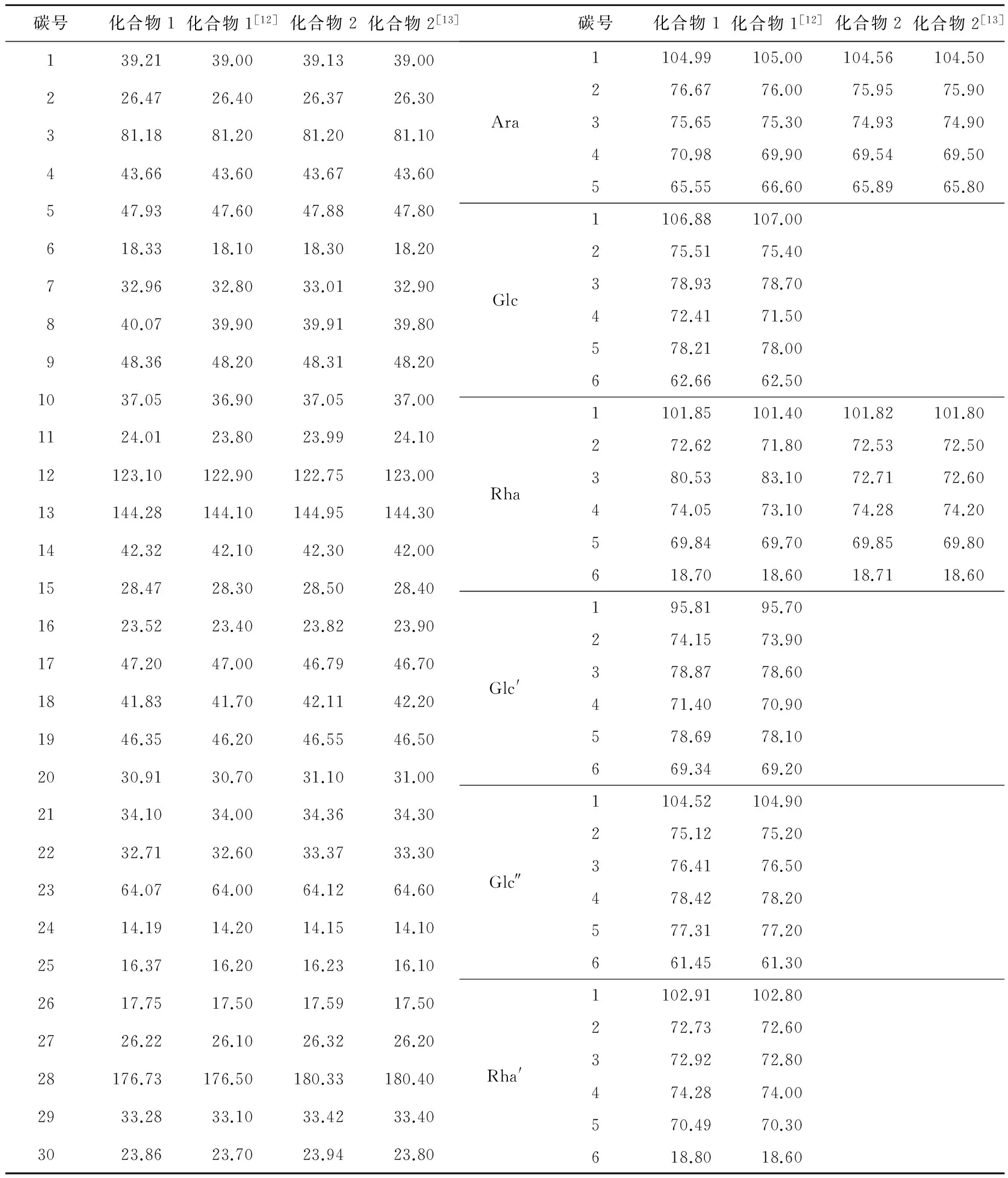
表1 两种白头翁皂苷化合物的13C NMR数据及其结构归属(与文献[12]和[13]比较)Tab.1 13C NMR chemical shifts and structure attribution of two pulchinenoside compounds (compared with literature [12] and [13])
参考文献:
[1] 张庆文,叶文才,车镇涛,等.朝鲜白头翁的三萜皂苷研究[J].药学学报,2000,35(10):756-758.
[2] 金凤燮.天然产物生物转化[M].北京:化学工业出版社,2009.
[3] 时维静,李立顺,董卫星.白头翁化学成分、药理作用及临床应用研究进展[J].中兽医医药杂志,2009(4):22-25.
[4] GAO X D, YE W C, YU A C H, et al. Pulsatilloside A and anemoside A3 protect PC12 cells from apoptosis induced by sodium cyanide and glucose deprivation[J]. Planta Medica, 2003, 69(2): 171-174.
[5] 王伟,唐正军,鱼红闪,等.白头翁皂苷酶解产物的分离纯化[J].大连轻工业学院学报,2005,24(1):4-7.
[6] 王征魁,曹体爽,刘廷强,等.白头翁皂苷及其酶解产物的分离纯化[J].大连工业大学学报,2013,32(2):98-100.

图5 白头翁皂苷化合物1的结构式

图6 白头翁皂苷化合物2的结构式
[7] 曹体爽,刘廷强,王东明,等.生物转化法制备白头翁皂苷A3[J].大连工业大学学报,2014,33(1):18-20.
[8] 林迪,金凤燮,鱼红闪.白头翁皂苷H3糖苷酶的分离纯化及酶性质[J].大连工业大学学报,2015,34(6):401-403.
[9] YU H S, LIU Q M, ZHANG C Z, et al. A new ginsenosidase fromAspergillusstrain hydrolyzing 20-O-multi-glycoside of PPD ginsenoside[J]. Process Biochemistry, 2009, 44(7): 772-775.
[10] JIN F X, YU H S, WANG M D, et al. Kinetics of a cloned special ginsenosidase hydrolyzing 3-O-glucoside of multi-protopanaxadiol-type ginsenosides, named ginsenosidase type Ⅲ[J]. Journal of Microbiology and Biotechnology, 2012, 22(3): 343-351.
[11] WANG D M, YU H S, SONG J G, et al. A novel ginsenosidase from anAspergillusstrain hydrolyzing 6-O-multi-glycosides of protopanaxatriol-type ginsenosides, named ginsenosidase type Ⅳ[J]. Journal of Microbiology and Biotechnology, 2011, 21(10): 1057-1063.
[12] 许永男,关颖丽,刘建宇,等.朝鲜白头翁的化学成分研究[C]//第九届全国中药和天然药物学术研讨会大会报告及论文集.南昌:中国药学会,2007:552-557.
[13] 丁秀娟.中药白头翁化学成分研究[D].苏州:苏州大学,2010.
