柠檬香蜂草对铜的耐性及其积累特征研究
2018-04-08杨道丽
张 斌,朱 江,王 朋,杨道丽*
(1 昆明理工大学 环境科学与工程学院,昆明 650504;2 上海市环境科学研究院,上海 200233)
目前,世界土壤污染形势严峻,耕地土壤环境质量以及工矿业废弃土壤的环境问题较为突出,土壤重金属污染的修复治理是当前中国环境保护领域中重要课题之一[1-2]。中国目前受重金属污染的耕地面积占全国耕地总面积的20%,每年因土壤污染而损失的粮食总量达1 000万t,直接经济损失2 000多亿元人民币[3]。Cu是典型的重金属污染物之一。而在中国土壤主要无机污染物(除有机污染外)中,Cu污染所占的比例为2.1%,且主要发生在农田土壤中。污染面积大,污染程度相对较轻是农田重金属污染的典型特征。采用传统的物理、化学处理方法修复污染土壤,不仅耗时、耗力,而且还会带来二次污染,对土壤生态系统造成破坏[4]。因此,植物修复技术作为一种更为合适的生态可持续发展技术,具有广泛的应用前景。重金属的植物修复已成为了土壤污染修复领域的研究热点之一[5]。目前,通过筛选和利用积累、超积累植物来进行的污染场地修复受到广泛关注。超积累植物对土壤中重金属的提取能力直接影响其修复效率。但目前所报道的超积累植物一般都存在植株矮小、生长周期长、生长速度慢、生物量较低等缺陷,这也是植物修复技术难以进行大面积的推广及应用的最大瓶颈问题[6-7]。因此,进一步筛选出适应性强、生物量大,且具有经济价值的重金属耐受植物或超积累植物,将有助于植物修复技术未来走向实用。
柠檬香蜂草(Melissaofficinalis)是一种唇形科植物,分布地域广泛,能在低海拔和高海拔的热、阴、旱、涝的环境中生长。同时,柠檬香蜂草也是一种具有一定药用价值的经济植物,如它可用来提取香油、作为食材、入药等。另外,它还具有生长速度快、易播种、能够扦插或分株繁殖以及多次采割等诸多特点[8]。迄今,已有关于唇形科植物对重金属耐性及富集能力的报道,如海州香薷是一种铜的超积累植物[9],薄荷不但对镉具有一定的富集能力[10],对铬也有较好的耐受性并且具有修复铬污染土壤的潜力等[11]。但是,柠檬香蜂草是否对Cu具有耐受性或超积累特性尚鲜见报道。因此,本试验采用盆栽方法,以植物叶绿素、抗氧化酶活性、生物量及Cu含量等为指标,探讨柠檬香蜂草对Cu的耐性及其吸收、积累特征,为进一步研究柠檬香蜂草应用于Cu污染土壤修复植物的可能性提供科学依据。
1 材料和方法
1.1 实验材料
柠檬香蜂草种子采购自上海百千花卉园艺有限公司。受试土壤采自四川大凉山越西县休耕地表土(0~20 cm),分别通过重铬酸钾容量法、半微量凯氏法、硫酸-高氯酸消煮法、NaOH熔融-火焰光度计法和原子吸收分光光度法测得土壤理化性质如下:pH 5.16, 有机质23.36 g·kg-1,全N 0.265 g·kg-1,全P 1.38 g·kg-1,全K 2.33 g·kg-1,总Cu 12.4 mg·kg-1。
1.2 材料培养与处理
将受试土壤风干后过2 mm筛,每盆2.5 kg。取一定量的柠檬香蜂草种子于5%的次氯酸钠溶液中浸泡消毒20 min,然后用去离子水冲洗3次后播种,进行6周的适应生长后;参照中国土壤质量标准及土壤环境Cu污染水平,试验设计200、400、800和1 000 mg·kg-1等4个Cu浓度系列处理,各处理分别按照设计要求以CuSO4·5H2O溶液均匀施入盆中土壤,以不施Cu土壤为对照组(CK)。土壤平衡4周后,选择长势一致、长出2片真叶的柠檬香蜂草移栽到各个盆中,每盆4株植物,每组设3盆重复,蒸发损失水分用去离子水补充,于处理第0、7、14、21、28天对植株收获并进行相关指标分析测定。
1.3 测定指标及方法
1.3.1叶绿素含量采用乙醇-丙酮浸泡提取法测定叶绿素含量[12]。采集柠檬香蜂草新鲜羽叶,用蒸馏水洗净并用滤纸吸干叶面上的水,精确称取0.1 g叶片,置于95%乙醇-丙酮混合液10 mL (体积比为1∶1)中并密封试管口,于暗处浸提,待叶片完全变白后进行比色。用紫外分光光度计测定663 nm和645 nm波长下的光密度值,每个浓度做3次重复来矫正误差,按照公式计算叶绿素a、b含量及总量含量。
1.3.2丙二醛含量采用双组分光光度法测定丙二醛(malondialdehyde,MDA)含量[13]。取0.2 g植物叶片加入5 mL的pH 7的磷酸缓冲液进行研磨后,在12 000 r·min-1下离心15 min,取叶片离心的上清液1 mL(对照加入1 mL蒸馏水)并加入3 mL的10 %TCA, 1 mL的1 % TBA于试管中,混合摇匀后,把混匀物放于沸水浴中加热20 min,迅速冷却后再离心,取上清液后测定532 nm,600 nm波长下的OD值。
1.3.3可溶性蛋白含量取上述离心液0.1 mL,蒸馏水0.9 mL,考马斯亮蓝5 mL,重复3次,反应2到3 nm后测定595 nm下的吸光值,随后根据标准曲线的回归方程以计算可溶性蛋白质(soluble protein, SP)含量[14]。
1.3.4抗氧化酶活性超氧化物歧化酶(superoxide Dismutase,SOD)活性测定采用氮蓝四唑法[15]。谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的测定采用愈创木酚法[16]。
1.3.5生物量和Cu含量及积累参数将植物样品分为地上部和地下部,用去离子水冲洗干净后,放入70 ℃的烘箱中干燥72 h,然后分别称重得到植物地上部和地下部干重。采用浓硝酸-高氯酸湿式消解法进行消解,使用原子吸收光谱仪(HITACHI Z-2000)测定植物体内Cu含量。然后,按照如下公式计算相关铜积累参数:
耐性系数=各处理组的平均根长/空白组的平均根长×平均根长%[17]
富集系数=植物体内重金属含量/土壤中重金属含量[18]
铜总积累量=植物体内重金属含量×干重[19]
1.4 数据处理
采用Microsoft Excel 2013和SPSS 21.0软件对数据进行统计处理,并进行平均值和标准差的运算,以Mean±SD形式表示。
2 结果与分析
2.1 Cu2+胁迫对柠檬香蜂草生物量的影响
如图1所示,随着土壤中Cu2+浓度的增加,柠檬香蜂草每盆的地上部和地下部生物量基本表现出先升高后降低的变化趋势。其中,当Cu2+胁迫处理第28天时,柠檬香蜂草地上部和地下部生物量在200 mg·kg-1浓度下分别比对照组增加12.55%和4.02%,在400 mg·kg-1浓度下分别比对照组增加2.05%和1.84%,但在800 mg·kg-1时较对照组分别减少24.55%和42.88%,在1 000 mg·kg-1时分别减少39.48%和50.33%。可见,在土壤中施加适量Cu2+对柠檬香蜂草的生长发育具有一定的促进作用,但Cu2+浓度过高则对柠檬香蜂草的生长产生明显的抑制作用。
2.2 Cu胁迫对柠檬香蜂草中叶绿素含量的影响
图2显示,随着浓度的增加,同一处理时间内柠檬香蜂草叶绿素a和叶绿素b含量以及总叶绿素含量均呈现出先上升后下降的变化趋势,并均在400 mg·kg-1处理时达到最大值,而在1 000 mg·kg-1处理时达到最小值。随着Cu2+处理时间的延长,叶绿素a和叶绿素b含量以及总叶绿素含量在对照(CK)、200和400 mg·kg-1Cu2+处理下均表现出逐渐增加趋势,在800 mg·kg-1Cu2+处理下则先升后降,在1 000 mg·kg-1Cu2+处理下却逐渐降低。以上结果表明低浓度(200~400 mg·kg-1)Cu2+处理可以促进柠檬香蜂草叶绿素的合成,提高叶绿素含量,而更高浓度Cu2+处理却会降低叶绿素含量,并且会将这种影响持续较长时间。
2.3 Cu胁迫对柠檬香蜂草可溶性蛋白含量的影响
如图3所示,随着Cu2+胁迫处理时间的延长,柠檬香蜂草可溶性蛋白含量在 200 和400 mg·kg-1浓度下逐渐增加,而在800 mg·kg-1浓度下先出现短暂降低后趋于稳定(这是植物对Cu2+胁迫的一种解毒机制),但在1 000 mg·kg-1浓度下持续降低。同时,随着Cu2+胁迫浓度的增加,同一处理时间内柠檬香蜂草可溶性蛋白含量整体呈现出低促高抑的趋势,具体表现为Cu2+浓度低于400 mg·kg-1时可溶性蛋白含量持续增加,而在800和1 000 mg·kg-1浓度下随时间持续降低。说明柠檬香蜂草的蛋白质合成在低浓度Cu2+诱导下得到促进,而在高浓度Cu2+胁迫下受损,同时胁迫第14天是一个敏感时间节点,此时高浓度Cu胁迫下的可溶性蛋白含量下降最为显著。

实验数据均为3个重复平均值,不同字母表示处理间在0.05水平存在显著性差异(P<0.05);下同图1 不同浓度Cu2+处理下柠檬香蜂草地上部及地下部干重的变化The experimental data are 3 repeating mean values, the different normal letters indicate significant differences between treatments at the 0.05 level (P<0.05). Similarly hereinafterFig.1 Dry weight of aboveground and underground parts of M. officinalis under different concentrations of Cu2+
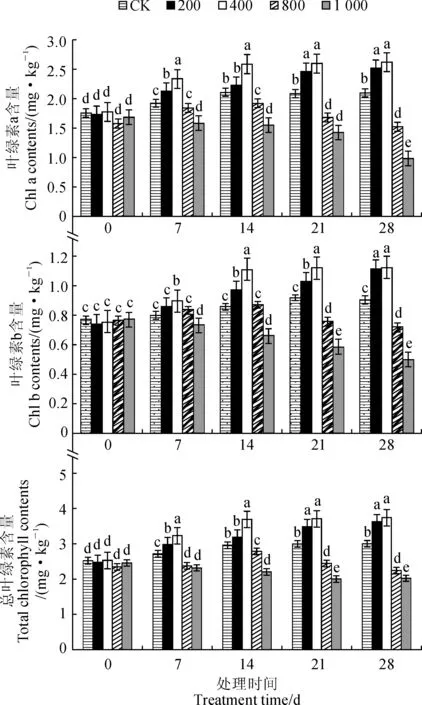
图2 不同Cu2+胁迫时间和浓度下柠檬香蜂草叶绿素a、叶绿素b和总叶绿素含量的变化Fig.2 The contents of chlorophyll a, chlorophyll b and total chlorophyll of M. officinalis under Cu2+ stress with different exposure time and concentrations
2.4 Cu胁迫对柠檬香蜂草MDA含量的影响
图4显示,随着Cu2+处理时间的延长,柠檬香蜂草的MDA含量在200~800 mg·kg-1Cu2+处理组中均比对照组显著增加,且在胁迫前期随胁迫程度加剧而升高;而MDA含量在1 000 mg·kg-1Cu2+处理组中于处理第14天显著升高,从第21天开始持续下降,显然植物受Cu2+胁迫影响的程度和膜脂过氧化程度增加,植物受到了更大伤害。同时,随着Cu2+胁迫浓度的增加,同期柠檬香蜂草的MDA含量整体呈现出逐渐增加的趋势,只有1 000 mg·kg-1胁迫处理MDA含量在第14天开始降低,但仍明显高于同期对照。可见,各浓度Cu2+胁迫均明显增加了柠檬香蜂草的MDA含量。

图3 不同Cu2+处理浓度和时间下柠檬香蜂草中可溶性蛋白含量的动态变化Fig.3 The soluble protein content in M. officinalis under Cu2+ stress with different exposure time and concentrations
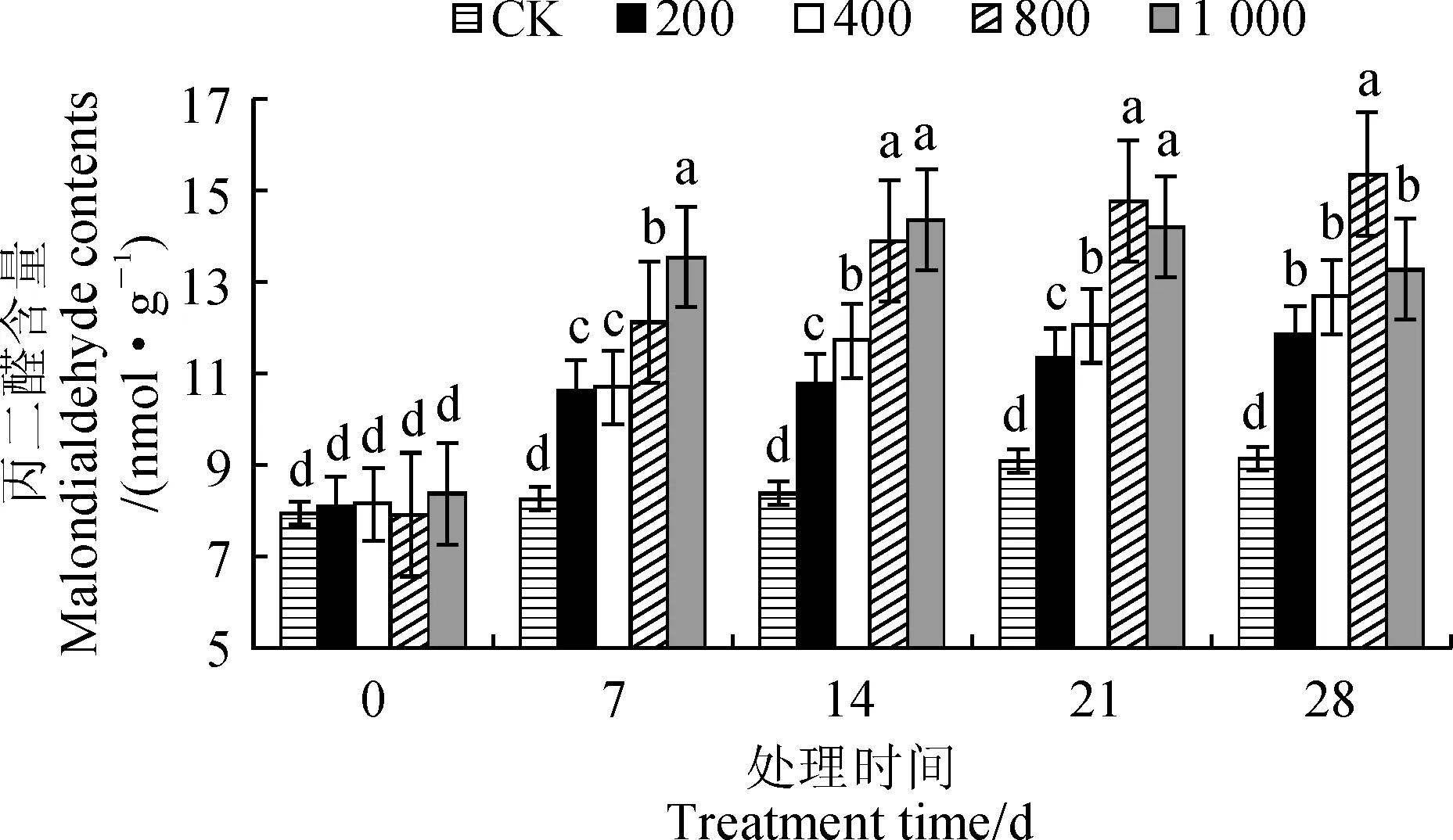
图4 不同Cu2+处理浓度和时间下柠檬香蜂草中MDA含量的动态变化Fig.4 The MDA content in M. officinalis under Cu2+ stress with different exposure time and concentrations
2.5 Cu胁迫对柠檬香蜂草抗氧化酶活性的影响
2.5.1SOD活性由图5,A可知:随着Cu2+胁迫时间的延长,柠檬香蜂草的SOD活性在200和400 mg·kg-1处理第14天时显著升高;在800 mg·kg-1处理第14天时增加,第21天时显著下降,呈现出先增后减的趋势;而在1 000 mg·kg-1处理下持续降低。同时,与同期对照相比较,柠檬香蜂草的SOD活性在200和400 mg·kg-1浓度下明显增强,而400 mg·kg-1处理又始终明显高于同期200 mg·kg-1处理;800 mg·kg-1浓度处理SOD活性在第14天时高于同期对照,随后下降并低于对照;1 000 mg·kg-1浓度处理SOD活性始终大幅低于同期对照。说明柠檬香蜂草生长在低浓度(200和400 mg·kg-1)Cu2+胁迫下并没有受到抑制,在800 mg·kg-1浓度下SOD仍可以做出应激保护表达以适应当前环境,但在高浓度Cu2+胁迫下SOD活性受到抑制,通过SOD自我调节缓解Cu2+毒害能力降低,且处理时间越长生长受损程度越重。

图5 不同Cu2+处理浓度和时间下柠檬香蜂草中SOD和GPX活性的动态变化Fig.5 The SOD and GPX activities in M. officinalis under Cu2+ stress with different exposure time and concentrations

表1 不同Cu2+浓度胁迫下柠檬香蜂草体内Cu积累状况
2.5.2GPX活性图5,B显示,随着Cu2+胁迫处理时间的延长,柠檬香蜂草的GPX活性在200和400 mg·kg-1处理下先降后升,并在处理第14天时最低;在800 mg·kg-1处理下逐渐增加,而在1 000 mg·kg-1处理下先升高后降低,且在处理第21 d时达到最高值。同时,与同期对照相比,各浓度Cu2+胁迫处理的GPX活性大都不同程度增强,尤其是处理后期这种趋势更明显;在Cu2+胁迫处理过程中,400 mg·kg-1处理柠檬香蜂草GPX活性始终处于最高水平,其次为800 mg·kg-1处理,其余处理无有交叉。整体上来看,各浓度Cu2+处理对柠檬香蜂草的GPX活性均具有不同程度促进效应,以增强植物对Cu2+胁迫的耐受性,但各处理浓度随时间的变化趋势不尽相同,中低浓度(200~800 mg·kg-1)处理的促进作用在中后期持续增强,而高浓度(1 000 mg·kg-1)处理的促进作用在后期会受到抑制。
2.6 Cu胁迫对柠檬香蜂草体内Cu2+含量和积累量的影响
由表1可知,柠檬香蜂草地上和地下部Cu2+含量均随土壤Cu2+胁迫浓度的增加而逐渐增加,它们分别处于11.17 ~ 95.28 mg·kg-1和25.36 ~ 901.68 mg·kg-1之间,地下部含量远大于相应地上部含量,且其间差异随处理浓度的增加而加大。同时,柠檬香蜂草体内Cu2+积累量随Cu2+胁迫浓度的增加而先升高后降低,并在Cu2+胁迫浓度为400 mg·kg-1达到最大值,它是CK组的13倍;另外,柠檬香蜂草对Cu2+的富集系数和耐性系数均随着胁迫浓度的增加而逐渐降低,各浓度组的富集系数均大于1,耐性系数均大于0.5。以上结果说明,柠檬香蜂草对Cu2+具有较强的耐受性及富集能力,主要铜积累部位为地下部。
3 讨 论
根系耐性指数是反映对重金属耐受能力的重要指标。当植物的耐性系数大于0.5时,说明植物具有较强的耐性,可以判断为耐性植物[20]。本研究中的柠檬香蜂草在0~1 000 mg·kg-1Cu2+胁迫下,各处理组根系耐性系数均大于0.5,表明柠檬香蜂草是一种铜耐性植物,其耐性和响应机制具有以下特征:
首先,低剂量铜胁迫具有刺激柠檬香蜂草植株生长的特性。如廖斌等[21]的研究显示较低的Cu浓度(40 μmol·L-1)对鸭跖草(Commelinacommunis)的生长会产生刺激作用;柠檬香蜂草的同科植物海州香薷(Elsholtziasplendens)生长也受到低浓度Cu2+(50 μmol·L-1)胁迫刺激[22]。本研究中当柠檬香蜂草植株处于在土壤Cu2+浓度为200和400 mg·kg-1环境时,植株地上部和地下部的生物量均高于对照组,这表明低浓度的Cu2+能够通过增强植物的根系活力来促进植物生长。
其次,低剂量铜胁迫促进了柠檬香蜂草叶绿素的合成。叶绿素是植物进行光合作用的主要色素,是一类与光合作用关系密切的最重要的色素[23];同时,叶绿素含量变化也是反映叶片光合能力的重要指标[24]。本试验在铜浓度为200和400 mg·kg-1的土壤环境条件下,柠檬香蜂草的叶绿素含量随着土壤Cu2+浓度的增加而呈现出上升的趋势,显示在这一浓度范围内,Cu2+促进了植株叶绿素的合成,提高了植物的光合作用强度,从而提升了植物的耐性。这可能与Cu2+参与光合作用过程中的电子传递、光合磷酸化和多种叶绿素酶的合成有关,因此铜对植物体内的叶绿素含量和光合作用都有直接影响。
再次,低剂量铜胁迫提高了柠檬香蜂草内酶促抗氧化系统活性和可溶性蛋白(SP)含量。植物体内抗自由基体系主要包括酶类阻止自由基形成以及通过非酶促抗氧化剂捕获不成对的电子使自由基失活两大系统。超氧化物歧化酶(SOD)是植物酶促抗氧化系统中第一种发挥作用的酶[25],它催化超氧阴离子发生歧化反应生成过氧化氢和分子氧,能对抗并阻断氧自由基对细胞造成的损害,并及时修复植物受损细胞,在保护细胞免受氧化损伤的过程中具有非常重要的作用[26-27]。同时,谷胱甘肽过氧化物酶(GPX)在植物的各个组织器官中分布广泛[28],它是细胞内抗脂质过氧化作用的酶性保护系统中的主要成分,能够催化过氧化脂质(lipid peroxidation,LPO)分解生成相应的醇,可以防止LPO均裂和引发脂质过氧化作用的链式支链反应,减少LPO的生成,保护膜结构及其功能的完整性,并以此来保护机体免受损害[29]。本研究中柠檬香蜂草SOD和GPX活性在200和400 mg·kg-1Cu2+处理下均得到促进和增强,处理组始终明显高于对照组,对Cu2+胁迫表现出积极响应,增强了植物对Cu2+的耐性,是对Cu2+胁迫增强的一种应激保护机制。
重金属离子在进入植物体后,会与其他化合物结合产生金属络合物或螯合物,从而抑制植物各种代谢活动,尤其是蛋白质的合成,其中可溶性蛋白(SP)的含量是衡量植物是否发生重金属胁迫的一项重要指标;MDA含量可以反映细胞膜受损程度,也被认为是衡量重金属胁迫程度的重要指标。本研究中柠檬香蜂草SP含量在200和400 mg·kg-1Cu2+胁迫时显著增加,同时MDA含量缓慢上升。柠檬香蜂草SP含量的提高,首先会降低细胞内溶质的溶质势,调节原生质体内外的渗透压,有助于维持细胞的正常代谢[30];其次还可以诱导产生Cu2+结合蛋白,从而降低Cu2+的毒性;再次还能有效抵抗MDA含量升高产生的负面影响,从而减轻铜对膜造成的伤害。因为MDA从膜脂过氧化释放后,会破坏蛋白质和核酸,还能够使纤维素分子间的桥键松弛或者抑制蛋白质的合成,还可以加剧膜的损伤及由MDA所导致的膜脂过氧化。本研究结果显示,随着土壤中Cu2+浓度的增加,柠檬香蜂草MDA含量在低浓度组升高速度比高浓度组迟缓一些,与SP含量的增加密不可分,这也是植物应对重金属胁迫的一系列重要解毒机制。
第四,柠檬香蜂草对Cu2+胁迫具有耐性,但存在一定的耐性限度。在本研究中,柠檬香蜂草叶绿素a、叶绿素b及总叶绿素含量在低浓度组升高,高浓度组降低,表明过量的Cu2+会破坏植物叶绿体的结构和功能。许多研究结果显示重金属能降低叶绿素含量,并且这种影响与植物叶片的衰老相关[31-33]。本研究中,处理组柠檬香蜂草MDA含量均持续上升,直到第14天时,1 000 mg·kg-1处理组才开始出现下降,这可能是重金属在植物体内过量而引发蛋白质代谢失调,导致植物无法进行正常的生物合成,同时干物质被消耗所致。另一方面,高浓度处理组的SP含量低于低浓度组,这一结果与Cu2+对菹草(PotamogetoncrispusL.)的作用相似[34],这与Cu进入细胞后通过提高蛋白水解酶的活性从而增强了原有蛋白质分解有关。许多研究显示,Cu2+会导致与蛋白质合成的相关细胞器受损,从而抑制新蛋白的合成,表现出对众多蛋白质合成酶系具有的毒害或钝化作用[35]。抗氧化酶系统的研究结果显示,SOD和GPX活性呈现出低促高抑的趋势,高浓度下对2种酶活的抑制作用可能是随着Cu2+浓度的升高,蛋白质与铜络合或替代的机会增加,从而导致SOD活性的下降[36]。SOD活性的下降会导致过量的O2-积累,通过加剧膜脂过氧化,最终增加膜的通透性[37],因此当铜的浓度过高时,会破坏细胞膜结构及其功能的完整性,从而表现出对植物的毒害作用。柠檬香蜂草生物量的变化与酶活的变化规律类似,表明高浓度的铜会抑制植物的正常生长。
目前,Cu2+超积累植物的判断标准为:植物地上部Cu2+含量超过1 000 mg·kg-1,富集系数大于1,生物量不能明显减少,地上部Cu2+含量大于地下部[38-39]。植物的修复能力采用重金属积累量来衡量[40]。本研究中,柠檬香蜂草地上部的最高Cu2+含量为95.28 mg·kg-1,富集系数大于1。据报道,紫花苜蓿(MedicagosativaL.)是一种具有铜污染土壤修复潜力的铜累积植物[41],其铜积累量在400 mg·kg-1Cu2+处理组达到最大(0.61 mg/盆),约为CK组的12倍,其生物量在Cu2+污染浓度为50 mg·kg-1时呈现降低趋势。本研究中柠檬香蜂草铜积累量在400 mg·kg-1Cu2+处理组为0.71 mg/盆,约为CK组的13倍,其生物量800 mg·kg-1Cu2+胁迫时开始降低。可见,柠檬香蜂草富集铜的能力虽达不到超积累植物的标准,但比紫花苜蓿具有更好的吸收铜的能力,加之柠檬香蜂草具有生长迅速、生长周期短、生物量积累快、经济价值高等特点,因此对铜污染土壤修复具有潜在的价值。
参考文献:
[1]F.H.TANI, S BARRINGTON. Zinc and copper uptake by plants under two transpiration rates. Part I. wheat (TriticumaestivumL.) [J].EnvironmentalPollution, 2015,138(3):538-547.
[2]王宏镔,王焕校,文传浩,等.镉处理下不同小麦品种几种解毒机制探讨[J].环境科学学报,2002,22(4):523-528.
WANG H B, WANG H X, WEN C H,etal. Some detoxication mechanisms of different wheat varieties under cadmium treatment [J].ActaScientiaeCircumstantiae, 2002,22(4): 523-528.
[3]张桂君,李景慧.植物修复在治理重金属污染土壤中的应用[J].广州化工,2012,3(22):24-25.
ZHANG G J, LI J H. Application of phytoremediation in the treatment of heavy metal contaminated soil [J].GuangzhouChemicalIndustry, 2012,22(40): 24-25.
[4]DICKINSON N. Phytoremediation [M]// Brian Thomas. Encyclopedia of Applied Plant Sciences, Elsevier, 2017:327.
[5]樊霆,叶文玲,陈海燕,等.农田土壤重金属污染状况及修复技术研究[J].生态环境学报,2013,22(10):1 727-1 736.
FAN T, YE W L,CHEN H Y,etal, Review on contamination and remediation technology of heavy metal in agricultural soil [J].EcologyandEnvironmentalSciences,2013,22(10):1 727-1 736.
[6]昝树婷,杨如意,汪伟伟.土壤理化性质与海州香薷铜锌积累的关系[J].生物学杂志,2011,1: 46-49.
ZAN S T, YANG R Y, WANG W W. The correlation of soil physiochemical properties and copper-zinc accumulation ofElsholtziasplendens[J].JournalofBiology, 2011, 1: 46-49.
[7]AMEL SOUHILA BELOUCHRANI,etal. Phytoremediation of soil contaminated with Zn using Canola (BrassicanapusL) [J].EcologicalEngineering, 2016,95(10): 43-49.
[8]ABOLFAZL SHAKERI, AMIRHOSSEIN SAHEBKAR, BEHJAT JAVADI.MelissaofficinalisL. - A review of its traditional uses, phytochemistry and pharmacology [J].JournalofEthnopharmacology, 2016,188(21):204-228.
[9]李锋民,熊治廷,胡洪营.海州香薷对铜的蓄积及铜的毒性效应[J].环境科学,2003,5(3):30-34.
LI F M, XIONG Z Y, HU H Y. Copper toxicity and accumulation inElsholtziasplendens[J].EnvironmentalScience, 2003,5(3):30-34.
[10]肖艳辉,何金明,潘春香,等.镉处理对薄荷植株生长及镉吸收累积的影响[J].江苏农业科学,2013,41(3):159-160.
XIAO Y H, HE J M, PAN C C,etal. Effects of cadmium treatment on growth and cadmium absorption and accumulation of mint plants [J].JiangsuGricultualSciences, 2013,41(3):159-160.
[11]张昌存,高洁.铬胁迫对薄荷生理特性的影响[J].中国农学通报,2011,27(4):115-119.
ZHANG C C, GAO J. Effect of chromium stress on physiological characteristics ofMenthahaplocalyxBriq[J].ChineseAgriculturalScienceBulletin,2011,27(4):115-119.
[12]张秀君,孙钱钱,乔双,等.菠菜叶绿素提取方法的比较研究[J].作物杂志,2011,3(1):57-60.
ZHANG X J, SUN Q Q, QIAO S,etal. A comparative study of chlorophyll extraction methods [J].Crops, 2011,3(1):57-60.
[13]X D LI, K Y ZHUANG, Z M LIU,etal. Overexpression of a novel NAC-type tomato transcription factor, SlNAM1, enhances the chilling stress tolerance of transgenic tobacco[J].JournalofPlantPhysiology,2016,204(10):54-65.
[14]邓丽莉,潘晓倩,生吉萍,等.考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J].食品科学,2012,33(24):185-189.
DENG L L,PAN X Q, SHENG J P,etal. Optimization of experimental conditions for the determination of water soluble protein in apple pulp using coomassie brilliant blue method [J].FoodScience,2012,33(24):185-189.
[15]L J CUI, Q HUANG, B YAN,etal. Molecular cloning and expression analysis of a Cu/Zn SOD gene (BcCSD1) fromBrassicacampestrisssp.chinensis[J].FoodChemistry, 2015,186(10):306-311.
[16]KRISZTINA BELA, EDIT HORVTH, AGNES GALLE,etal.Plant glutathione peroxidases: Emerging role of the antioxidant enzymes in plant development and stress responses [J].JournalofPlantPhysiology, 2015,176(3):192-201.
[17]YU L H, HAI Y Y, S Z H. Cadmium tolerance and accumulation by two species of Iris [J].Ecotoxicology, 2014, 16:557-563.
[18]严莉,李龙山,倪细炉. 5种湿地植物对土壤重金属的富集转运特征[J].西北植物学报,2016,10(36):2 078-2 085.
YAN L, LI L S, NI X L. Accumulation of soil heavy metals in five species of wetland plants[J].ActaBotanicaBoreali-OccidentaliaSinica,2016,10(36): 2 078-2 085.
[19]白向玉,刘汉湖,韩宝平,等.花卉植物修复剩余污泥中重金属的实验研究[J].环境科学与技术,2010,10(33):39-44.
BAI X Y, LIU H H, HAN B P,etal. Experimental study on ornamental plants remediation of heavy metals in sewage sludge [J].EnvironmentalScience&Technology, 2010,10(33):39-44.
[20]周燕,张桂花,徐迎春,等.铜对凤丹生长、生理及体内矿质元素吸收分配的影响[J].生态学杂志,2011,30(3):415-423.
ZHOU Y,ZHANG G H,XU Y C.etal. Effects of Cu onPaeoniaostiigrowth, physiology, and element absorption and allocation[J].ChineseJournalofEcology, 2011,30(3):415-423.
[21]廖斌,邓冬梅,杨兵,等.鸭跖草(Commelinacommunis)对铜的耐性和积累研究[J].生态学报,2003,23(11):797-801.
LIAO B, DENG D M, YANG B,etal. Cu tolerance and accumulation inCommelinacommunis[J].ActaScientiaeCircumstantiae, 2003,23(11):797-801.
[22]姜理英,杨肖娥,叶正钱.等.海州香薷和紫花香薷对Cu、Zn的吸收和积累[J].农业环境科学学报,2003,5:524-538.
JIANG L Y, YANG X E, YE Z Q.etal. Uptake and accumulation of Cu and Zn inElsholtziasplendensandElsholtziaargyi[J].JournalofAgro-EnvironmentScience, 2003, 5:524-538.
[23]HEE-OCK BOO, SUNG-JINHWANG, CHUN S B,etal. Extraction and characterization of some natural plant pigments [J].IndustrialCropsandProducts, 2012,40(10):129-135.
[24]SUNAYANA GOSWAMI, SUCHISMITA DAS. Copper phytoremediation potential ofCalandulaofficinalisL. and the role of antioxidant enzymes in metal tolerance [J].EcotoxicologyandEnvironmentalSafety, 2016,126(4):211-218.
[25]TEHSEEN ASGHARA,YASIR JAMIL, MUNAWAR IQBAL,etal. Laser light and magnetic field stimulation effect on biochemical, enzymes activities and chlorophyll contents in soybean seeds and seedlings during early growth stages[J].JournalofPhotochemistryandPhotobiologyB:Biology,2016,165(10), 283-290.
[26]MOHAMMED MOURADIA,ABDELAZIZ BOUIZGARENB, MOHAMED FARISSI,etal. Seed osmopriming improves plant growth, nodulation, chlorophyll fluorescence and nutrient uptake in alfalfa (MedicagosativaL.)-rhizobia symbiosis under drought stress [J].ScientiaHorticulturae, 2016,213(10):232-242.
[27]HESHAM F, ALHARBYA, EHAB M R,etal. The alteration of mRNA expression of SOD and GPX genes, and proteins in tomato (LycopersiconesculentumMill) under stress of NaCl and/or ZnO nanoparticles [J].SaudiJournalofBiologicalSciences, 2016,23(11):773-781.
[28]ITI SHARMA, PARVAIZ AHMAD. Catalase: A Versatile Antioxidant in Plants [M]. Oxidative Damage toPlants, 2014:131.
[30]AURENIVIA BONIFACIOA,FABRCIO E.L. CARVALHOA, MARCIO O. MARTINS,etal. Silenced rice in both cytosolic ascorbate peroxidases displays pre-acclimation to cope with oxidative stress induced by 3-aminotriazole-inhibited catalase[J].JournalofPlantPhysiology, 2016,201(8):17-27.
[31]MARTIN J. MAUNDERS, STANLEY B. BROWN, HAROLD W. WOOLHOUSE. The appearance of chlorophyll derivatives in senescing tissue. [J].Photochemistry, 1983,22(1):2 443-2 446.
[32]鲁先文,余林,宋小龙,等.土壤Cr6+污染对小麦种子萌发和幼苗生理生化特性的影响[J].农业与技术,2007,4(27):60-63.
LU X W,YU L,SONG X L,etal. Effect of heavy metal Cr on chlorophyll synthesis in wheat [J].Agriculture&Technology, 2007,4(27):60-63.
[33]SUNAYANA GOSWAMI, SUCHISMITA DAS. Copper phytoremediation potential ofCalandulaofficinalisL. and the role of antioxidant enzymes in metal tolerance [J].EcotoxicologyandEnvironmentalSafety, 2016,4(126):211-218.
[34]李婉璐,张光生,成小英. Cd2+、Cu2+、Zn2+、Pb2+对菹草生长胁迫影响及其应答机制[J]. 食品与生物技术学报,2016,9(35):1 002-1 007.
LI W L,ZHANG G S,CHENG X Y. Stress effect and response mechanism of Cd2+, Cu2+, Zn2+and Pb2+onPotamogetoncrispusL. growth[J].JournalofFoodScienceandBiotechnology, 2016,9(35):1 002-1 007.
[35]GUSTAVO BRUNETTO, GEORGE WELLINGTON BASTOS DE MELO, ROBERTO TERZANO,etal. Copper accumulation in vineyard soils: Rhizosphere processes and agronomic practices to limit its toxicity [J].Chemosphere, 2016,162(11):293-307.
[36]衣艳君,李芳柏,刘家尧.尖叶走灯藓 (Plagiomniumcuspidatum)叶绿素荧光对复合重金属胁迫的响应[J].生态学报, 2008,28(11):5 438-5 444.
YI Y J,LI F B,LIU J Y, Physiological response of chlorophyll fluorescence in mossPlagiomniumcuspidatumto mixture heavy metal solution [J].ActaEcologicaSinica,2008,28(11):5 438-5 444.
[38]MOHAMMADHOSSEIN RAVANBAKHSH, ABDOL-MAJID RONAGHI, SEYED MOHSEN TAGHAVI,etal. Screening for the next generation heavy metal hyperaccumulators for dryland decontamination [J].JournalofEnvironmentalChemicalEngineering, 2016,4(2):2 350-2 355.
[39]邢丹,刘鸿雁.重金属对植物的毒害及植物的耐性机制[J].安徽农业科学,2009,37(7): 3 208-3 209, 3 329.
XING D,LIU H Y. Research advances in selecting heavy metals tolerance and hyperaccumulator in the lead -zinc mine area [J].JournalofAnhuiAgri, 2009,37(7): 3 208-3 209, 3 329.
[40]BROOKS R R, GENERAL INTRODUCTION. Plants Hyperaccumulate Heavy Metals [M].W Wallingford: CAB International, 1998: 15.
[41]王文星,曹成有,崔振波,等.紫花苜蓿对土壤中铜的富集效应及其生理响应[J].东北大学学报,2006, 10:1 161-1 164.
WANG W X, CAO C Y, CUI Z B,etal. Copper enrichment from contaminated soil byAlfalfaand its physiological response [J].JournalofNortheasternUniversity(Natural Science), 2006,10:1 161-1 164.
