中间锦鸡儿WRKY75基因对拟南芥耐受盐和ABA能力的影响
2018-04-08万永青毛铭铢万东莉柳金华王光霞李国婧王瑞刚
万永青,毛铭铢,万东莉,柳金华,王光霞,李国婧,王瑞刚*
(1 内蒙古农业大学 生命科学学院,呼和浩特 010018;2 中国农业科学院 草原研究所,呼和浩特 010010;3 内蒙古自治区植物逆境生理与分子生物学重点实验室,呼和浩特 010018;4 农业部草地生态与修复治理重点实验室,呼和浩特 010010)
盐碱和干旱等非生物胁迫是造成农作物等减产的主要原因之一[1]。内蒙古地区处干旱半干旱区域,农业生产中的干旱、低温和盐碱化问题比较突出。中间锦鸡儿(Caraganaintermedia)属于豆科(Fabaceae)锦鸡儿属(Caragana)蝶形花亚科 (Papilionoideae)植物,与小叶锦鸡儿、柠条锦鸡儿亲缘关系较近[2],统称为柠条,分布于山西、陕西、宁夏及内蒙古自治区等省、区。柠条是典型的旱生植物,生态适应性极强,被广泛应用于生态修复工程。柠条抗旱、抗寒、耐盐碱、耐瘠薄,因此对其耐逆境的分子机制研究逐渐成为热点。对中间锦鸡儿和柠条锦鸡儿在不同逆境处理条件下的实时荧光定量PCR(qRT-PCR)基因表达分析的内参基因进行了筛选[3-4],为研究锦鸡儿属植物的基因功能奠定了重要基础。在烟草中过量表达中间锦鸡儿miR2118能增强植物的耐旱能力,并改变植物正常形态的建成[5]。在拟南芥中过量表达中间锦鸡儿CiNAC3和CiNAC4,增强了植物对盐胁迫的耐受能力[6]。中间锦鸡儿CiDHN1的表达受冷、脱水和NaCl等非生物胁迫的诱导,在拟南芥过量表达CiDHN1后,其中表达量最强的株系表现出对NaCl处理敏感的表型[7]。
WRKY转录因子是植物最大的转录调节子家族之一,是信号网络不可缺少的部分,调节许多植物生物学进程,例如防御反应、衰老和非生物胁迫响应等[8]。WRKY转录因子最典型的特征就是其DNA结合结构域,一般由约60个氨基酸组成,靠近N-端含有高度保守的氨基酸序列WRKYGQK,在C-端含有一个非典型的锌指结构(CX4-5CX22-23HXH或者 CX7CX23HXC)[8]。根据WRKY结构域的数目和锌指的结构,WRKY转录因子可分为三大类:第Ⅰ类,含有2个WRKY结构域,锌指结构类型为C2H2(CX4-5CX22-23HXH)型;第Ⅱ类,含有1个WRKY结构域,锌指结构为C2H2(CX4-5CX22-23HXH)型,第Ⅱ类又可以分为a、b、c、d和e 5个亚族;第Ⅲ类,含有1个WRKY结构域,锌指结构为C2HC(CX7CX23HXC)型[9]。
WRKY转录因子在植物体内的表达受各种环境因子诱导,包括各种非生物和生物胁迫[10-14]。在拟南芥中表达对干旱响应的小麦TaWRKY1和TaWRKY33增强了拟南芥对干旱和热的抵抗能力[15]。CmWRKY1通过调节ABA相关基因而增强菊花的耐旱能力[16]。AtWRKY53通过调节气孔运动而负调节拟南芥对干旱的耐受能力[17]。拟南芥功能获得型突变体adt中通过激活表达AtWRKY57而赋予了拟南芥抗旱的能力[18]。拟南芥中表达野生大豆的WRKY20增强了植物的耐旱能力[19]。水稻的2个等位基因OsWRKY45-1和OsWRKY45-2在ABA信号途径和对盐的适应上的作用不同,OsWRKY45-2过表达株系增强了对ABA的敏感性、减弱了对盐的耐受能力,而OsWRKY45-1过表达株系对ABA的敏感性减弱,同时对盐的耐受性与对照相比无明显区别[20]。此外,OsWRKY45-1和OsWRKY45-2均负调节水稻对冷和干旱胁迫的响应[20]。过量表达AtWRKY25和AtWRKY39均提高了拟南芥对热胁迫的耐受能力[21-22]。AtWRKY6和AtWRKY42通过调节PHO1的表达而参与拟南芥对低磷的响应[23]。过量表达OsWRKY74增强了水稻对磷饥饿的耐受性[24]。过量表达OsWRKY89增强了水稻对紫外辐射的耐受能力[25]。AtWRKY70和AtWRKY54通过调节气孔开度而参与拟南芥对渗透胁迫的响应[26]。
本研究在中间锦鸡儿干旱转录组库中,筛选、克隆到了1个CiWRKY75基因,进行了生物信息学分析和亚细胞定位研究,并在拟南芥中过量表达CiWRKY75对其在植物抵抗盐和ABA处理中的功能进行探讨,以期为中间锦鸡儿耐逆境胁迫的分子机制研究提供理论基础和实验支持。
1 材料和方法
1.1 植物材料、菌体和载体
中间锦鸡儿的种子于2014年采自内蒙古乌兰察布市四子王旗(111.69°E, 41.44°N)。拟南芥Columbia-0(Col-0)野生型种子由实验室保存。大肠杆菌DH5α和根癌农杆菌GV3101均为本实验室保藏菌种。连接载体pEASY-Blunt Simple购自北京全式金生物技术有限公司;表达载体pCambia1302和pCanG-HA由中国科学院遗传与发育生物学研究所谢旗研究员惠赠。
1.2 方 法
1.2.1中间锦鸡儿培养及胁迫处理选取均一饱满的中间锦鸡儿种子播种于装有蛭石和营养土(2∶1)的培养钵中,置于温室,温度23~25 ℃、16 h光照/8 h黑暗的条件下培养。生长25 d后选取长势一致的中间锦鸡儿幼苗用作盐和ABA处理。处理前将中间锦鸡儿幼苗小心地从培养钵中取出,洗净根上的土和蛭石,并浸入水中生长2 d后,分别浸于300 mmol/L NaCl溶液和100 μmol/L ABA溶液中[27],在处理的0、1、3、6、9、12、24和48 h取样。每个处理时间点取3株植物混合作为后续检测的样品,每个处理重复3次。
1.2.2总RNA提取和cDNA合成利用Trizol试剂提取中间锦鸡儿地上组织总RNA,方法详见文献[6]。cDNA的合成使用M-MLV反转录酶(TaKaRa公司),具体步骤按产品说明书进行。
1.2.3基因全长克隆及进化树构建依据中间锦鸡儿WRKY75基因序列,利用Primer Premier 5.0设计基因全长扩增引物CiWRKY75-HA-F/CiWRKY75-HA-R (表1),并以中间锦鸡儿cDNA为模板,通过PCR技术对目的基因进行扩增,用胶回收试剂盒(百泰克)回收目的PCR产物,并与pEASY-Blunt Simple载体(全式金)连接,转化大肠杆菌DH5α,通过蓝白斑筛选挑取单菌落利用M13引物进行PCR验证,将阳性克隆进行测序验证。利用DNAMAN7分析CiWRKY75的ORF序列及其推导的氨基酸序列,采用NCBI CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对CiWRKY75的保守结构域进行预测。利用NCBI blastp对序列进行比对分析,选取相关序列,运用MEGA6软件进行align,采用邻近法构建系统进化树,Bootstrap值设为1 000次。
1.2.4CiWRKY75与GFP融合表达载体构建以中间锦鸡儿的cDNA为模板,利用引物 CiWRKY75-GFP-F/CiWRKY75-GFP-R(表1)对目的基因CiWRKY75进行扩增,与克隆载体pEASY-Blunt Simple连接后,将阳性克隆进行测序验证。测序验证正确后,利用限制性内切酶NcoⅠ/SpeⅠ(Thermo Fisher Scientific)将目的基因切下,通过T4连接酶(Thermo Fisher Scientific)将目的基因和同样经过NcoⅠ/SpeⅠ酶切过的pCambia1302载体(含有35S启动子)相连接,获得CiWRKY75与GFP融合表达载体35S∷CiWRKY75-GFP。
1.2.5亚细胞定位将重组质粒35S∷CiWRKY75-GFP转入到拟南芥原生质体,拟南芥原生质体制备及转化方法参考Yoo等的方法[28]。利用荧光显微镜(Zeiss)对转化重组质粒的原生质体进行GFP荧光信号观察。
1.2.6不同胁迫下CiWRKY75基因表达分析利用罗氏LightCycler 480 Real-Time PCR System,TaKaRa的SYBR Premix Ex Taq Ⅱ试剂盒进行qRT-PCR检测。PCR反应体系为:SYBR Ⅱ 10 μL,正、反向引物各0.4 μL (10 μmol/L),cDNA模板(反转录得到的cDNA原液稀释16倍)5 μL,DEPC水4.2 μL。PCR反应程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸15 s,40个循环。
采用2-ΔΔCT法对基因表达量进行分析。以中间锦鸡儿的CiEF1α为内参基因。每个样品3个技术重复,每个实验进行3次独立的生物学重复。引物序列见表1。
1.2.7CiWRKY75过量表达载体构建及拟南芥遗传转化利用限制性内切酶SalⅠ/SpeⅠ(Thermo Fisher Scientific)将1.2.3中测序验证的阳性克隆质粒中的目的基因片段切下,并通过T4连接酶将目的基因与经过相同酶切过的pCanG-HA表达载体(含有35S启动子)相连接,获得重组表达载体35S∷CiWRKY75。利用电转化法将重组表达载体导入到农杆菌GV3101中。采用浸花法[29]转化野生型拟南芥。采用卡那霉素抗性筛选法对转基因纯合体植株进行筛选。筛选获得T3代纯合体植株后,利用基因特异性引物CiWRKY75-F/CiWRKY75-R,通过qRT-PCR对CiWRKY75在转基因拟南芥中的表达量进行检测。以拟南芥AtEF1α基因作为内参(表1),采用2-ΔΔCT法对基因表达量进行分析。

表1 PCR引物
1.2.8拟南芥胁迫处理(1)萌发率检测:将转基因和野生型拟南芥种子用酒精灭菌后播种于1/2 MS、分别含有200 mmol/L NaCl或2 μmol/L ABA的1/2 MS培养基平板上,4 ℃黑暗春化3 d后置于温室培养,并进行萌发率统计,每天统计1次萌发率。每处理3个重复,共进行3次独立的生物学重复实验。
(2)盐胁迫处理:将转基因和野生型拟南芥种子用酒精灭菌后播种于1/2 MS培养基上,4 ℃黑暗春化3 d后置于温室培养。待长出2片真叶后,移至浸透营养液的蛭石与营养土为2∶1的混合土中继续培养10 d后,浇200 mmol/L NaCl溶液进行耐盐胁迫处理,共浇3次(每次间隔4~5 d)。培养温度23~25 ℃,光周期16 h光照/8 h黑暗。每个处理进行3次独立的生物学重复实验。
2 结果与分析
2.1 CiWRKY75基因克隆鉴定
从中间锦鸡儿干旱转录组数据库中筛选获得注释为CiWRKY75的基因片段1 087 bp,NCBI比对发现该基因具有完整的开放阅读框(ORF)。根据该基因ORF序列设计特异性引物,以中间锦鸡儿cDNA为模板,对CiWRKY75基因进行特异扩增(图1),并对扩增产物进行测序验证。测序结果显示克隆得到的CiWRKY75基因ORF序列长为570 bp,编码189个氨基酸(图2)。
2.2 CiWRKY75的保守结构域和进化树分析
采用NCBI CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对CiWRKY75的保守结构域进行分析。结果(图2)显示,CiWRKY75具有一个WRKY基序(WRKYGQK)和一个C2H2型锌指结构(CX4CX23HXH)。将CiWRKY75氨基酸序列在NCBI进行相似性比对分析,结果显示CiWRKY75与已经鉴定的豆科植物蒺藜苜蓿(Medicagotruncatula)的WRKY(XP_013447931)和大豆相似性分别达到76%(序列覆盖率为98%)和73%(序列覆盖率为100%);与拟南芥的AtWRKY75和AtWRKY45相似性分别为87%和78%,序列覆盖率均为48%。
为了进一步分析CiWRKY75与其他物种同源WRKY的进化关系,选取拟南芥、大豆、蒺藜苜蓿、鹰嘴豆和二穗短柄草等物种的WRKY蛋白,利用MEGA6.0构建系统进化树(图3),聚类分析结果显示,中间锦鸡儿WRKY75与蒺藜苜蓿WRKY、大豆WRKY75和木豆WRKY75聚到一起,表明其亲缘关系比较近。

M. DL2000;1.CiWRKY75 ORF图1 PCR克隆CiWRKY75Fig.1 The electrophoresis of the cloned CiWRKY75 using PCR

方框表示保守的WRKY结构域,圆圈表示锌指结构图2 CiWRKY75的ORF序列及推导的氨基酸序列The box indicates conserved WRKY domain, the circles indicate zinc finger motifsFig.2 The ORF and deduced amino acid sequences of CiWRKY75
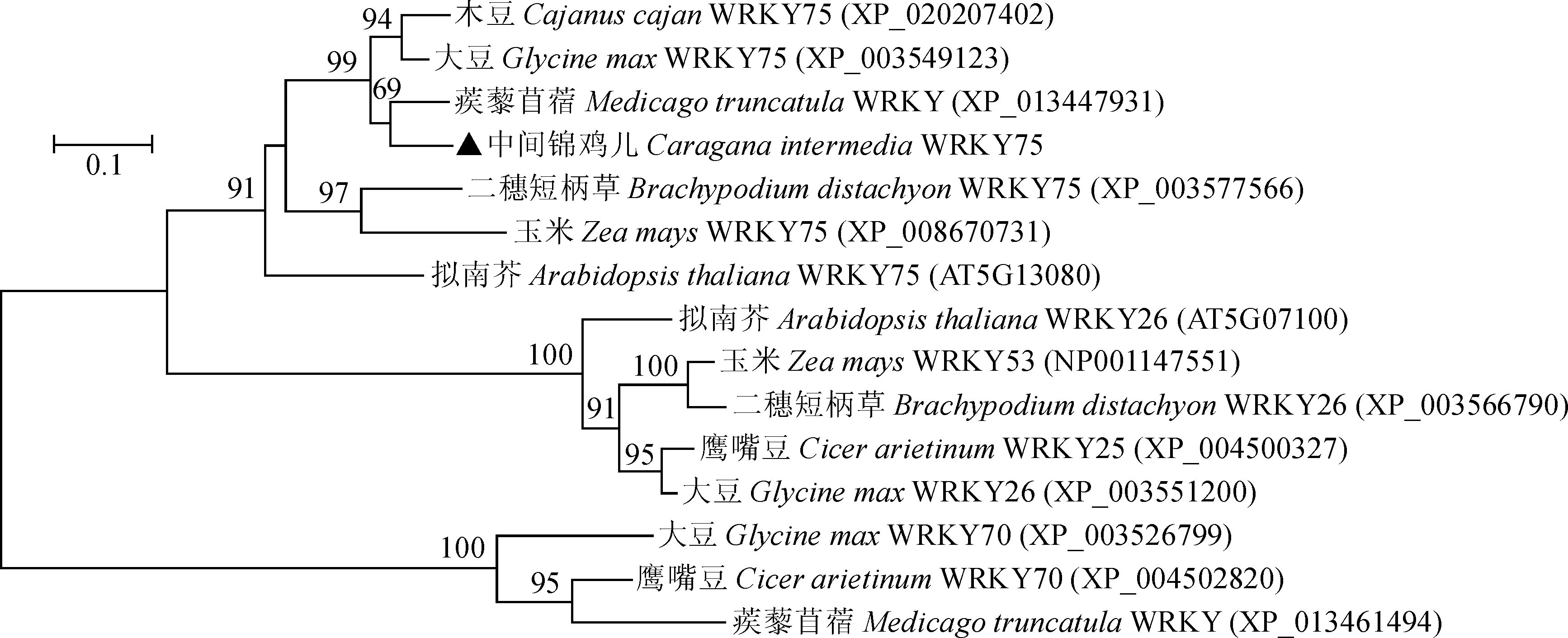
进化树采用邻近法构建,Bootstrap值设为1 000次图3 CiWRKY75的系统进化树The phylogenetic tree is constructed using the neighbor joining method, Bootstrap values based on 1 000 replicationsFig.3 The phylogenetic tree of CiWRKY75

图4 拟南芥叶肉细胞原生质体中35S∷CiWRKY75-GFP的亚细胞定位Fig.4 The nuclear localization of 35S∷CiWRKY75-GFP in Arabidopsis thaliana mesophyll protoplast
2.3 CiWRKY75的亚细胞定位研究
为了研究CiWRKY75亚细胞水平定位,将CiWRKY75的cDNA与GFP报告基因相融合构建35S启动子驱动的重组表达载体35S∷CiWRKY75-GFP,并转化野生型拟南芥原生质体,培养约16 h后进行GFP荧光信号观察。结果(图4)显示,对照空载体35S∷GFP的荧光信号遍布整个细胞,而35S∷CiWRKY75-GFP的荧光信号只在细胞核观察到,这与转录因子在细胞核表达的规律相符合。
2.4 CiWRKY75基因对盐胁迫和ABA处理响应的表达分析
为了研究CiWRKY75对盐胁迫和ABA处理的响应情况,利用qRT-PCR检测了高盐和ABA处理下中间锦鸡儿中CiWRKY75基因的表达模式。结果显示,高盐胁迫能强烈诱导CiWRKY75基因的表达;在盐处理1 h时,CiWRKY75基因明显被诱导表达,是对照的2.7倍;随着处理时间的延长,CiWRKY75基因的表达量增强,在48 h表达量是对照的215.6倍。在ABA处理下,与对照相比,CiWRKY75基因在1 h被诱导表达,在6 h达到峰值,是对照的2.9倍 (图5)。表明CiWRKY75基因可能参与了中间锦鸡儿对盐和ABA响应的分子信号途径。
2.5 过量表达CiWRKY75减弱了拟南芥对盐胁迫的耐受能力
为了进一步研究CiWRKY75在拟南芥对逆境胁迫响应中的功能,构建了35S启动子驱动下的CiWRKY75重组表达载体35S∷CiWRKY75,并转化野生型拟南芥,通过卡那霉素抗性筛选转基因植物。根据孟德尔遗传定律,T2代植物中符合3∶1(抗性苗∶非抗性苗)分离规律的转基因株系被认为是单拷贝插入,并继续用于T3代纯合体筛选,最终筛选获得15个CiWRKY75过量表达拟南芥转基因纯合体株系(CiWRKY-OE1至OE15)。利用qRT-PCR对过表达株系中CiWRKY75的相对表达量进行检测(图6),结果显示CiWRKY75在15个过表达株系中均有不同程度的表达,后续实验选择过表达株系OE3、OE5和OE6作为研究材料。
为了检测CiWRKY75过表达转基因拟南芥对盐的耐受能力,进行了萌发率和4周苗龄植物对盐的耐受力检测实验。萌发率检测结果显示(图7),在正常的1/2 MS培养基上,野生型(WT)和转基因拟南芥没有区别,在萌发的第4天萌发率均达到100%。在含有200 mmol/L NaCl的1/2 MS培养基上,与WT相比,转基因拟南芥的萌发率降低,在萌发的第10天,WT的萌发率为80%,OE3、OE5和OE6的萌发率分别为69.6%、61.4%和65.9%。对4周苗龄的植物浇200 mmol/L NaCl进行盐胁迫处理,以正常浇水作为对照。实验结果显示(图8),在正常条件下WT和转基因植物没有明显的区别;在盐胁迫条件下,与WT相比,转基因植物叶子萎蔫发白,表现出不耐盐的表型。以上研究表明过量表达CiWRKY75降低了拟南芥对盐的耐受性。

图5 qRT-PCR检测盐和ABA处理下中间锦鸡儿中CiWRKY75的表达模式Fig.5 The expression patterns of CiWRKY75 in C. intermedia under salt and ABA treatments examined by qRT-PCR
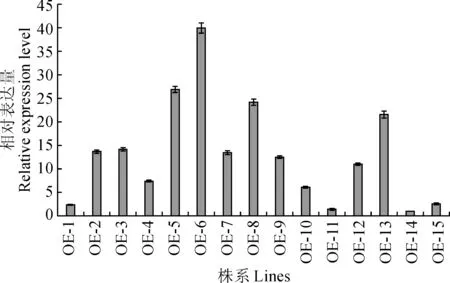
图6 过表达株系中CiWRKY75的表达Fig.6 The expression levels of CiWRKY75 in the CiWRKY75 over-expression lines

图7 盐胁迫下野生型拟南芥和CiWRKY75过表达株系的萌发率检测Fig.7 The germination rate of wild-type Arabidopsis and CiWRKY75 over-expression lines under salt treatment

图8 CiWRKY75过表达株系对盐的耐受能力检测Fig.8 Salt tolerance examination of CiWRKY75 over-expression lines

图9 ABA处理下野生型拟南芥及其CiWRKY75过表达株系的萌发率检测Fig.9 The germination rate of wild-type Arabidopsis thaliana and CiWRKY75 over-expression lines under ABA treatment
2.6 过量表达CiWRKY75增强了ABA对拟南芥种子萌发的抑制作用
将CiWRKY75转基因拟南芥播种于含有2 μmol/L ABA的1/2 MS培养基平板上,以正常1/2 MS培养基作为对照,进行ABA抑制的种子萌发检测实验。结果显示,在正常1/2 MS培养基平板上,野生型拟南芥与转基因株系OE5和OE6的萌发率没有明显的区别,在萌发后的第2天均达到98%以上。在含有2 μmol/L ABA的培养平板上,与WT相比,转基因株系OE5和OE6的萌发率明显被抑制,在萌发的第5天,WT的萌发率为25.9%,而OE5和OE6分别为10.3%和9.6%(图9)。表明ABA对过量表达CiWRKY75拟南芥种子萌发的抑制作用增强。
3 讨 论
目前,在不同植物中已发现了大量的WRKY家族成员。例如拟南芥中鉴定了72个WRKY转录因子[11],水稻中103个[12],葡萄中80个[30],大豆中182个[31],苹果127 个[32],二穗短柄草86个[33],木薯85个[34],萝卜95个[35]。本课题组对中间锦鸡儿的一个WRKY转录因子编码基因CiWRKY2进行克隆和表达分析,基因表达模式检测表明干旱、盐碱、高温、低温和ABA处理均能诱导其表达,推测CiWRKY2可能参与了中间锦鸡儿对逆境胁迫响应的分子信号途径[36]。此外,杨杞等对柠条锦鸡儿一个WRKY转录因子CkWRKY1进行了克隆和干旱胁迫下的表达分析[37]。本研究对从中间锦鸡儿干旱转录组文库中获得的一个WRKY转录因子编码基因CiWRKY75,进行了克隆鉴定分析。通过保守结构域分析显示CiWRKY75包含一个典型的“WRKYGQK”基序和一个C2H2型锌指结构,属于第II类WRKY转录因子。系统进化树结果显示,在拟南芥的WRKY基因家族中AtWRKY75与CiWRKY75的相似度最高。拟南芥中,AtWRKY75是磷饥饿信号途径的正调控因子,是根发育的负调控因子[38-39]。但是中间锦鸡儿CiWRKY75是否参与磷信号和影响根的发育有待于进行实验研究。
基因表达模式检测结果显示CiWRKY75对盐胁迫处理响应强烈,进一步的研究表明过量表达CiWRKY75基因降低了拟南芥对盐胁迫的耐受能力,在种子萌发期间过表达转基因株系与野生型相比在200 mmol/L NaCl培养平板上的萌发率降低,表明CiWRKY75是植物响应盐信号途径的负调控因子。但是CiWRKY75是如何起作用的?通过调节哪些基因而参与到盐信号途径中的?具体的分子机制还不清楚。
根据已有研究,不同的WRKY在植物抵抗盐等逆境胁迫信号途径中的作用不同,并且一个WRKY可能参与多种逆境胁迫途径。例如在拟南芥中过量表达大豆GmWRKY13和GmWRKY54基因后发现,GmWRKY54过表达转基因植物提高了对干旱和盐害的忍耐性,而GmWRKY13过表达转基因植株则对盐害和甘露醇胁迫表现出了易感的表型并对ABA的敏感性降低[10]。过量表达MtWRKY76增强蒺藜苜蓿抗旱和耐盐能力[40]。棉花GhWRKY41正调节干旱和盐胁迫,在烟草中过表达GhWRKY41增强植物对干旱和盐的耐受性[41]。烟草中过表达GhWRKY25导致植物对干旱耐受力减弱、对盐的耐受力增强[42]。我们在研究中也发现,CiWRKY75除了对盐胁迫处理有响应,对ABA处理也有响应。在ABA处理下,CiWRKY75过表达转基因植物的种子萌发率明显低于野生型拟南芥,表明过量表达CiWRKY75增强了ABA对拟南芥种子萌发的抑制作用,CiWRKY75正调控ABA抑制的种子萌发。但在幼苗的生长过程中CiWRKY75是否影响根的伸长,需要进一步的实验研究。综合以上研究结果,作为一个转录调控因子,CiWRKY75具体是如何通过调控其下游的基因而参与逆境胁迫响应分子途径的,是我们下一步重点展开的研究内容。
参考文献:
[1]BOYER J S. Plant productivity and environment[J].Science, 1982,218(4 571):443-448.
[2]宋俊双,王赞,高洪文. 三种锦鸡儿遗传多样性ISSR分析[J]. 草地学报,2006,14(4):384-386.
SONG J S,WANG Z,GAO H W. ISSR analysis on the genetic diversity of threeCaraganaFabr. species[J].ActaAgrestiaSinica,2006,14(4):384-386.
[3]YANG Q,YIN J,LI G,etal. Reference gene selection for qRT-PCR inCaraganakorshinskiiKom. under different stress conditions[J].MolecularBiologyReports, 2014,41(4):2 325-2 334.
[4]ZHU J,ZHANG L,LI W,etal. Reference gene selection for quantitative real-time PCR normalization inCaraganaintermediaunder different abiotic stress conditions[J].PLoSOne, 2013,8(1):e53196.
[5]WU B F,LI W F,XU H Y,etal. Role of cin-miR2118 in drought stress responses inCaraganaintermediaand tobacco[J].Gene, 2015,574(1):34-40.
[6]HAN X,FENG Z,XING D,etal. Two NAC transcription factors fromCaraganaintermediaaltered salt tolerance of the transgenicArabidopsis[J].BMCPlantBiology, 2015,15(1):208.
[7]万永青,杨洋,张春林,等. 中间锦鸡儿DHN1基因克隆及表达分析[J]. 中国生物工程杂志, 2016, (4):88-96.
WAN Y Q,YANG Y,ZHANG C L,etal. Cloning and expression analysis ofCiDHN1 gene inCaraganaintermedia[J].ChinaBiotechnology,2016, (4):88-96.
[8]RUSHTON P J,SOMSSICH I E,RINGLER P,etal. WRKY transcription factors[J].TrendsPlantScience, 2010,15(5):247-258.
[9]EULGEM T,RUSHTON P J,ROBATZEK S,etal. The WRKY superfamily of plant transcription factors[J].TrendsPlantScience, 2000,5(5):199-206.
[10]ZHOU Q Y,TIAN A G,ZOU H F,etal. Soybean WRKY-type transcription factor genes,GmWRKY13,GmWRKY21, andGmWRKY54, confer differential tolerance to abiotic stresses in transgenicArabidopsisplants[J].PlantBiotechnolJournal, 2008,6(5):486-503.
[11]DONG J,CHEN C,CHEN Z. Expression profiles of theArabidopsisWRKY gene superfamily during plant defense response[J].PlantMolecularBiology, 2003,51(1):21-37.
[12]RAMAMOORTHY R,JIANG S Y,KUMAR N,etal. A comprehensive transcriptional profiling of the WRKY gene family in rice under various abiotic and phytohormone treatments[J].PlantCellPhysiology, 2008,49(6):865-879.
[13]ZHANG J,PENG Y,GUO Z. Constitutive expression of pathogen-inducibleOsWRKY31 enhances disease resistance and affects root growth and auxin response in transgenic rice plants[J].CellResearch, 2008,18(4):508-521.
[14]YU F, HUA Y, LU W,etal. GhWRKY15, a member of the WRKY transcription factor family identified from cotton (GossypiumhirsutumL.), is involved in disease resistance and plant development[J].BMCPlantBiology, 2012,12:144.
[15]HE G H,XU J Y,WANG Y X,etal. Drought-responsive WRKY transcription factor genesTaWRKY1 andTaWRKY33 from wheat confer drought and/or heat resistance inArabidopsis[J].BMCPlantBiology, 2016,16(1):116.
[16]FAN Q Q,SONG A P,etal.CmWRKY1 enhances the dehydration tolerance of chrysanthemum through the regulation of ABA-associated genes[J].PLoSOne, 2016,11(3):e0150572.
[17]SUN Y D,YU D Q. Activated expression ofAtWRKY53 negatively regulates drought tolerance by mediating stomatal movement[J].PlantCellReports, 2015,34(8):1 295-1 306.
[18]JIANG Y,LIANG G,YU D. Activated expression of WRKY57 confers drought tolerance inArabidopsis[J].MolecularPlant, 2012,5(6):1 375-1 388.
[19]LUO X,BAI X,SUN X,etal. Expression of wild soybeanWRKY20 inArabidopsisenhances drought tolerance and regulates ABA signalling[J].JournalofExperimentalBotany, 2013,64(8):2 155-2 169.
[20]TAO Z,KOU Y,LIU H,etal.OsWRKY45 alleles play different roles in abscisic acid signalling and salt stress tolerance but similar roles in drought and cold tolerance in rice[J].JournalofExperimentalBotany, 2011,62(14):4 863-4 874.
[21]LI S,ZHOU X,CHEN L,etal. Functional characterization ofArabidopsisthalianaWRKY39 in heat stress[J].MoleculesandCells, 2010,29(5):475-483.
[22]LI S,FU Q,HUANG W,etal. Functional analysis of anArabidopsistranscription factor WRKY25 in heat stress[J].PlantCellReports, 2009,28(4):683-693.
[23]CHEN Y F,LI L Q,XU Q,etal. The WRKY6 transcription factor modulates PHOSPHATE1 expression in response to low Pi stress inArabidopsis[J].PlantCell, 2009,21(11):3 554-3 566.
[24]DAI X,WANG Y,etal. OsWRKY74, a WRKY transcription factor, modulates tolerance to phosphate starvation in rice[J].JournalofExperimentalBotany, 2016,67(3):947-960.
[25]WANG H,HAO J,etal. Overexpression of riceWRKY89 enhances ultraviolet B tolerance and disease resistance in rice plants[J].PlantMolecularBiology, 2007,65(6):799-815.
[26]LI J,BESSEAU S,TORONEN P,etal. Defense-related transcription factors WRKY70 and WRKY54 modulate osmotic stress tolerance by regulating stomatal aperture inArabidopsis[J].NewPhytologist, 2013,200(2):457-472.
[27]WANG F,CHEN H W,etal. GmWRKY27 interacts with GmMYB174 to reduce expression ofGmNAC29 for stress tolerance in soybean plants[J].PlantJournal, 2015,83(2):224-236.
[28]YOO S D,CHO Y H,Sheen J.Arabidopsismesophyll protoplasts: a versatile cell system for transient gene expression analysis[J].NatureProtocols, 2007,2(7):1 565-1 572.
[29]CLOUGH S J,BENT A F. Floral dip:a simplified method forAgrobacterium‐mediated transformation ofArabidopsisthaliana[J].ThePlantJournal, 1996,16(6):735-743.
[30]ZHANG Y,FENG J C. Identification and characterization of the grape WRKY family[J].BioMedResearchInternational, 2014,2014:1-14.
[31]BENCKE-MALATO M,CABREIRA C,etal. Genome-wide annotation of the soybean WRKY family and functional characterization of genes involved in response to phakopsora pachyrhizi infection[J].BMCPlantBiology, 2014,14:236.
[32]MENG D,LI Y,BAI Y,etal. Genome-wide identification and characterization of WRKY transcriptional factor family in apple and analysis of their responses to waterlogging and drought stress[J].PlantPhysiologyBiochemistry, 2016,103:71-83.
[33]WEN F,ZHU H,LI P,etal. Genome-wide evolutionary characterization and expression analyses of WRKY family genes inBrachypodiumdistachyon[J].DNAResearch, 2014,21(3):327-339.
[34]WEI Y,SHI H,XIA Z,etal. Genome-wide identification and expression analysis of the WRKY gene family inCassava[J].FrontiersinPlantScience, 2016,7:25.
[35]LI M Y,XU Z S,TIAN C,etal. Genomic identification of WRKY transcription factors in carrot (Daucuscarota) and analysis of evolution and homologous groups for plants[J].ScientificReports, 2016,6:23 101.
[36]毛铭铢,万永青,李国婧,等. 中间锦鸡儿CiWRKY2基因克隆与表达分析[J]. 分子植物育种, 2017, (4):1 280-1 288.
MAO M Z,WAN Y Q,LI G J,etal. Cloning and expression analysis ofCiWRKY2 fromCaraganaintermedia[J].MolecularPlantBreeding,2017, (4):1 280-1 288.
[37]杨杞,张涛,王颖,等. 干旱胁迫下柠条锦鸡儿叶片SSH文库构建及CkWRKY1基因克隆[J]. 林业科学, 2013,49(7):62-68.
YANG Q,ZHANG T,WANG Y,etal. Construction of a suppression subtractive hybridization library ofCaraganakorshinskiiunder drought stress and cloning ofCkWRKY1 gene[J].ScientiaSilvaeSinicae,2013,49(7):62-68.
[38]DEVAIAH B N,KARTHIKEYAN A S,RAGHOTHAMA K G. WRKY75 transcription factor is a modulator of phosphate acquisition and root development inArabidopsis[J].PlantPhysiology, 2007,143(4):1 789-1 801.
[39]DEVAIAH B N,RAGHOTHAMA K G. Transcriptional regulation of Pi starvation responses by WRKY75[J].PlantSignalingandBehavior, 2007,2(5):424-425.
[40]LIU L P,ZHANG Z Q,DONG J L,etal. Overexpression ofMtWRKY76 increases both salt and drought tolerance inMedicagotruncatula[J].EnvironmentalandExperimentalBotany, 2016,123:50-58.
[41]CHU X,WANG C,CHEN X,etal. The cotton WRKY geneGhWRKY41 positively regulates salt and drought stress tolerance in transgenicNicotianabenthamiana[J].PLoSOne, 2015,10(11):e0143022.
[42]LIU X,SONG Y,XING F,etal.GhWRKY25, a group I WRKY gene from cotton, confers differential tolerance to abiotic and biotic stresses in transgenicNicotianabenthamiana[J].Protoplasma, 2016,253(5):1 265-1 281.
