旋毛虫肌幼虫虫体蛋白对小细胞肺癌H446细胞凋亡的影响
2018-04-04,,,,,,,
, ,, ,,, ,
肺癌在全球肿瘤相关死亡原因中占据首位,是我国第4大主要死亡原因,其发病率和死亡率均高,并呈逐年上升趋势。据2016年国际癌症研究中心报告显示,在2012年全球由于肺癌造成的死亡人数达160万人,占恶性肿瘤死亡病例的19%。肺癌种类较多,小细胞肺癌 (small cell lung cancer, SCLC)属于其中一种,占肺癌总比例15%~18%,侵袭性强,恶性程度高,对化疗最敏感[1]。研究学者发现,旋毛虫(T.spiralis)具有抑制肿瘤作用,且有动物实验表明,旋毛虫感染可以体内抵抗肿瘤[2]。旋毛虫排泄分泌产物通过激活机体的固有免疫细胞、 产生细胞因子或肿瘤相关活性物质,从而可以体外抑制肿瘤细胞生长[3],因此为肿瘤生物治疗的研究提供了一个方向[4]。旋毛虫生活史包括3个阶段,成虫、新生幼虫和肌幼虫,其中肌幼虫寄生在宿主肌肉组织内。在旋毛虫感染过程中肌幼虫较成虫和新生幼虫易获取,罗婧梅[5]等实验表明,旋毛虫肌幼虫排泄分泌蛋白(ESP)有抗肿瘤活性物质,而旋毛虫虫体蛋白是否对小细胞肺癌H446细胞的增殖有抑制作用,以及是否诱导其凋亡,为本实验的研究目的。
1 材料与方法
1.1旋毛虫、实验动物和细胞株实验所用旋毛虫为河南猪源旋毛虫,由本实验室小鼠保种。6周龄健康小鼠,清洁级,雌性昆明小鼠,体重20-25 g,购自本校动物实验中心。H446细胞株购自上海北诺生物科技有限公司。
1.2旋毛虫肌幼虫的收集和虫体蛋白的制备昆明小鼠经口感染300条肌幼虫45 d后颈椎离断处死。参照文献[6]的方法收集纯净的旋毛虫肌幼虫。肌幼虫用含500 U/mL青链霉素的无菌生理盐水反复清洗3次,将虫体于4 ℃和-20 ℃反复冻存5次,用匀浆器冰上研磨虫体30 min,镜下观察虫体彻底分离断开即可,收集研磨后的液体于4 ℃过夜,12 000 r/min、4 ℃离心30 min,取上清即为虫体蛋白,0.22 μm滤器过滤后分装,-80 ℃保存。
1.3H446细胞的培养与传代将于-80 ℃冰箱保存的H446细胞取出,迅速放入37 ℃水中快速摇晃直至完全溶解,再放入普通离心机以1 000 r/min速度离心 3 min,弃掉冻存液。加入1 mL配好的含10%血清和1%青链霉素混合液的RPMI1640培养基,重悬细胞后移入培养皿中放入37 ℃、CO2培养箱中继续培养。每2 d更换含血清的RPMI1640培养基,待细胞长到培养皿的70%~80%,即可用含0.25%胰酶消化细胞,进行细胞传代,3次传代后取对数生长期的细胞待用。
1.4MTT法检测H446细胞增殖抑制率收集对数生长期H446细胞,调整为8×104/mL的细胞密度,按每孔100 μL接种于96孔培养板,于37 ℃ 5% CO2培养箱中培养24 h,实验组虫体蛋白浓度分别为0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL、1.2 mg/mL的RPMI1640培养基,阴性对照组更换为不含虫体蛋白的RPMI1640培养基,每孔200 μL,每组各设5个复孔。分别培养24 h、48 h、72 h后加入20 μL MTT(5 mg/mL),37 ℃培养4 h后弃掉培养基,加入150 μL DMSO,振板10 min,通过酶标仪检测吸光度(A490值)的OD值,实验重复4次,计算抑制率和半数抑制率(IC50)的浓度。抑制率=(1-实验组OD值/阴性对照组OD值)×100%。
1.5流式细胞术检测H446细胞凋亡率收集对数生长期H446细胞,取1×106/mL的细胞密度接种于6 cm培养皿中,过夜培养。待细胞贴壁后弃掉培养基,实验组用含 0.2 mg/mL、0.4 mg/mL、0.6 mg/mL虫体蛋白的RPMI 1640培养基培养24 h,同时设立不含虫体蛋白的RPMI1640培养基的阴性对照组。虫体蛋白作用24 h后收集H446细胞并计数,用1×Buffer调整细胞密度为1×106/mL,每组各取100 μL细胞放入流式BD管,加入5 μL Annexin V FITC和5 μL PI染色抗体,室温避光孵育15 min,补加400 μL Buffer,过300钼尼龙网上机检测细胞凋亡率。
1.6Real-timePCR检测Cyt-C、Apaf-1 mRNA表达情况将对数期H446细胞接种到6孔板,CO2培养箱孵育过夜贴壁,实验组分别加入0.4 mg/mL、0.6 mg/mL、0.8 mg/mL虫体蛋白,阴性对照组加入不含血清1640培养基,培养24 h后按TRIzol 试剂说明书提取细胞总RNA,紫外分光光度仪检测RNA的浓度。依照TAKARA RT-PCR试剂盒说明书将RNA反转录为cDNA。取1 μg 总RNA 为模板反转录成cDNA, 反应条件为:37 ℃反转录15 min,95 ℃ 5 s,4 ℃。后续进行PCR 扩增,反应条件:94 ℃预变性2 min,94 ℃变性30 s,退火60 s。引物序列见表1。
表1Cyt-C、Apaf-1、GAPDH引物序列
Tab.1Primer sequence of Cyt-C, Apaf-1 and GAPDH

基因名称Genename序列Sequence扩增片段长度/bpAmplifiedfragmentlengthCyt⁃C上游引物5′⁃ACACCTGACCAGAAACTTTGTCTCC⁃3′下游引物5′⁃GCCAAAGCAGCAGCTCAGTATGTA⁃3′79Apaf⁃1上游引物5′⁃GCCAGTGCCAAGATGCACA⁃3′下游引物5′⁃ATCAGATGAGCAGGGCCTACAAG⁃3′95GADPPH上游引物5′⁃GCACCGTCAAGGCTGAGAAC⁃3′下游引物5′⁃TGGTGAAGACGCCAGTGGA⁃3′138
1.7Western blot检测Cyt-C、Apaf-1蛋白表达情况将对数期H446传代到100 mm培养皿中,待细胞长到70%~80%,实验组分别加入0.4 mg/mL、0.6 mg/mL、0.8 mg/mL虫体蛋白,阴性对照组加入不含血清1640培养基,作用24 h后按细胞裂解液说明书提取细胞总蛋白,BCA蛋白定量试剂盒检测蛋白浓度。每孔加样100 μg,电压80 V转120 V进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),稳流冰浴电转至PVDF 膜上,5%脱脂奶粉封闭3 h,室温下与兔抗人Cyt-C、Apaf-1、β-actin单克隆抗体分别孵育2 h后,4 ℃过夜。TBST洗膜3次,每次10 min,二抗室温孵育1.5 h。TBST洗膜3次,每次10 min。使用增强型化学发光(ECL) 试剂盒按照说明进行后续实验。应用Quntity One 4.62 软件对蛋白质印迹条带进行定量分析。
2 结 果
2.1MTT对H446细胞增殖抑制率MTT结果显示,虫体蛋白对H446细胞有明显的抑制作用,并随着剂量增大和时间的延长,虫体蛋白对H446细胞的抑制作用也在增加,呈现出剂量-时间依赖性,见表2。
2.2流式细胞术诱导H446细胞凋亡利用流式细胞术检测发现,虫体蛋白作用于H446细胞24 h后,实验组浓度分别为0.2 mg/mL、0.4 mg/mL、0.6 mg/mL的虫体蛋白凋亡率高于对照组(P<0.05)见表3,图1。
2.3Real-time PCR及Western blot检测Cyt-C、Apaf-1 mRNA和蛋白表达结果显示,实验组Cyt-C、Apaf-1 mRNA和蛋白的表达均高于对照组(图2、图3)。各实验组与对照组比较,均有差异统计学意义(P<0.05),见表4。


虫体蛋白浓度Polypideproteinconcentration(mg/mL)24h48h72h0.26.5±5.37∗8.1±5.67∗10.9±6.74∗0.411.83±4.56∗14.3±3.3∗15.6±1.15∗0.619.8±4.84∗28.1±1.61∗43.36±2.87∗0.833.03±1.87∗39.87±6.15∗54.97±7.97∗1.037.03±3.3∗56.83±3.58∗71.97±5.25∗1.249.26±1.3∗70.13±6.85∗85.07±5.89∗
注:P<0.05。


组别Group凋亡率ApoptosisrateControl6.49±1.120.2mg/mL14.67±0.47∗0.4mg/mL20.32±1.28∗0.6mg/mL25.1±2.98∗
注:P<0.05。

A为对照组,B为0.2 mg/mL虫体蛋白组,C为0.4 mg/mL虫体蛋白组,D为0.6 mg/mL虫体蛋白组A is control group, B is 0.2 mg/mL somatic protein group, C is 0.4 mg/mL somatic protein group, and D is 0.6 mg/mL somatic protein group 图1 虫体蛋白诱导H446细胞凋亡Fig.1 Somatic proteins induced apoptosis on H446 cell

图2 Cyt-C和Apaf-1 mRNA表达Fig.2 mRNA expression of Cyt-C and Apaf-1
表4各组Cyt-C和Apaf-1与对照组相比的结果
Tab.4Results of Cyt-C and Apaf-1 in each group conpare with the contrd group

组别GroupCyt⁃CApaf⁃1control110.4mg/mL1.37±0.14∗1.43±0.1∗o.6mg/mL1.47±0.12∗1.52±0.12∗0.8mg/mL1.85±0.33∗1.95±0.33∗
注:*P<0.05。
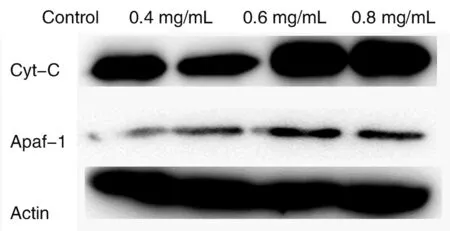
图3 Cyt、Apaf-1、Actin蛋白表达Fig.3 The protein expression of Cyt-C, Apaf-1 and Actin
3 讨 论
肿瘤生物制剂的发现已经成为当今研究热点。有研究发现,天然抗肿瘤活性物质存在于多种生物中,如喜树碱、鬼臼毒素、苔藓虫素-1、苦参碱等天然抗肿瘤药物[7],此外一些寄生虫如棘阿米巴滋养体[8]、疟原虫[9]、旋毛虫[10]也发现对多种肿瘤有抵抗作用。旋毛虫虫体感染或其分泌物、提取物与抑制肿瘤的研究越来越多。旋毛虫的生活史经历成虫、新生幼虫和肌幼虫3个阶段,成虫寄生于宿主的小肠,产出新生幼虫,研究表明,旋毛虫的成虫和新生幼虫有抑制肿瘤增殖的作用[11],但是成虫和新生幼虫在肠道生活时间较短,不易获得,旋毛虫肌幼虫寄生于肌肉组织中,较成虫和新生幼虫更易获取。Luo JM[12]等研究发现旋毛虫肌幼虫排泄分泌蛋白(ESPs)能够通过线粒体凋亡通路诱导H446肿瘤细胞的凋亡。刘箐等[13]以BALB/c裸鼠右侧腋下注射人肝癌H7402细胞为研究对象,探讨旋毛虫A200711蛋白对BALB/c裸鼠皮下人肝H7402细胞实体瘤的抑制作用, 建立裸鼠实体瘤模型。结果发现,注射A200711蛋白的对照组12d后裸鼠实体瘤体积明显缩小,抑瘤率达到 39.67%,证实了旋毛虫虫体蛋白A200711可调控肿瘤细胞凋亡。本实验选用旋毛虫肌幼虫虫体蛋白作为研究对象,应用MTT和流式细胞术检测,结果表明旋毛虫肌幼虫虫体蛋白对小细胞肺癌H446细胞增殖有抑制作用,并诱导肿瘤细胞凋亡,Cyt-C和Apaf-1高表达。
Cyt-C是线粒体中第一个被鉴定出在细胞凋亡过程中起重要作用的细胞凋亡因子[14]。线粒体受损之后导致Cyt-C释放,Cyt-C从线粒体释放到胞质中,并且与Apaf-1结合,聚集ProCaspase-9,形成Cyt-C,Apaf-1,ProCaspase-9三者的复合物,即“凋亡复合体”,导致Caspase-3活化切割底物使细胞凋亡。其中,Cyt-C是唯一能启动Apaf-1的凋亡分子,发挥着至关重要的作用[15]。Apaf-1是线粒体凋亡途径中的一个促凋亡因子,是重要的肿瘤抑制基因,是凋亡复合体的核心,在凋亡复合体的形成过程中起关键作用,其表达升高可恢复肿瘤细胞凋亡的敏感性[16]。Apaf-1作为线粒体凋亡途径中的核心组成部分,它的变化与细胞凋亡的程度呈正相关。
本实验中线粒体凋亡因子Cyt-C、Apaf-1高表达,考虑旋毛虫肌幼虫虫体蛋白可能会通过线粒体内源性凋亡途径诱导H446细胞发生凋亡。本研究结果为寻找抗肿瘤药物提供了新设想,为肿瘤生物治疗提供了实验依据。
参考文献:
[1] Planchard D, Le PC. Small cell lung cancer: new clinical recommendations and current status of biomarker assessment[J]. Euro J Cancer, 2011, 47(Suppl 3): S272-283. DOI: 10.1016/S0959-8049(11)70173-3
[2] Gong PT, Zhang JZ, Cao LL, et al. Identification and characterization of myeloma-associated antigens inTrichinellaspiralis[J]. Exper Parasitol, 2011, 127(4): 784-788. DOI: 10.1016/j.exppara.2010.12.001
[3] Duan LX, Li JH, Cheng BQ, et al. Identification of a novel gene product expressed byTrichinellaspiralis, that binds antiserum to Sp2/0 myeloma cells[J]. Vet Parasitol, 2013, 194(2/4): 183-185. DOI: 10.1016/j.vetpar.2013.01.051
[4] Duan LX, Guan XM, Zhang CS, et al. Research progress on anti-tumor mechanism ofTrichinellaspiralis[J]. Chin J Parasitol Parasit Dis Feb, 2011, 29(2): 142-146. DOI: 1000-7423(2011)-02-0142-05 (in Chinese)
段玲欣,关学敏,张传生,等.旋毛虫抗肿瘤机制研究进展[J].中国寄生虫学与寄生虫病杂志,2011,29(2):142-146.
[5] Luo JM, Cheng LY, Guan XD, et al. LC-MS/MS Analsis on the compoent of excretory-secretory protein oftrchinellaspiralismuscle larvae[J]. Chin J Parasitol Parasit Dis, 2016, 34(1): 53-57. DOI: 1000-7423(2016)-01-0053-05 (in Chinese)
罗婧梅,程露阳,关晓东,等.质谱法分析旋毛虫肌幼虫排泄分泌蛋白的组分[J].中国寄生虫学与寄生虫病杂志,2016,34(1):53-57.
[6] Wang GY,Ma YF, Liu GC, et al. Immune protective effect of excretroy-secretory antifen fromTrichinellaspiralis[J]. Immunological J, 2007, 23(5): 586-587. (in Chinese)
王国英,马远方,刘广超,等.两种方法制备的旋毛虫ES抗原对小鼠免疫保护作用研究[J].免疫学杂志,2007,23(5):586-587.
[7] Zhang J, Yang L, Gao WY, et al. Advances in studies on natural antitumor drugs[J]. Chin Traditional Herbal Drugs,2010, 41(6): 1014-1020. (in Chinese)
张靖,杨柳,高文远,等.天然抗肿瘤药物研究进展[J].中草药,2010,41(6):1014-1020.
[8] Qian M, Yan Z, Zhang P, et al. Toxic effect ofacanthamoebaon melanoma cell[J]. Acta Parasitol Med Entomol Sin, 2003, 10(2): 65-69. DOI:10.3969/j.issn.1005-0507.2003.02.001 (in Chinese)
钱旻,严正,章平,等.棘阿米巴对黑色素瘤细胞毒性作用初探[J].寄生虫与医学昆虫学报,2003,10(2):65-69.
[9] Quan L, Ying JY, Xue FX, et al.Plasmodiumparasite as an effective hepatocellular carcinoma antigen glypican-3 delivery vector[J]. Oncotarget, 2017, 8(15): 24785-24796. DOI: 10.18632/oncotarget.15806
[10] Wang XL, Fu BQ, Yang SJ, et al.Trichinellaspiralis-a potential anti-tumor agent[J]. Vet Parasitol, 2009, 159(4): 249-252.
[11] Wang XL, Yang SJ,Wu XP, et al. Inhibitory effect ofTrichinellaspiralispolypide protein on hepatic cancer cells H7402[J]. Chin J Cancer Biother, 2007, 14(5): 440-444. DOI:10.3872/j.issn.1007-385X.2007.5.139(in Chinese)
王学林,杨世杰,吴秀萍,等.旋毛虫虫体蛋白对肝癌细胞H7402的抑制作用[J].中国肿瘤生物治疗杂志,2007,14(5):440-444.
[12] Luo JM, Yu L, Xie GC, et al. Study on the mitochondrial apoptosis pathways of small cell lung cancer H446 cells induced byTrichinellaspiralismuscle larvae ESPs[J]. Parasitology, 2017:793-800. DOI: 10.1017/S0031182016002535
[13] Liu J, Liu XL, Bai X, et al.Inhibitory effect of the A200711 protein fromTrichinellaspiralison BALB/c nude mice bearing H7402 soid tumor[J].Chin J Vet Sci, 2015, 35(9): 1483-1487. (in Chinese)
刘菁,刘晓雷,白雪,等.旋毛虫A200711蛋白对裸鼠H7402细胞实体瘤的抑制作用[J].中国兽医学报,2015,35(9):1483-1487.
[14] Koty PP, Tyurina YY, Tyurin VA, et al. Depletion of Bcl-2 by an antisense oligonucleotide induces apoptosis accompanied by oxidation and externalization of phosphatidylserine in NCI-H226 lung carcinoma cells[J]. Mol Cellular Biochem, 2002, 234-235(1): 125-133. DOI: 10.1023/A:1015932615769
[15] Yu X, Wang L, Acehan D, et al. Three-dimensional structure of a double apoptosome formed by the Drosophila, Apaf-1 related killer[J]. J Mol Biol, 2006, 355(3): 577-589. DOI: 10.1016/j.mb.2005.10.040
[16] Kasai H, Yamamoto K, Koseki T, et al. Involvement of caspase activation through release of cytochrome c from mitochondria in apoptotic cell death of macrophages infected withActinobacillusactinomycetemcomitans[J]. Fems Microbiol Lett, 2004, 233(1): 29-35. DOI: 10.1016/j.femsle,2004.01.034
