TACE联合125I放射性粒子植入或三维适形放疗对肝细胞癌伴门静脉癌栓的疗效比较
2018-04-03吴凡郑家平邵国良罗君
吴凡 郑家平 邵国良 罗君
原发性肝细胞癌(HCC)为临床常见肿瘤疾病。在我国,HCC病死率在消化系统恶性肿瘤中列第3位,每年约有10~12万例患者死于HCC[1]。HCC发展迅速、起病隐匿,在患者明确诊断时,肿瘤往往发展到了中晚期,且HCC常伴门静脉癌栓(PVTT)[2]。研究发现,PVTT与HCC肝内外转移、复发及门静脉高压、肝功能衰竭均密切相关,如不予有效干预,HCC伴PVTT患者平均生存期仅2.7~4.0个月,预后很不理想[3]。近年来,临床针对HCC伴PVTT提出多种非手术治疗方法,包括放疗、经皮肝动脉化疗栓塞(TACE)、分子靶向治疗等,其中TACE联合放疗是目前最常用的方法之一[4],而放疗包括体内局部125I放射性粒子植入与体外三维适形放疗(3DCRT)、伽玛刀放疗等。本研究旨在观察并比较TACE治疗前提下,125I放射性粒子植入与3DCRT对HCC伴PVTT的临床疗效,现报道如下。
1 对象和方法
1.1对象选取2013年7月至2015年7月浙江省肿瘤医院收治的HCC伴PVTT患者65例,纳入标准:(1)初次诊断者;(2)年龄18~75岁;(3)功能状态评分0~1分;(4)肝功能Child-Pugh分级为A或B级;(5)获得患者知情同意。排除标准:(1)合并其他器质性病变者;(2)门静脉主干因PVTT引致的完全阻塞者,且不存在门静脉侧支循环建立或PVTT累及肠系膜上静脉、脾静脉;(3)肝功能Child-Pugh分级为C级;(4)PLT<60×109/L,PT>18s,血清白蛋白<28g/L;(5)病毒性肝炎活动期。其中32例(观察组)采用TACE联合125I放射性粒子植入治疗,33例(对照组)采用TACE联合3DCRT治疗。所有患者均参照HCC诊疗规范(2015年版)[5]确诊;根据PVTT的范围分为3型[6],分别为A型(门静脉主干PVTT)、B型(门静脉一级分支PVTT)和C型(门静脉二级及以下分支PVTT)。两组患者性别、年龄、肿瘤大体分型、甲胎蛋白(AFP)水平、肝功能Child-Pugh分级、有无肝外转移、PVTT分型等比较差异均无统计学意义(均P>0.05),具有可比性,见表1。

表1 两组患者一般资料比较[例(%)]
1.2方法
1.2.1仪器(1)125I放射性粒子植入治疗应用密封籽源125I放射性粒子,长4.5mm,直径0.8mm,活度0.6 mCi,平均能量27~35KeV,穿透半径1.7cm,半衰期为60.2 d。治疗计划系统(TPS)为天津赛德生物制药公司生产的近距离放射治疗三维TPS设备。引导系统为德国Siemens 16排螺旋CT。扫描条件为120kV,180mAs,层厚及层间隔均为5mm。(2)3DCRT定位系统:CT-sim扫描设备为Philips Brilliance 16排螺旋CT或GE Light Speed 4排螺旋CT,扫描条件为120kV,180mAs,层厚及层间隔均为3mm。放疗设备:RayStation4.0V(RaySearch Laboratories AB)制定放疗计划;直线加速器为瑞典医科达PRECISE全数字化直线加速器。
1.2.2治疗两组患者均先行常规TACE,术后3d复查肝、肾功能。TACE术后2周内针对PVTT及其周围肿瘤组织分别行125I放射性粒子植入治疗(观察组)和3DCRT(对照组)。观察组患者术后1周复查肝功能、凝血功能、血常规。对照组患者放疗期间每周复查以上指标。两组患者均于治疗后4~6周行CT或MRI动态增强扫描及AFP检测作疗效评价,并评估是否需要再次接受TACE及125I粒子植入或3DCRT,以后间隔1~3个月复查和随访。
1.2.2.1TACE应用Seldinger法使用4F-RH导管经股动脉穿刺插管至腹腔干(或肝总动脉)、肠系膜上动脉、肾动脉或膈动脉等,确定肿瘤规格、数量,明确位置和供血动脉。利用3F微导管超选直至肿瘤供血动脉。经导管灌注奥沙利铂(艾恒,江苏恒瑞医药股份有限公司)100~150mg,再以表阿霉素(法玛新,美国辉瑞制药有限公司)30mg+超液化碘油(法国Laboratorie Guerbet公司)(10~20ml)缓慢注入肿瘤供血动脉内。再依据肿瘤血供情况选择不同大小的Embo Sphere微球(美国波科Biosphere Medical,300~700μm)适量栓塞肿瘤供血动脉。对合并肝动脉-门静脉瘘患者,先用碘油明胶海绵复合型栓塞剂或300~700μm微球封堵瘘口[7],然后再行肿瘤供血动脉化疗栓塞术。
1.2.2.2CT引导125I放射性粒子植入观察组患者手术开始前,行肝脏CT动态增强检查,全面定义PVTT和四周肝内肿瘤为靶区。在TPS系统内导入影像学资料,制定计划过程中,要求布源点分布于癌栓内部和其周围肝肿瘤实质内,靶体积比(TVR)>95.0%,靶区90%致死率剂量(D90)为120~160Gy,并最大限度保护周边重要组织器官处于安全照射范围。术中穿刺路径避开大血管及重要组织器官如胆囊、胰腺等。在开始粒子植入之前,首先进行CT定位,后依照TPS计划,选定穿刺面、点以及布源位置。完成局部麻部之后,使用规格为18G的粒子植入针穿刺,到位之后结合治疗计划布源,粒子的植入间距为0.5~1.0cm,完成后拔针,针道用明胶海绵颗粒(710μm)加以封堵处理。完成手术后行上腹部CT平扫,全面验证粒子放置数量和位置,并评估有无肝脏、腹腔出血、粒子移位等不良反应,发现冷区及时补种粒子。
1.2.2.33DCRT对照组患者仰卧,两手交叉上举直至前额,使用水解塑料膜固定体位,在体表、体模以及治疗床标记出正确位置,减少摆位误差。患者在平静呼吸状态下行CT定位薄层(3mm)增强扫描,范围上界为气管隆突平面下,下缘至右肾下缘,CT定位图像传输至RayStation4.0V(RaySearch Laboratories AB)制定放疗计划。大体肿瘤体积(GTV)为PVTT、靠近的肝内原发灶或肝内原发灶直接侵犯至门静脉而形成的癌栓。临床靶区体积(CTV):于GTV位置均匀扩大5.0~10.0mm;内靶体积(ITV):根据肿瘤随呼吸运动的程度,于CTV基础上外放5mm。计划靶区体积(PTV):以ITV为基准,从三维方向外扩5~6mm。加强控制计量,保证危及器官在耐受剂量之下。肝脏剂量在25 Gy之下,使接受>30.0 Gy剂量照射的正常百分体积(V30)达到最小化。85%~90%等剂量面完全覆盖PTV,其内部剂量差异在±5%以内[8]。设置4~6个共面或非共面放射野,单次照射剂量1.8~2.0 Gy,3~5次/周,肿瘤总剂量43.2~50.4Gy。放疗期间给予积极的保肝、护胃、对症支持治疗。
1.3PVTT疗效评价由2位高级职称影像科医师审读患者治疗前后MRI及CT资料,评价治疗后PVTT变化情况,同时查看肝脏中肿瘤详情、是否发生远处转移。PVTT疗效评价标准:(1)临床缓解(CR):既往PVTT消失;(2)部分缓解(PR):既往PVTT减少幅度≥30%;(3)稳定(SD):既往PVTT无显著增加(>20%)或缩小(<30%);(4)病灶进展(PD):PVTT范围增大超过20%或出现新发病灶。有效=CR+PR,疾病控制=CR+PR+SD。1.4观察指标(1)观察两组患者治疗情况。(2)比较两组患者PVTT近期(治疗后3个月)疗效。(3)比较两组患者生存情况:随访截至2017年1月,观察并比较两组患者中位生存期(从治疗开始,50%的患者能存活过这个时间)、中位进展期(从治疗开始至50%患者肿瘤无法控制,疾病开始进展的时间)及1、2、3年生存率。(4)比较两组患者的住院时间与治疗费用。(5)比较两组患者并发症发生情况。
1.5统计学处理应用SPSS 18.0统计软件;计量资料以表示,组间比较采用两独立样本t检验;计数资料以频数和构成比表示,两组比较采用χ2检验或四格表χ2检验;采用Kaplan-Meier法绘制生存曲线,两组患者生存率的比较采用log-rank检验;P<0.05为差异有统计学意义。
2 结果
2.1两组患者治疗情况两组患者均顺利完成TACE。观察组患者均顺利植入125I放射性粒子,技术成功率100%;共行粒子植入40次,平均1.3次/例,15~70粒/次;总植入粒子1 421粒,平均44.4粒/例;粒子植入区实际D90≥120Gy者22例,<120Gy者10例。对照组患者均顺利完成3DCRT;患者单次照射剂量1.8~2.0 Gy,肿瘤总剂量43.2~50.4Gy,其中<45 Gy者4例,≥45 Gy者29例。
2.2两组患者PVTT近期疗效比较见表2。

表2 两组患者PVTT近期疗效比较[例(%)]
由表2可见,观察组患者PVTT治疗有效率明显高于对照组(P<0.05),疾病控制率与对照组比较差异无统计学意义(P>0.05)。
2.3两组患者生存情况比较见表3、图1。
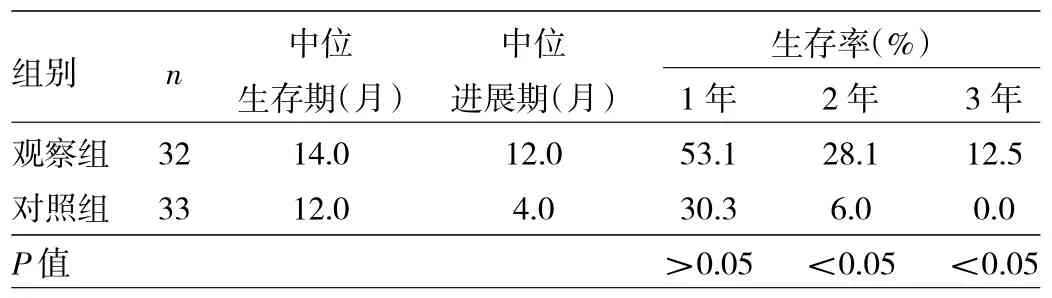
表3 两组患者生存情况比较

图1 两组患者生存曲线比较
由表3、图1可见,观察组患者中位生存期、中位进展期均长于对照组。观察组患者1、2、3年生存率分别为53.1%、28.1%、12.5%,对照组患者1、2、3年生存率分别为30.3%、6.0%、0.0%。两组患者1年生存率比较差异无统计学意义(P>0.05),观察组患者2、3年生存率均高于对照组(均P<0.05)。
2.4两组患者住院时间与治疗费用比较观察组患者住院时间2~9(5.53±1.95)d;对照组患者住院时间31~69(40.24±8.67)d;观察组患者住院时间明显短于对照组(P<0.05)。观察组患者治疗费用1.0~4.52(2.58±1.07)万元,对照组患者治疗费用4.0~10.0(5.27±1.52)万元,观察组患者治疗费用明显少于对照组(P<0.05)。
2.5两组患者并发症发生情况比较两组共49例患者(75.38%)TACE后出现轻/中度肝功能指标(ALT、AST、TBil、白蛋白、PT等)异常,经护肝治疗3~10d基本恢复正常。观察组5例患者(15.63%)在粒子植入过程中有明显针道出血,立即予以针道内明胶海绵颗粒封堵处理,无术后大出血发生;1例患者(3.13%)治疗期间发生腹腔内感染伴发热,抗炎治疗3d后好转;1例患者(3.13%)治疗期间腹痛明显,止痛药物缓解效果不佳,经外照射补救后好转。对照组8例患者(24.24%)在外照射后出现骨髓抑制(3度),予以重组人粒细胞集落刺激因子(惠尔血,日本协和发酵麒麟株式会社)、参麦注射液(正大青春宝药业有限公司)等处理后基本恢复;1例患者(3.03%)出现胃肠道反应,予以甲氧氯普胺(胃复安,无锡市第七制药有限公司)对症处理后好转;2例患者(6.06%)出现发热,暂停放疗1周后好转。所有患者均未出现肝脓肿、肝破裂、消化道溃疡或出血等严重并发症。
3 讨论
HCC是最常见的消化系统恶性肿瘤之一,病情进展迅速。PVTT是导致HCC复发和转移的主要因素之一,直接影响患者的生存质量和生存时间。因此,如何对PVTT进行有效的治疗,控制其进展和肝内转移,是提高晚期HCC患者生存质量的关键。
既往观点认为,对于肝功能Child-Pugh分级A/B级的HCC伴PVTT患者,首选外科手术,但因术后短期内肿瘤复发,故手术治疗受到很大限制。且患者预后与PVTT的部位密切相关。为能提高HCC伴PVTT患者的生存率,临床尝试不同的治疗方法。近年来,各种非手术介入方法先后用于治疗HCC伴PVTT。研究发现,PVTT为肝动脉-门静脉双重供血,因此TACE不仅能阻断肝肿瘤的血供,同时也对PVTT起到化疗栓塞的作用。Meta分析显示,TACE应用于HCC伴PVTT的治疗是安全、有效的[9-10]。但也发现TACE主要作用在控制肝内原发肿瘤病变部位,其在治疗癌栓方面效果不佳,通常仅有极少的碘化油栓可进入到癌栓中[11]。Niu等[12]发现癌栓越接近门静脉主干,治疗效果越差。这也是目前TACE对PVTT治疗效果欠理想的重要原因。近年来,更多学者选择在基于TACE前提下,联合放射性治疗。有学者对19例HCC伴PVTT患者开展TACE治疗[13],发现1、2年生存率分别为40.6%、10.2%。刘清欣等[14]开展多普勒超声引导下125I粒子条联合金属支架在门静脉中植入+TACE治疗HCC伴PVTT也取得了满意成效。因此,基于TACE前提下,进行放射性治疗是目前公认的相对有效的治疗方案。但对于HCC伴PVTT的患者,在TACE治疗后针对PVTT选择粒子植入内照射或外照射,哪种方法更有优势,目前尚无定论。
本研究对HCC伴PVTT患者分别进行TACE联合125I放射性粒子植入或TACE联合3DCRT治疗,结果显示观察组患者PVTT治疗有效率明显高于对照组,疾病控制率与对照组比较差异无统计学意义。分析其原因,可能有以下两点:(1)PVTT的肿瘤类型早期以增殖型为主,对放射线比较敏感,癌栓短期内易失去活性或处于停滞状态,癌栓大小不进展,因此也可认为癌栓得到控制,故两组患者疾病控制率无统计学差异。(2)肿瘤的增殖周期对放射线的敏感度有时相性,即处于G2和M期的肿瘤细胞对放射线较敏感,因而短期的外照射只对处于特定时相的这一部分肿瘤细胞有效,而植入癌栓内的125I放射性粒子半衰期为59.6d,可持续、有效地作用于各个增殖周期的肿瘤细胞,且植入性粒子较体外放疗局部照射剂量更高,因而观察组较对照组在短期内可得到更有效的治疗。
进一步观察两组患者的远期疗效发现,观察组患者中位生存期、中位进展期均长于对照组。观察组患者1、2、3年生存率分别为53.1%、28.1%、12.5%,对照组患者1、2、3年生存率分别为30.3%、6.0%、0.0%。两组患者1年生存率比较差异无统计学意义,观察组患者2、3年生存率均高于对照组。分析其原因,笔者认为一般2个半衰期内125I放射性粒子较外照射持续时间长,局部照射剂量高,瘤体接受有效照射剂量更多,因而观察组患者肿瘤进展相对缓慢;另一方面由于正常全肝照射耐受剂量仅为30~50Gy,限制了对照组外放疗的设定剂量,而这个剂量在控制PVTT生长是不满意的;此外,由于外照射时呼吸运动的影响,肿瘤治疗体积丢失率高,且外放疗的治疗间隔周期较长,放疗期间出现癌栓有效控制率低或癌栓转移,以上因素均可导致对照组疾病进展时间较观察组缩短,并影响其生存率。两组患者1年生存率无统计学差异,笔者认为其可能原因是观察组约1/3患者植入粒子的有效致死剂量D90<120Gy,其生存率往往<1年,考虑为放射剂量不足以杀死肿瘤,导致局部肿瘤未控,继而肿瘤快速进展播散和肝功能恶化,生存期缩短;因而两组患者1年病死率均偏高,这也解释了两组的中位生存时间相仿。但对于癌栓有效控制率较高的患者,观察组患者2、3年生存率均高于对照组。这也可以说明,癌栓内粒子植入较外照射在提高患者的远期生存率方面更胜一筹。
两组患者分别出现不同类型、不同程度的并发症。其中观察组患者以针道出血发生率最高,予以针道内明胶海绵颗粒封堵止血处理是极其简便有效的方法。而对照组患者以放疗后骨髓抑制最为常见,通常予以重组人粒细胞集落刺激因子处理可有效改善。两种治疗方案均适应证广、并发症相对较少,但粒子植入相对较便捷,因而在住院时间、治疗费用上粒子植入治疗更占优势。
综上所述,HCC伴PVTT患者经TACE治疗后,肝内病灶得到控制的前提下,125I放射性粒子植入与3DCRT短期内均可控制PVTT进展,但125I放射性粒子植入治部在癌栓的减瘤方面更有优势;从远期疗效来看,125I放射性粒子植入治部可有效延长PVTT进展时间,提高生存率。
[1]马良,叶甲舟,向邦德,等.不同治疗方案对直径小于10cm肝细胞癌合并门静脉癌栓患者生存率的影响[J].中华肝胆外科杂志,2013,19(3):165-170.
[2]Su CH,Lin Y,Cai L.Genetic factors,viral infection,other factors and liver cancer:an update on current progress[J].Apjcp,2013,14(9):4953-4960.
[3]Jiang JF,Lao YC,Yuan BH,et al.Treatment of hepatocellular carcinoma with portal vein tumor thrombus:advances and challenges[J].Oncotarget,2017,8(20):33911-33921.
[4]翁志成,杨维竹,江娜,等.CT引导下125I放射性粒子植入治疗肝癌门静脉癌栓的疗效评价[J].介入放射学杂志,2010,19(7):535-539.
[5]中华人民共和国卫生部.原发性肝癌规范化病理诊断指南(2015年版)[J].中华肝脏病杂志,2015,23(5):321-328.
[6]Zhu K,Chen J,Lai L,et al.Hepatocellular carcinoma with portal vein tumor thrombus:treatment with transarterial chemoembolization combined with sorafenib:a retrospective controlled study[J].Radiology,2014,272(1):284-293.
[7]郑家平,邵国良,陈玉堂,等.复合型栓塞剂治疗肝癌合并动静脉瘘的临床研究[J].中国肿瘤,2011,20(5):383-388.
[8]Capussotti L,Muratore A,Massucco P,et al.Major liver resections for hepatocelluar carcinoma on cirrhosis:early and longtermoutcoms.Liner[J].Transpl,2004,10(2):64-68.
[9]Leng JJ,Xu YZ,Dong JH.Efficacy of transarterial chemoembolization for hepatocellular carcinoma with portal vein thrombosis:a meta-analysis[J].ANZ J Surg,2016,86(10):816-820.
[10]Xue TC,Xie XY,Zhang L,et al.Transarterial chemoembolization for hepatocellular carcinoma with portal vein tumor thrombus:a meta-analysis[J].BMC Gastroenterol,2013,13(1):1-9.
[11]Luo J,Guo RP,Lai EC,et al.Transarterial chemoembolization forunresectable hepatocellular carcinoma with portal vein tumor thrombus:a prospective comparative study[J].Ann Surg Oncol,2011,18(2):413-420.
[12]Niu ZJ,Ma YL,Kang P,et al.Transarterial chemoembolization compared with conservative treatment for advanced hepatocellular carcinoma with portal vein tumor thrombus:using a new classification[J].Med Oncol,2012,29(4):2992-2997.
[13]Yamada K,Lzaki K,Sugimoto K,et al.Prospective trial of combined transeatheter arterial ehemoemlmlization and three dimensional eonfornud radiotherapy for portal vein tumor thrombus in patientswith unresectable hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,2003,57(1):113-119.
[14]刘清欣,颜志平,李锐,等.125I粒子条联合门静脉支架及化疗栓塞治疗原发性肝癌合并门静脉癌栓[J].介入放射学杂志,2009,18(8):593-595.
