二甲双胍丁酸盐对人肺腺癌A549细胞增殖、凋亡与迁移能力的影响
2018-03-30陈晴晴谢庆书沈继龙
陈晴晴,束 军,谢庆书, 沈继龙
双胍类衍生物二甲双胍是广泛用于Ⅱ型糖尿病的降糖药物,主要通过抑制肝糖原产生和增加肌糖原吸收调节体内血糖的平衡。2005年Evans et al[1]关于二甲双胍可降低糖尿病患者肿瘤发病率的报道具有里程碑的意义。陆续有流行病学调查显示二甲双胍的治疗可以减少多种癌症如乳腺癌、前列腺癌、结肠癌、胰腺癌和肺癌的发病率[2-3]。最近的回顾性研究和Meta分析报道在服用二甲双胍的患者中癌症的发生率降低了31%[4]。目前,许多学者关注其抗癌作用,提出二甲双胍或者相关的双胍类可能具有抗肿瘤活性[5]。尽管流行病学和临床前研究[6]显示二甲双胍具有抗肿瘤效果,但是只有高浓度的二甲双胍才具有抗肿瘤活性,然而目前还不确认高浓度是否具有副作用,因此有人提出对二甲双胍衍生物进行设计、合成并检测[7]。近来有研究[8]表明二甲双胍衍生物二甲双胍丁酸盐(metformin butyrate, MFB),激活腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase, AMPK),抑制哺乳动物雷帕霉素靶蛋白(mTOR),使细胞周期停滞在S和G2/M 期的效果更强。MFB具有较强的抗肿瘤活性[8]。虽然二甲双胍在肿瘤中应用已有研究,但是二甲双胍衍生物 MFB对肺腺癌细胞的影响鲜有报道。该研究旨在探讨不同浓度的MFB作用不同时间后对A549细胞增殖、凋亡和迁移能力的影响,从而为肺癌患者的治疗提供帮助。
1 材料与方法
1.1主要试剂与仪器MFB、四甲基偶氮唑盐(MTT)和二甲基亚砜(DMSO)购自美国Sigma公司;胎牛血清购自杭州四季青生物有限公司;RPMI-1640培养基购自美国HyClone公司;流式试剂盒购自上海贝博公司;胰酶购自上海碧云天生物技术有限公司。CO2细胞培养箱购自德国Heraeus公司;ELX800UV酶标仪购自美国Bio-Tek公司;流式细胞仪购自美国Beckman公司;超净工作台购自苏州安泰空气技术有限公司;电热恒温水浴锅购自上海天平仪器厂。
1.2方法
1.2.1细胞培养 人肺腺癌细胞株A549细胞由中国科学技术大学惠赠,用含10%的胎牛血清在37 ℃、5% CO2培养箱内常规传代培养。细胞生长到80%时弃去原有培养基,PBS冲洗,胰酶消化,显微镜下观察当细胞回缩变圆时终止消化,用移液器吹打,待细胞分散成单个细胞时离心,重悬,1 ∶3传代。当细胞处于对数生长期时用于实验。
1.2.2MTT法检测MFB对肺腺癌细胞A549增殖的影响 复苏的细胞传3代之后处于对数生长期时,用胰酶消化后加培养基终止消化,4 ℃时800 r/min下离心5 min。弃上清液,加培养基重悬,细胞计数,调整细胞浓度,每孔加100 μl使细胞最终以3×104个/ml的密度接种到96孔板,边缘用无菌PBS填充,放于37 ℃、5% CO2孵箱过夜。实验组加入浓度梯度的MFB(0.5、1、2、4、8 mmol/L),对照组加入等体积的培养基,每组有6个复孔。作用24、48 h后每孔加入20 μl的MTT溶液,继续培养4 h,终止培养,小心吸去孔内培养液。每孔加入150 μl的DMSO,在摇床上低速震荡10 min,酶标仪490 nm处测量各孔的吸光值。计算MFB对细胞增殖的抑制率,抑制率(%)=[1-实验组吸光度(optical delnsity,OD)值]/对照组OD值×100%,实验重复3次。
1.2.3流式细胞术检测MFB对A549细胞凋亡的影响 将处于对数生长期的A549细胞(1×105/ml)接种于6孔板,培养24 h后弃去孔内的培养基,实验组加入用培养基稀释的不同浓度MFB(0.5、1、2、4、8 mmol/L),对照组加入等体积培养基,置于37 ℃、5% CO2培养箱培养,分别于加药24、48 h后,用胰酶和预冷的PBS 消化、离心(800 r/min离心4 min)、洗涤、收集细胞,按试剂盒说明书操作:向流式管中加入5 μl AnnexinV, FITC结合物,再加入5 μl的PI,室温下避光培养15 min。加入400 μl的Annexin V Binding buffer,1 h内在流式仪上检测凋亡情况。实验重复3次。
1.2.4划痕实验测MFB对A549细胞迁移能力的影响 复苏的细胞传3代之后处于对数生长期时,接种于6孔板(接种前用记号笔在背面均匀化横线,间隔0.5~1 cm,每孔至少穿过5条线),待细胞贴壁长满时用蓝色枪头画垂直于6孔板背面平行线的直线,枪头尽量垂直。去除培养基,加PBS清洗3~5次,去除划下的细胞,加无血清的培养基,在显微镜下拍照,为0 h的划痕宽度,弃去培养基,加入用培养基稀释的药物,使其浓度为2、4、8 mmol/L,对照组加入等体积的培养基,于24 h在显微镜下观察拍照。然后用Image-pro plus 6.0软件计算划痕的宽度,则细胞迁移的距离=0 h距离-24 h距离。
2 结果
2.1MFB对A549细胞增殖的影响A549细胞在浓度梯度的MFB干预后,MTT法测量的OD值如图1,细胞生长抑制率如表1。比较5个浓度的实验组与对照组抑制率,差异均有统计学意义(P<0.05)。单因素方差分析显示在同一时间段,随着MFB浓度的增加,MFB对A549细胞增殖的抑制率增加,差异有统计学意义(P<0.05),双因素方差分析结果显示在同一给药浓度下,MFB对A549细胞的增殖抑制率48 h高于24 h,差异有统计学意义(P<0.05)。
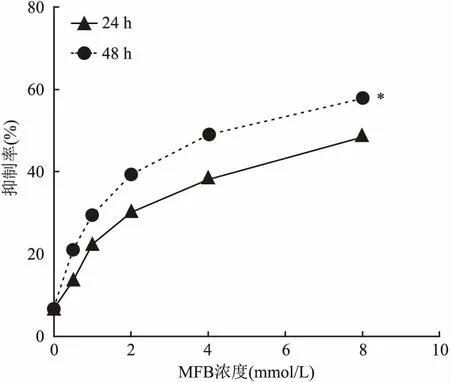
图1 MTT法检测MFB对A549细胞增殖的影响

组别OD490值24h48h抑制率(%)24h48h对照(0mmol/L)0.940±0.0200.940±0.0256.4±22.36.5±2.8实验(mmol/L) 0.50.872±0.0210.804±0.07213.8±2.5*21.0±8.0* 1.00.790±0.0250.723±0.03022.4±3.1*#29.6±8.1*#▼ 2.00.717±0.0300.635±0.05030.2±3.8*△39.3±6.4*△▼ 4.00.642±0.0500.542±0.05438.1±6.0*▲48.9±7.0*▲▼ 8.00.544±0.0250.456±0.02248.6±5.6*▽58.0±3.8*▽▼
与对照组比较:*P<0.05;与0.5 mmol/L比较:#P<0.05;与1.0 mmol/L比较:△P<0.05;与2.0 mmol/L比较:▲P<0.05;与4 mmol/L比较:▽P<0.05;与24 h比较:▼P<0.05
24 h时,线性趋势检验F=84.83,P<0.05;48 h时,线性趋势检验F=102.52,P<0.05。综上可以得出,MFB对A549细胞的增殖抑制作用具有一定的浓度依赖性且48 h的作用强度大于24 h。
2.2MFB对A549细胞凋亡的影响流式细胞术结果显示,不同浓度的MFB干预24 h细胞凋亡率分别为15.87%、22.79%、27.91%、30.77%、40.65%。 48 h后凋亡率为 22.54%、22.93%、29.73%、49.82%、50.49 %。对照组为0%、10.45%。实验组凋亡率高于对照组,并且相同浓度的MFB 48 h的凋亡率高于24 h。此外还显示,MFB对A549细胞的促凋亡主要表现在晚期。各实验组与对照组相比差异均有统计学意义(P<0.05),不同浓度的MFB干预组间差异有统计学意义(P<0.05)。见图2、3。
2.3MFB对A549细胞迁移力的影响对照组细胞迁移的距离为 (58.37±2.55) μm,实验组(2、4、8 mmol/L)迁移的距离分别为(52.47±6.21)、(31.87 ±4.65)、(21.53±4.57) μm,不同浓度MFB作用于细胞后细胞的迁移能力不同,实验组迁移的距离小于对照组,高浓度干预组细胞的迁移距离小于低浓度组,差异有统计学意义(P<0.05)。见图4。
3 讨论
众所周知,癌症威胁人类健康,肺癌是全球范围内癌症相关死亡的主要原因之一,占世界范围内癌症死亡的31%,尽管诊断和治疗方法的完善,5年生存率仍低于15%[6]。复发、转移、耐药、毒副反应至今仍是治疗的难点,此外,一些治疗方法虽然效果相对较好,但是价格昂贵,给患者带来较重的经济负担。因此,寻找新的性价比高的治疗药物迫在眉睫。小分子化学药物对于肿瘤靶向治疗和个体化治疗具有重要意义。然而,小分子新药的开发,从基础实验研究到临床试验到最终应用到临床实践,无疑是一个漫长的过程,需要消耗大量的时间、精力和成本。大多数药物从实验室研发到证实其有效性和安全性至少需要5年时间[9]。较之开发新药,挖掘传统非肿瘤药物的抗肿瘤功能可能是一个捷径[5,10]。二甲双胍因治疗糖尿病而被熟知,最近,细胞实验和动物研究[11-12]均表明二甲双胍还具有抗癌作用。但是其衍生物MFB的研究较少,其抗癌作用仅在乳腺癌中得到验证[8]。在肺癌中的研究目前未见报道。从本研究的上述结果可以显示低浓度的MFB可以明显抑制A549细胞的增殖、迁移,促进凋亡,且作用强度存在MFB的浓度依赖性。本课题组前期研究[13]显示高浓度的葡萄糖可以促进肺腺癌细胞的增殖、迁移。已有研究[6]显示尽管二甲双胍可以抑制肺腺癌细胞的生长,但只有高浓度时有效果,但此时浓度之高已超出人体耐受范围,因此有研究[8]提出,可以对二甲双胍结构进行改造以达到使人体可以耐受的程度。MFB的抗肿瘤作用主要通过激活LKB1/AMPK途径、诱导细胞周期抑制和(或者)凋亡、抑制蛋白质的合成这三条途径抑制肿瘤的生长。目前二甲双胍主要通过激活AMPK、通过调节E钙粘素和基质金属蛋白酶9、基质金属蛋白酶2、血管内皮生长因子的表达来抑制人癌细胞的迁移和侵袭等[14-17],因此可能对肺腺癌细胞具有较好的效果。目前的研究显示MFB可以有效抑制A549细胞的增长,促进凋亡,抑制迁移。然而本实验只局限于一种细胞,在动物水平和临床上的应用还有待于进一步验证。
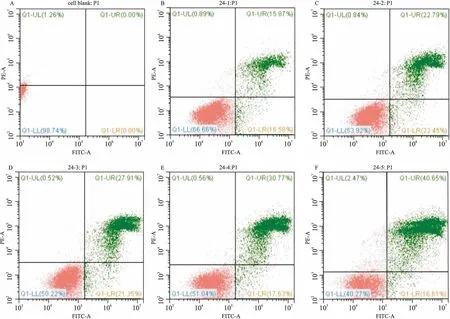
图2 流式细胞术检测MFB作用24 h后对A549细胞凋亡的影响

图3 流式细胞术检测MFB作用48 h后对A549细胞凋亡的影响

图4 MFB对A549细胞迁移力的影响 ×100
[1] Evans J M, Donnelly L A, Emslie-Smith A M, et al. Metformin and reduced risk of cancer in diabetic patients[J]. BMJ, 2005,330(7503):1304-5.
[2] Shi W Y, Xiao D, Wang L, et al. Therapeutic metformin/ampk activation blocked lymphoma cell growthviainhibition of mtor pathway and induction of autophagy[J]. Cell Death Dis, 2012,3:e275.
[3] Tsai M J, Yang C J, Kung Y T, et al. Metformin decreases lung cancer risk in diabetic patients in a dose-dependent manner[J]. Lung Cancer, 2014,86(2):137-43.
[4] Gandini S, Puntoni M, Heckman-Stoddard B M, et al. Metformin and cancer risk and mortality: a systematic review and meta-analysis taking into account biases and confounders[J]. Cancer Prev Res (Phila), 2014,7(9):867-85.
[5] Pollak M. Potential applications for biguanides in oncology[J]. J Clin Invest, 2013,123(9):3693-700.
[6] Wang J, Gao Q, Wang D, et al. Metformin inhibits growth of lung adenocarcinoma cells by inducing apoptosisviathe mitochondria-mediated pathway[J]. Oncol Lett, 2015,10(3):1343-9.
[7] Dowling R J, Niraula S, Stambolic V, et al. Metformin in cancer: translational challenges[J]. J Mol Endocrinol, 2012,48(3):R31-43.
[8] Lee K M, Lee M, Lee J, et al. Enhanced anti-tumor activity and cytotoxic effect on cancer stem cell population of metformin-butyrate compared with metformin HCl in breast cancer[J]. Oncotarget, 2016,7(25):38500-12.
[9] 李金平, 宁志丰, 刘复兴, 等. 老药新用,小分子药物二甲双胍的抗肿瘤研究进展[J]. 中国生化药物杂志, 2016, 36(8):16-21.
[10] Kourelis T V, Siegel R D. Metformin and cancer: new applications for an old drug[J]. Med Oncol, 2012,29(2):1314-27.
[11] Anisimov V N, Berstein L M, Egormin P A, et al. Effect of metformin on life span and on the development of spontaneous mammary tumors in her-2/neu transgenic mice[J]. Exp Gerontol, 2005,40(8-9):685-93.
[12] Zakikhani M, Dowling R, Fantus I G, et al. Metformin is an amp kinase-dependent growth inhibitor for breast cancer cells[J]. Cancer Res, 2006,66(21):10269-73.
[13] 李晓峰, 束 军, 程 宇, 等. 高浓度葡萄糖对肺腺癌a549细胞生长及vegf、mmp-2表达的影响[J]. 安徽医科大学学报, 2016, 51(3):363-8.
[14] Sun X J, Zhang P, Li H H, et al. Cisplatin combined with metformin inhibits migration and invasion of human nasopharyngeal carcinoma cells by regulating E-cadherin and MMP-9[J]. Asian Pac J Cancer Prev, 2014,15(9):4019-23.
[15] Fang Z, Xu X, Zhou Z, et al. Effect of metformin on apoptosis, cell cycle arrest migration and invasion of a498 cells[J]. Mol Med Rep, 2014,9(6):2251-6.
[16] Laskov I, Abou-Nader P, Amin O, et al. Metformin increases e-cadherin in tumors of diabetic patients with endometrial cancer and suppresses epithelial-mesenchymal transition in endometrial cancer cell lines[J]. Int J Gynecol Cancer, 2016,26(7):1213-21.
[17] Liang G, Ding M, Lu H, et al. Metformin upregulates E-cadherin and inhibits b16f10 cell motility, invasion and migration[J]. Oncol Lett, 2015,10(3):1527-32.
