微流控纸芯片的开发用于尿液总蛋白含量的快速检测
2018-03-29李秀平崔天宇钟文英岳婉晴
李秀平,任 由,崔天宇,钟文英,岳婉晴
微流控芯片技术是近20年发展起来的新技术,具有集成度高、反应速度快和流体易控制等特点,在生命分析领域具有明显的优势[1]。2008年,Whitesides[2]研究团队首次提出了微流控纸芯片(μPAD)这一概念。纸芯片是指在一些性能上优于传统的玻璃、硅、聚二甲基硅氧烷(poly(dimeylsiloxane),PDMS)等材料上加工的微流控芯片,常见的纸芯片制作材料有色谱纸、硝酸纤维素膜、尼龙纸等。微流控纸芯片有着易于制造、成本低廉、使用方便和后处理简单等优点,已逐渐成为当下一种可靠和低成本的分析手段,有望在临床边检测(Point-of-Care Testing,POCT)[3]、食品安全、环境监测等方面得到广泛应用。
μPAD的制作方法有很多,如蜡印[4]、喷墨打印[5]、喷墨溶剂刻蚀[6]、等离子体处理[7]、光刻[8]、激光处理[9]、柔印技术[10]和手绘[11]等。制作原理是采用能固化的疏水材料如SU8光刻胶、蜡、聚苯乙稀、PDMS、聚甲基丙稀酸甲酰胺(PoNBMA)和烷基烯酮二聚体(AKD)等形成亲水性和疏水性交替的通道,来引导流体的流向[1]。每种技术都有其自身的优点和局限性。如光刻技术具有较高的分辨率,但需要昂贵的光刻设备;喷墨打印技术操作简单、试剂廉价、可实现大批量生产,但通常需要具有强溶解力的有机溶剂,而这可能损坏墨盒和打印机;等离子体处理技术试剂廉价,成本较低,但需要制作不同形状的金属掩模[12]。所以这就需要科学工作者不断优化纸芯片的制作过程,来实现批量化生产。同时对纸芯片上流体驱动机理的研究、更精准的流体驱动控制、与多种检测方法结合、提高检测的重现性和检出限等,也需要研究者们不断地思考[1]。
本研究采用了紫外光刻技术制作微流控纸芯片,并将得到的纸芯片用于人尿中总蛋白的检测,开发了一种快速便捷易操作的人尿总蛋白检测方法,可以实现对正常尿液和蛋白质超标尿液的检测,有望用于临床边检测中肾病的早期检测。
1 实验部分
1.1 仪器与试剂
1.1.1 试剂和材料
环戊酮(CP,上海阿拉丁试剂有限公司),异丙醇和氯化钠(AR,国药集团化学试剂有限公司),溴酚蓝(溴酚蓝)(Alfa aesar, #ALFA-032641-5G)和尿素(Sigma)均为分析纯。蛋白质标准品(0.3 mg /mL)购自Sigma公司,1号色谱纸购自GE公司,SU8 2050光刻胶和SU8显影剂购自MicroChem Inc,Newton MA。
1.1.2 仪器
紫外线曝光机(KVD-30,台湾金电子有限公司),LED数显加热型磁力搅拌器(MS-H280-Pro,Scilogex),倒置显微镜(TS2-S-SM,NiKon)。
1.2 微流控纸芯片的制作
首先,用环戊酮稀释SU8光刻胶,环戊酮与SU8的质量比为4∶1。室温下将色谱纸浸入2 mL稀释过的SU8光刻胶中静置30 s,之后在95 ℃电热板上预烘5 min,使光刻胶中的溶剂蒸发,然后室温冷却。光掩模用600 dpi激光打印机打印在透明菲林膜上。将设计好通道形状的掩膜与色谱纸重叠放置,在405 nm紫外线下照射60~80 s,再将色谱纸放置在95 ℃的电热板上后烘5 min。待室温冷却后将色谱纸浸在SU8显影剂中,不断搅拌5 min。显影完全的色谱纸用异丙醇清洗,再用纸巾吸去色谱纸上的异丙醇,自然风干1 h。
1.3 总蛋白的快速检测
将0.05 g溴酚蓝粉末溶解在1 mL 95%的乙醇中,制备浓度为50 mg/mL的溴酚蓝溶液,用去离子水将其稀释至5、8和10 mg/mL等系列质量浓度。再用含9.3 g/L尿素的0.9% NaCl溶液将蛋白质标准品稀释至0.02,0.05,0.10,0.15和0.20 mg/mL系列质量浓度。将0.2 μL不同质量浓度的溴酚蓝溶液预先点样到纸芯片上的试剂区,将纸芯片空气干燥10 min,用倒置显微镜拍摄图像。之后在样品区域添加10 μL不同质量浓度的蛋白质标准品,5 min后拍摄纸芯片的图像并进行后续分析。
2 结果与讨论
2.1 微流控纸芯片的设计和制作
设计的纸芯片由中间的加样区和周围的不同检测区组成。这样的设计可以在一块芯片上进行样品的平行检测,确保了实验的准确性。微流控纸芯片的制作过程如图1所示。首先将亲水性的纸用疏水性的光刻胶浸泡,之后预烘,使光刻胶中的溶剂蒸发。将设计好通道形状的掩膜与感光纸重叠放置,经紫外光(ultraviolet,UV)曝光处理,然后显影除去未交联的光刻胶。这里用到的是环氧基负性SU8光刻胶,未曝光的区域将在显影过程中被洗去。
为了节约时间和成本,我们并没有使用高分辨率打印机设计光掩模,而是利用办公室中的激光打印机以600 dpi的分辨率打印,得到的掩膜上点的理论最小直径值约为42.3 μm。对于大多数用于检测的微流控纸芯片,其通道的设计尺寸通常在毫米范围内。因此,较低分辨率的办公打印机不会影响纸芯片的质量。结果表明,两种光掩模制作的微流控纸芯片都可以成功地用于总蛋白含量分析。
2.2 加样量和加样方法优化
由于色谱纸是亲水性的,而光刻胶是疏水性的,在UV曝光和显影之后,我们首先进行了亲水性测试。在实验中必须确保纸仍然是亲水性的,并且在没有图案的区域上无残留的光刻胶。实验中优化了检测区上探针液体的用量,使其仅留存在确定的区域上,不会扩散到加样区,以避免与被测物混合。实验发现当纸芯片检测区域上探针液体用量为0.2 μL时,没有观察到染料的混合。
根据不同的需求,我们设计了蘸取和滴加两种加样方法(见图2)。蘸取是用纸芯片蘸取样品液滴,样品溶液由于毛细作用而被吸在芯片上。滴加则是将一滴样品溶液滴加到芯片的中心。蘸取方法的优点是无需对液体进行精确的体积控制,容易为大众所使用。然而,在芯片图案设计和制作时,需确保纸芯片的边界是疏水性的,否则被测样品将泄漏出检测区域。
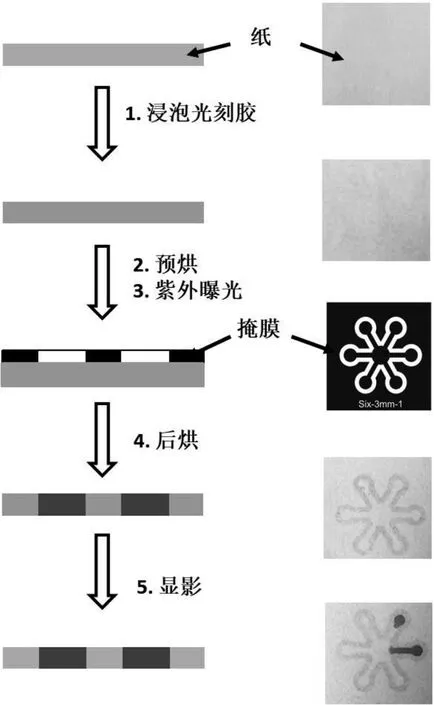
图1 微流控纸芯片制作过程示意

图2 在纸芯片上的两种加样方法(分别加入5 μL,10 μL样品)
我们在芯片上分别加入5 μL和10 μL的染料来探究合适的加样量,如图2所示。当加样量为10 μL时,样品可覆盖到所有检测区域,而5 μL的加样量却达不到这样的效果。虽然不同纸芯片设计的尺寸可能略有不同,但选择10 μL加样量可确保样品被有效检测。
2.3 缓冲液的选择
缓冲液的选择对准确分析复杂生物样品中的总蛋白非常重要。我们在一系列不同浓度溴酚蓝点样的纸芯片上加不同类别的缓冲液来进行筛选,如图3所示。加入pH=6.2和pH=7.4的磷酸盐缓冲液(Phosphate Buffered Saline,PBS)后,纸芯片颜色从黄色变为蓝色,这意味着当使用PBS作为空白和稀释溶液时,检测的背景影响将很高。而0.9%的氯化钠溶液显示出较好的降低背景效果。通过测量加入缓冲液前后斑点的灰度变化,发现当溴酚蓝浓度高于5 mg/mL时,0.9%NaCl缓冲液灰度变化低于15,显示最小背景。所以对于下一步实验,我们使用了0.9%的氯化钠溶液作为空白和稀释蛋白质标准品。
2.4 探针浓度的优化
为了使蛋白质分析的结果便于肉眼观察,我们进一步优化了探针溶液的浓度。溴酚蓝在水中的溶解度小于1 mg/mL,但在乙醇中溶解度较高。因此,选用为95%的乙醇制备质量浓度为50 mg/mL的溴酚蓝溶液,再用去离子水稀释。本次实验首先在纸芯片上分别滴加0.2 μL质量浓度范围为0.1~50 mg/mL的溴酚蓝溶液,空气干燥斑点10 min。然后在每个斑点上加入10 μL质量浓度为0.1 mg/mL的蛋白质标准品,干燥5 min。
在纸上滴加溴酚蓝溶液并干燥后,颜色由浅蓝色变为黄色,最后显示橙色。再加入质量浓度为0.1 mg/mL蛋白质标准品后,质量浓度为5,8和10 mg/mL的溴酚蓝斑点显示由黄色到蓝色的颜色变化比较明显。在较高质量浓度溴酚蓝(25和50 mg/mL)存在下,斑点由黄色到蓝色的颜色变化不像低质量浓度溴酚蓝那样明显。当溴酚蓝质量浓度过低(如0.1和1 mg/mL)时,颜色变化无法通过肉眼来识别。与无蛋白质标准品的空白溶液的灰度比较,低质量浓度溴酚蓝下斑点的灰度变化不太明显,但在溴酚蓝质量浓度范围为5~10 mg/mL时灰度显着增加,随着溴酚蓝质量浓度进一步升高时又开始降低。因此,选质量浓度范围为5~10 mg/mL的溴酚蓝可进一步优化纸芯片上总蛋白质的分析。

图3 系列不同质量浓度溴酚蓝点样的纸芯片上添加不同缓冲液后斑点的灰度变化
如图4a所示,纸芯片用0.2 μL质量浓度为5,8和10 mg/mL的溴酚蓝预先点样,用0.9%NaCl缓冲液配制质量浓度为0,2,5,10,15,20 mg /dL的蛋白质标准品,用芯片蘸取10 μL蛋白质标准品使其反应。
纸芯片用质量浓度为5,8和10 mg/mL 的溴酚蓝预先点样,然后分别与10 μL质量浓度为0,2,5,10,15和20 mg/dL的蛋白质标准品反应,用倒置显微镜CCD拍摄图像。从图4a可以看出,这3种溴酚蓝质量浓度都可以区分2~10 mg/dL的蛋白质,而在质量浓度为15和20 mg/dL的蛋白质在5mg/mL和8 mg/mL溴酚蓝存在下的颜色变化难以通过肉眼来鉴别。因此,选择10 mg/mL溴酚蓝作为检测浓度范围与尿液中蛋白质水平相关的总蛋白的最佳浓度。
2.5 检测限
确定了使用溴酚蓝的最佳浓度,我们进一步评估了纸芯片的检测限。从图4a可以看出,2~20 mg/dL蛋白质范围内的蛋白质可被10 mg/mL的溴酚蓝鉴别,其颜色从橙色变为蓝色,蛋白质的浓度越高,检测区的蓝色区域越多。我们接着又做了在10 mg/mL溴酚蓝点样的纸芯片上加入不同浓度蛋白质后的RGB强度图,如图4b所示。根据线性拟合结果,检测限和定量限分别为0.21和0.69 mg/dL。
2.6 模拟尿液中总蛋白质
我们用制得的纸芯片对尿液中总蛋白含量进行分析。将1.373 5 g NaCl,0.038 2 g KCl,0.257 3 g MgCl2,0.073 g CaCl2·2H2O和1.7 g尿素在100 mL去离子水中溶解来制备模拟尿液。使用标准加入法在模拟尿液中分别添加6和12 mg/mL蛋白质。使用无蛋白质的模拟尿液作为对照,以评估存在于尿液中的离子的干扰。结果表明,Na+,K+,Mg2+,Ca2+,Cl-和尿素的存在不影响蛋白质分析。
实际测量的蛋白质浓度将根据标准曲线来确定。重复最佳拟合曲线和溴酚蓝浓度来评估回收率。结果表明,从RGB通道测得的平均蛋白浓度,如表1所示,得到的回收率在96.78%~103.82%。

表1 通过标准添加法计算蛋白质浓度和回收率
2.7 稳定性试验
将纸芯片放置在暗室中,通过在几个纸芯片上点样质量浓度为10 mg /mL的溴酚蓝来进行稳定性测试。在制备之后的第0,1,5,8,12,15,19,22,26,30,34,42,48,62,68,71,76和83天拍摄纸芯片图像。每天的检测实验使用3个纸芯片:一个做空白对照,另外两个加10 mg/dL的蛋白质。空白和添加蛋白质标准品前后纸芯片的灰度级,由ImageJ软件来定量。
通过绘制每个条带中的蓝色通道的灰度与时间的关系,我们可以绘制如图5a所示的稳定性曲线。室温下在暗室中储存的条纹灰度在前40天保持在20~40的范围内,在第83天后略微增加到大约60。在9.3 g/L尿素和0.9%NaCl存在时,信号也保持在与测试前相同的范围内。当添加10 mg/dL蛋白质时,蓝色通道中的灰度增加到70,并且信号相对于新鲜制备的条带和存储48天的条带来说比较稳定,但在83天后稍微增加到大约90。然而,减去背景信号后显示灰度变化在83天内保持稳定(见图5b),这表明得到的纸芯片具有良好的稳定性和再现性。
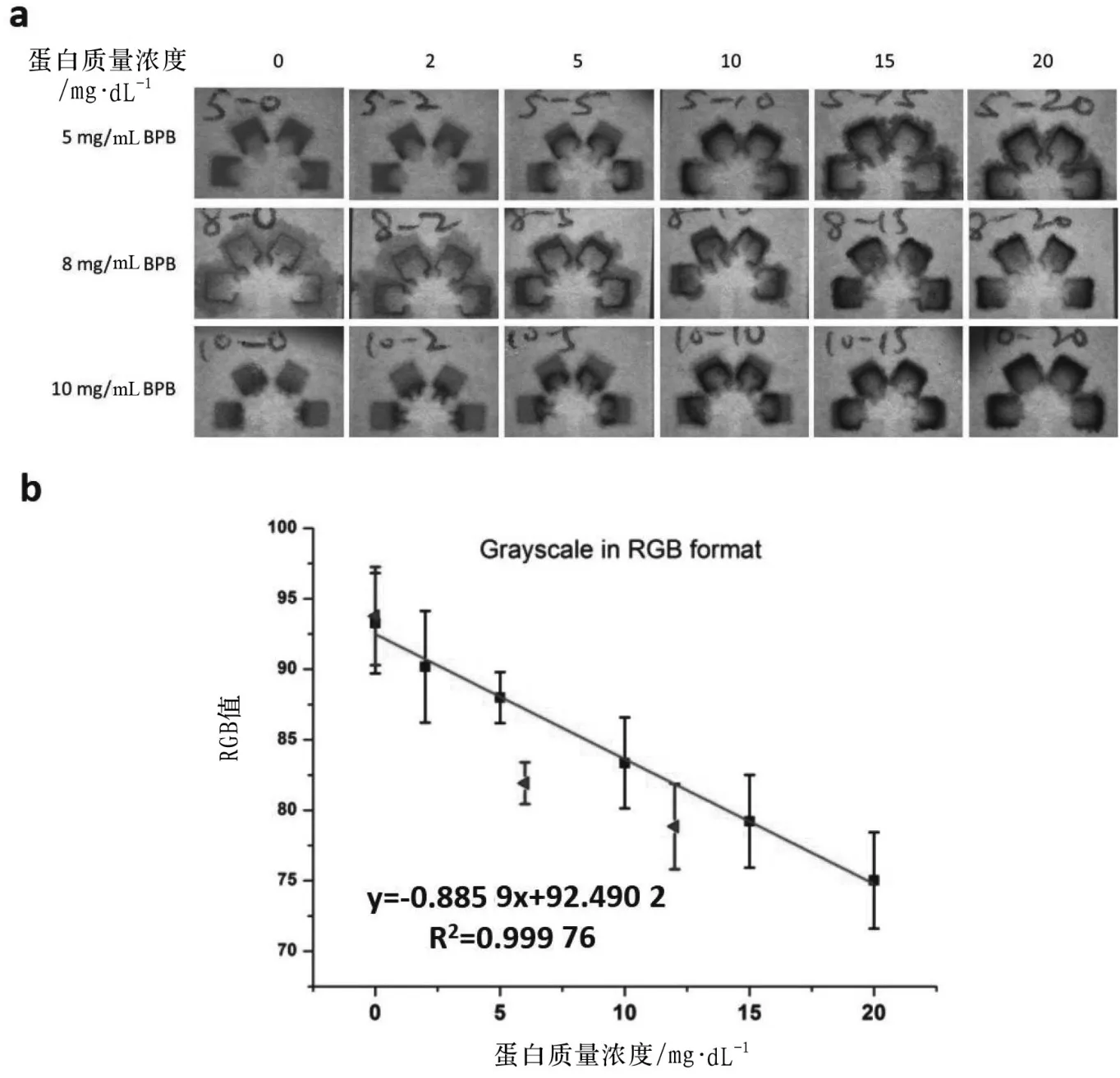
图4 在10 mg/mL溴酚蓝点样的纸芯片上加入不同浓度蛋白质后的RGB强度
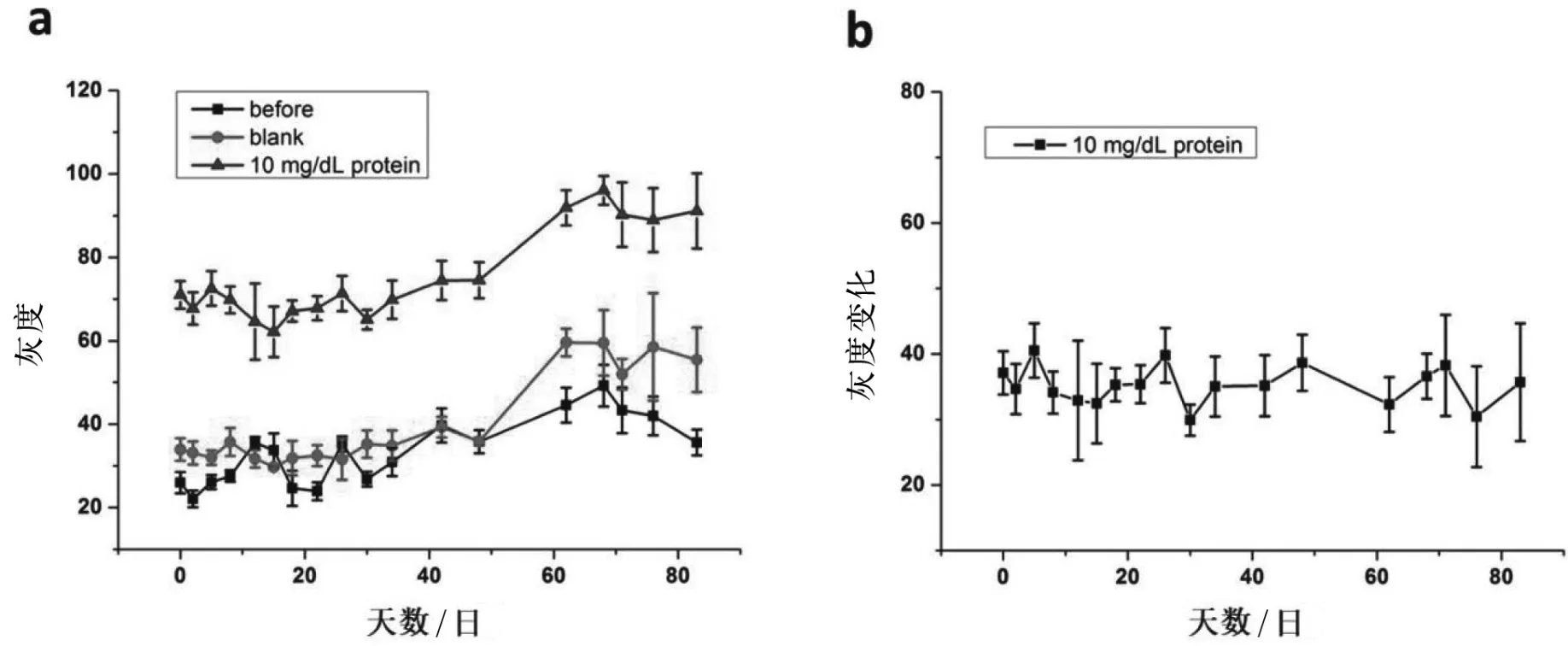
图5 室温下在暗室中储存的纸芯片上检测区的灰度总结(评估期为83天)
3 结语
对于尿中总蛋白质含量的分析,我们构建了基于微流控纸芯片的快速检测法,并且优化了指示剂的加载量和浓度、加样方法和加样量以及缓冲液的选择等参数。每个检测试验的指示剂用量为0.2 μL,样品量为10 μL。采用浸渍和滴加两种加样方法,原理都是利用毛细作用将样品吸收到检测区。检测过程在5 min内可用肉眼观察。可以通过量化由显微镜或手机拍摄的芯片图像的灰度来执行半定量。检测限为0.21 mg/dL,定量限为0.69 mg/dL。结果表明,使用微流控纸芯片进行尿液中总蛋白质分析时,尿样中的尿素不会干扰结果。模拟尿液中总蛋白质分析,回收率为96.78%~103.82%。在3个月内评估的纸芯片测定法有良好的稳定性和可重复性,表明该测定潜在地可以在完整的生物样品中进行。
[参考文献]
[1] 刘蒙蒙.纸芯片-质谱分析方法研究及其在药物分析中的应用[D].合肥:中国科学技术大学,2016.
[2] BRUZEWICZ D A,RECHES M,WHITESIDES G M.Lowcost printing of poly(dimethylsiloxane)barriers to define microchannels in paper[J].Analytical Chemistry,2008,80(9):3387-3392.
[3] TSAI T T,SHEN S W,CHENG C M,et al.Paper-based tuberculosis diagnostic devices with colorimetric gold nanoparticles[J].Science and Technology of Advanced Materials,2013(14):4404-4408.
[4] LU Y,SHI W W,QIN J H,et al.Fabrication and characterization of paper-based microfluidics prepared in nitrocellulose membrane by wax printing[J].Analytical Chemistry,2010(82):329-335.
[5] DELA N EY J L,HOGA N C F.Elect rogenerated chemiluminescence detection in paper-based microfluidic sensors[J].Analytical Chemistry,2011(83):1300-1306.
[6] LI X,TIAN J F,GARNIER G,SHEN W.Fabrication of paperbased micro fl uidic sensors by printing[J].Colloids and Surfaces B Biointerfaces,2010(76):564-570.
[7] LI X,TIAN J F,NGUYEN T,SHEN W.Paper-based microfluidic devices by plasma treatment[J].Analytical Chemistry,2008(80):9131-9134.
[8] KLASNER S A,PRICE A K,HOEMAN K W,et al.Paperbased microfluidic devices for analysis of clinically relevant analytes present in urine and saliva[J].Analytical and Bioanalytical Chemistry,2010(397):1821-1829.
[9] CHITNIS G,DING Z W,CHANG C L,et al.Laser-treated hydrophobic paper: an inexpensive micro fl uidic platform[J].Lab Chip,2011(11):1161-1165.
[10] OLKKONEN J,LEHTINEN K,ERHO T.Flexographically printed fluidic structures in paper[J].Analytical Chemistry,2010(82):10246-10250.
[11] RATNARATHORN N,CHAILAPAKUL O,HENRY C S,et al.Simple silver nanoparticle colorimetric sensing for copper by paper-based device[J].Talanta,2012(99):552-557.
[12] 马翠翠. 基于紫外光降解自组装单分子层的纸芯片研制及其应用研究[D].杭州:浙江大学,2013.
