CNTF联合RA诱导成肌细胞类神经分化及与REST的相关性*
2018-03-28邱裕佳马义勇李光然段思腾李宇王伟
邱裕佳,马义勇,李光然,段思腾,李宇,王伟
(锦州医科大学附属第一医院,辽宁 锦州 121000)
自体神经移植一直以来被认为是治疗周围神经损伤修复的“金标准”,但是因其来源受限、造成供区功能障碍等缺点,使其临床应用受到一定的限制[1]。组织工程及干细胞治疗技术的发展避免上述问题,为周围神经损伤的治疗带来新的希望。成肌细胞因其取材方便、增殖能力强、易于培养、成瘤风险低、自体移植无伦理限制及低免疫排斥等优点而备受关注[2]。新近研究表明,成肌细胞能够被睫状神经营养因子(ciliary neurotrophic factor,CNTF)体外诱导去分化[3],且去分化成肌细胞能够被视黄酸(retinoic acid,RA)诱导成具有神经表型的细胞[4]。目前,关于类神经分化的研究虽较多,但是相关机制尚不清楚。神经元限制性沉默因子(neuron-restrictive silencer factor,REST)在神经细胞的发育分化过程中发挥重要作用,能与靶基因特异结合而抑制神经元的分化[5-6];REST与类神经分化存在怎样的联系,目前尚未见相关报道。本研究采用CNTF联合RA诱导成肌细胞类神经分化,并初步探讨该过程与REST可能存在的关系。
1 材料与方法
1.1 主要材料与仪器
C2C12细胞株(美国ATCC公司),胎牛血清FBS(美国Sera Pro公司),DMEM/F12、胰蛋白酶、青链霉素(美国Hy Clone公司),Neurobasal培养基、B27(美国Gibco公司),表皮生长因子EGF、碱性成纤维细胞生长因子bFGF、CNTF(美国Pepro Tech公司),谷氨酰胺、RA、DAPI染料(美国Sigma公司),肝素(PBS国产),兔抗NSE多克隆抗体,兔抗SOX1多克隆抗体,兔抗GFAP多克隆抗体,兔抗Desmin多克隆抗体,兔抗Myogenin多克隆抗体,兔抗P21多克隆抗体,兔抗actin多克隆抗体(美国ABCAM公司),山羊抗兔二抗(美国Earthox公司),蛋白提取试剂盒、蛋白定量试剂盒、SDS-PAGE凝胶试剂盒(上海碧云天生物技术有限公司),蛋白Maker(美国Thermo Fisher公司)。
细胞培养箱(美国Thermo Fisher),超净工作台(海尔公司),倒置相差显微镜(日本Olympus公司),紫外分光光度计(瑞士Tecan公司),荧光显微镜(德国Leica公司),全自动电泳仪(美国Bio-Rad公司),凝胶成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 成肌细胞去分化及类神经诱导分化按5×105个/ml接种C2C12于培养皿,以成肌细胞生长培养基(DMEM/F12培养基+10%胎牛血清+1%双抗)培养,待生长到70%汇合时开始诱导分化,诱导方案见附表。
1.2.2 细胞形态学观察分别于诱导第0、3、5、8及11天时倒置相差显微镜下观察各组细胞数量、形态、生长状况等相关变化,记录并采集图片。
1.2.3 细胞免疫荧光鉴定诱导后的细胞细胞以PBS漂洗3次去除培养基,4%多聚甲醛室温固定15 min后PBS漂洗3次,0.1% Triton-100室温通透胞膜10 min,1%牛血清白蛋白室温封闭60 min,加入稀释的一抗 NSE(1︰ 500)、Sox1(1︰ 500)、GFAP(1︰500)4℃孵育过夜(18~20 h),二抗(1︰500)室温孵育2 h,DAPI染料(10 μg/ml)染核5 min,荧光防淬灭剂封片。以PBS代替一抗作为阴性对照组。荧光显微镜下观察并采集图片。为进一步鉴定神经球,取联合诱导11 d的神经球细胞以胰酶消化后吹打成单个悬浮细胞,并以神经生长培养基+2% FBS培养1 d,待细胞贴壁后予以神经干细胞标志物nestin(1︰100)荧光染色鉴定。
1.2.4 Western blot检测特异性蛋白表达水平取各组细胞加入裂解液裂解30 min后,以离心半径3 cm,12 000 r/min离心30 min,取上清液,BCA法蛋白定量后调整至同等浓度,每孔上样30 μg,经10% SDS-PAGE凝胶电泳后转移至PVDF膜,1%BSA封闭1 h,加 入 TBST稀 释 一 抗 NSE(1︰ 500)、Sox1(1︰1 000)、GFAP(1 ︰ 1 000)、Desmin(1 ︰ 1 000)、Myogenin(1 ︰ 1000)、P21(1 ︰ 500)、REST(1 ︰500)、β-actin(1︰ 5 000)4℃过夜,TBST 洗膜 3次,加入二抗(1︰1 000)室温孵育2 h,TBST洗膜3次,ECL显色显影拍照。

附表 成肌细胞类神经分化诱导方案
1.2.5 流式细胞术分析诱导后阳性细胞胰酶消化联合诱导组细胞并制成单细胞悬液,收集单细胞悬液,1 500 r/min离心5 min,弃上清液,4%多聚甲醛4℃固定30 min,0.1% Triton-100室温通透10 min,加入稀释好的一抗(NSE,1︰500),对照管加入对应于一抗的正常实验动物IgG,轻轻吹打混匀,4℃孵育2 h。冷PBS离心洗涤去除多余的未结合的特异性抗体。加入稀释的荧光素标记的二抗(1︰100)。吹打混匀,4℃孵育30 min,避光。冷PBS离心洗涤后重悬浮于500 μl PBS中,混匀,上机检测。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 神经球形成过程
未诱导成肌细胞呈长梭形或不规则形;诱导3 d后,细胞生长状态良好,未见细胞融合形成肌管;诱导5 d后,诱导组细胞折光性增加,体形拉长;诱导8 d左右,诱导组细胞开始聚集呈团簇样生长,随着培养时间延长,于诱导第11天左右,部分团块细胞可呈悬浮生长,表现出神经球样生长特性。见图1。
2.2 CNTF诱导成肌细胞去分化
CNTF诱导成肌细胞3 d后,Western blot检测结果显示,CNTF诱导后成肌细胞分化相关蛋白Myogenin及P21表达均低于对照组(t=6.811和6.665,P=0.002和0.003)。表明CNTF成功诱导成肌细胞去分化,本结果与以往研究报道一致[3]。见图2。
2.3 细胞免疫荧光鉴定诱导神经球
对联合诱导后的神经球行免疫荧光染色,可见诱导组细胞能够被神经细胞相关特异性标志物NSE、SOX1、GFAP标记,且神经球部分呈现荧光高亮。对照组中未见神经球形成,且细胞不能被荧光标记(见图3)。神经球离散后接种细胞生长状态良好,部分细胞可伸出突触,且荧光染色显示重新接种后的细胞仍 带有神经干细胞标志物nestin(见图4)。
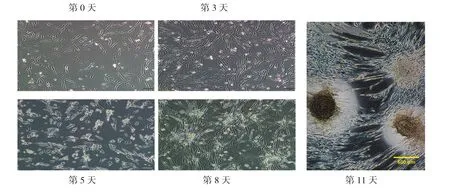
图1 成肌细胞诱导为神经球的变化过程 (×100)

图2 CNTF诱导后成肌细胞分化相关蛋白变化 (n =3)

图3 诱导神经球 (免疫荧光染色×100)

图4 神经球离散后接种细胞 (免疫荧光染色×200)
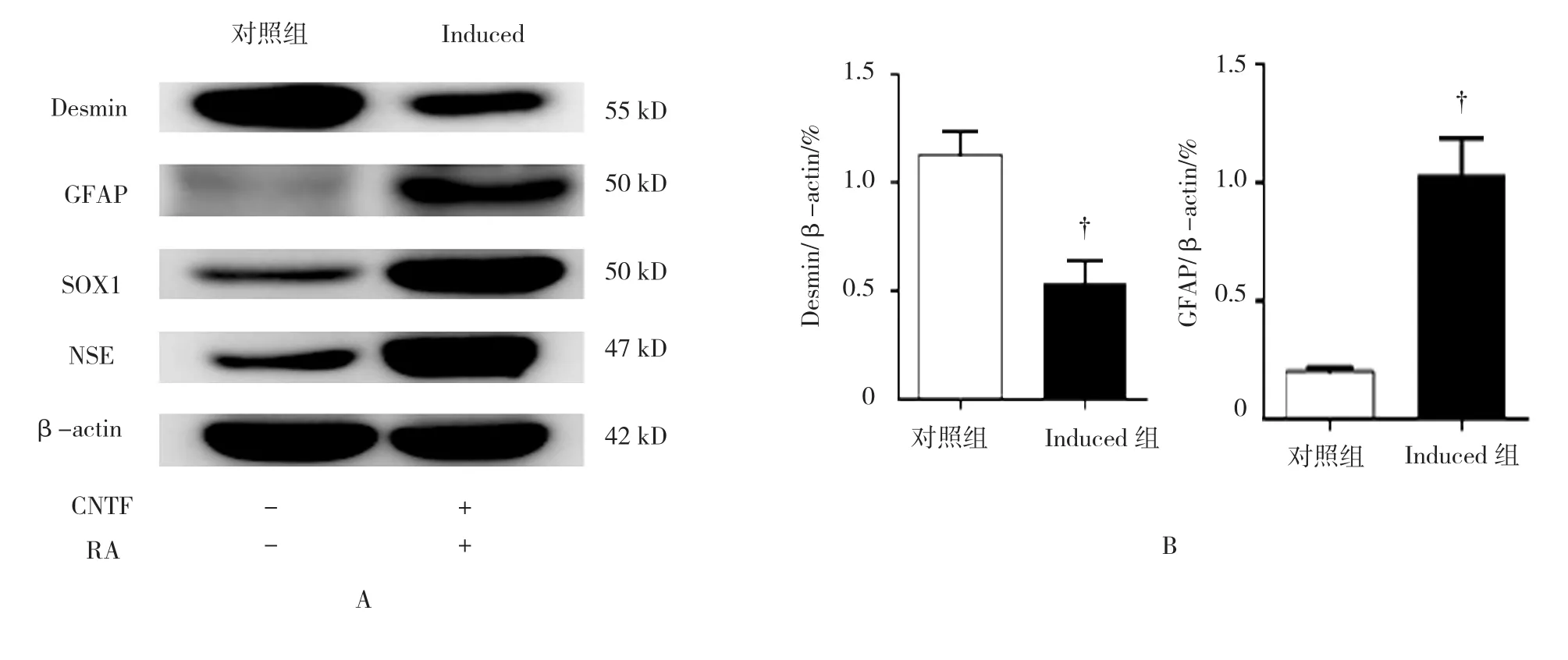

图5 联合诱导后细胞神经特异性标志物及成肌细胞标志物表达变化 (n =3)
2.4 联合诱导后细胞神经特异性标志物及成肌细胞标志物表达变化
对联合诱导后的神经球行Western blot检测,结果显示,联合诱导后细胞GFAP、SOX1、NSE表达高于对照组(t=5.192、3.401和6.303,P=0.007、0.003和0.003),且成肌细胞标志物Desmin表达低于对照组(t=3.646,P=0.022)。说明联合诱导后细胞由成肌细胞类型向类神经细胞类型转化。见图5。
2.5 联合诱导后细胞流式细胞仪检测结果
对联合诱导后的细胞用流式细胞仪分析表面标志物NSE,结果显示联合诱导后荧光标记阳性细胞率最高达84%,明显高于对照组(t=45.81,P=0.000)。见图6。
2.6 联合诱导后REST蛋白水平变化
联合诱导后的神经球行Western blot检测结果显示,联合诱导后细胞REST表达水平低于对照组(t=4.110,P=0.015)。REST是参与神经细胞发育的重要调控基因,REST水平降低利于细胞向神经细胞类型分化[5-6]。由此可得出联合诱导成肌细胞类神经分化可能是通过干预REST基因的表达变化来实现。见图7。
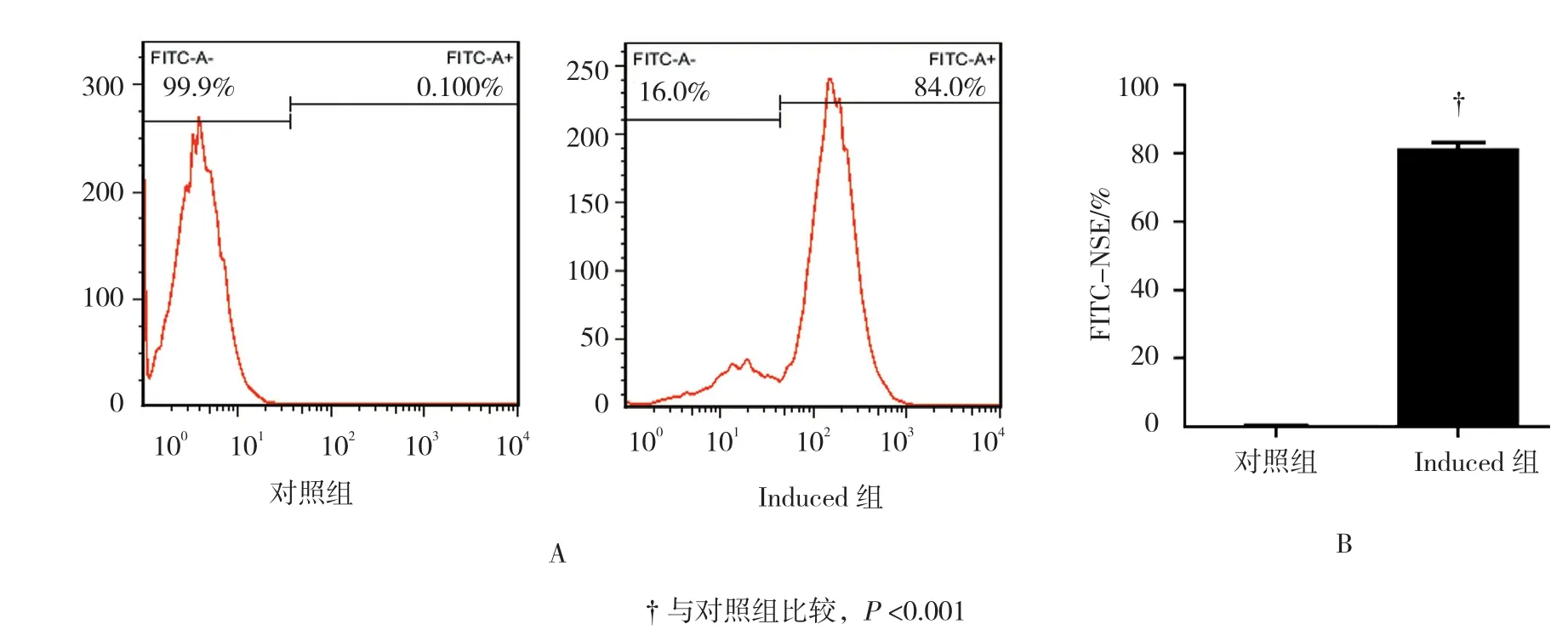
图6 联合诱导后细胞流式细胞术检测结果 (n =3)

图7 联合诱导后REST蛋白水平变化 (n =3)
3 讨论
随着诱导多能干细胞的发现[7],细胞治疗在神经损伤修复领域中越来越受到关注。目前大量研究已证实,从胚胎干细胞到各种类型的成体干细胞再到诱导多能干细胞均在神经修复中展示良好的应用前景[8-12];但是上述各种细胞存在各种问题,例如伦理争议、取材困难、基因表达不稳定等[13],目前还不能作为十分理想的神经修复的细胞来源,由此拓宽神经损伤细胞治疗的细胞选择范围十分必要。成肌细胞是骨骼肌中具有增殖分化潜能的细胞,1961年由MUAOR首次从青蛙骨骼肌纤维中分离出来[14]。成肌细胞具有多向分化潜能[15]且取材方便、增殖能力强、易于培养、成瘤风险低、自体移植无伦理限制及低免疫排斥等优点[2],已成为细胞治疗在神经损伤修复领域的新热点。
新近研究表明,成肌细胞在外源性CNTF的作用下能够达到去分化状态[3],且成肌细胞能够被小分子化合物reversine诱导去分化进而被RA诱导为类神经样细胞[4]。RA能够调节各种转录因子的表达,在改变干细胞形态及转录特征上充当着开关作用,已被广泛应用于细胞诱导分化的研究中[16-18]。本研究采用CNTF联合RA诱导成肌细胞类神经分化,试图获得成肌细胞类神经分化的新方法。研究结果表明,CNTF能够成功诱导成肌细胞去分化,联合RA及神经生长微环境后成肌细胞能够形成神经球样结构,并表达NSE、SOX1、GFAP,且成肌细胞标志物Desmin表达降低,说明联合诱导后细胞表型已发生转变,细胞已由肌源性细胞转变为类神经样细胞。将神经球离散后接种再次检测仍然表达神经干细胞标志nestin,说明诱导后细胞表型稳定,需要注意的是nestin阳性细胞的形状并不完全一致,可能因为重新接种后神经球细胞可能分化为不同类型神经样细胞;此外,部分细胞经诱导后仍存在成肌细胞样特性,可能与表观遗传记忆有关[19]。为进一步探讨上述联合诱导过程可能涉及内在机制,发现REST作为调节神经细胞分化的重要转录调控因子一直以来备受关注,WATANABE等将REST-VP16重组转录因子转入C2C12获得神经元样表型且具有电生理活动的细胞[20];GOPALAKRISHNAN等通过该方式在小鼠小脑中获得特定亚型的谷氨酸能神经元[21]。由此本研究联合诱导后成肌细胞形成的神经球的REST表达进行检测分析,结果显示诱导后形成的神经球与对照组比较REST表达下调,说明REST参与成肌细胞类神经分化过程,可能是该过程的调控机制之一。
通过基因调控的方式可获得特定表型细胞,但因改变内源性基因序列,使得其临床应用受到阻碍。本研究以非基因调控方式转变成肌细胞为类神经细胞表型为神经组织工程种子细胞的选择提供尝试。近期国外学者通过高通量筛选的方式已找到针对调控REST表达的化合物[22],若能以化合物调控REST表达实现将非神经细胞转变为神经细胞干细胞或者特定类型神经细胞,将能做到尽可能避免外源性的基因及因子的引入,极大地促进神经损伤的治疗,更是为临床细胞治疗的应用提供了保障。
综上所述,本研究初步证实CNTF联合RA可诱导成肌细胞类神经分化,为神经组织工程种子细胞的选择提供新的尝试;并进一步探讨该诱导过程可能与REST调控有关,为下一步研究更为优良的种子细胞提供思路和方向。
[1] FARONI A, SMITH R J, LU L, et al. Human Schwann-like cells derived from adipose-derived mesen-chymal stem cells rapidly de-differentiate in the absence of stimulating medium[J]. Eur J Neurosci, 2016, 43(3): 417-430.
[2] DURRANI S, KONOPLYANNIKOV M, ASHRAF M, et al.Skeletal myoblasts for cardiac repair[J]. Regen Med, 2010, 5(6):919-932.
[3] ZHANG P, CHEN X P. The regulation of myoblast plasticity and its mechanism[J]. Chinese Journal of Applied Physiology, 2012,28(6): 524-531.
[4] LEE E K, BAE G U, YOU J S, et al. Reversine increases the plasticity of lineage-committed cells toward neuroectodermal lineage[J]. J Biol Chem, 2009, 284(5): 2891-2901.
[5] ZHAO Y, ZHU M, YU Y, et al. Brain REST/NRSF Is Not Only a Silent Repressor but Also an Active Protector[J]. Mol Neurobiol,2017, 54(1): 541-550.
[6] YANG Y J, BALTUS A E, MATHEW R S, et al. Microcephaly gene links trithorax and REST/NRSF to control neural stem cell proliferation anddifferentiation[J]. Cell, 2012, 151(5): 1097-1112.
[7] TAKAHASHI K, YAMANAKA S. Induction of pluripotent stem cells from mouse embry-onic and adult fibroblast cultures bydefined factors[J]. Cell, 2006, 126(4): 663-676.
[8] ZHANG H T, LIU Z L, YAO X Q, et al. Neural differentiation ability of mesenchymal stromal cells from bone marrow and adipose tissue: a comparative study[J]. Cytotherapy, 2012, 14(10):1203-1214.
[9] LAVASANI M, THOMPSON S D, POLLETT J B, et al. Human muscle-derived stem/progenitor cells promote functional murine peripheral nerveregeneration[J]. J Clin Invest, 2014, 124(4): 1745-1756.
[10] GROCHMAL J, DHALIWAL S, STYS P K, et al. Skin-derived precursor schwann cell myelination ca-pacity in focal tibial demyelination[J]. Muscle Nerve, 2014, 50(2): 262-272.
[11] LEE E J, XU L, KIM G H, et al. Regeneration of peripheral nerves by transplanted sphere of human mesenchymal stem cellsderived from embryonic stem cells[J]. Biomaterials, 2012, 33(29): 7039-7046.
[12] IKEDA M, UEMURA T, TAKAMATSU K, et al. Acceleration of peripheral nerve regeneration using nerve conduits in combination with inducedpluripotent stem cell technology and a basic fibroblast growth factor drug delivery system[J]. J Biomed Mater Res A, 2014, 102(5): 1370-1378.
[13] JIANG L, JONES S, JIA X. Stem Cell Transplantation for Peripheral Nerve Regeneration: Cur-rent Options and Opportunities[J]. Int J Mol Sci, 2017, 18(1): 94.
[14] MAURO A. Satellite cell of skeletal muscle fibers[J]. J Biophys Biochem Cytol, 1961(9): 493-495.
[15] ASAKURA A, KOMAKI M, RUDNICKI M. Muscle satellite cells are multipotential stem cells that ex-hibit myogenic, osteogenic,andadipogenic differentiation[J]. Differentiation, 2001, 68(4/5):245-253.
[16] WANG N, XU Y, QIN T, et al. Myocardin-related transcription factor-a is a key regulator in retinoic acid-induced neurallikedifferentiation of adult bone marrow-derived mesenchymal stem cells[J]. Gene, 2013, 523(2): 178-186.
[17] YU Z, WU S, LIU Z, et al. Sonic hedgehog and retinoic Acid induce bone marrow-derived stem cells to differentiate intoglutamatergic neural cells[J]. J Immunoassay Immunochem,2015, 36(1): 1-15.
[18] ZHANG K, LIU Z, LI G, et al. Electro-acupuncture promotes the survival and differentiation of transplanted bone marrowmesenchymal stem cells pre-induced with neurotrophin-3 and retinoic acid in gelatin spongescaffold after rat spinal cord transection[J]. Stem Cell Rev, 2014, 10(4): 612-625.
[19] BAR-NUR O, RUSS H A, EFRAT S, et al. Epigenetic memory and preferential lineage-specific differentiation in induced pluripotent stemcells derived from human pancreatic islet beta cells[J]. Cell Stem Cell, 2011, 9(1): 17-23.
[20] WATANABE Y, KAMEOKA S, GOPALAKRISHNAN V, et al. Conversion of myoblasts to physiologically active neuronal phenotype[J]. Genes Dev, 2004, 15, 18(8): 889-900.
[21] GOPALAKRISHNAN V, BIE B, SINNAPPAH-KANG N D, et al.Myoblast-derived neuronal cells form glutamatergic neurons in the mouse cerebellum[J]. Stem Cells, 2010, 28(10): 1839-1847.
[22] CHARBORD J, POYDENOT P, BONNEFOND C, et al. High throughput screening for inhibitors of REST in neural derivatives of human embryonic stemcells reveals a chemical compound that promotes expression of neuronal genes[J]. Stem Cells, 2013,31(9): 1816-1828.
