微波辅助萃取蓝莓中花青素降解工艺研究
2018-03-28薛宏坤朱广浩郑先哲
薛宏坤,徐 浩,朱广浩,郑先哲
(东北农业大学 工程学院,哈尔滨 150030)
0 引言
蓝莓中富含丰富的花青素、维生素C和维生素E[1-2],这些活性成分具有较高的营养价值,有益于人体健康。其中,花青素具有抗氧化、清除人体自由基、抗炎、保护心脑血管和缓解视疲劳等功效[3-4],在食品、保健品、药品和化妆品等行业中有着巨大的应用潜力[5]。由于花青素属于热敏性成分,对高温、光、氧气等外界条件有很强的敏感性[6]。
如何从蓝莓中获取高得率、低降解率的花青素成为科研工作者研究的热点话题。造成花青素降解的因素有内因和外因:内因是花青素自身结构,由于花青素具有多个酚羟基,根据取代基的不同,稳定性差异较大,甲基化能增加花青素的稳定性,羟基化使花青素稳定性降低[7];外因国内外学者也进行了相关研究。王芳等[8]研究了温度对蓝莓活性成分影响,表明高温可加快活性成分降解;Chan[9]等研究微波辅助萃取植物中的花青素,表明微波辐射使萃取体系极性分子吸收微波能,温度升高,高温加速花青素降解;Reyes等[10]研究不同pH下花青素降解特性,研究发现pH越高花青素降解速率越快;Ochoa等[11]研究光照对花青素降解速率的影响,表明在光照下花青素的降解明显高于避光条件;Chung等[12]研究金属离子对花青素降解的影响,研究发现Fe3+、Cu2+加速花青素降解;Dorota等[13]研究向花青素中通入氧气,发现随通氧量增加,花青素降解速率增加;Veridiana等[14]研究在樱桃中加入适量的Vc能显著降低花青素降解速率。以上学者仅对影响花青素降解的因素进行研究,但微波辅助萃取工艺对花青素降解影响尚未见报道。
本文研究主要内容:通过单因素试验,考查微波强度、萃取时间、乙醇浓度、料液比对花青素降解规律的影响;以花青素降解率最低为目标,通过二次正交旋转中心组合设计试验来优化合理的工艺参数。
1 材料与方法
1.1 试验材料
挑选成熟度均一、籽粒饱满的蓝莓置于冰箱中冷冻,在试验前从冰箱中取出,解冻3h,然后放在九阳打浆机中进行打浆;将果浆置于玻璃皿中,放在冰箱中冷冻12h后,置于TD-50冻干机(上海浦东冷冻干燥设备有限公司)冻至24h,用植物性粉碎机进行粉碎,过40目筛,制成果粉,避光密封保存与冰箱中备用。
试剂:香草醛、浓盐酸、甲醇、无水乙醇均为分析纯,购自于天津市富宇精细化工有限公司。
1.2 试验方法
1.2.1 萃取过程
1)萃取体系的构建:用AB204-S型电子分析天平(梅特勒-托利多仪器(上海)有限公司)准确称取2.000 0(±0.000 5)g蓝莓粉置于萃取容器中,加入试验预先确定体积和浓度的乙醇作为萃取剂来构建萃取体系。
2)微波萃取过程:将萃取容器置于微波工作站(MWS,加拿大FIOS公司)的中央,连接温度和压力光纤传感器,将传感器的探头置于萃取体系内,利用FIOS软件实时测定萃取液内部温度和压力的变化。
3)萃取体系渣液分离:经微波处理后萃取体系倒入离心管中,置于LG10-2.4A(北京京立离心机有限公司)离心机中以4 000r/min、15min离心,其目的将上清液和残渣分离,用一定浓度乙醇洗涤残渣,直到残渣无色为止;收集多次洗涤的渣液置于100mL容量瓶中,用一定浓度的乙醇定容至刻度得到渣液备用;将上清液用一定浓度乙醇定容100mL容量瓶中得到原液备用。
4)显色液制备:A液取1.000g香草醛置于100mL容量瓶中,用甲醇定容到100mL混均;B液取8 mL的浓盐酸置于100mL容量瓶中,用甲醇定容到100mL混均。将A液与B液1∶1混合制得显色液。
1.2.2 花青素萃取率测定
采用低浓度香草醛-盐酸法[15]测定蓝莓中花青素萃取率和降解率。方法如下:用移液枪准确移取1.0mL原液置于10mL比色管中,用一定浓度的乙醇将原液稀释10倍;然后从稀释的原液中取出2 mL置于另一个10mL比色管中,加入10mL显色液,混匀后置于30℃DK-98-IIA型恒温水浴锅(天津市泰斯特仪器有限公司)中,30min(避光)。用LAMBDA35型紫外-可见分光光度计(美国Perkin Elmer公司)在500nm处测定原液的OD值,利用标准方程y=1.612x-0.048 5[16](决定系数R2=0.998 9)计算出蓝莓中的花青素的浓度值,最后通过花青素萃取率的计算公式计算出花青素萃取率,其公式为
(1)
其中,D为花青素萃取率(%);C为花青素浓度(mg/mL);V为定容体积(mL);n为稀释倍数;W为花青素总量(mg)。本研究中新鲜蓝莓中100g果粉花青素总含量为101.17mg。
1.2.3 花青素降解率测定
用移液枪准确移取2 mL的渣液置于10 mL的比色管中,加入10 mL的显色液,以下的操作步骤同原液OD值测定方法相同。使用上述方法测定渣液中花青素含量,即为花青素残留率,通过式(2)[17],可计算得到微波辅助萃取过程中花青素的降解率,即
Y降解率=1-Y萃取率-Y残留率
(2)
1.2.4 试验设计
选用微波强度(W/g)、萃取时间(s)、乙醇浓度(%)、料液比 (g/mL)作为试验因素,以蓝莓中花青素降解率为试验指标进行试验设计,如表1所示。

表1 单因素试验的因素和水平
1)单因素试验。以蓝莓为原料,选取微波强度(50~250W/g),萃取时间(0~100s),乙醇浓度(20%~80%),料液比(1∶10~1∶50)作为试验因素,以花青素降解率为目标因素。每组试验重复3次,并对试验数据进行方差分析。
2)组合试验。选用微波强度、萃取时间、乙醇浓度、料液比作为中心组合试验的影响因素,采用响应曲面法(RSM)建立试验参数的回归模型,研究试验因素对花青素降解率的影响。各因素的取值范围如表2所示。
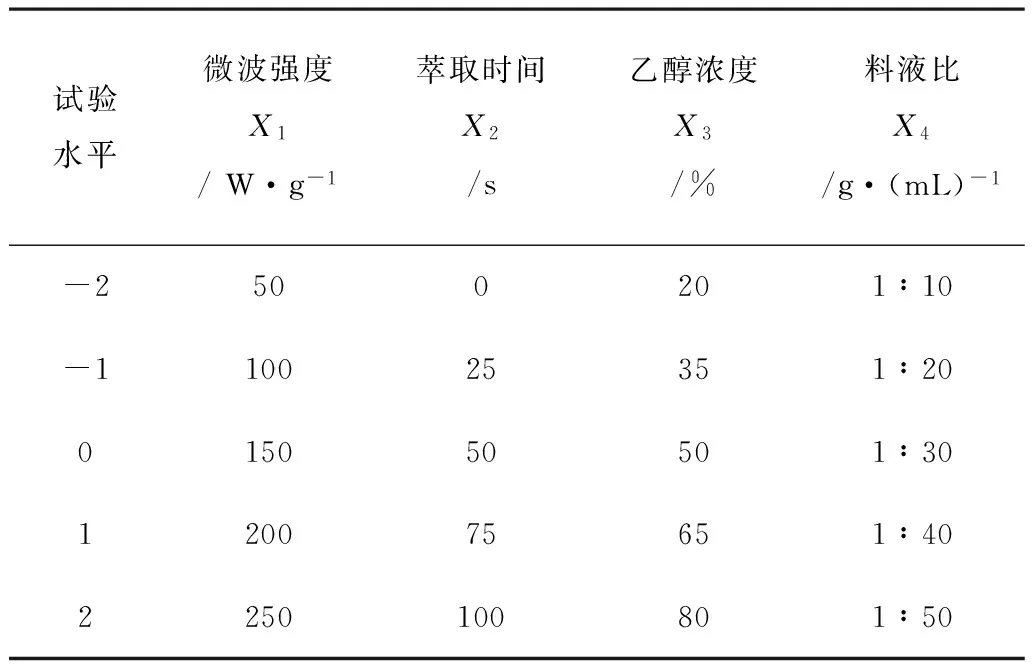
表2 试验设计因素水平及编码表
利用Design-Expert ver6.0(SAT-EASE, Inc., Last September,UK)对试验进行设计,并对所有的数据进行分析,采用响应面分析法得到二次回归模型为
(3)
其中,b0为截距回归系数;bi为线性回归系数;bii为交互项的回归系数;Xi、Xj为自变量。
1.3 数据处理
分别采用SigmaPlot12.5(SPSS, Inc., Chicago, US)软件进行作图和DesignExpert ver6.0(SAT-EASE, Inc., Last September,UK)软件,构建响应曲面模型,研究因素之间的交互影响及对蓝莓花青素的工艺参数进行优化和验证,确定本研究的可靠性。
2 结果与讨论
2.1 微波强度对花青素降解率的影响
选取萃取时间为50s,乙醇浓度50%,料液比为1∶30,考查不同微波强度对花青素降解率的影响,结果如图1所示。
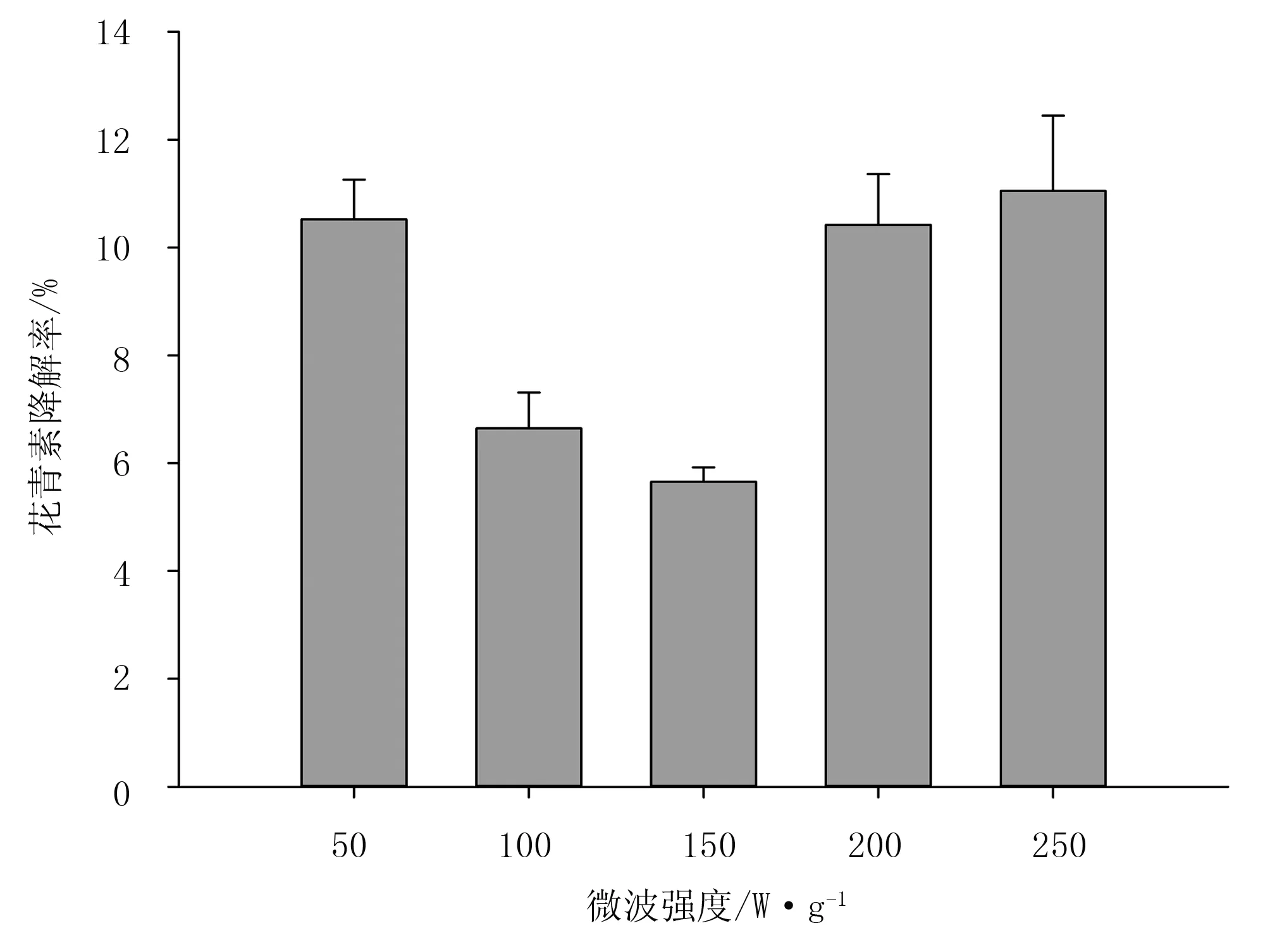
图1 不同微波强度对花青素降解率的影响
由图1可知:随着微波强度的增加,蓝莓中花青素降解率呈现先降低后升高的趋势。当微波强度在150W/g时,花青素降解率达到最小值5.66%;当微波强度在50~150W/g范围内,随着微波强度的增加,花青素降解率降低;当微波强度在150~250W/g范围内,随着微波强度的增加,降解率增加。其原因是随着微波强度的进一步增加,萃取液温度迅速增加,花青素是热敏性物质,当萃取液温度到50℃时,花青素结构被破坏,50%以上的花青素发生降解[18];微波强度在150W/g以上时,萃取液的温度均大于50℃,从而使花青素降解率增加。
2.2 萃取过程对花青素降解率的影响
选取微波强度为150W/g,乙醇浓度为50%,料液比为1∶30,考查不同萃取时间对花青素降解率的影响,结果如图2所示。
由图2可知:随着萃取时间的延长,蓝莓中花青素降解率呈现先降低后升高的趋势。当微波萃取时间在50s时,降解率达到最小值5.57%。当萃取时间在0~50s范围内,降解率随萃取时间的增加而降低,原因是此时花青素萃取率随时间的延长而增加,故花青素降解率降低;随着萃取时间的延长,花青素降解率增加。由于随着微波辐射时间的延长,热积累效应增强,温度迅速升高。有微波萃取条件下花青素降解规律和阿伦尼乌斯方程可以导出,花青素降解量与萃取体系温度的关系方程,其方程[19]为
(4)
由式(4)可知:温度越高,花青素降解量越大,故花青素降解率增加。
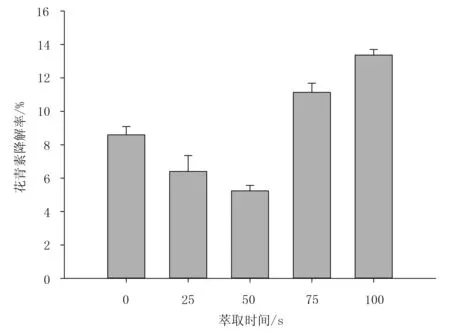
图2 不同萃取时间对花青素降解率的影响
2.3 乙醇浓度对花青素降解率的影响
选取微波强度为150W/g、萃取时间为50s、料液比为1∶30,考查不同乙醇浓度对花青素降解率的影响,结果如图3所示。
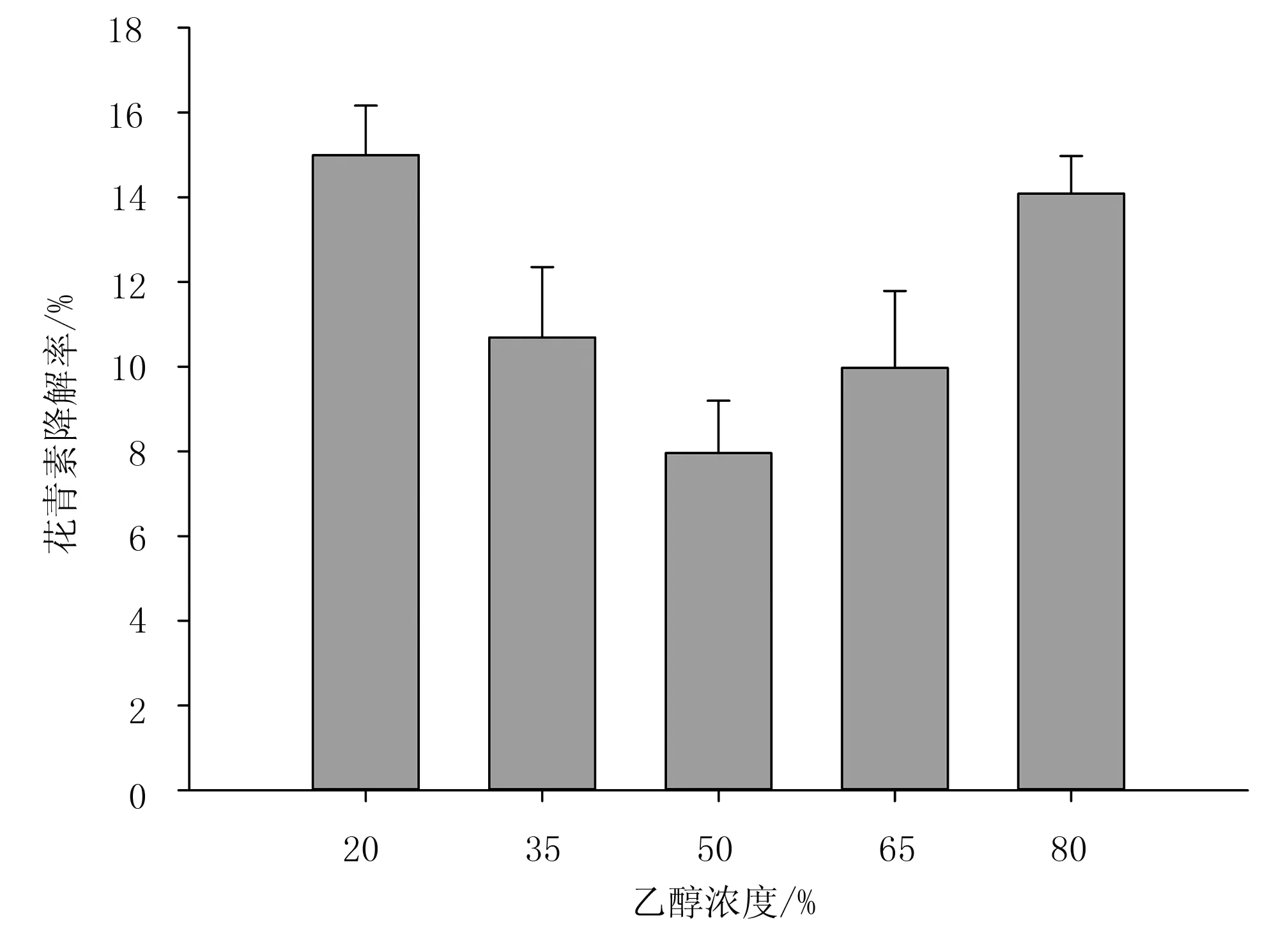
图3 不同乙醇浓度对花青素萃取率和降解率的影响
由图3可知:当乙醇浓度在50%时,花青素萃降解率达到最小值7.96%;当乙醇浓度在20%~50%范围内,花青素降解率随乙醇浓度的升高而降低。当乙醇浓度在50%时,乙醇极性与花青素极性相似,根据相似相容原理,故此时花青素萃取率最高[16],降解率最低;当乙醇浓度进一步增加,高浓度乙醇破坏花青素-蛋白质和花青素-纤维素之前的氢键和疏水键[20],造成花青素结构被破坏,故花青素降解率增大。
2.4 料液比对花青素降解率的影响
选取微波强度为150W/g、萃取时间为50s、乙醇浓度50%考查不同料液比对花青素萃降解率的影响,结果如图4所示。

图4 不同料液比对花青素萃取率和降解率的影响
由图4可知:当料液比在1∶30时,花青素降解率达到最小值3.79%;当料液比在1∶10~1∶30范围内,花青素的降解率随料液比的升高而降低;当料液比在1∶30~1∶50时,花青素降解率随料液比的增加而增加。一方面由于固体内部存在传质极限,因此当溶剂量增大时,驱动力不再增大[21],溶剂吸收消耗微波能,使得进入蓝莓颗粒内的微波能少,细胞壁破坏能力减弱,花青素萃取率降低,降解量增加;另一方面由于料液比的增加,加快了其它杂质的溶出,溶出的杂质加速花青素降解,因此花青素降解率增加。
3 花青素的降解工艺优化
3.1 微波辅助萃取参数交互作用分析
按照表3中试验的设计编码条件进行中心组合试验,以花青素降解率为试验指标,进行数据统计分析。
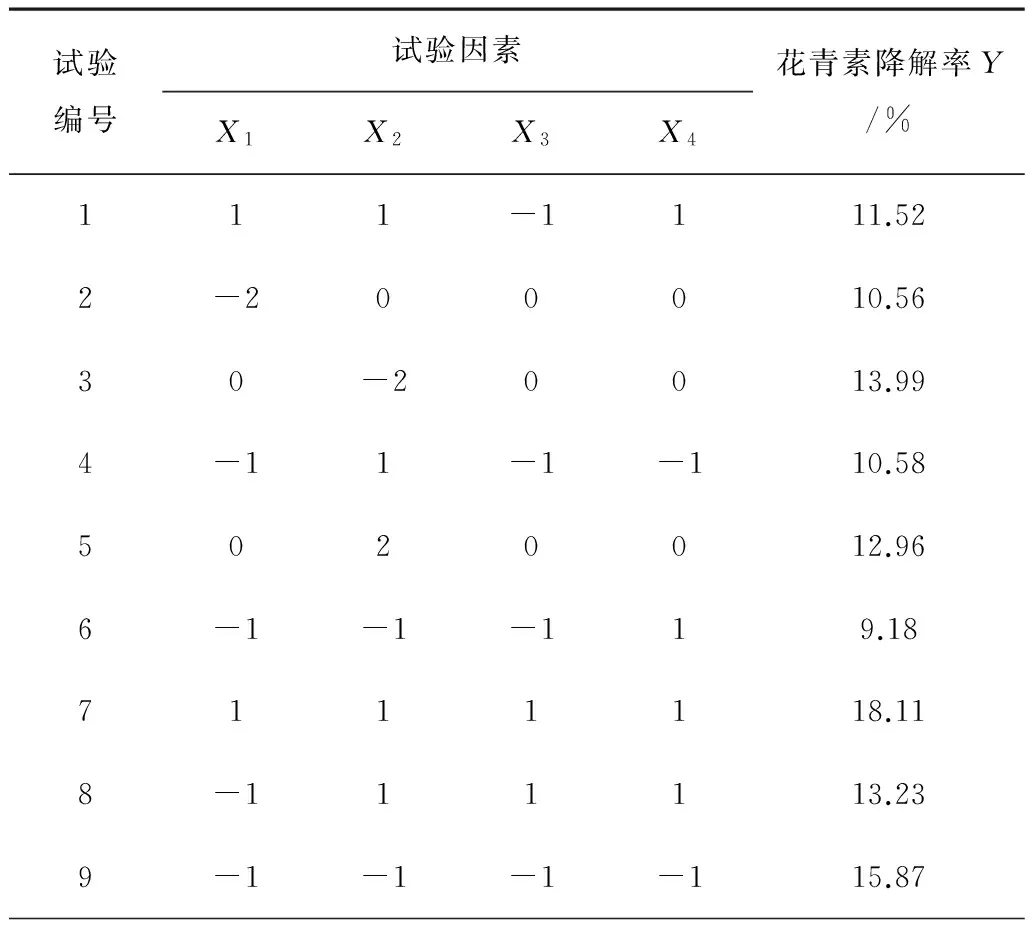
表3 中心组合试验设计和结果
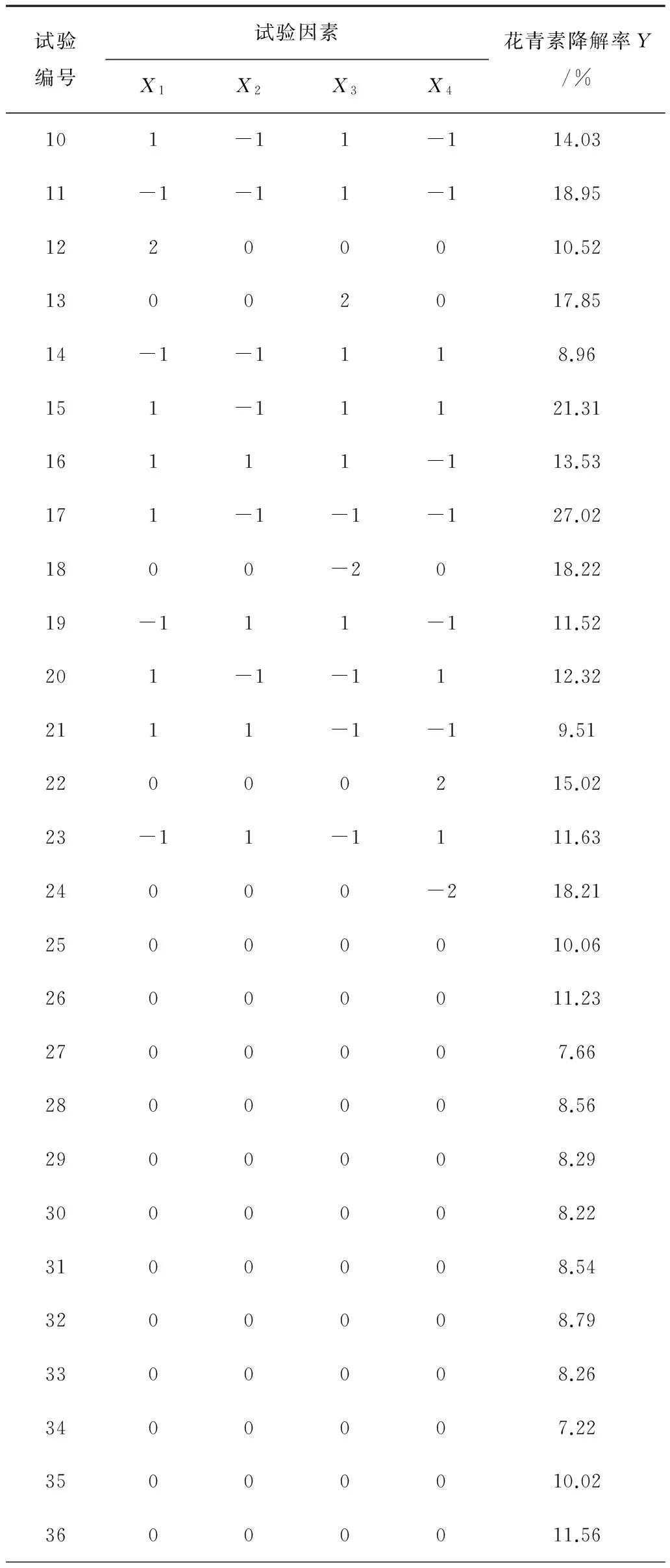
续表3
表3中,X1为微波强度(W/g);X2为萃取时间(s);X3为乙醇浓度(%);X4为料液比(g/mL)。
3.1.1 花青素降解率的方差分析和回归方程
由方差分析可知,该模型极显著(p<0.01),失拟项不显著(p>0.05)。决定系数R2=0.923 5,说明92.35%的响应值变化能够用该模型解释。由方差分析表中各因素的F值大小可知:在花青素萃取率的回归模型中,X1、X4、X12、X42项极显著,X2、X3、X1X4、X2X3项显著。试验选取的各因素对蓝莓花青素降解率的影响程度大小顺序依次为微波强度>料液比>萃取时间>乙醇浓度。剔除模型中不显著项,得到蓝莓花青素降解率的回归方程,即
(5)
其中,X1为微波强度(W/g);X2为萃取时间(s);X3为乙醇浓度(%);X4为料液比(g/mL);Y为蓝莓花青素萃取率(%)。
3.1.2微波强度和料液比对花青素降解率交互影响
当萃取时间和乙醇浓度在50s和50%水平时,考察料液比和微波强度对蓝莓花青素降解率的交互影响,如图5所示。
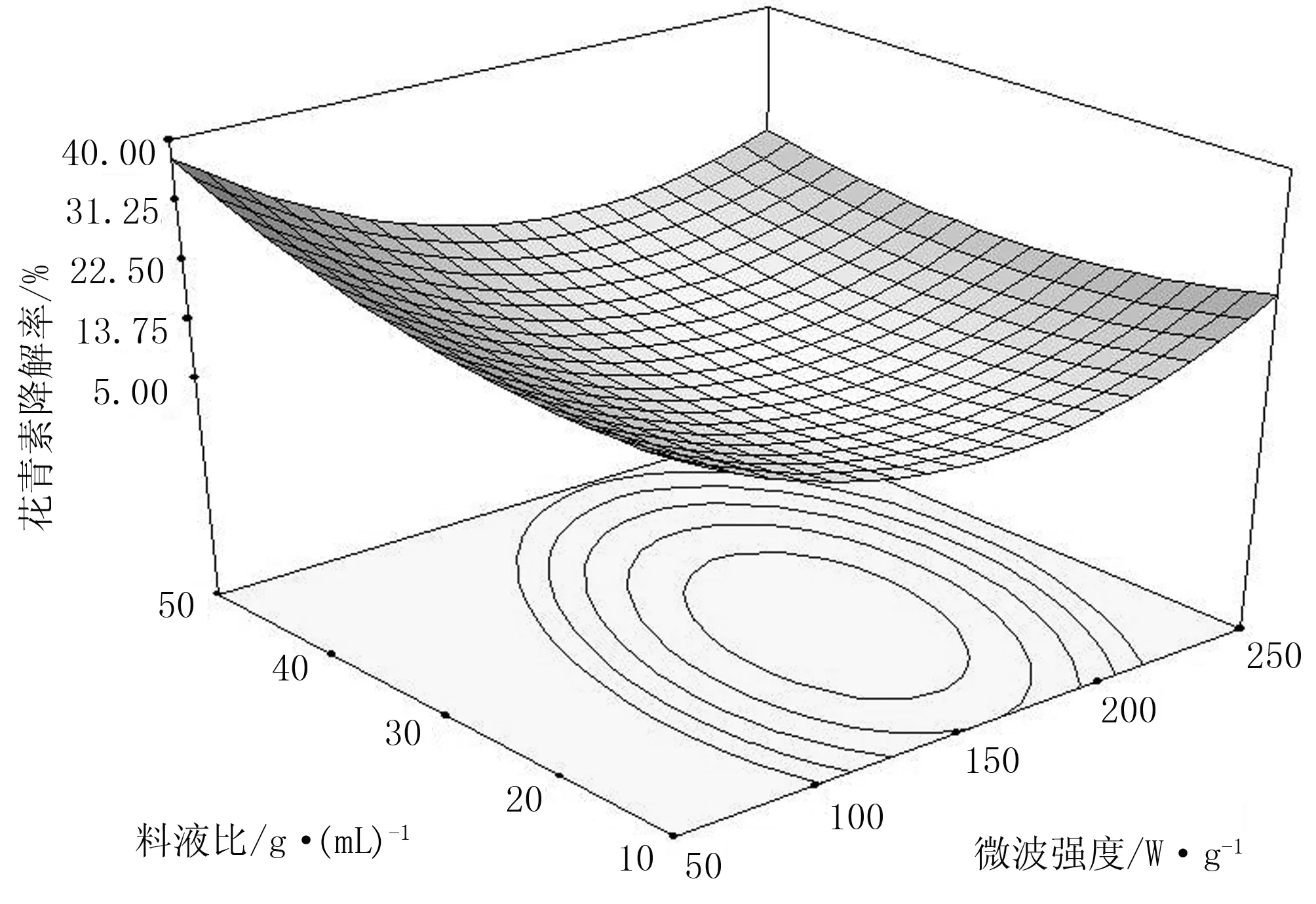
图5 微波强度和料液比对花青素降解率的影响
当料液比在某一水平时,随微波强度的增加,花青素降解率呈现先减小后升高的趋势。其原因同单因素2.1。 当微波强度一定时,花青素降解率随料液比的增加呈现先降低后升高的趋势,其原因是随料液比的增加,花青素萃取率增加,因此花青素降解率降低。当料液比较高时,其他极性醇溶性成分溶解,抑制花青素溶解,花青素萃取率下降,故花青素降解率增加。当料液比在1∶30和微波强度在150W/g时,花青素萃取率最低7.23%。
3.1.3萃取时间和乙醇浓度对花青素降解率的交互影响
当微波强度和料液比在150W/g和1∶30水平时,考察萃取时间和乙醇浓度对蓝莓花青素降解率的交互影响,如图6所示。
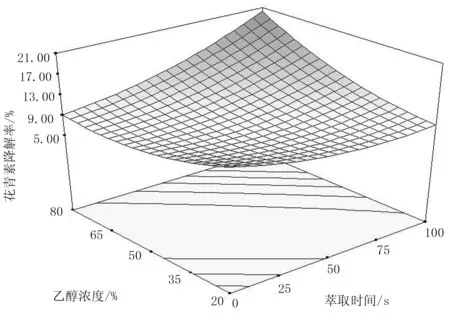
图6 萃取时间和乙醇浓度对花青素降解率的影响
由图6可知:乙醇浓度和萃取时间显著影响花青素降解率。乙醇浓度在某一水平时,花青素降解率随萃取过程呈现逐渐增加的趋势。由于花青素降解符合一级反应动力学模型[22],即
C=C0·exp(-kt)
(6)
其中,k为反应速率常数。微波处理过程中温度对k的影响采用Arrhenius经验方程[23],即
(7)
由式(6)、式(7)可知:随着萃取时间的延长,萃取液的温度升高,反应速率常数k增大,故花青素降解率增加。当萃取时间一定时,花青素降解率随乙醇浓度的增加而增加。其原因是随乙醇浓度的增加,萃取体系蒸馏水含量减少,其沸点低于蒸馏水,因此高浓度的乙醇更易吸收微波能,使萃取体系温度升高,高温加速花青素降解,故花青素降解率随乙醇浓度的增加而增加。
3.2 最优工艺参数优化
在建立蓝莓花青素微波强度、萃取时间、乙醇浓度、料液比的回归模型的基础上,采用中心组合试验设计(Response Surface/Central Composite Design)对萃取蓝莓花青素的工艺参数进行优选组合,优化后的工艺参数和最优结果如表4所示。
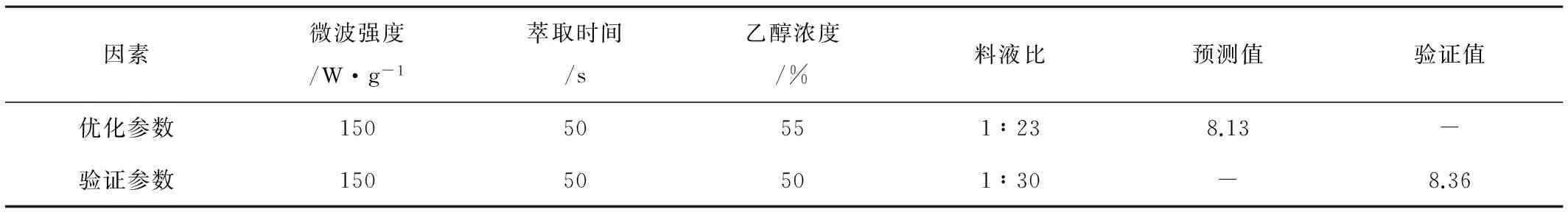
表4 优化结果和验证值
以花青素降解率最低作为目标,所得的最优工艺参数为:微波强度为150W/g、萃取时间为50s、乙醇浓度为50%、料液比为1∶30。在最优工艺条件下进行验证试验,经过3次试验确定的最优结果为8.36%,而回归模型的预测值为8.13%。试验值与预测值相对误差为0.23%,表明了优化结果的合理性,并进一步验证了回归模型的适用性。
4 结论
蓝莓中花青素降解率随微波强度、萃取时间、乙醇浓度、料液比的增加均呈现先减小后升高的趋势。通过中心组合试验,以花青素降解率最低为目标,确定了最优的工艺参数组合为:微波强度为150W/g、萃取时间为50s、乙醇浓度为50%、料液比为1∶30,在此条件下花青素降解率为8.36%。本研究结果可为工业化生产提供理论依据。
[1] 胡雅馨,李京,惠伯棣.蓝莓果实中主要营养及花青素成分的研究[J].食品科学,2006,27(10):600-603.
[2] 曹雪丹,方修贵,赵凯,等.蓝莓花色苷研究进展[J].中国农学通报,2012,28(15): 221-226.
[3] 孙建霞,张燕,胡小松,等.花青素的提取、分离以及纯化方法研究进展[J].食品与发酵工业,2008,34(8): 111-117.
[4] Sarma A D, Sreelakshmi Y, Sharma R. Antioxidant ability of anthocyanins against ascorbic acid oxidation[J].Phytochemistry, 1997, 45(4): 671-674.
[5] Bonerz D, Würth K, Dietrich H, et al. Analytical characterization and the impact of ageing on anthocyanin composition and degradation in juices from five sour cherry cultivars[J].European Food Research and Technology, 2007, 224(3): 355-364.
[6] Du Q, Zheng J, Xu Y. Composition of anthocyanins in mulberry and their antioxidant activity[J].Journal of Food Composition and Analysis, 2008, 21(5): 390-395.
[7] Giusti M M, Rodríguez-Saona,Wrolstad R E.Molar absorptivity and color characteristics of acylated and non-acylated pelargonidin-based anthoycanins[J].Journal of Agricultural and Food Chemistry,1999,47:4631-4637.
[8] 王芳,刘华,陈文荣,等.贮藏温度对蓝莓活性成分及抗氧化活性的影响[J].宁夏大学学报:自然科学版,2011(2):172-175.
[9] Chan C H, Yusoff R, Ngoh G C, et al.Microwave-assisted extractions of active ingredients from plants[J].Journal of Chromatography A, 2011, 1218(37): 6213-6225.
[10] Reyes F L,Cisneros-Zevallos L.Degradation kinetics and colour of anthocyanins in aqueous extracts of purple and red-flesh potatoes(Solanum tuberosum L.)[J].Food Chemistry,2007,100(3): 885-894.
[11] Ochoa M R,Kesseler A G,Michelis A D,et al. Kinetics of colour change of raspberry,sweet(Prunus avium) and sour (Prunus cerasus) cherries preserves packed in glass containers:light and room temperature effects[J].Journal of Food Engineering,2001,49:55-62.
[12] Chung Y C, Chang C T, Chao W W, et al. Antioxidative activity and safety of the 50 ethanolic extract from red bean fermented by Bacillus subtilis IMR-NK1[J].Agricultrual and Food Chemistry,2002,50(8):2454-2458.
[13] Dorota Walkowiak-Tomczak,Janusz Czapski.Colour changes of a preparation from red cabbage during storage in a model system[J].Food Chemistry,2007,104: 709-714.
[14] Veridiana V De Rosso, Adriana Z. Mercadante.The high ascorbic acid content is the main cause of the low stability of anthocyanin extracts from acerola[J].Food Chemistry,2007,103:935-943.
[15] 李春阳,许时婴,王璋.香草醛-盐酸法测定葡萄籽,梗中原花青素含量的研究[J].食品科学,2004,25(2):157-161.
[16] 许相雯.微波辅助萃取蓝莓中花青素及纯化的研究[D].哈尔滨:东北农业大学,2012.
[17] 陶岩.微波辅助萃取蓝莓中花青素过程模拟与分析[D].哈尔滨:东北农业大学,2015.
[18] 邓祥元,沙鹏,高坤.微波辅助萃取蚕沙叶绿素的工艺研究[J].东北农业大学学报,2012,43(8):12-16.
[19] J Saien,S Khezrianjoo.Degradation of the fungicide carbendazim in aqueous solutions with UV/TiO2 process: Optimization, kinetics and toxicity studies[J].Journal of Hazardous Materials, 2008,157(2-3): 269-276.
[20] Dai J, Mumper R J.Plant phenolics: extraction, analysis and their antioxidant and anticancer properties[J].Molecules, 2010, 15(10): 7313-7352.
[21] Zhao S,Kwok K C,Liang H.Investigation on ultrasound assisted extraction of saikosaponins from Radix Bupleuri[J].Separation and Purification Technology,2007,55(3) : 307-312.
[22] Labuza T P,Shapero M.Prediction of nutrient losses[J].Journal of Food Processing and Preservation,1978( 2) : 91-99.
[23] Wang W D,Xu S Y.Degradation kinetics of anthocyanins inblackberry juice and concentrat[J].Journal of Food Engineering,2007,82(3):271-275.
