直肠癌新辅助治疗后病理变化的MRI信号特点
2018-03-27都雪朝孙朋涛潘振宇闫玉昌韩晓风赵媛
都雪朝, 孙朋涛, 潘振宇, 闫玉昌, 韩晓风, 赵媛
结直肠癌是我国消化系统常见的恶性肿瘤之一,其发病率在女性中居第三位,在男性中居第五位[1]。为了增加保肛几率、降低局部复发率、延长无病生存期,低位直肠癌、T3、T4期或有区域淋巴结转移者术前需常规行新辅助放化疗[2-3]。尽管MRI对新辅助治疗前直肠癌的T分期符合率平均可达85%[4],但其对新辅助治疗后直肠癌的T分期符合率平均仅为52%[5]。新辅助治疗后,病灶会发生多种病理变化,如肿瘤组织纤维化、黏液变以及病灶周围系膜内纤维索条增生等[6]。本文通过图例阐明直肠癌新辅助治疗后各病理变化在MR图像上的信号特点及其与残余癌灶的信号差异,旨在帮助放射科医师提高直肠癌新辅助治疗后T分期的准确性。
肿瘤纤维化
纤维化是新辅助治疗后最常见的病理学变化,几乎见于所有患者[5],其为放化疗损伤肿瘤组织后,为了保持肠壁完整性,间质纤维结缔组织增生修复而发生的病理改变。纤维化在MRI图像上呈等T1、短T2信号, DWI及ADC图像均呈等或低信号,与固有肌层相似,通过调节窗宽、窗位,较易与癌肿(多呈等T1、稍长T2信号影,DWI图像上呈高信号,ADC图像上呈低信号)区分(图1)。但由于新辅助治疗后残余癌细胞活性降低,并夹杂不同程度的纤维化,T2及DWI信号较治疗前均降低,临床经验不足者难以将其与纤维化区分。此外,当残余癌灶较小而包埋于大量纤维组织内时,MRI图像上往往很难发现(图2)。
黏液变
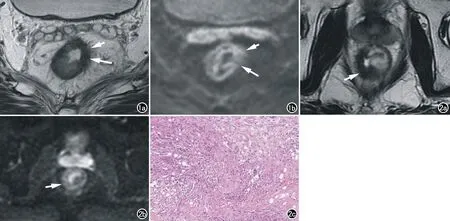
黏液变病理上表现为无结构液体样成分,非粘液细胞腺癌黏液变表现为原等T1、稍高T2信号的肿瘤内出现长T1、长T2信号影,DWI图像上呈等或稍高信号,ADC图像上呈高信号(图3)。由于T2穿透效应的存在,黏液变周围无癌细胞组织DWI上也可表现为稍高信号,易与残余癌灶混淆,此时ADC图有助于两者的鉴别。黏液成分在ADC图上呈稍高信号,残余癌灶在ADC图上呈低信号。当黏液成分较多,残余癌灶较少时,ADC图像上癌灶低信号会被掩盖,很容易分期不足,这是粘液腺癌新辅助治疗后分期不足的重要原因。
反应性纤维索条增生
肿瘤周围系膜内的纤维索条表现为指向癌肿方向的等T1、短T2线样影,主要由嗜酸性粒细胞和/或淋巴细胞引起的炎性浸润或增生的血管所组成[7]。一般而言,增生的纤维索条边缘较光滑,T2信号较低,且DWI上无异常高信号,而癌性索条影边缘多较毛糙,T2信号类似肠壁内癌灶,较纤维索条稍高,且DWI上呈高信号。细、长的纤维索条影与肿瘤组织较易鉴别,而粗、短的纤维索条影则是导致错误分期的常见原因之一。由于直肠腺癌对放化疗比较敏感,因此如果治疗后直肠系膜内出现新增的索条影,且DWI上未见明显高信号,则可以诊断为纤维索条增生(图4);但若治疗前直肠系膜内即有癌灶线样浸润,则治疗后需仔细观察纤维索条内是否有癌灶残留。研究表明,肿瘤周围炎性反应性增生或血管病变也可强化,这进一步加大了新辅助治疗后T分期的难度[6]。
正常肠壁炎性水肿
直肠癌多为环腔或半环腔生长,从而引起管腔狭(箭)。图4 男,32岁,直肠癌,新辅助治疗后,出现反应性纤维索条增生。a) 治疗前横轴面T2WI示直肠约截石位11~6点方向肠壁不均匀增厚,呈稍长T2信号影; b) 治疗前横轴面DWI示病灶呈高信号; c) 治疗后横轴面T2WI示病灶所在肠壁变薄,新见周围系膜内多发细、长的线样T2低信号影(箭),边缘光滑; d) 治疗后横轴面DWI示相应区域DWI呈等信号。
癌灶呈稍高信号(短箭)。 图2 男,53岁,直肠癌新辅助治疗后,MR诊断为ymrT0期,病理诊断为ypT2期。a) 横轴面T2WI平扫示直肠右、后壁呈低信号(箭),浆膜面毛糙; b) 横轴面DWI示病灶呈等信号(箭),腔内弧形高信号为T2穿透效应; c) 镜下见直肠肌层内大量纤维组织增生,伴少许癌细胞残留(箭)。
图1 男,42岁,直肠癌新辅助治疗后,MRI诊断为ymrT3期,病理诊断为ypT3期。a) 横轴面T2WI示直肠左前壁不均匀等/低信号,浆膜面毛糙,低信号区为纤维化(长箭),等信号区为残余癌灶(短箭); b) 横轴面DWI示病灶呈低/稍高信号,纤维化区呈低信号(长箭),残余
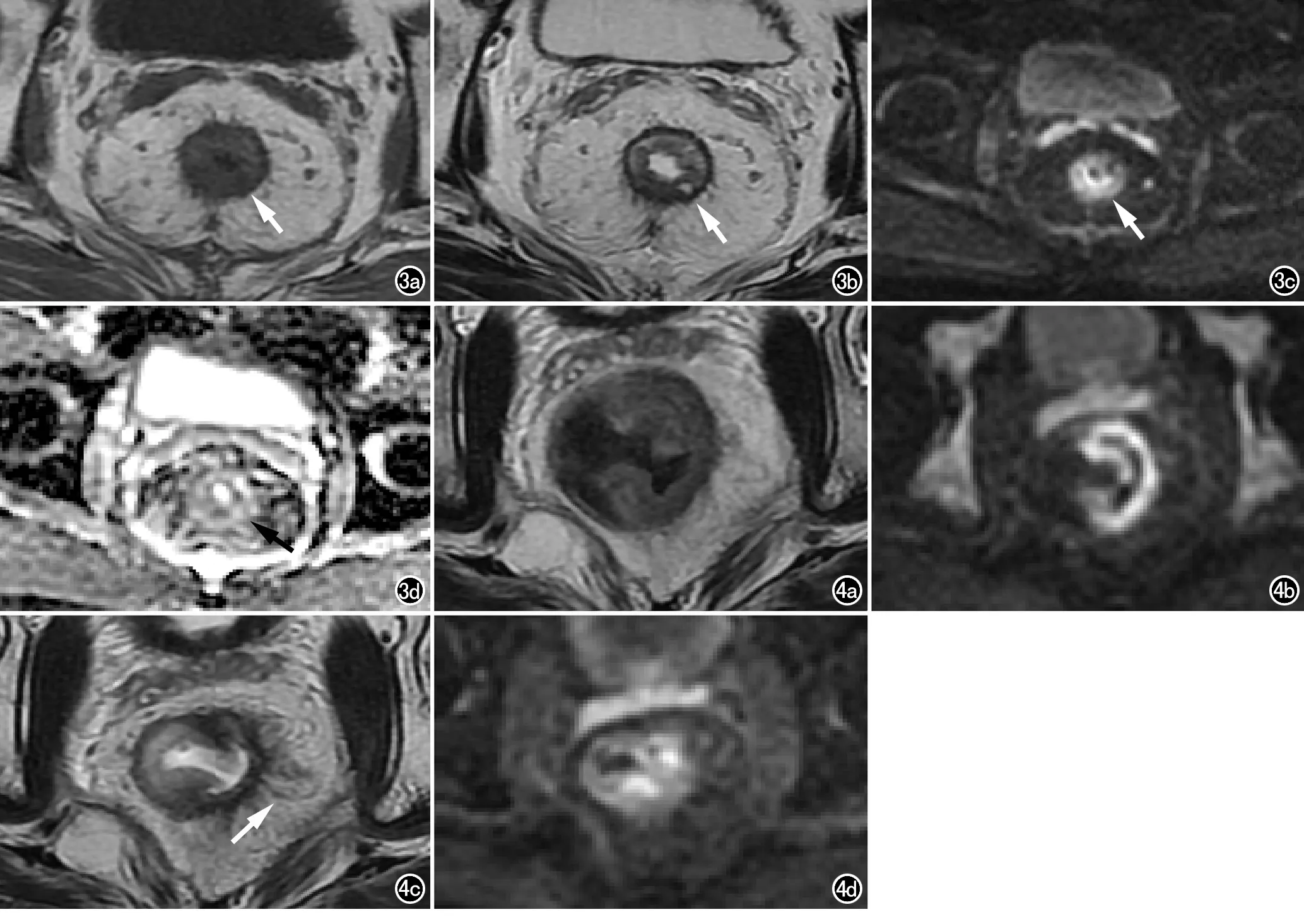
图3 男,76岁,直肠癌新辅助治疗后,出现黏液变。a) 横轴面T1WI示肠壁截石位约5点方向可见一类圆形低信号影(箭); b) 横轴面T2WI示病灶呈高信号(箭); c) 横轴面DWI示病灶呈等信号(箭); d) 横轴面ADC示病灶呈高信号
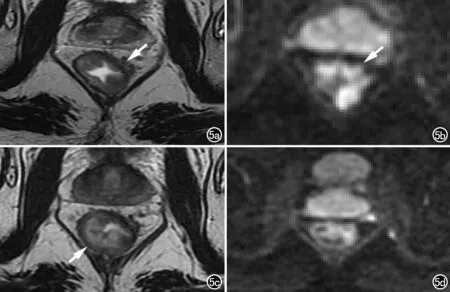
图5 男,55岁,直肠癌,新辅助治疗后,正常肠壁出现水肿。a) 治疗前横轴面T2WI示病灶位于直肠左前壁(箭),呈稍高信号,侵犯周围系膜; b) 治疗前横轴面DWI示病灶呈高信号(箭); c) 治疗后横轴面T2WI示病灶缩小,其所在肠壁变薄,邻近肠壁黏膜下层增厚(箭),肠壁层次结构显示清晰; d) 治疗后横轴面DWI示水肿的肠壁未见异常高信号。
窄。放化疗后,由于肿瘤组织坏死、纤维化,病灶所在肠壁会变薄、形成溃疡;邻近正常肠壁因放疗影响会增厚、水肿,经验不足者容易将水肿的肠壁误认为肿瘤,即假肿瘤征(图5)。因此,为了提高诊断准确性,评估新辅助治疗后病灶时需与治疗前图像进行对照。不同于癌性病灶,水肿的肠壁层次结构完整,T2WI上能清晰地观察到肠壁三层结构的正常信号,由内向外依次为:黏膜层(低信号影)、黏膜下层(高信号影)和肌层(低信号影)。
肖毅等[8]研究表明,直肠癌新辅助治疗后MRI诊断为T0期者,约57%分期不足,因此,尽管有文献报道[9]临床完全缓解者可暂不手术、密切观察,但由于术前检查T分期准确性欠佳,无论新辅助治疗后临床分期如何,目前临床仍多积极地进行根治性手术治疗。为了给临床提供可靠的个体化治疗依据,最大化患者在术前放化疗中的收益,放射科医师需熟知上述直肠癌治疗后病理变化及其与残余癌灶的区别,提高新辅助治疗后再分期的准确性。
综上所述,在评估直肠癌放化疗后T分期时,需注意以下几点:①MR图像上未见到肿瘤组织,即诊断为ymrT0者,存在一定的假阴性,少量的残余癌灶在MR图像上不易被发现;②由于T2穿透效应的存在,直肠腺癌治疗后黏液变可导致过度分期,ADC图有助于鉴别诊断; ③对自肠壁向直肠系膜内延伸的索条影进行定性时,需与治疗前病灶进行对照,如为新增索条影,且DWI上未见高信号,则为系膜内纤维索条增生;④放疗容易引起正常肠壁水肿,MR图像上表现为“假肿瘤征”,诊断时需对照治疗前图像,并观察肠壁层次结构是否完整。
[1] 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[2] Zhan S,Wang X,Huang X,et al.Magnetic resonance imaging in restaging rectal cancer after neoadjuvant chemoradiotherapy[J].J BUON,2015,20(1):62-67.
[3] Park IJ,Kim JY,Yu CS,et al.Preoperative chemoradiotherapy for clinically diagnosed T3N0 rectal cancer[J].Surg Today,2016,46(1):90-96.
[4] Al-Sukhni E,Milot L,Fruitman M,et al.Diagnostic accuracy of MRI for assessment of T category,lymph node metastases,and circumferential resection margin involvement in patients with rectal cancer:a systematic review and meta-analysis[J].Ann Surg Oncol,2012,19(7):2212-2223.
[5] Memon S,Lynch AC,Bressel M,et al.Systematic review and meta-analysis of the accuracy of MRI and ERUS in the restaging and response assessment of rectal cancer following neoadjuvant therapy[J].Colorectal Dis,2015,17(9):748-761.
[6] 周妮娜,陈敏,王文超,等.动态增强磁共振成像对直肠癌术前新辅助治疗疗效的评价[J].磁共振成像,2010,1(2):103-109.
[7] Kuo LJ,Chern MC,Tsou MH,et al.Interpretation of magnetic resonance imaging for locally advanced rectal carcinoma after preoperative chemoradiation therapy[J].Dis Colon Rectum,2005,48(1):23-28.
[8] 肖毅,薛华丹,仲光熙,等.基于术前影像学和术后病理结果分析直肠癌新辅助治疗后临床完全缓解状况的临床意义[J].中华胃肠外科杂志,2015,18(5):474-477.
[9] Russo S,Blackstock AJ.The 'watch-and-wait' approach for rectal cancer:are outcomes improved with more limited T stage and routine use of MRI for staging[J].Oncology (Williston Park),2013,27(10):976-977.
