高温与性激素诱导对褐牙鲆kiss2和gpr54-2基因表达的影响
2018-03-27向玉婷张俊玲施志仪
向玉婷,张俊玲,施志仪
(上海海洋大学 水产与生命学院,农业部淡水水产种质资源重点实验室,上海 201306)
Kisspeptin是一种重要的神经内分泌因子,通过调控促性腺激素释放激素的分泌进而控制哺乳动物生殖轴的各种活动[1-2],在近几年成为研究热点。鱼类Kisspeptin的研究始于2004年,Parhar等[3]在尼罗罗非鱼(Oreochromisniloticus)中首次克隆了鱼类第一个Kisspeptin的受体gpr54基因,发现性成熟罗非鱼的gpr54基因可调控促性腺激素释放激素的分泌进而调控性腺的正常发育。目前,两种形式的Kisspeptin基因,即kiss1和kiss2及其受体gpr54-1和gpr54-2,在多种鱼类中已被鉴定[4-9],同时发现在某些鱼类中如塞内加尔鳎(Soleasenegalensis)、绿河豚(Tetraodonnigroviridis)和三刺鱼(Gasterosteusaculeatus)等只有一种kiss2基因[5,7,10]。研究表明,kiss2基因对生殖功能的调控作用要强于kiss1基因,斑马鱼(Daniorerio)kiss2基因是促性腺激素释放激素分泌的主要调控因子[6,11-12]。
硬骨鱼类Kisspeptin系统可以集成环境和代谢信号,并将这些信号传递到生殖轴[13]。Shahjahan等[14]研究发现,斑马鱼脑中kiss1及其受体系统只对低温敏感,而kiss2及其受体系统则对高温和低温都极端敏感,表明两种Kisspeptin系统在斑马鱼中有不同的调节机制。在星点东方鲀(Takifuguniphobles)产卵季节,温度通过影响Kisspeptin及受体基因的表达进而影响正常生理反应[15]。除此之外,外源激素也可以影响鱼类Kisspeptin系统的基因表达。研究发现,在雄性尼罗罗非鱼中外源甲状腺激素可上调下丘脑kiss2基因的表达,且甲状腺激素可能直接作用于促性腺激素释放激素,而间接调控kiss2[16]。将稀有鮈鲫(Gobiocyprisrarus)暴露在17α-炔雌醇之下,可能会影响稀有鮈鲫kiss/gpr54/促性腺激素释放激素系统的基因表达,从而干扰神经内分泌平衡[17]。
褐牙鲆(Paralichthysolivaceus)属鲽形目,是我国重要的海水养殖经济鱼类,与其他大多数鲽形目鱼类一样,雌性褐牙鲆较雄性个体生长快,其性别控制研究在鱼类性别决定和性腺分化及生产中都具有重要意义[18-19]。鱼类由于处于较低的分类地位,其性别分化具有很大的可塑性,许多环境因子如温度、激素、pH、密度、光照等均可能影响其性别分化[20-21],其中温度和激素是最重要的影响因子[22]。本实验室先前已克隆和鉴定了褐牙鲆kiss2及其受体gpr54-2基因,并分析了其在褐牙鲆不同组织不同发育时期的表达模式,发现二者在褐牙鲆脑和性腺中具有较丰富的表达,但关于其在褐牙鲆性腺分化中的作用及温度、激素等对其表达的影响仍不清楚,因此本研究检测了高温和外源雌雄性激素诱导后,褐牙鲆早期性腺分化阶段kiss2及其受体gpr54-2基因在脑和性腺中的表达变化情况,其结果为进一步深入探讨Kisspeptin系统在褐牙鲆性腺分化和生殖调控中的功能提供了新的资料。
1 材料与方法
1.1 试验鱼
试验用褐牙鲆胚胎和仔鱼采集于中国水产科学研究院北戴河中心实验站,人工受精后在自动过滤海水循环系统中自然孵化和饲养,控制海水盐度33,温度(16±1) ℃,孵化后仔鱼用轮虫和初孵卤虫无节幼体配合喂养。培育仔鱼至25日龄后将其分为雄激素、雌激素、高温和常温对照4组分别饲养。采用的雌激素为17β-雌二醇,雄激素为17α-甲基睾酮,激素用无水乙醇溶解后质量浓度为10 μg/L,采用直接浸浴法对褐牙鲆进行雌性化和雄性化诱导;高温组为28 ℃、常温对照组保持在20 ℃,每个处理组设3个重复。
各处理组分别在45、55、65日龄采集样品,每个样品采集15~20尾幼鱼,解剖取脑和性腺部位组织,用焦碳酸二乙酯处理水清洗后立即浸入Trizol(Invitrogen)中匀浆,并在液氮中稍冻存后置于-80 ℃保存备用。
1.2 总RNA提取和反转录
将上述各样品按照Trizol说明书步骤提取总RNA,采用分光光度计(NANODROP2000C) 和琼脂糖凝胶电泳检测,所提取的总RNA其OD260/OD280值为1.8~2.0。用Dnase I(Promega)处理1 h,除去各样品总RNA中的基因组DNA污染。
将处理后的总RNA作为模板,按以下体系进行反转录:在无RNase的离心管中加入1 μg总RNA,1 μL OligodT Primer(50 μmol/L),1 μL dNTP Mixture (10 mmol/L),补充RNase free ddH2O至10 μL;然后在PCR仪上进行变性退火反应,条件为65 ℃ 5 min,冰上急冷5 min;加入以下试剂:5X PrimeScript Buffer 4 μL,RNase Inhibitor(40 U/μL)0.5 μL,Prime Script Rtase(200 U/μL)1 μL,补充RNase free ddH2O至20 μL;然后在PCR仪上进行反转录,反应条件为42 ℃ 60 min,72 ℃ 15 min,然后冰上放置5 min,-20 ℃保存。
1.3 荧光定量PCR
根据已鉴定序列设计kiss2、gpr54-2及内参基因18s的定量引物(表1),在CFX96TouchTMReal Time PCR Detection System(Bio-Rad)上进行定量检测。
首先制备目的基因和内参基因的标准曲线。反应体系为20 μL,包括1 μL cDNA(从100~0.1 ng,5倍梯度稀释),0.4 μL特异性引物,10 μL 2×iQTMSYBR Green Supermix(Bio-rad)和8.2 μL ddH2O。反应条件为:95 ℃ 1 min;95 ℃ 10 s和60 ℃ 15 s,采集荧光40次,然后进行融解曲线的扩增。标准曲线结果显示目的基因和内参基因的相关系数均>0.99,相应的扩增效率为95%~100%。其后对采集样品进行定量检测,反应体系和条件同上,试验重复3次。
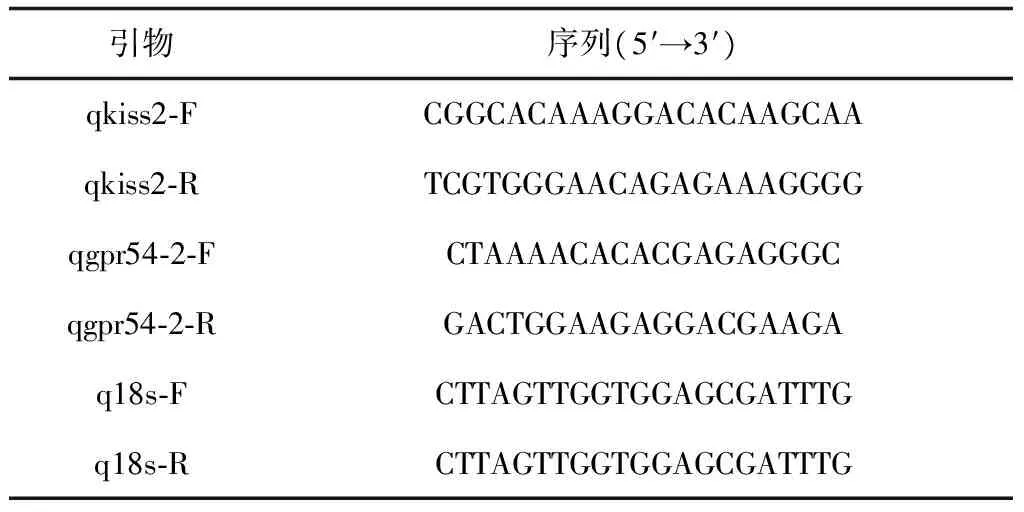
表1 荧光定量PCR引物
1.4 数据分析
目的基因相对表达量采用2-△△CT法计算,其数值用平均值±标准差表示,生物学重复(n)=3。统计分析采用SPSS17.0软件中的单因素方差分析,使用Dunnett’s T3 test 进行差异性比较,当P<0.05时表示有显著差异,当P<0.01时表示有极显著差异。
2 结 果
2.1 高温处理后kiss2和gpr54-2的表达变化
荧光定量PCR结果显示:高温处理后,kiss2在褐牙鲆脑中的表达明显升高(P<0.01);除在55日龄幼鱼性腺中,其表达有一个显著的下调外,kiss2在褐牙鲆性腺中的表达变化不明显。相反,高温处理后gpr54-2在褐牙鲆脑中的表达变化不显著(55日龄除外),而其褐牙鲆性腺中的表达变化较大,在45日龄和55日龄幼鱼性腺中上调(P<0.01),但在65日龄幼鱼性腺中逐渐降低(P<0.05)(图1)。
2.2 雌激素处理后kiss2和gpr54-2的表达变化
雌激素处理后,褐牙鲆脑中kiss2的表达升高(P<0.05),而在性腺中其表达明显下调;而gpr54-2则出现了不同的表达趋势,其在45日龄幼鱼脑中表达增加(P<0.01),但在随后的55日龄幼鱼脑中又出现了明显的下调;在性腺中,激素处理后gpr54-2基因在45日龄和55日龄表达上调(P<0.01),在65日龄逐渐降低(图2)。
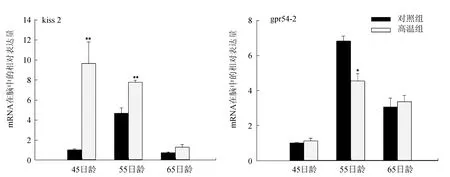
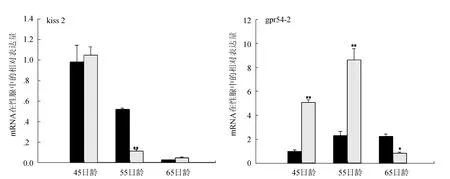
图1 褐牙鲆脑和性腺中kiss2、gpr54-2在温度处理后的表达变化


图2 褐牙鲆脑和性腺中kiss2、gpr54-2在雌激素处理后的表达变化
2.3 雄激素处理后kiss2和gpr54-2的表达变化
雄激素处理后,褐牙鲆脑中kiss2的表达变化迟缓,至65日龄时才有较明显的升高,但其受体基因gpr54-2在脑中的表达明显降低(P<0.01)。同时,二者在褐牙鲆性腺中的表达明显下调(图3)。
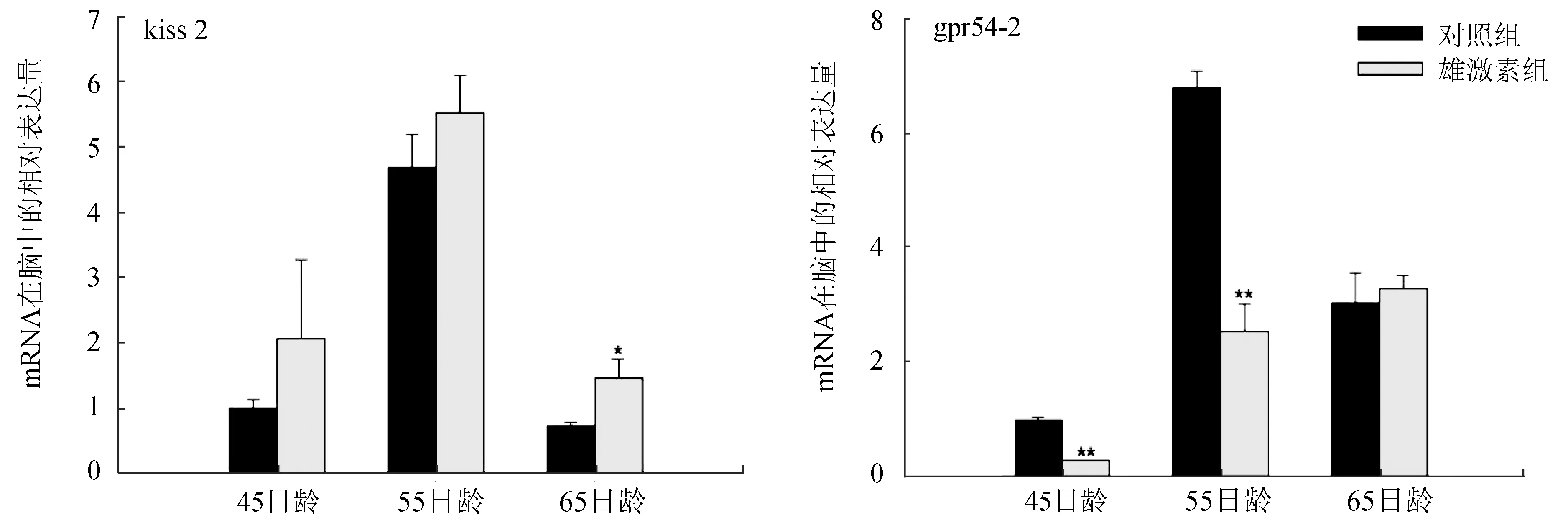

图3 褐牙鲆脑和性腺中kiss2、gpr54-2在雄激素处理后的表达变化
3 讨 论
温度是影响鱼类性腺分化重要的环境因子之一,褐牙鲆的性腺发育、排卵及胚胎发育,均受温度的影响[23,20],而且高温诱导还可使遗传雌性褐牙鲆发生性逆转,向生理雄性褐牙鲆转变[21]。本研究结果表明,温度对性腺分化早期褐牙鲆脑中kiss2和性腺中gpr54-2的基因表达有较大影响,高温诱导可使其表达水平明显上调,但是在长时间高温处理下,kiss2基因对温度变化不敏感,在65日龄时与对照组基因表达无明显差异,推测kiss2基因表达的变化可能只与环境温度的改变有关。与此不同的是,研究表明在高温条件下,斑马鱼脑中kiss2的基因表达水平会呈现明显的减少趋势,且伴随着其受体基因gpr54-2的表达降低,而在低温条件下,kiss1及其受体的基因表达会升高[14];在星点东方鲀中,低温(14 ℃)和高温(28 ℃)处理都会使kiss2及其受体gpr54-2的基因表达降低,但在25 ℃处理3、7 d的研究中表明kiss2的表达略有升高[15]。这些研究表明,温度会影响kiss2系统的基因表达,但不同温度条件对不同种类的鱼影响可能会不一样,且其影响机制仍需要进一步深入的研究。
本研究发现,外源雌激素处理对性腺分化早期褐牙鲆脑中kiss2和性腺中gpr54-2的基因表有促进作用,而对脑中gpr54-2和性腺中kiss2的表达却有下调作用,表明二者在褐牙鲆不同组织部位对外源雌激素的刺激会产生不同的反应。目前关于雌激素对鱼类脑中kiss2和gpr54-2基因表达的影响有较多的报道,而其在性腺中的表达情况很少。在青鳉(Oryziaslatipes)中,17β-雌二醇处理对脑中kiss1的表达有一定的促进作用[24]。在热带雀鲷(Chrysipteracyanea)中,用17β-雌二醇处理7 d后,其脑中gpr54-1和gpr4-2的基因表达量有显著的升高[25]。在塞内加尔鳎[26]和幼年斑马鱼[27]中,发现17β-雌二醇也可以上调脑中gpr54的表达;而用17α-乙炔雌二醇处理稀有鮈鲫,发现脑中kiss2的表达有升高,但性腺中gpr54-2的表达却降低[17]。而且,Wang等[28]对金鱼(Carassiusauratus)的研究中表明,雌激素可以通过不同的途径调节两类kiss基因的表达,其通过雌激素受体可直接作用于kiss2基因。因此,kiss-gpr54系统可能是雌激素作用的靶位置,进而参与雌激素调节的鱼类性腺发育。
雄激素处理后,褐牙鲆脑中kiss2基因在45日龄和55日龄变化不明显,可能是其对雄激素处理反应不敏感,但性腺中kiss2及其受体基因gpr54-2的表达受到了显著的抑制作用,且gpr54-2在脑中的表达也明显下调,总体上看雄激素处理对kiss2的效应具有抑制作用。用17α-甲基睾酮诱导斜带石斑鱼(Epinepheluscoioides),发现kiss2的表达在处理1周时有显著的降低,但在4周后其表达反而会增加,这种改变可能是因为kiss2对于17α-甲基睾酮产生应答反应后进而发生基因表达的改变[12]。综上所述,Kisspeptin系统对外界环境因子如温度、外源性激素等的变化反应较敏感,但其如何将外界环境信号传递到生殖轴进而参与调控鱼类的性腺分化与繁殖等的内在分子机制仍需要深入的探讨。
4 结 论
本研究结果表明高温和雌激素处理可以促进褐牙鲆脑中kiss2和性腺中gpr54-2的表达,但下调了褐牙鲆性腺中kiss2的表达;而雄激素处理则使褐牙鲆脑和性腺中kiss2和gpr54-2的表达几乎都受到显著的抑制作用,为进一步阐述kiss2和gpr54-2基因在褐牙鲆早期性腺分化中的作用奠定了基础。
[1] Gottsch M,Cunningham M,Smith J,et al.A role for kisspeptins in the regulation of gonadotropin secretion in the mouse[J].Endocrinology,2004,145(9):4073-4077.
[2] Messager S,Chatzidaki E,Ma D,et al.Kisspeptin directly stimulates gonadotropin-releasing hormone release via G protein-coupled receptor 54[J].Proc Natl Acad Sci USA,2005,102(5):1761-1766.
[3] Parhar I,Ogawa S,Sakuma Y.Laser-captured single digoxigenin-labeled neurons of gonadotropin-releasing hormone types reveal a novel G proteincoupled receptor (Gpr54) during maturation in cichlid fish[J].Endocrinology,2004,145(8):3613-3618.
[4] Biran J,Bendor S,Levavisivan B.Molecular identification and functional characterization of the kisspeptin/kisspeptin receptor system in lower vertebrates [J].Biol Reprod,2008,79(4):776-786.
[5] Felip A,Zanuy S,Pineda R,et al.Evidence for two distinct KiSS genes in non-placental vertebrates that encode kisspeptins with different gonadotropin-releasing activities in fish and mammals[J].Mol Cell Endocrinol,2009,312(2):61-71.
[6] Kitahashi T,Ogawa S,Parhar I.Cloning and expression ofkiss2 in the zebrafish and medaka[J].Endocrinology,2009,150(2):821-831.
[7] Lee Y,Tsunekawa K,Moon M,et al.Molecular evolution of multiple forms of kisspeptins and GPR54 receptors in vertebrates[J].Endocrinology,2009,150(6):2837-2846.
[8] Li S,Zhang Y,Liu Y,et al.Structural and functional multiplicity of the kisspeptin/GPR54 system in goldfish (Carassiusauratus)[J].J Endocrinol,2009,201(3):407-418.
[9] Mechaly A,Vias J,Murphy C,et al.Gene structure of the Kiss1 receptor-2 (kiss1r-2) in the Atlantic halibut: insights into the evolution and regulation of Kiss1r genes[J].Mol Cell Endocrinol,2010,317(2):78-89.
[10] Mechaly A,Vinas J,Piferrer F.Identification of two isoforms of the kisspeptin-1 receptor (kiss1r) generated by alternative splicing in a modern teleost,the Senegalese sole (Soleasenegalensis)[J].Biol Reprod,2009,80(1):60-69.
[11] 张勇,李水生,刘云,等.养殖鱼类生殖内分泌调控相关功能基因的研究和应用[J].中国水产科学,2010,17(2):363-368.
[12] Shi Y,Zhang Y,Li S,et al.Molecular identification of the kiss2/kiss1ra system and its potential function during 17alpha-methyltestosterone-induced sex reversal in the orange-spotted grouper,Epinepheluscoioides[J].Biol Reprod,2010,83(1):63-74.
[13] Zohar Y,Muozcueto J,Elizur A,et al.Neuroendocrinology of reproduction in teleost fish[J].Gen Comp Endocr,2010,165(3):438-455.
[14] Shahjahan M,Takashi K,Satoshib O,et al.Temperature differentially regulates the two kisspeptin systems in the brain of zebrafish[J].Gen Comp Endocr,2013,193(4):79-85.
[15] Shahjahan M,Takashi K,Ando H.Temperature affects sexual maturation through the control of kisspeptin,kisspeptin receptor,GnRH and GTH subunit gene expression in the grass puffer during the spawning season[J].Gen Comp Endocr,2017,243(3):138-145.
[16] Ogawa S,Ng K,Xue X,et al.Thyroid hormone upregulates hypothalamic kiss2 gene in the male Nile tilapia,Oreochromisniloticus[J].Frontiers in Endocrinology,2013,4(1):184.
[17] Yang Y,Gao J,Yuan C,et al.Molecular identification of Kiss/GPR54 and function analysis with mRNA expression profiles exposure to 17α-ethinylestradiol in rare minnowGobiocyprisrarus[J].Mol Biol Rep,2016,43(7):737-749.
[18] 金艳梅,张晓庆.牙鲆性别控制研究进展[J].河北渔业,2015,39(11):65-70.
[19] 徐加涛,尤锋,许建和,等.黑鲷精子诱导漠斑牙鲆雌核发育研究[J].水产科学,2011,30(12):744-748.
[20] 孙朝徽,刘海金,司飞,等.养殖牙鲆性腺分化的组织学观察[J].大连水产学院学报,2008,23(6):451-454.
[21] Yamamoto E.Studies on sex-manipulation and production of cloned populations in hirame,Paralichthysolivaceus[J].Aquaculture,1999,34(1/4):235-246.
[22] 桂建芳.银鲫生殖方式和克隆多样性及其新品种选育[G]//中国水产学会.2007年中国水产学会学术年会暨水产微生态调控技术论坛论文摘要汇编,桂林:中国水产学会,2007:40-41.
[23] 唐晓阳,姜宏波,刘海金,等.温度对杂合克隆牙鲆性别分化、性比和生长的影响[J].中国水产科学,2015,22(1):164-168.
[24] Kanda S,Akazome Y,Matsunaga T,et al.Identification of KiSS-1 product kisspeptin and steroid-sensitive sexually dimorphic kisspeptin neurons in medaka (Oryziaslatipes)[J].Endocrinology,2008,149(5):2467-2476.
[25] Imamura S,Hur S,Takeuchi Y,et al.Molecular cloning of kisspeptin receptor genes (gpr54-1 and gpr54-2) and their expression profiles in the brain of a tropical damselfish during different gonadal stages[J].Comparative Biochemistry and Physiology A-Molecular & Integrative Physiology,2017,203(1):9-16.
[26] Mechaly A,Vias J,Piferrer F.Sex-specific changes in the expression of kisspeptin,kisspeptin receptor,gonadotropins and gonadotropin receptors in the Senegalese sole (Soleasenegalensis) during a full reproductive cycle [J].Comp Biochem Physiol A,2012,162(4):364-371.
[27] Servili A,Le P,Leprince J,et al.Organization of two independent kisspeptin systems derived from evolutionary-ancientkissgenes in the brain of zebrafish[J].Endocrinology,2011,152(4):1527-1540.
[28] Wang Q,Sham K,Ogawa S,et al.Regulation of the two kiss promoters in goldfish (Carassiusauratus) by estrogen via different ERα pathways[J].Mol Cell Endocrinol,2013,375(1/2):130-139.
