紫外辐射对两种海洋微藻生长及培养体系碳流的影响
2018-03-26廖健祖郭亚娟袁翔城周伟华黄晖
廖健祖, 郭亚娟, 袁翔城, 周伟华, *, 黄晖
紫外辐射对两种海洋微藻生长及培养体系碳流的影响
廖健祖1, 2, 3, 4, 郭亚娟1, 3, 4, 袁翔城1, 3, 周伟华1, 3, *, 黄晖1, 3
1. 中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与生态重点实验室, 广州 510301 2. 中国科学院南海海洋研究所, 中国科学院热带海洋环境国家重点实验室, 广州 510301 3. 中国科学院海南热带海洋生物实验站, 三亚 572000 4. 中国科学院大学, 北京 100049
以硅藻威氏海链藻()和甲藻锥状斯氏藻()为实验材料, 通过室内模拟华南地区秋季晴天紫外辐照强度, 研究两种不同波段的紫外辐射(Ultraviolet radiation, UVR)对两种微藻生长以及培养体系碳流的影响。结果表明: UV-A对两种微藻的生长有显著的促进作用, 而UV-B则表现为抑制作用。锥状斯氏藻对UV-B的耐受性更强。在UV-A的作用下, 培养体系中溶解无机碳(Dissolved inorganic carbon, DIC)的净消耗量低于对照组, 但释放出更多的溶解有机碳(Dissolved organic carbon, DOC)。对照组的有色溶解有机物(Chromophoric dissolved organic matter, CDOM)含量显著升高, 表明浮游植物生长过程是CDOM的来源之一。然而, 在UV-A的作用下, 两种微藻培养体系的CDOM浓度变化呈现相反趋势, 说明不同藻种的CDOM产物受光漂白和光腐殖化的影响不同。在UV-B的作用下, 微藻碎屑的分解使水体DIC和DOC浓度轻微升高。总体上, 锥状斯氏藻比威氏海链藻净释放出更多的DOC和CDOM。
威氏海链藻; 锥状斯氏藻; 紫外辐射; 碳流
1 前言
紫外辐射(Ultraviolet radiation, UVR)根据波长不同分为: UV-A(315—400 nm)、UV-B(280—315 nm)和UV-C(200—280 nm), 其中UV-C被大气中的臭氧层全部吸收, UV-B大部分被吸收, 而波长较长的UV-A基本不受影响。工业革命以来, 受人类活动的影响, 臭氧层被削薄使更多的UVR能达到地球的表面。由于太阳辐射在热带和亚热带地区比高纬度地区有更高的辐照量, 南海浮游植物常暴露于高剂量的UVR下[1]。
浮游植物是海洋中最主要的初级生产者。尽管与陆生植物相比, 它们的生物量非常低, 仅占全球植物碳含量的1—2%, 却固定了全球约40%的碳[2]。它们在海洋中分布极其广泛, 是海洋生物泵的驱动者, 在全球尺度上影响着气候变化以及海洋中的碳循环。硅藻是海洋浮游植物的主要组成部分, 其初级生产力占海洋总初级生产力的40%以上[3]。近年来, 在人类活动和气候变化的影响下, 海洋中的赤潮肇事种出现由硅藻向甲藻演替的趋势[4]。
在真光层, 除了可见光(Photosynthetically active radiation, PAR), UVR亦可穿透一定的深度[5]。UVR对浮游植物的生长通常被认为是一种负面效应, 如: 抑制光合和生长速率、损伤结构蛋白和DNA分子等[6–7]。然而, UVR也有正面效应的研究报道, 特别是UV-A波段, 在一定程度上可以促进浮游植物的固碳作用[8–9], 以及修复UV-B辐射所导致的损伤[10–11]。同时, UVR对微藻生长和生理的影响也在一定程度上导致水体碳循环的改变[12]。尽管目前已有不少关于UVR对微藻生理生态影响的研究, 然而这些研究大多采用短期或强烈的紫外照射培养方式[13–14]。而UVR对微藻的中长期培养, 以及对培养体系碳循环变化的研究依然缺乏。本实验拟通过室内模拟华南地区秋季紫外辐照强度, 以海区代表性硅藻—威氏海链藻()和甲藻—锥状斯氏藻()为实验材料, 研究UV-A和UV-B辐射分别对其生长, 以及培养体系的溶解无机碳(Dissolved inorganic carbon, DIC)、溶解有机碳(Dissolved organic carbon, DOC)和有色溶解有机物(Chromophoric dissolved organic matter, CDOM)等的影响, 以期为分析UVR对浮游植物产量以及海洋碳流途径的影响提供参考。
2 材料与方法
2.1 实验材料
实验所用的威氏海链藻和锥状斯氏藻均由中国科学院南海海洋研究所提供。
2.2 培养方法和条件
将藻种接种于2 L三角瓶中, 采用f/2培养基[15],基础介质为过滤大洋海水, 在光照培养箱中培养。培养温度为(25±1)°Ϲ, 以日光灯管作为光源, PAR为800—1200 μw·cm-2, 光周期为12 h:12 h, 每天定时晃动4次。待藻细胞生长到指数生长期, 收集细胞进行紫外辐射实验。
2.3 太阳辐射测定
用北京师范大学生产的FZ-A辐照计、UV-A和UV-B型紫外辐照计测定辐射强度。实验测定2015年11月23日的太阳辐射情况。测定地点为广东省广州市南海海洋研究所(23.1 °N, 113.3 °E)实验楼楼顶。
2.4 紫外辐射处理
将处于指数生长期的藻细胞分装于烧杯中, 采用f/2培养基培养, 培养液体积约为3 L, 用聚乙烯薄膜包裹烧杯口从而减少外界CO2的影响, 其它培养条件和方法与实验前一致。威氏海链藻的接种密度为2.37×104个·mL-1, 锥状斯氏藻为2.88×103个·mL-1。用日本三共株式会社生产的UV-A灯(6 W, 中心波长为352 nm)和UV-B灯(6 W, 中心波长为306 nm)作为添加光源[16], UV-A和UV-B的辐射强度设置约为华南地区秋季晴天正午强度的50%(UV-A: 1200—1400 μw·cm-2, UV-B: 45—55 μw·cm-2) (图1)。以无UVR为对照组, 每个处理组均设置3个平行样。整个实验培养时间为19 d, 每天紫外照射时间为9 h。
2.5 藻类丰度和水体化学指标测定
2.5.1 藻细胞密度的测定
取1 mL藻液于塑料杯中, 加入19 mL稀释液, 缓缓颠倒数次以摇匀后, 用Beckman细胞计数仪测定, 每个样品测定三次取平均值。根据公式(1)计算细胞平均生长速率(104个·mL-1·d-1):
平均生长速率=(N—N)/(t—t) (1)
式中:和分别为和时的细胞数量。
2.5.2 活体荧光值和叶绿素a(Chlorophyll, Chl)浓度的测定
用荧光计(Turner Designs TD-700)直接测定活体荧光。Chl浓度的测定采用荧光法, 于90%丙酮中萃取, 冰箱中避光萃取12—24 h, 离心后的上清液用荧光计测定[17]。两种微藻的生物碳含量按照经验值50 mg C·(mg Chl)-1进行转换[18]。
2.5.3 DIC浓度的测定
DIC用AS-C3型DIC分析仪(Apollo SciTech)测定, 通过将定量的海水样品酸化使其转化为CO2, 用N2将其吹出送入Li-7000非色散红外检测器中进行测定[19]。
2.5.4 DOC浓度的测定和CDOM光谱吸收系数的计算
取经Whatman GF/F滤膜(450 °Ϲ灼烧5 h)过滤后水样约20 mL酸化(pH<2), 冷冻保存, 用岛津(SHIMADZU)TOC-VCPH型总有机碳分析仪测定DOC含量。取经0.2 μm的Millipore聚碳酸酯膜过滤后的水样, 冷冻保存, 用岛津(SHIMADZU) UV-2600紫外-可见分光光度计测定CDOM吸收光谱, 以355 nm处的吸收系数(355)表示CDOM 的相对浓度[20]。根据式(2)计算吸收系数:
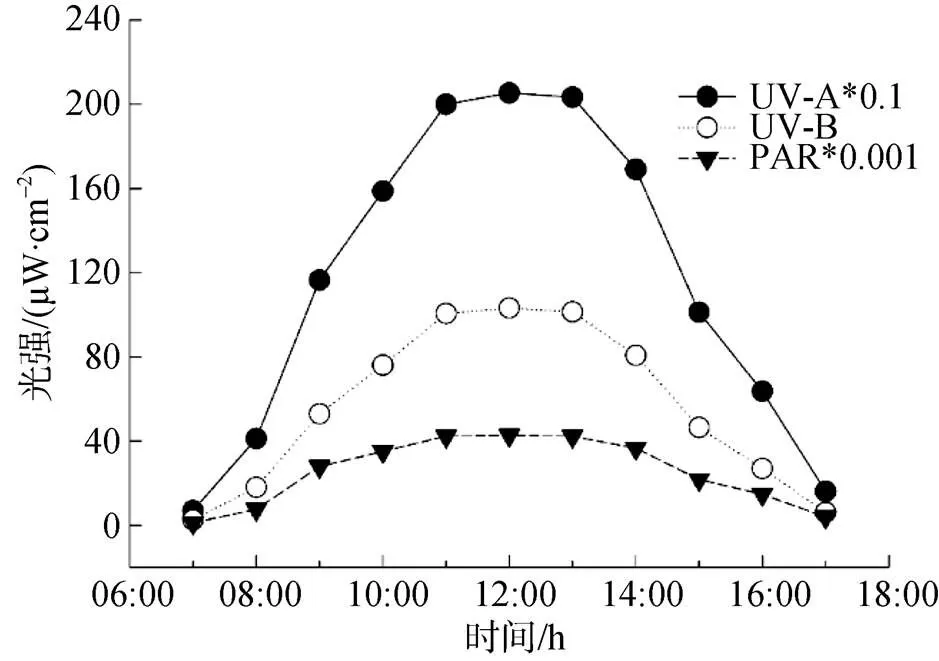
图1 2015年11月23日的太阳光日辐射强度
=2.303/(2)
式中:为波长的吸收系数(m-1),为吸光度,为光程路径(m)。
2.6 UV-B对藻细胞密度、活体荧光值和Chl a抑制率的计算
抑制率(%)=(对照组—UV-B组)/对照组 (3)
2.7 数据分析
图件用Sigmaplot 11.0软件绘制, 实验数据采用SPSS 18.0 One-way ANOVA分析, 显著水平设为<0.05。
3 结果
3.1 不同波段UVR对两种微藻生长的影响
从两种微藻的生长曲线(图2A、B)可以看出, 在不同的UVR处理下, 其总体生长趋势相同。在UV-A或无UVR(对照组)的作用下, 两种微藻细胞数量呈逐渐升高趋势, 培养初期的增长速度较快。在UV-A的作用下, 两种微藻平均生长速率略有提高, 细胞数量显著高于对照组(<0.05)。就整个培养阶段而言, UV-A组的威氏海链藻平均生长速率约为对照组的1.5倍, 锥状斯氏藻为1.4倍。此外, 与对照组相比, UV-A致使威氏海链藻细胞数量最终提高约47%, 锥状斯氏藻提高35%。在UV-B处理下, 两种微藻细胞数量显著快速下降(<0.05)。
两种微藻在不同UVR处理下的活体荧光值与其细胞密度变化相一致。UV-A处理下的微藻活体荧光值高于对照组, 9 d后显著升高(图2C、D)。然而, 在UV-B的培养条件下, 藻细胞活体荧光值在4 d后接近于0。
两种微藻Chl浓度变化趋势与其它生长参数相似(图2E、F)。威氏海链藻Chl浓度的最大值比细胞数量的最大值提前出现。在UV-A处理下, 锥状斯氏藻的Chl浓度始终呈现增长趋势, 对照组的Chl浓度则在4 d后趋向稳定并维持在15—20 mg·m-3。
从UV-B对两种微藻生长的抑制率(表1)可以看出, 随着暴露时间的增加, 其抑制率不断上升, 培养至4 d时, 抑制率基本高达90%以上。锥状斯氏藻前3 d的抑制率低于威氏海链藻, 表现最为明显的是活体荧光值, 其次为藻细胞密度和Chl。
3.2 不同波段UVR处理下的两种微藻培养体系化学参数的变化
两种微藻培养体系DIC的变化趋势基本一致(图3A、B)。对照组DIC浓度下降最快, 培养结束时, 威氏海链藻培养体系DIC浓度降低45.6%, 锥状斯氏藻培养体系降低32.6%。而UV-A组的DIC浓度呈现先下降后上升的趋势, UV-B组的DIC则表现为缓慢上升。
在不同UVR处理下, 两种微藻培养水体的DOC浓度均呈上升趋势(图3C、D)。在威氏海链藻培养水体中, 9 d时各实验组的DOC浓度接近, 约为3.5 mg·L-1, 此后, UV-A组DOC显著升高。两种微藻培养水体的DOC变化趋势相似, 但锥状斯氏藻培养水体的DOC增量更高。然而, 对DOC的净释放速率进行生物量(Chl浓度)的归一化分析(表2), 可以看出UV-A致使锥状斯氏藻DOC的净释放速率显著降低(<0.05), 但对威氏海链藻没有明显的影响。在培养中期(9 d), 锥状斯氏藻对照组的DOC净释放速率约为威氏海链藻的40倍。在培养后期(19 d), 威氏海链藻的DOC净释放速率有显著提高。
两种微藻培养水体的CDOM含量大致呈现先下降后上升的趋势。在威氏海链藻培养水体中, 对照组的CDOM含量>UV-B组>UV-A组。而在锥状斯氏藻培养水体中, UV-A组的CDOM含量则最高, 而且其对照组和UV-A组CDOM增量均高于威氏海链藻(图3E、F)。
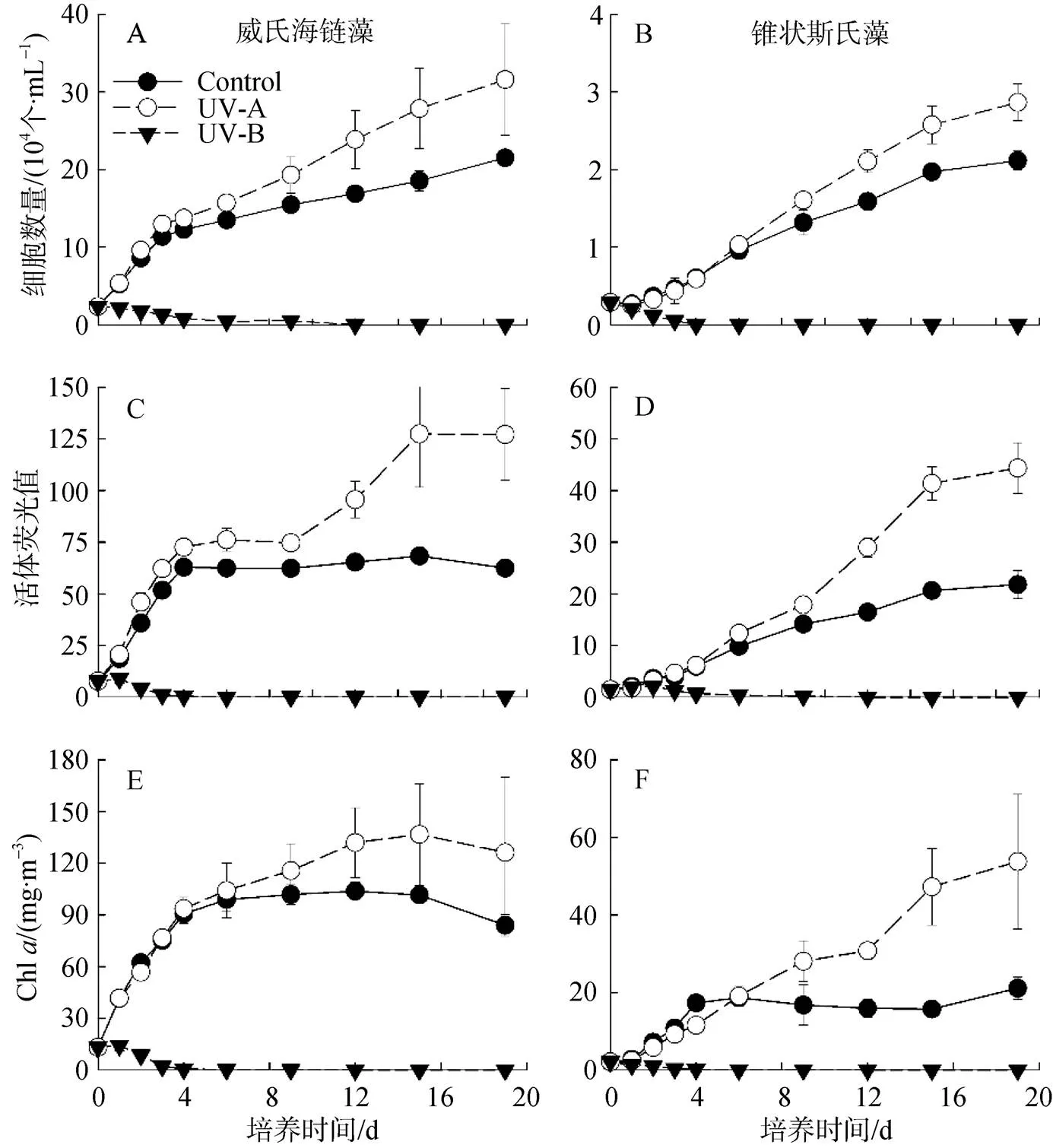
图2 不同波段紫外辐射对威氏海链藻(A, C, E)和锥状斯氏藻(B, D, F)细胞数量、活体荧光值和叶绿素a的影响
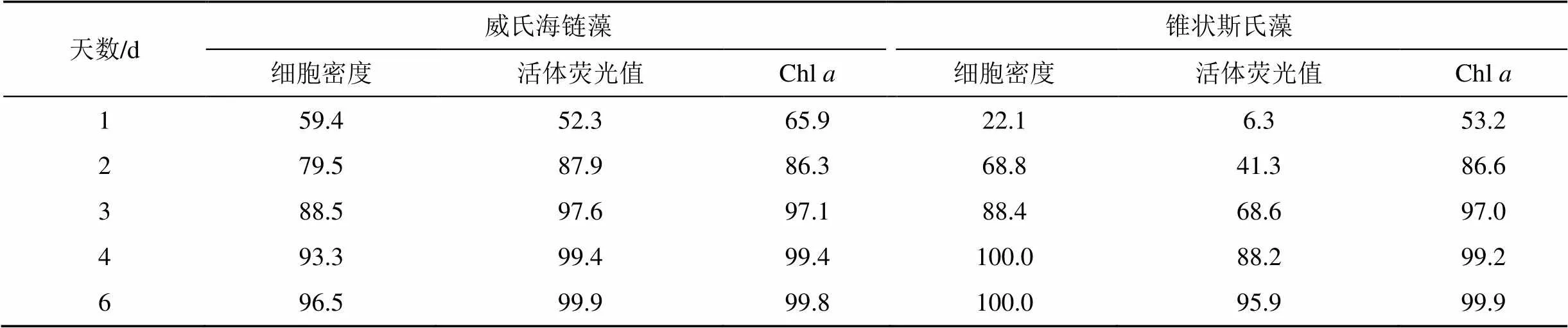
表1 UV-B对威氏海链藻和锥状斯氏藻生长参数的抑制率(%)
注: 培养至6 d时, UV-B对两种微藻的抑制率均达到95%以上
4 讨论
4.1 UVR对微藻生长的影响
一般来说, UVR可抑制海洋微藻的生长和光合作用, 然而低强度的UVR和UV-A也有正面效应的报道。我们的研究发现, 相对于对照组, UV-A显著地促进了两种微藻的生长, 而UV-B处理下的微藻在短时间内便出现细胞死亡的现象。
相对于UV-B, UV-A的波长更长, 所含的能量更少, 穿透能力更强, 且光谱更接近可被用于微藻光合作用的蓝光。有研究指出, UV-B最短波长(280 nm)对南海浮游植物的单位光能抑制率是UV-A的100万倍以上[21]。Chl在UV-A波段有较高的吸收峰, 表明Chl可以直接吸收利用UV-A。Gao等[22]认为UV-A是热带海洋微藻光合作用的能量来源之一, 特别是在低PAR强度下, UV-A可作为补充光能, 促进其光合固碳和生长。在大型海藻的研究中, Xu等[23]发现UV-A可以促进藻体的光合作用, 并证实了与PAR相似的光利用途径。然而, 在实验室模拟实验中也有报道UV-A可对微藻的生长和光合产生抑制作用, 可能是微藻从室内转移到室外时, 暴露在室外较高的PAR和UV-A下, 产生了“光氧化”现象, 而在本研究中, PAR辐射强度较低, UV-A起到了促进作用。在南海近岸海域的研究也观察到UV-A促进微藻光合作用的现象[24]。
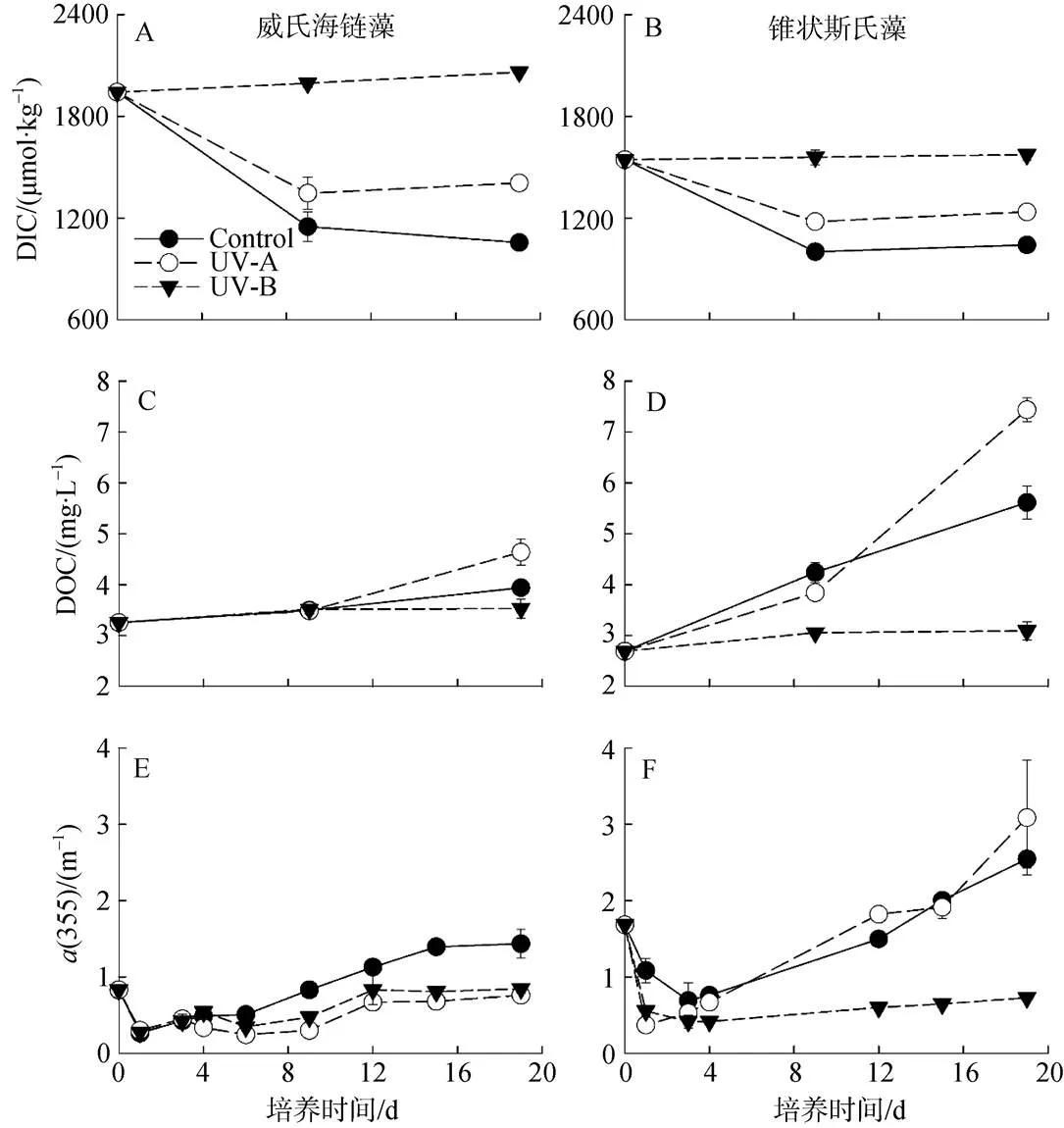
图3 不同波段紫外辐射对威氏海链藻(A、C、E)和锥状斯氏藻(B、D、F)培养体系溶解无机碳、溶解有机碳和吸收系数a(355)的影响
微藻对UV-B的耐受性可能与细胞大小相关[7]。Karentz等[11]用D37来表示微藻对UV-B的耐受性, 即每杀死一个细胞所需要的辐射剂量。他们发现细胞较小的藻类, 由于具有高的表面积/体积, 其D37值相对低, 因而对UV-B较为敏感。此外, 较大个体的藻细胞能更有效地利用吸光物质作为其光保护机制[25]。威氏海链藻的细胞体积(长12—18 µm,宽10—16 µm)比锥状斯氏藻(长18—30 µm, 宽15—26 µm)小, UVR可能更容易对其造成损伤。影响微藻对UVR耐受性强弱的因素还包括藻细胞壁的厚度和组分、保护机制和自身代谢等因素[26]。Wu等[27]发现与其它两种海链藻相比, 威氏海链藻有更高UVR穿透度, 在较高强度的UVR下辐照60 min, 其光化产量抑制率约10%。有学者对锥状斯氏藻进行长时间的UVR照射培养发现, 锥状斯氏藻在培养后期可适应在室外太阳光下生长, 并且证实其具有较高的紫外吸收物质的合成速率和D1蛋白的修复速率[28]。本研究通过对比UV-B对两种微藻生物量参数抑制率(表1)发现, 甲藻锥状斯氏藻比硅藻威氏海链藻耐受性更强。然而, 在静置培养的条件下, 由于锥状斯氏藻具有鞭毛, 运动能力比威氏海链藻要强, 更有利于其通过主动迁移躲避UV-B, 对实验结果产生一定的误差。在自然条件下, 这种有效的躲避机制有助于提高甲藻在种间竞争中的优势。微藻对UVR的耐受性也与光环境相关, 如热带海区的微藻比极地的更耐受, 位于跃层上方的微藻比下方的更耐受[29–30]。此外, 高UVR剂量导致微藻大量死亡的研究也有过相关报道[31]。本研究中受UV-B辐射的藻类在培养过程中全部死亡, 可能的原因有: (1)藻种已在实验室长期驯化, 很少接受UVR的照射, 实验中较高的辐射强度容易对其生长产生较强的光抑制[32]; (2)实验中藻类于固定烧杯中培养, 整个水体均接受较强UV-B辐射, 无法通过垂直迁移等方式来躲避辐射[33]。虽然本实验不能以偏概全地认为甲藻比硅藻更耐受UVR, 但是甲藻的抗逆性强, 已经成为甲藻赤潮增多的重要原因之一[34]。近年来, 我国近海甲藻类赤潮的发生比例逐渐上升, 已占到赤潮发生总数的一半, UVR的增强可能成为另一个促使甲藻赤潮增多的因素, 具体机理尚需进一步论证[4]。
4.2 UVR对培养体系碳流的影响
培养过程的DIC主要是以微藻光合作用的形式被吸收。在自然条件的海水中, 由于低的CO2浓度以及其在海水中较慢的扩散速度, 海洋微藻形成了一种CO2的浓缩机制(CO2concentrating mechanisms, CCM)[35]。微藻通过该机制使其既能利用CO2, 又能利用HCO3-作为其外源碳源进行固碳作用。而DIC的释放主要通过呼吸作用, 当光合作用大于呼吸作用时, 水体的DIC减少; 当光合作用小于呼吸作用时, DIC增多。两种微藻在UV-A的作用下, DIC的净消耗量均比对照组少, 表明UV-A减少了微藻光合作用对DIC的利用(图4)。而在UV-B组, 微藻细胞死亡后, 有机碳被分解转化为无机碳, 使pH降低, DIC升高。
初级生产者通过分泌代谢产物和死亡后产生碎屑等不断向海水中注入有机物质。研究表明, 微藻DOC的释放量与营养盐水平[36]、藻细胞体积[37]以及UVR[12, 38]等相关。UVR对微藻释放DOC有促进作用, 但高强度的UVR会产生抑制作用[12, 38]。一般认为, 低的光照条件下, 高分子化合物合成速率减弱, 碳被更多地合成容易释放的小分子代谢物; 在稍高的光强下, 藻类光呼吸作用旺盛, 造成大量乙醇酸的释放, 因而高DOC释放量一般出现在近表层和真光层底部[39]; 然而高光强会严重损伤藻细胞, 并扰乱细胞正常代谢, 导致DOC释放量的显著下降[38]。在本研究中, 对照组和UV-A组的水体DOC含量呈现不断升高的趋势, 而UV-B组的DOC也有缓慢上升的趋势, 说明浮游植物是水体DOC的重要贡献者。在UV-A处理下, 微藻培养体系的DOC含量显著升高, 与其高生物量一致。然而, 对DOC的净释放速率进行归一化分析(表2), 可以看出UV-A对锥状斯氏藻DOC的净释放速率有显著的抑制作用(<0.05), 说明UV-A促使水体DOC含量升高的主要原因是其有效地促进了微藻的生长, 提高了生物量。此外, 不同种类微藻在不同生长期的DOC净释放速率也不一样(表2)。Romera-Castillo等[40]的研究也发现了不同藻类之间DOC释放率的巨大差异。从UV-B组看出, 两种微藻细胞碎屑在分解过程中使培养水体DOC浓度略有上升。国内也有开展过相关的研究, 付强等[41]对不同磷浓度培养条件下, 甲藻DOC的释放量的变化进行了研究, 而刘诚刚[42]在黄海的现场调查表明, 甲藻释放的DOC比硅藻多, 我们的结果与之相符。
假设微藻光合生产的颗粒有机碳(Particulate organic carbon, POC)除了自身生物量部分, 其余的POC均释放到水体环境中。对培养9 d的两种微藻在有无UV-A照射下的碳流进行分析(图4), 可以看出, 在UV-A的作用下, DIC更多地被分配到藻生物量上, POC的净释放减少, 而DOC则无显著变化。一方面, 在UV-A的作用下, 微藻生长得到促进, 生物量的提高使DOC的生产得到保证。另一方面, UV-A可促进有机碳的分解, 为微藻的生长提供碳源[43]。因此, UV-A对水体的碳流的分配有重要影响。
有色溶解有机物(Chromophoric dissolved organic matter, CDOM)是海洋重要的有机碳组成部分, 可吸收PAR和UVR从而影响光在水层中的穿透能力[44]。一方面, CDOM发色团在吸收光(主要是UVR)的过程中, 会引起其吸光度损失, 该过程称为光漂白。另一方面, 部分有机物(如: 脂肪酸和甘油三酯)可以在太阳光的作用下转化成腐殖质, 从而提高了CDOM的含量, 该过程称为光腐殖化[45]。我们的结果发现, 两种微藻对照组的CDOM含量升高, 表明浮游植物的生长过程是CDOM的来源之一。然而, 在UV-A的作用下, 两种微藻培养水体的CDOM浓度变化相反, 可能是不同微藻的CDOM产物受光漂白和光腐殖化的影响不同[46]。UV-B组的CDOM也有升高的趋势, 可能是由于微藻碎屑降解而产生[47]。总的来说, UVR比PAR对CDOM的光漂白更显著。然而, 在实验室模拟实验过程中很少有考虑到UVR的作用, 使得测量的CDOM值与自然条件下相比偏高。
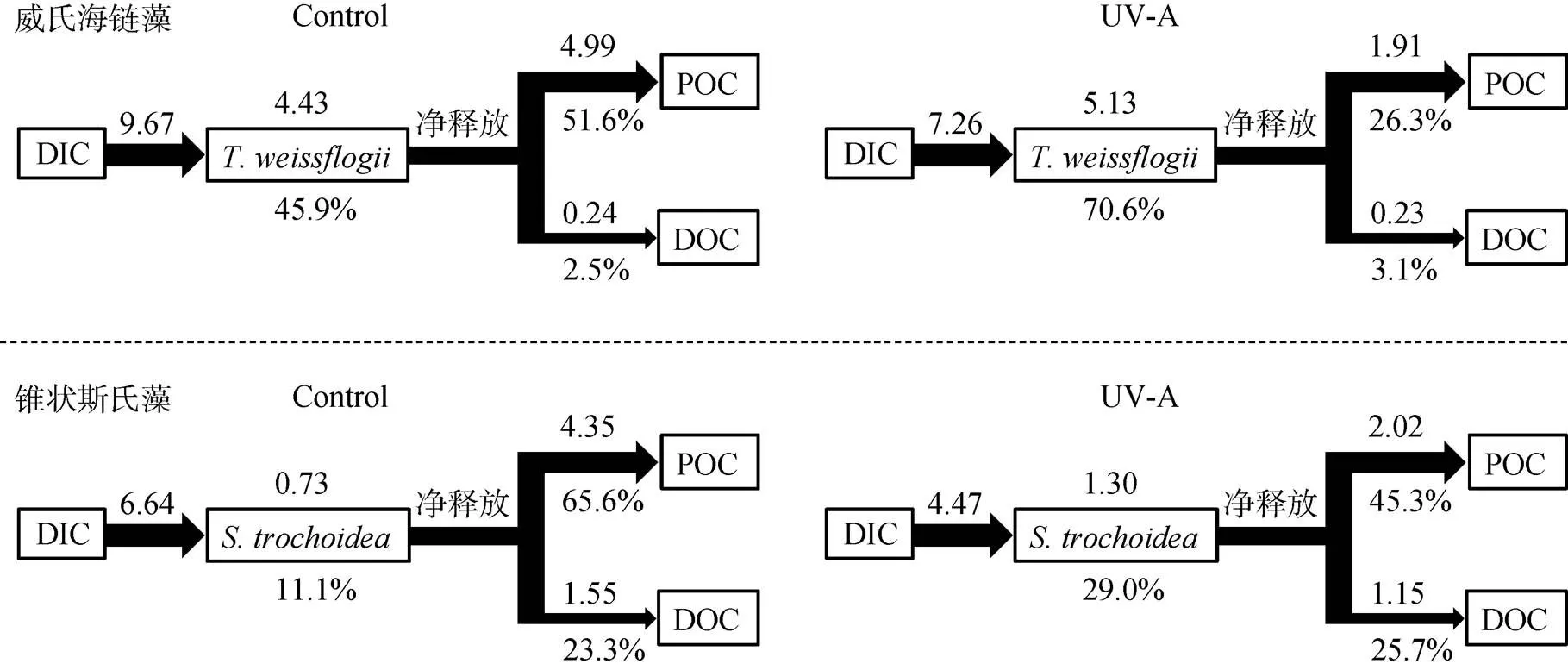
图4 UV-A作用下的威氏海链藻和锥状斯氏藻在培养至9 d时的碳流(mg C·L-1)
UVR的增强对初级生产者的生长和光合固碳起到了双刃剑的作用, 对处于表层的初级生产者来说, UVR无疑是一种环境压力, 初级生产者在应对高强度的UVR时, 提高了其光呼吸作用, 造成初级生产的下降。相对UV-B, UV-A在水层中有更高的穿透力, 在开阔的大洋, 10%的表层UV-A可达30 m以上[48]。因而, UV-A有可能是真光层初级生产者光合作用的光能来源之一。
5 结论
本文通过室内模拟培养实验, 探讨了不同波段UVR对两种微藻(威氏海链藻和锥状斯氏藻)的生长和培养体系碳流的影响, 主要的结论有:
1) 在低PAR的条件下, UV-A(1200—1400 μw·cm-2)显著地促进两种微藻的生长, 然而UV-B(45—55 μw·cm-2)显示明显的抑制作用。甲藻锥状斯氏藻对UV-B的耐受性强于硅藻威氏海链藻。
2) 不同UVR和藻种对培养体系碳流的影响存在显著差异。在UV-A作用下, 微藻对水体DIC的利用减少, 但释放出更多的DOC, 从而影响水体的碳流过程。在UV-B的作用下, 微藻碎屑分解过程中使培养水体DIC和DOC浓度略有升高。总体上, 锥状斯氏藻DOC和CDOM的净释放量高于威氏海链藻。
[1] MADRONICH S. The atmosphere and UV-B radiation at ground level[M]// YOUNG A R, MOAN J, BJÖRN L O, et al. Environmental UV Photobiology[M]. New York: Plenum Press,1993: 1–39.
[2] FALKOWSKI P G. The Role of phytoplankton photosynthesis in global biogeochemical cycles[J]. Photosynthesis Research, 1994, 39(3): 235–258.
[3] ROUSSEAUX C S, GREGG W W. Interannual variation in phytoplankton primary production at a global scale[J]. Remote Sensing, 2014, 6(1): 1–19.
[4] 郭皓, 丁德文, 林凤翱, 等. 近20a我国近海赤潮特点与发生规律[J]. 海洋科学进展, 2015, 33(4): 547–558.
[5] BOOTH C R, MORROW J H. The penetration of UV into natural waters[J]. Photochemistry and Photobiology, 1997, 65(2): 254–257.
[6] HÄDER D P, KUMAR H D, SMITH R C, et al. Effects on aquatic ecosystems[J]. Journal of Photochemistry and Photobiology B: Biology, 1998, 46: 53–68.
[7] BOELEN P, DE BOER M K, KRAAY G W, et al. UVBR-induced DNA damage in natural marine picoplankton assemblages in the tropical Atlantic Ocean[J]. Marine Ecology Progress Series, 2000, 193: 1–9.
[8] BARBIERI E S, VILLAFAÑE V E, HELBLING E W. Experimental assessment of UV effects on temperate marine phytoplankton when exposed to variable radiation regimes[J]. Limnology and Oceanography, 2002, 47(6): 1648–1655.
[9] HELBLING E W, GAO K S, GONÇALVES R J, et al. Utilization of solar UV radiation by coastal phytoplankton assemblages off SE China when exposed to fast mixing[J]. Marine Ecology Progress Series, 2003, 259(8): 59–66.
[10] QUESADA A, MOUGET J L, VINCENT W F. Growth of Antarctic cyanobacteria under ultraviolet radiation: UVA counteracts UVB inhibition[J]. Journal of Phycology, 1995, 31(2): 242–248.
[11] KARENTZ D, CLEAVER J E, MITCHELL D L. Cell survival characteristics and molecular responses of Antarctic phytoplankton to ultraviolet-B radiation[J]. Journal of Phycology, 1999, 35(27): 326–341.
[12] CARRILLO P, MEDINA-SÁNCHEZ J M, VILLAR-ARGAIZ M. The interaction of phytoplankton and bacteria in a high mountain lake: Importance of the spectral composition of solar radiation[J]. Limnology and Oceanography, 2002, 47(5): 1294–1306.
[13] WU H Y, GAO K S. Ultraviolet radiation stimulated activity of extracellular carbonic anhydrase in the marine diatom[J]. Functional Plant Biology, 2009, 36(2): 137–143.
[14] 彭小伟, 何剑锋, 罗玮, 等. UV-B短期照射对北极冰川小球藻sp.的生物学效应[J]. 极地研究, 2010, 22(2): 164–173.
[15] ANDERSEN R A. Algal Culturing Techniques[M]. London: Elsevier Acadenmic Press, 2005: 507.
[16] ZHOU W H, YIN K D, YUAN X C, et al. Comparison of the effects of short-term UVB radiation exposure on phytoplankton photosynthesis in the temperate Changjiang and subtropical Zhujiang Estuaries of China[J]. Journal of Oceanography, 2009, 65(5): 627–638.
[17] PARSONS T R, MAITA Y, LALLI C M. A manual of chemical and biological methods for seawater analysis[M]. New York: Pergamon Press, 1984: 475–490.
[18] BARLOW R G, MANTOURA R F C, Cummings D G, et al. Evolution of phytoplankton pigments in mesocosm experiments[J]. Estuarine Coastal and Shelf Science, 1998, 46(Supplement A): 15–22.
[19] 王聪. 差分非色散红外法测量不同盐度海水样品的总溶解无机碳研究[J]. 海洋技术学报, 2014, 33(3): 80–84.
[20] GUO W D, STEDMON C A, HAN Y C, et al. The conesrvative and non-conservative behavior of chromophoric dissolved organic matter in Chinese estuarine waters[J]. Marine Chemistry, 2007, 107(3): 357–366.
[21] 吴亚平, 高坤山. 夏季南海浮游植物光合固碳对不同波长阳光紫外辐射的响应[J]. 海洋学报, 2011, 33(5): 146–151.
[22] GAO K S, WU Y P, LI G, et al. Solar UV radiation drives CO2fixation in marine phytoplankton: A double-edged sword[J]. Plant Physiology, 2007, 144(1): 54–59.
[23] XU J T, GAO K S. Use of UV-A energy for photosynthesis in the red macroalga[J]. Photochemistry and Photobiology, 2010, 86(3): 580–585.
[24] LI G, GAO K S. Cell size-dependent effects of solar UV radiation on primary production in coastal waters of the South China Sea[J]. Estuaries and Coasts, 2013, 36(4): 728–736.
[25] GARCIA-PICHEL F. A model for internal self‐shading in planktonic organisms and its implications for the usefulness of ultraviolet sunscreens[J]. Limnology and Oceanography, 1994, 39(7): 1704–1717.
[26] 王悠, 杨震, 唐学玺, 等. 7种海洋微藻对UV-B辐射的敏感性差异分析[J]. 环境科学学报, 2002, 22(2): 225–230.
[27] WU Y P, LI Z Z, DU W J, et al. Physiological response of marine centric diatoms to ultraviolet radiation, with special reference to cell size[J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 153: 1–6.
[28] GUAN W C, LU S H. The short- and long-term response of(Pyrrophyta) to solar ultraviolet radiation[J]. Photosynthetica, 2010, 48(2): 287–293.
[29] HELBLING E W, VILLAFAÑE V, FERRARIO M, et al. Impact of natural ultraviolet radiation on rates of photosynthesis and on specific marine phytoplankton species[J]. Marine Ecology Progress Series, 1992, 80(1): 89–100.
[30] HELBLING E W, VILLAFAÑE V, BUMA A, et al. DNA damage and photosynthetic inhibition induced by solar UVR in tropical phytoplankton (Lake Titicaca, Bolivia)[J]. European Journal of Phycology, 2001, 36(2): 157–166.
[31] 齐雨藻, 黄长江, 应浙鸿, 等. 紫外光对有毒甲藻塔玛亚历山大藻的生态学效应[J]. 海洋与湖沼, 1997, 28(2): 113–120.
[32] 金文育, 关万春, 李平, 等. 三种甲藻对阳光紫外辐射响应机制的种间差异[J]. 水生生物学报, 2015, 39(2): 419–425.
[33] BEBOUT B M, GARCIA-PICHEL F. UV B-induced vertical migrations of cyanobacteria in a microbial mat[J]. Applied and Environmental Microbiology, 1995, 61(12): 4215–4222.
[34] 周名江, 朱明远. “我国近海有害赤潮发生的生态学、海洋学机制及预测防治”研究进展[J]. 地球科学进展, 2006, 21(7): 673–679.
[35] GIORDANO M, BEARDALL J, RAVEN J A. CO2concentrating mechanisms in algae: Mechanisms, environmental modulation, and evolution[J]. Annual Review of Plant Biology, 2005, 56: 99–131.
[36] HASEGAWA T, KASAI H, ONO T, et al. Dynamics of dissolved and particulate organic matter during the spring bloom in the Oyashio region of the western subarctic Pacific Ocean[J]. Aquatic Microbial Ecology, 2010, 60(2): 127–138.
[37] TEIRA E, SERRET P, FERNÁNDEZ E. Phytoplankton size-structure, particulate and dissolved organic carbon production and oxygen fluxes through microbial communities in the NW Iberian coastal transition zone[J]. Marine Ecology Progress Series, 2001, 219(219): 65–83.
[38] FUENTES-LEMA A, SOBRINO C, GONZÁLEZ N, et al. Effect of solar UVR on the production of particulate and dissolved organic carbon from phytoplankton assemblages in the Indian Ocean[J]. Marine Ecology Progress Series, 2015, 535: 47–61.
[39] 刘诚刚, 宁修仁, 郝锵, 等. 海洋浮游植物溶解有机碳释放研究进展[J]. 地球科学进展, 2010, 25(2): 123–132.
[40] ROMERA-CASTILLO C, SARMENTO H, ÁLVAREZ- SALGADO X A, et al. Production of chromophoric dissolved organic matter by marine phytoplankton[J]. Limnology and Oceanography, 2010, 55(1): 446–454.
[41] 付强, 谭丽菊, 王江涛. 甲藻生长对水体中溶解有机碳(DOC)含量影响[J]. 青岛海洋大学学报(自然科学版), 1999, (S1): 191–196.
[42] 刘诚刚. 中国近海浮游植物光合溶解有机碳生产研究[D]. 青岛: 中国海洋大学, 2012: 12–87.
[43] WANG X J, LOU T, XIE H X. Photochemical production of dissolved inorganic carbon from suwannee river humic acid[J]. Chinese Journal of Oceanology and Limnology, 2009, 27(3): 570–573.
[44] ZEPP R G, SHANK G C, STABENAU E, et al. Spatial and temporal variability of solar ultraviolet exposure of coral assemblages in the Florida Keys: Importance of colored dissolved organic matter[J]. Limnology and Oceanography, 2008, 53(5): 1909–1922.
[45] KIEBER R J, HYDRO L H, SEATON P J. Photooxidation of triglycerides and fatty acids in seawater: Implication toward the formation of marine humic substances[J]. Limnology and Oceanography, 1997, 42(6): 1454–1462.
[46] ORTEGA-RETUERTA E, RECHE I, PULIDO-VILLENA E, et al. Distribution and photoreactivity of chromophoric dissolved organic matter in the Antarctic Peninsula (Southern Ocean)[J]. Marine Chemistry, 2010, 118(3–4): 129–139.
[47] ZHANG Y L, VAN DIJK M A, LIU M L, et al. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: Field and experimental evidence[J]. Water Research, 2009, 43(18): 4685–4697.
[48] TEDETTI M, SEMPÉRÉ R. Penetration of ultraviolet radiation in the marine environment. A review[J]. Photochemistry and Photobiology, 2006, 82(2): 389–397.
The effects of UVR on the growth of two marine microalgae and the carbon flow in the culture system
LIAO Jianzu1, 2, 3, 4, GUO Yajuan1, 3, 4, YUAN Xiangcheng1, 3, ZHOU Weihua1, 3, *, HUANG Hui1, 3
1. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China 2. State Key Laboratory of Tropical Oceanography, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China 3. Tropical Marine Biological Research Station in Hainan, Chinese Academy of Sciences, Sanya 572000, China 4. University of Chinese Academy of Sciences, Beijing 100049, China
The effects of two different wavelengths of ultraviolet radiation (UVR) on the growth of two species of marine microalgae, i.e.(diatom) and(dinoflagellate), and the carbon flow in their culture systems were examined. The intensity of simulated UVR in this study was set according to sunny doses in fine day of autumn in southern China. The results showed that UV-A caused a positive effect on the growth ofand, while UV-B obtained an opposite pattern. In general,was much tolerant to UV-B than. Compared to the control, net consumption of dissolved inorganic carbon (DIC) decreased under UV-A exposure. In addition, more dissolved organic carbon (DOC) was released in the culture media under UV-A exposure. The level of chromophoric dissolved organic matter (CDOM) was significantly higher in the control, indicating that microalgae could be an important source for CDOM. However, the change of CDOM level during the experiment also showed an opposite pattern between these two microalgae culture media under UV-A, indicating different processes of photobleaching and photohumification. Under the UV-B exposure, DIC and DOC increased slightly due to the degradation of microalgae detritus. In summary,might release more DOC and CDOM than.
;; ultraviolet radiation; carbon flow
Q178.1+1
A
1008-8873(2018)01-001-09
10.14108/j.cnki.1008-8873.2018.01.001
2017-03-20;
2017-04-14
国家自然科学基金(31370500, 40806050, 31370499)
廖健祖(1992—), 男, 广东江门市人, 硕士研究生, 主要从事海洋生态环境研究, E-mail: liaojianzu@126.com
周伟华, 男, 博士, 研究员, 主要从事海洋生态环境研究, E-mail: whzhou@scsio.ac.cn
廖健祖, 郭亚娟, 袁翔城, 等. 紫外辐射对两种海洋微藻生长及培养体系碳流的影响[J]. 生态科学, 2018, 37(1): 1-9.
LIAO Jianzu, GUO Yajuan, YUAN Xiangcheng, et al. The effects of UVR on the growth of two marine microalgae and the carbon flow in the culture system[J]. Ecological Science, 2018, 37(1): 1-9.
