干旱胁迫对不同抗旱性苜蓿品种根系生长及生理特性影响
2018-03-26张翠梅师尚礼吴芳
张翠梅,师尚礼,吴芳
干旱胁迫对不同抗旱性苜蓿品种根系生长及生理特性影响
张翠梅,师尚礼,吴芳
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续研究中心 兰州 730070)
【目的】研究干旱胁迫对不同抗旱性苜蓿品种根系生长特征及生理特性的影响,明确不同抗旱性苜蓿品种响应干旱胁迫的生长及生理差异,为进一步阐明紫花苜蓿抗旱的分子机理、提高紫花苜蓿耐旱性和水分利用效率提供理论依据。【方法】采用营养液沙培法,选用强抗旱的陇中苜蓿(L. cv. Longzhong)、中抗旱的陇东苜蓿(L. cv. Longdong)和弱抗旱的甘农3号紫花苜蓿(L. cv. Gannong No.3)为试验材料,在幼苗期对其进行6种不同水势(0、-0.4、-0.8、-1.2、-1.6和-2.0 MPa)的PEG-6000人工模拟干旱胁迫,研究干旱胁迫对供试苜蓿根系生长特征(根系总长度、根系总表面积、根系平均直径、根体积、根尖数和根系干重)、根系活力、游离脯氨酸(Pro)含量、可溶性蛋白(SP)含量、可溶性糖(SS)含量,丙二醛(MDA)含量、质膜相对透性、活性氧(H2O2、OH·和O2•-)含量,抗氧化酶(SOD、POD和CAT)活性、还原型抗坏血酸(AsA)和还原型谷胱甘肽(GSH)含量的影响。并用逐步回归分析建立最优回归方程,进而筛选出不同胁迫程度下对不同抗旱性苜蓿品种抗旱性影响较为显著的指标。【结果】干旱胁迫会显著影响苜蓿的根系生长特征及生理特性。随着干旱胁迫的加剧,供试苜蓿的根系总长度、Pro含量、MDA含量、质膜相对透性、活性氧(H2O2、OH·和O2•-)含量及CAT活性不断增加;根系干重、根系活力、SS含量和GSH含量先增加后下降。此外,随胁迫程度增加,陇中苜蓿的根系平均直径、根体积、根尖数、POD活性及SOD活性均呈先增加后下降的变化趋势,AsA含量不断增加;陇东苜蓿和甘农3号的根系平均直径、根体积、根尖数、POD活性及根系总表面积则呈不断下降的趋势,而AsA含量呈先增加后下降的变化趋势。整体而言,陇中苜蓿的根系总长度、根系总表面积、根系干重显著高于陇东苜蓿和甘农3号,H2O2含量和O2•-含量显著低于甘农3号;陇中苜蓿和陇东苜蓿的SP含量、SS含量和MDA含量显著低于甘农3号。-1.2 MPa至-2.0 MPa胁迫时,陇中苜蓿的H2O2和OH·含量显著低于陇东苜蓿。-2.0 MPa胁迫时,陇中苜蓿的POD活性、AsA和GSH含量均显著高于甘农3号。逐步回归分析表明,根系活力、根体积、根系总长度、MDA和AsA是对陇中苜蓿抗旱性影响较为显著的指标;根尖数、根系平均直径、根系总表面积、根系干重、O2•-、GSH和CAT是对陇东苜蓿抗旱性影响较为显著的指标;根系活力、根尖数、Pro、SS、MDA、质膜相对透性和GSH是对甘农3号紫花苜蓿抗旱性影响较为显著的指标。【结论】不同抗旱性苜蓿品种在形态特征和生理特性上对干旱胁迫存在相同和不同的生长及生理响应策略。轻度和中度胁迫(0 MPa至-1.2 MPa)下,抗旱苜蓿品种主要通过增加根系总长度、根体积和根尖数及降低膜脂过氧化程度来适应干旱,弱抗旱苜蓿品种则通过改变细胞膜稳定性、根系活力及渗透调节能力来适应干旱;重度胁迫(-1.2 MPa至-2.0 MPa)下,不同抗旱性苜蓿品种均可通过改变根系生长特征和启动抗氧化系统来抵御干旱,其中强抗旱苜蓿品种主要通过增加根长和AsA含量来适应干旱,而中等抗旱和弱抗旱苜蓿品种主要通过增加根尖数和GSH含量来适应干旱。
苜蓿;根系;PEG 胁迫;根系特征;生理特性;差异化响应策略
0 引言
【研究意义】干旱是限制植物生长、发育和分布的重要环境胁迫之一,其对农作物造成的损失在所有非生物胁迫中占首位[1-3]。紫花苜蓿(L.)为多年生豆科牧草,地下根系发达,在改善生态环境、水土保持方面具有天然的优势;紫花苜蓿同时具有高产、优质、适应性强、分布广等优点,已经成为中国种植面积最大、利用非常广泛的一种饲草作物[4-5]。然而,日益加剧的干旱对紫花苜蓿的种植面积和产量构成了严重威胁,干旱地区的旱作苜蓿产量只有通过抗旱苜蓿品种的培育和应用才能达到增产和稳产[6-7]。根系发育能力和生理生态特性与苜蓿的抗旱性关系十分密切。不同抗旱性苜蓿品种的根系对不同的环境条件表现出不同的适应特性,主要体现在形态结构、生理功能、物质代谢以及基因和蛋白表达等多方面[3],因此,探明干旱逆境下不同抗旱性苜蓿品种根系适应性变化的潜在机制,可为提高苜蓿耐旱性和水分利用效率提供理论依据。【前人研究进展】根系作为土壤-植株-大气水循环过程中的关键一环,在植物适应干旱缺水环境中发挥着重要作用[8]。干旱胁迫后,植物根系从生长发育、形态解剖结构、根系生物量、生理生化代谢等方面发生一系列变化以适应干旱逆境。植物根系的形态结构及生理特性反映了植物抗旱的形态基础和生理基础[9-12]。干旱胁迫下,根系的形态结构是植物生长发育水平和适应外界环境能力的直接体现[3]。以往研究认为根长、根系干重、根系体积、根系总吸收面积与品种抗旱性密切相关,抗旱性较强的品种能够保持更庞大的根系、更大的根-土交互面和更强的根系吸收能力[9-10]。此外,干旱胁迫下,植物根系的水分状况、渗透调节物质积累、细胞膜透性、活性氧产生速率、抗氧化系统的防御能力等常被用来判断其抵御干旱胁迫的能力[2, 13]。紫花苜蓿具有强大的根系系统,能够高效吸收利用深层土壤水分,被认为是其抗旱的主要原因之一[14]。前人对干旱胁迫下紫花苜蓿形态结构变化[15-19]、渗透调节物质积累[20-21]、膜结构与功能的变化[20, 22]、活性氧产生与清除[22]、酶促及非酶促抗氧化防御系统[22]、耐旱相关基因克隆及转化[23]、响应干旱的基因表达分析[20]、蛋白质组学[24]等方面进行了相关研究。郭正刚等[15]研究发现,不同紫花苜蓿品种间的根系发育能力差异显著,根系发育能力强的苜蓿品种吸收养分和水分的能力较强。李文娆等[14, 25]研究表明,干旱胁迫会显著抑制紫花苜蓿主根的伸长生长但同时促进侧根伸长生长,显著增加侧根数、根系总长度和根系总表面积;且根系总长度、根系生物量及根冠比与苜蓿水分利用效率(WUE)间具有显著的相关性。Erice等[16]研究发现,轻度干旱胁迫对适应于不同气候条件的苜蓿品种的生物量或水分状况未产生影响;中度干旱胁迫下,适应地中海气候的苜蓿品种主要通过改变叶面积比(LAR),比叶面积(SLA)来适应干旱,而适应海洋性气候的苜蓿品种主要通过改变叶重比(LWR)来适应干旱;重度干旱胁迫总体增加了根冠比,但不同苜蓿品种的抗旱能力差异不显著。HAMIDI等[19]研究表明,随胁迫程度增加,6个紫花苜蓿品种的发芽率、发芽势、胚芽长、胚根长和活力指数均显著降低,而胚根/胚芽比值显著增加,不同苜蓿品种在种子萌发期的抗旱性差异显著,且抗旱性强的品种具有较高的发芽率和发芽势。QUAN[20],BOLDAJI[22]和KANG[26]等研究发现,干旱胁迫下,相比弱抗旱苜蓿品种,强抗旱的苜蓿品种表现出较低的膜脂过氧化水平,较高的脯氨酸、可溶性糖和抗坏血酸的积累,较高的抗氧化酶(SOD、POD和CAT)活性。KANG等[26-27]研究表明,不同抗旱性苜蓿品种(Wisfal和Chilean)幼苗根系和地上部分对干旱胁迫响应策略相似,但在生理及分子水平(尤其是活性氧产生与清除相关基因表达)的差异反应表明Wisfal具有强的耐旱性。综上所述,不同抗旱性苜蓿品种在形态、生理、生化及分子水平对干旱胁迫表现出相似的响应策略,但抗旱能力的强弱则与品种本身潜在的适应能力有关。【本研究切入点】紫花苜蓿根系与地上部的生长、形态建成密切相关,强大的根系优势是其高产、抗旱的重要生理基础[28]。以往关于苜蓿抗旱形态、生理及分子机制的研究主要集中在地上部[20-27],而有关干旱胁迫对不同抗旱性苜蓿品种根系形态特征及生理特性影响的比较研究还很缺乏,研究不同抗旱性苜蓿根系响应干旱胁迫的潜在机制能更好地揭示苜蓿抗旱性的本质。【拟解决的关键问题】本研究选用不同抗旱性苜蓿品种,对其幼苗根系进行模拟干旱胁迫处理,通过综合比较干旱胁迫对其根系生长特征、渗透调节物质含量、膜稳定性、活性氧含量、抗氧化系统中相关生理生化指标的影响,明确不同抗旱性苜蓿品种根系响应干旱胁迫的生长及生理差异,为进一步阐明紫花苜蓿抗旱的分子机理奠定生理基础,也为提高紫花苜蓿抗旱性和水分利用效率提供理论依据。
1 材料与方法
1.1 试验材料
选用3个不同抗旱性的紫花苜蓿品种为试验材料,即陇中苜蓿(L. cv. Longzhong)、陇东苜蓿(L. cv. Longdong)和甘农3号紫花苜蓿(L. cv. Gannong No.3)。陇中苜蓿系地方品种,适宜生长在年均降雨量200—400 mm,年蒸发量1 531 mm,年平均气温6.3℃,年日照时数2 500 h,无霜期平均为140 d的黄土高原陇中干旱区域,具有强抗旱性[29];陇东苜蓿系地方品种,适宜生长在年均降雨量400—600 mm,年蒸发量1 400—1 600 mm,年平均气温 8.7℃,年日照时数2 491.4 h,无霜期平均为156 d的黄土高原陇东地区,耐旱性较强[14, 25];甘农3号紫花苜蓿系育成品种,株型紧凑直立,茎枝多,高度整齐,叶片中等大小,叶色浓绿,花紫色,春季返青早,初期生长快,适应于西北内陆灌溉农业区和黄土高原地区,为灌区丰产品种,对干旱环境的耐受性较差[30]。供试苜蓿种子由甘肃农业大学草业生态系统教育部重点实验室提供。
1.2 试验方法
2017年3月,在甘肃农业大学草业学院采用营养液沙培法,选用消毒后的细沙(121℃,高温灭菌26 min),装入口径为9 cm,高度为11 cm的营养钵中,摆放在长×宽×高为25 cm×15 cm×10 cm的水培盒中,置于光照培养室(每天光照14 h,光通量密度400 μmol·m-2·s-1,昼夜温度分别为(25±1)℃和(20±1)℃,相对湿度60%左右)。将经HgCl2溶液消毒后的供试苜蓿种子播种在营养钵,出苗后间苗,每钵保留生长一致、分布均匀的幼苗10株,每隔2 d浇灌300 mL Hoagland营养液,保证幼苗正常生长。参考Boldaji[22],穆怀彬[31]和Nagy等[32]PEG模拟干旱胁迫的方法,幼苗生长至第45天,设置0、-0.4、-0.8、-1.2、-1.6和-2.0 MPa 6个水势梯度。处理后每隔2 d每盒浇灌300 mL不同水势的含 PEG-6000的Hoagland营养液以维持溶液浓度,以仅含Hoagland营养液(水势为0 MPa)的处理为对照,连续胁迫处理7 d后采集根系测定各项指标,3次重复。不同水势所需PEG-6000溶液的量依据Michel公式[33]计算:
Ψs=-(1.18×10-2)×C-(1.18×10-4)×C2+(2.67×10-4)×C ×T+(8.39×10-7)×C2×T
式中,Ψs为溶液的水势(MPa);C为PEG-6000溶液的浓度(g·kg-1);T为温度(℃)。
1.3 测定项目与方法
1.3.1 根系生长特征及根系干重测定 将各处理的根系用去离子水冲洗干净,采用台式扫描仪(Epson Experssion)对根系进行扫描并将图像存入电脑,扫描仪的分辨率为300 dpi。扫描时,把根系放入透明托盘内,并注入10—15 mm深的蒸馏水,整理根系,防止根系分枝互相缠绕。采用WinRHIZO根系分析系统软件(Regent Instruments,Inc.,Quebec,Canada)对根系的图像进行分析,获得根系总长度、根系总表面积、根体积、根尖数和根系平均直径等特征参数。
根系干重采用烘干法测定。处理结束后,将各处理的苜蓿幼苗以去离子水冲洗干净,按地上部和地下部分开,取苜蓿幼苗根系,擦干水分,105℃杀青15 min,70℃烘干至恒重后称重。
1.3.2 生理生化指标测定 根系活力采用氯化三苯基四氮唑(TTC)法测定[34];游离脯氨酸含量采用酸性茚三酮比色法测定[34];可溶性蛋白含量采用考马斯亮蓝G-250染色法测定[34];可溶性糖含量采用蒽酮比色法测定[34];丙二醛(MDA)含量采用硫代巴比妥酸法测定[34]。质膜相对透性测定参照李锦树的方法[35];双氧水(H2O2)含量采用KI显色法测定[36];羟自由基(OH·)浓度采用2-脱氧-D-核糖显色法测定[37];超氧阴离子自由基(O2·-)产生速率采用对氨基苯磺酸法测定[38]。粗酶液的制备参考De Azevedo Neto的方法[39],超氧化物歧化酶(SOD)活性测定参考Giannopolitis等的方法[40],过氧化氢酶(CAT)活性测定参考Beers等的方法[41]。过氧化物酶(POD)活性参考De Azevedo Neto等方法测定[39];还原型抗坏血酸(AsA)含量采用4,7-二苯基-1,10-菲咯啉(BP)显色法测定[42];还原型谷胱甘肽(GSH)含量采用5,5-二硫代双-2-硝基苯甲酸(DTNB)显色法测定[43]。
1.4 数据统计分析
用Microsoft Excel软件整理数据,SPSS19.0软件进行单因素方差(ANOVA)统计分析,Duncan法多重比较,差异显著性定义为<0.05,所有数据均为3个重复的平均值±标准误(±SE)。
2 结果
2.1 干旱胁迫对不同抗旱性苜蓿品种幼苗根系生长的影响
随着胁迫程度增加,供试苜蓿的根系总长度显著增加;而陇东苜蓿和甘农3号的根系总表面积则不断降低(图1-A,B)。-0.4 MPa胁迫时,陇中苜蓿,陇东苜蓿和甘农3号的根系总长度均开始显著增加;且在-2.0 MPa胁迫时增至最高值,增幅分别为17.42%,12.50%和6.89%(<0.05)。-0.8 MPa至-2.0 MPa胁迫时,陇东苜蓿和甘农3号的根系总表面积显著降低,且在-2.0 MPa胁迫降至最低值,降幅分别为9.14%和7.60%(<0.05)。除0 MPa和-1.2 MPa外,陇中苜蓿的根系总长度在其他胁迫处理时均显著高于陇东苜蓿和甘农3号。-0.8 MPa至-2.0 MPa胁迫时,陇中苜蓿的根系总表面积均显著大于陇东苜蓿和甘农3号(<0.05)。
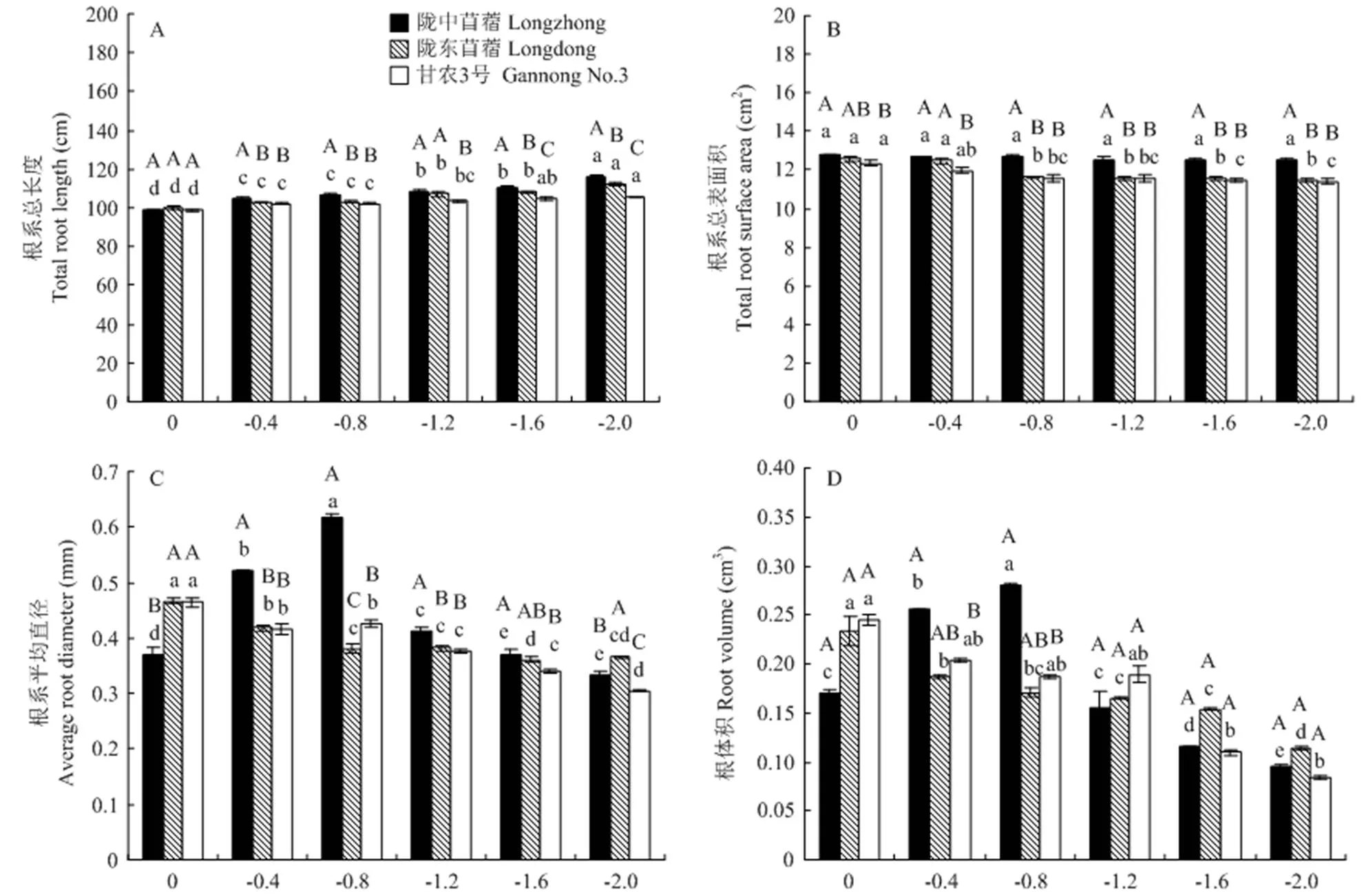
图内数据为平均值±标准误。不同大写字母表示同一胁迫水势下不同品种间的差异显著(<0.05);不同小写字母表示同一品种在不同胁迫水势下的差异显著(<0.05)。下同
Values are mean±SE. Different capital letters indicate significant difference of different alfalfa varieties in the same water potential treatment at 0.05 level; Different small letters indicate significant difference of the same different alfalfa varieties in the different water potential treatment at 0.05 level. The same as below
图1 干旱胁迫对不同抗旱性苜蓿品种幼苗根系生长特征的影响
Fig. 1 Effects of drought stress on root growth characteristics of different drought-tolerant alfalfa varieties
随胁迫程度增加,根系平均直径,根体积和根尖数在陇中苜蓿中呈先增加后下降的趋势,而在陇东苜蓿和甘农3号中则呈不断下降的趋势(图1-C,D,E)。-0.4 MPa至-0.8 MPa胁迫时,根系平均直径,根体积和根尖数在陇中苜蓿显著增加,而在陇东苜蓿和甘农3号显著降低。-1.2 MPa胁迫时,陇中苜蓿,陇东苜蓿和甘农3号以上各指标均开始显著下降,且在-2.0 MPa胁迫时降至最低值,其中根系平均直径的降幅为9.98%、21.52%和34.43%;根体积的降幅为43.97%、51.06%和65.55%;根尖数的降幅为 29.21%、39.82%和53.33%(<0.05)。0 MPa胁迫时,陇中苜蓿的根系平均直径显著低于陇东苜蓿和甘农3号,而在-0.4 MPa至-1.2 MPa胁迫时,陇中苜蓿的根系平均直径显著高于陇东苜蓿和甘农3号。-1.6 MPa至-2.0 MPa胁迫时,陇中苜蓿的根系平均直径和根尖数显著高于甘农3号(<0.05)。
供试苜蓿的根系干重均随胁迫程度加剧呈先增加后下降的趋势(图1-F)。-0.4 MPa下,陇中苜蓿和陇东苜蓿的根系干重增至最大,增幅分别为31.42%和25.36%(<0.05),而甘农3号的根系干重变化差异不显著。-0.4 MPa至-1.6 MPa胁迫时,陇中苜蓿的根系干重显著高于陇东苜蓿和甘农3号(<0.05);而在-2.0 MPa胁迫时,陇中苜蓿的根系干重仅显著高于甘农3号。
2.2 干旱胁迫对不同抗旱性苜蓿品种根系活力和渗透调节物质含量的影响
供试苜蓿的根系活力均随胁迫程度加剧先增加后下降(图2-A)。-0.4 MPa下,陇中苜蓿、陇东苜蓿和甘农3号的根系活力增至最大值,增幅分别为60.66%、30.02%和18.45%(<0.05)。0 MPa至-0.8 MPa胁迫时,甘农3号的根系活力显著高于陇中苜蓿和陇东苜蓿;-1.2 MPa至-1.6 MPa胁迫时,供试苜蓿的根系活力变化差异不显著。-2.0 MPa胁迫时,陇东苜蓿和甘农3号的根系活力显著降低,分别较0 MPa下降了20.96%和69.38%(<0.05),而陇中苜蓿与0 MPa相比差异不显著。
干旱胁迫显著增加了供试苜蓿根系的游离脯氨酸(Pro)含量(图2-B)。0 MPa胁迫时,陇中苜蓿根系的Pro含量显著低于陇东苜蓿和甘农3号(<0.05)。-0.4 MPa胁迫时,陇中苜蓿、陇东苜蓿和甘农3号的根系Pro含量均显著增加,增幅分别为631.66%、104.91%和86.31%(<0.05)。-0.4 MPa至-2.0 MPa胁迫时,供试苜蓿根系的Pro含量均显著增加,但品种间差异不显著。
随胁迫程度的增加,陇中苜蓿根系的可溶性蛋白(SP)含量先增后降,陇东苜蓿的SP含量仅在-2.0 MPa胁迫时显著降低,而甘农3号的SP含量未发生显著变化(图2-C)。陇中苜蓿根系的SP含量在-0.8 MPa胁迫时增至最高值,增幅为117.39%(<0.05)。除-1.2 MPa外,陇中苜蓿和陇东苜蓿根系的SP含量均显著低于甘农3号。

图2 干旱胁迫对不同抗旱性苜蓿根系活力、游离脯氨酸、可溶性蛋白和可溶性糖含量的影响
供试苜蓿根系的可溶性糖(SS)含量随胁迫程度加剧先增后降(图2-D)。-0.4 MPa胁迫时,陇中苜蓿、陇东苜蓿和甘农3号根系的SS含量均显著增加,且后两者增至最大值,增幅分别为126.57%和67.11%(<0.05);陇中苜蓿根系的SS含量在-1.6 MPa胁迫时增至最大,增幅为316.97%(<0.05)。除-1.2 MPa和-1.6 MPa外,陇中苜蓿和陇东苜蓿根系的SS含量均显著低于甘农3号。
2.3 干旱胁迫对不同抗旱性苜蓿品种根系MDA含量和质膜相对透性的影响
干旱胁迫显著增加了供试苜蓿根系的MDA含量和质膜相对透性(图3-A,B)。陇中苜蓿、陇东苜蓿和甘农3号的MDA含量和质膜相对透性在-0.4 MPa下开始显著增加,且在-2.0 MPa胁迫时增至最大值,增幅分别为158.32%、101.06%和143.60%(<0.05)。除-1.6 MPa胁迫外,陇中苜蓿的MDA含量均显著低于陇东苜蓿和甘农3号。陇中苜蓿的质膜相对透性在-0.4 MPa、-0.8 MPa和-2.0 MPa胁迫时均显著低于陇东苜蓿(<0.05);而与甘农3号差异不显著(>0.05)。
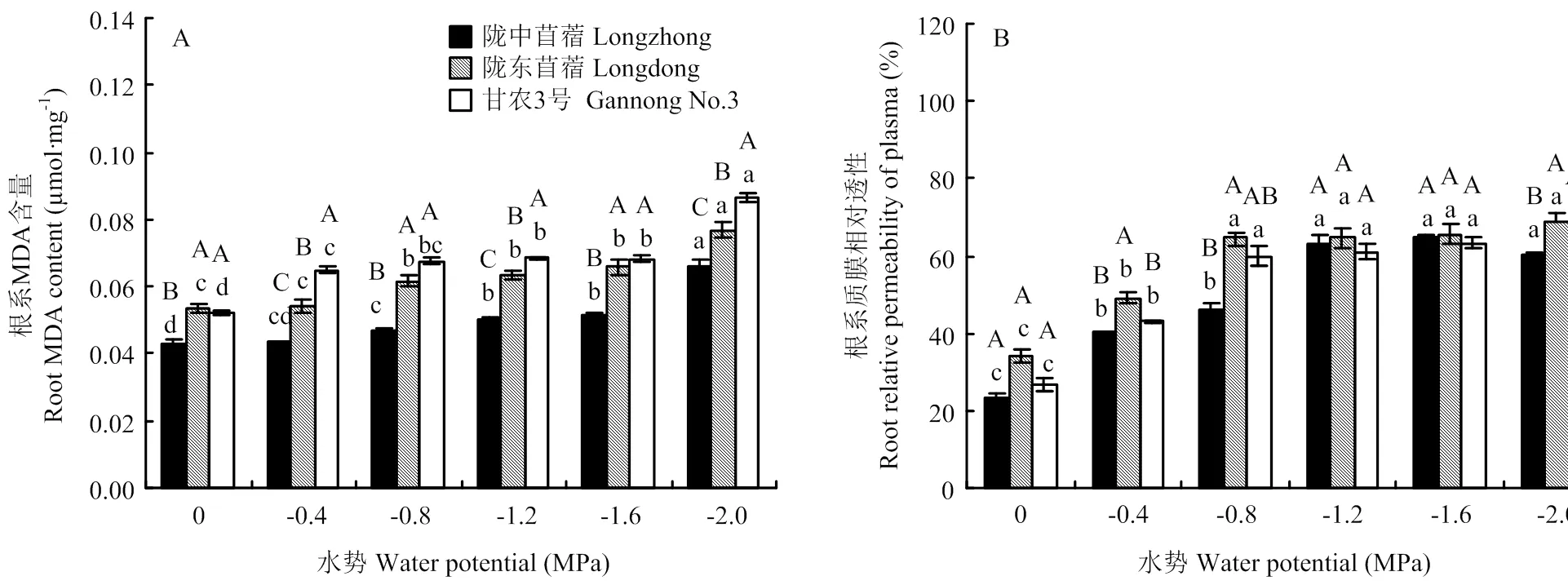
图3 干旱胁迫对不同抗旱性苜蓿根系MDA含量和质膜相对透性的影响
2.4 干旱胁迫对不同抗旱性苜蓿品种根系活性氧含量和抗氧化酶活性的影响
2.4.1 过氧化氢(H2O2)含量 供试苜蓿根系的H2O2含量随胁迫程度加剧而不断增加(图4-A)。陇中苜蓿和甘农3号根系的H2O2含量在-0.8 MPa胁迫时显著增加;而陇东苜蓿的H2O2含量则在-1.2 MPa胁迫时显著增加。-0.4 MPa至-0.8 MPa胁迫时,供试苜蓿根系的H2O2含量差异不显著;而在-1.6 MPa至-2.0 MPa胁迫时,陇中苜蓿根系的H2O2含量显著低于陇东苜蓿和甘农3号(<0.05)。
2.4.2 羟自由基(OH·)浓度 供试苜蓿根系的OH·浓度随胁迫程度加剧而不断增加(图4-B)。-0.4 MPa至-2.0 MPa胁迫时,陇东苜蓿的OH·浓度均显著增加,而甘农3号的OH·浓度未发生显著变化;陇中苜蓿根系的OH·浓度仅在-0.8 MPa显著增加,增幅为65.60%(<0.05)。除-0.8 MPa外,陇东苜蓿的OH·浓度在其他胁迫处理下均显著高于陇中苜蓿和甘农3号,而后两者的OH·浓度差异不显著。
2.4.3 超氧阴离子自由基(O2•-)产生速率 供试苜蓿根系O2•-产生速率随胁迫程度增加而增加(图4-C)。甘农3号根系的O2•-产生速率在-0.4 MPa胁迫时显著增加,而陇中苜蓿和陇东苜蓿则在-1.2 MPa胁迫时显著增加。-0.4 MPa至-1.6 MPa胁迫时,陇中苜蓿根系的O2•-产生速率显著低于甘农3号,而与陇东苜蓿差异不显著。-2.0 MPa胁迫时,陇中苜蓿、陇东苜蓿和甘农3号根系的O2•-产生速率均增至最大值,但品种间差异不显著。
2.4.4 超氧化物歧化酶(SOD)活性 随胁迫程度加剧,陇中苜蓿和陇东苜蓿根系的SOD活性先升后降,而甘农3号则呈“降-升-降”的变化趋势(图4-D)。-0.4 MPa胁迫时,陇东苜蓿根系的SOD活性开始显著增加,而陇中苜蓿和甘农3号根系的SOD活性未发生显著变化。-1.2 MPa胁迫时,陇中苜蓿,陇东苜蓿和甘农3号根系的SOD活性均增至最高值,增幅分别为137.40%、51.79%和23.14%(<0.05)。-1.6 MPa至-2.0 MPa胁迫时,和对照(0 MPa)相比,陇中苜蓿根系的SOD活性仍显著增加,而陇东苜蓿和甘农3号根系的SOD活性差异不显著。
2.4.5 过氧化物酶(POD)活性 随胁迫程度加剧,陇中苜蓿根系的POD活性先升后降,而陇东苜蓿和甘农3号根系的POD活性不断下降(图4-E)。甘农3号根系的POD活性在-0.8 MPa胁迫时显著下降;而陇中苜蓿和陇东苜蓿根系的POD活性则在-1.2 MPa胁迫时显著下降(<0.05)。除-1.2 MPa和-1.6 MPa处理外,陇中苜蓿根系的POD活性在其他胁迫条件下均显著高于甘农3号。-2.0 MPa下,陇中苜蓿根系的POD活性分别较陇东苜蓿和甘农3号高出7.55%和4.70%(<0.05)。

2.4.6 过氧化氢酶(CAT)活性 供试苜蓿根系的CAT活性随胁迫程度加剧均不断升高(图4-F)。-0.4 MPa胁迫时,陇东苜蓿根系的CAT活性显著增加,且在-1.6 MPa时增至最高值,增幅为239.36%(<0.05)。-1.2 MPa胁迫时,陇中苜蓿和甘农3号根系的CAT活性显著增加,且在-2.0 MPa时增至最高值,增幅分别为599.60%和424.16%(<0.05)。0 MPa至-0.8 MPa胁迫时,陇东苜蓿根系的CAT活性显著高于陇中苜蓿和甘农3号;而在-1.2 MPa和-2.0 MPa胁迫时,陇中苜蓿根系的CAT活性则显著高于陇东苜蓿。
2.5 干旱胁迫对不同抗旱性苜蓿品种根系还原型抗坏血酸(AsA)和还原型谷胱甘肽(GSH)的影响
随胁迫程度加剧,陇中苜蓿根系的AsA含量不断增加,而陇东苜蓿和甘农3号根系的AsA含量先增后降(图5-A)。-0.4 MPa胁迫时,甘农3号根系的AsA含量开始显著增加。-1.6 MPa胁迫时,陇中苜蓿,陇东苜蓿和甘农3号根系的AsA含量增至最大值,增幅分别为426.69%、364.47%和223.79%(<0.05)。-0.4 MPa至-0.8 MPa胁迫时,甘农3号根系的AsA含量显著高于陇中苜蓿和陇东苜蓿;而在-2.0 MPa胁迫时,却显著低于陇中苜蓿和陇东苜蓿。
供试苜蓿根系的GSH含量随胁迫程度增加呈先增加后下降的趋势(图5-B)。-0.4 MPa胁迫时,陇中苜蓿、陇东苜蓿和甘农3号根系的GSH含量均显著增加,且在-1.6 MPa胁迫时增至最大值,增幅分别为47.67、28.99和28.16倍(<0.05)。陇中苜蓿根系的GSH含量在-1.2 MPa胁迫时分别较陇东苜蓿和甘农3号高出44.78%和34.01%(<0.05);而-2.0 MPa胁迫时,仅较甘农3号高出93.12%(<0.05)。
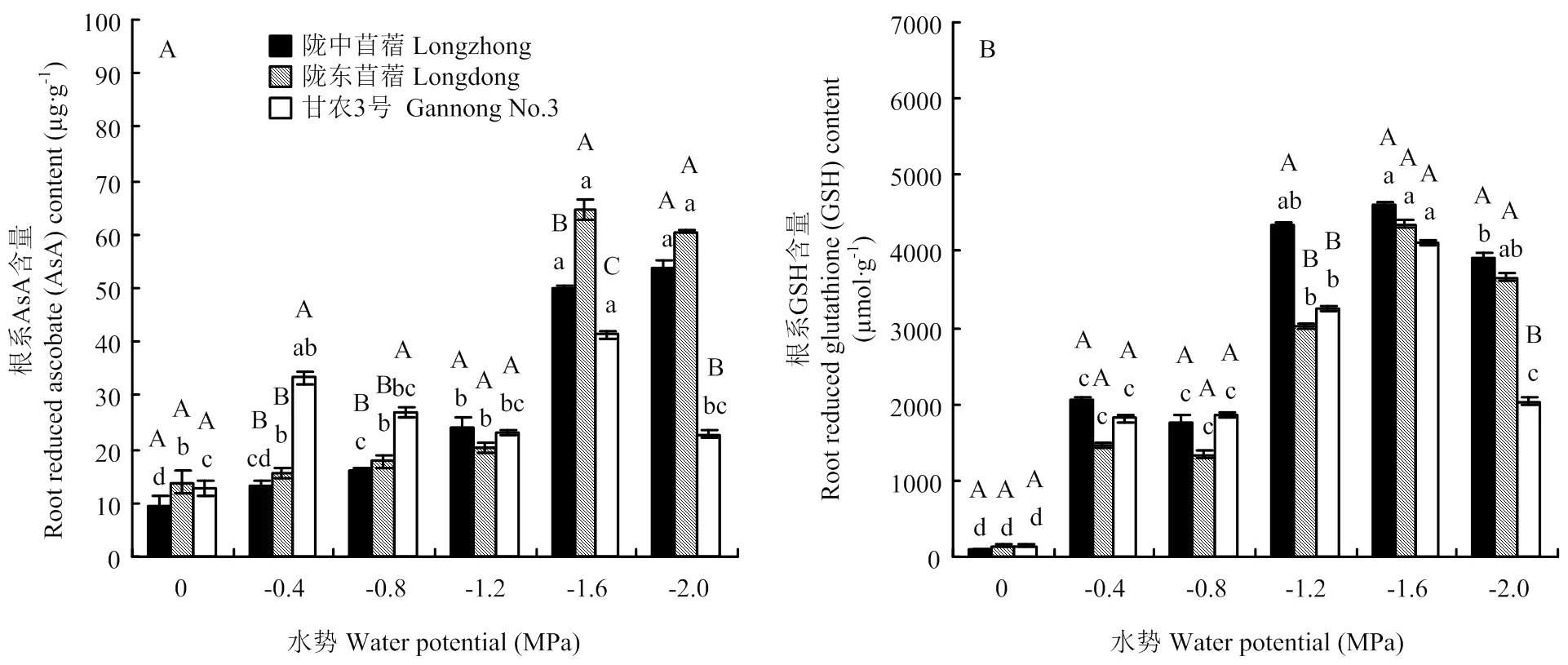
图5 干旱胁迫对不同抗旱性苜蓿品种根系还原型抗坏血酸 (AsA)和还原型谷胱甘肽 (GSH) 含量的影响
2.6 不同抗旱性苜蓿品种生长及生理指标与胁迫程度的逐步回归分析
如表1所示,采用逐步回归分析不同胁迫程度下对供试苜蓿品种抗旱性影响较为显著的指标。轻度胁迫(0 MPa至-0.4 MPa)下,根体积和根系活力是对陇中苜蓿抗旱性影响较显著的指标(2=0.999);根尖数是对陇东苜蓿抗旱性影响较显著的指标(2=0.985);MDA、GSH和质膜相对透性是对甘农3号抗旱性影响较显著的指标(2=1.000)。中度胁迫(-0.4 MPa至-1.2 MPa)下,MDA最能反映陇中苜蓿的抗旱能力(2=0.867);根系平均直径、O2•-、根系总表面积和CAT是对陇东苜蓿抗旱性影响较显著的指标(2=1.000);根系活力、可溶性糖和游离脯氨酸是对甘农3号抗旱性影响较显著的指标(2=0.991)。重度胁迫(-1.2 MPa至-2.0 MPa)下,根系总长度和AsA是对陇中苜蓿抗旱性影响较显著的指标(2=0.984);根尖数、GSH、CAT和根系干重是对陇东苜蓿抗旱性影响较显著的指标(2=0.999);根尖数和GSH是对甘农3号抗旱性影响较显著的指标(2=0.989)。

表1 不同抗旱性苜蓿品种生长及生理指标与胁迫程度的逐步回归分析
Y代表不同胁迫程度。X代表所测定的不同抗旱性苜蓿品种根系生长及生理参数,包括根系干重(X1)、根系总长度(X2)、根系总表面积(X3)、根系平均直径(X4)、根体积(X5)、根尖数(X6)、根系活力(X7)、游离脯氨酸(X8)、可溶性蛋白(X9)、可溶性糖(X10)、MDA(X11)、质膜相对透性(X12)、过氧化氢(H2O2)含量(X13)、羟自由基(OH•)浓度(X14)、超氧阴离子自由基(O2•-)产生速率(X15)、SOD(X16)、POD(X17)、CAT(X18)、还原型抗坏血酸(AsA)含量(X19)和还原型谷胱甘肽(GSH)含量(X20)。**表示在<0.01差异显著
The letter Y represented different degrees of stress. The letter X represented growth and physiological parameters in roots of different drought-tolerant alfalfa varieties, including root dry weight (X1), total root length (X2), total root surface area (X3), average root diameter (X4), root volume (X5), root tip number (X6), root activity (X7), free proline (X8), soluble protein (X9), soluble sugar (X10), MDA (X11), relative permeability of plasma (X12), H2O2(X13), OH•(X14), O2•-(X15), SOD (X16), POD (X17), CAT (X18), AsA (X19), and GSH (X20). ** represents significantly different at<0.01
3 讨论
3.1 干旱胁迫对不同抗旱性苜蓿品种幼苗根系生长特征的影响
根系是植物吸收水分和养分的主要部位,也是对干旱胁迫最先起反应的部位。根系感受逆境信号后,通过信号分子的转导,调节细胞内抗逆相关酶及蛋白的表达,进而调整自身的生理状态;通过代谢途径和方向的改变来影响碳同化产物在不同器官中的分配比例,最终又会影响根系生长,并从形态和分布上来适应环境胁迫[44-45]。在干旱环境中,根系的下扎深度、根系分支和根毛的形成直接关系到作物对土壤水分的吸收和利用,较长的根系、较大的根系表面积和根体积有利于作物大范围的吸收土壤水分和养分[4, 45]。厉广辉等[10]和Pirnajmedin等[46]研究认为根系干重、根系体积、根系总吸收面积与品种抗旱能力呈显著正相关。WANG等[11]研究发现,干旱胁迫显著降低了高羊茅的根系生物量和根系总长度,而抗旱型品种的根系生物量和根系总长度降幅较小。丁红等[45]研究发现干旱胁迫降低了干旱敏感型花生品种的根系总表面积,而增加了抗旱型花生品种的根系总表面积。李文娆等[25]研究表明,干旱胁迫显著增加了紫花苜蓿根系表面积。本研究表明,干旱胁迫下,陇中苜蓿和陇东苜蓿的根系总长度和根系干重显著增加;陇东苜蓿和甘农3号的根系总表面积显著下降,而陇中苜蓿的根系总表面积未发生显著变化。说明增加根部生物量和功能根长度是苜蓿适应干旱胁迫的一种重要的根系生长机制,Erice等[16],陈积山等[17]和王富贵等[18]研究也得出过相似的结果。-0.4 MPa胁迫时,供试苜蓿的根系活力和陇中苜蓿的根系平均直径、根体积、根尖数均显著增加;随胁迫程度增加(-0.8 MPa至-2.0 MPa胁迫),供试苜蓿品种的根系活力、根系平均直径、根体积和根尖数均显著下降。以上结果说明低强度的干旱胁迫可能会提高苜蓿幼苗的根系活力,以弥补根系总表面积减小带来的水分吸收的损失,从而促进根系生长;而重度胁迫则会抑制苜蓿根系的生长,这与马富举[47]等在小麦上的研究结果类似。整个胁迫期间,陇中苜蓿根系干重和根系总长度的增幅最高;重度胁迫下,供试苜蓿品种的根系平均直径、根体积、根尖数和根系活力均显著下降,但以陇中苜蓿的降幅最低,甘农3号的降幅最高。说明干旱胁迫下,根系生物量和根系长度的增加、维持较大的根系平均直径、根系表面积、根体积和较高的根系活力等可能是抗旱型苜蓿品种抗旱能力较强的重要原因。
3.2 干旱胁迫对不同抗旱性苜蓿品种幼苗根系生理特性的影响
植物根系对干旱胁迫的生理抗性主要包括渗透调节作用、启动保护酶系统、活性氧(ROS)代谢、改变膜结构与功能、产生抗逆蛋白以及合成根系生物活性物质等[13]。渗透调节是植物在干旱胁迫下降低渗透势、抵抗逆境胁迫的一种重要方式,植物通过主动积累溶质来降低渗透势,从而降低水势,维持细胞膨压[48]。脯氨酸作为生物体内重要的渗透剂和有效的羟基自由基清除剂,能够保护植物免受氧化胁迫的损伤[49]。干旱胁迫下,可溶性糖含量的增加主要是通过不溶性碳水化合物的降解及其转化[50]。前人研究表明干旱胁迫下,苜蓿可通过重新分配叶片和根系中的可溶性糖和贮藏蛋白的含量,以保证具有光合活性的新叶的生长和发育[16]。Majid等[51]研究发现,干旱胁迫下,引进苜蓿品种Hunterfield和Hyb555根系中可溶性糖积累量高于地方品种Gabès,但相比之下,引进苜蓿品种叶片衰老速度和新叶产生难度增加。本研究发现,供试苜蓿根系的游离脯氨酸含量在干旱胁迫下均显著增加,但品种间差异不显著,说明脯氨酸可能是苜蓿在干旱胁迫时维持细胞膨压所需的一种主要的渗透调节物质,韩瑞宏等[21]和余玲等[52]研究也得出过类似的结论。此外,正常水分条件下,甘农3号的可溶性糖和可溶性蛋白含量均显著高于陇中苜蓿和陇东苜蓿;随胁迫程度增加,陇中苜蓿和陇东苜蓿的可溶性糖和可溶性蛋白含量有所增加,而甘农3号却未发生显著变化。说明干旱胁迫下,苜蓿品种的渗透调节能力因品种不同而异,陇中苜蓿和陇东苜蓿主要通过增强其根系的渗透调节能力抵御干旱;而甘农3号根系本身具有较高的渗透调节物质含量以适应干旱胁迫,但根系中过多的可溶性糖和可溶性蛋白分配量可能会间接影响到其地上部的生长及植株适应干旱的能力[51]。整体而言,-0.4 MPa至-1.6 MPa胁迫时,陇中苜蓿根系的渗透调节物质(Pro,SP和SS)含量均低于陇东苜蓿和甘农3号,但增幅却高于其他两个苜蓿品种。说明较强的渗透调节能力是强抗旱陇中苜蓿根系适应干旱胁迫的一种重要的生理机制。
正常情况下,植物细胞中具有有效的抗氧化系统,使得活性氧产生与清除能够保持平衡;而在干旱胁迫下,当细胞失水达到一定程度时,植物体内产生的活性氧超出了活性氧清除系统的能力时,就会引起活性氧的大量积累。活性氧包括超氧自由基(O2•-)、H2O2、单线态氧(O21)和羟自由基(OH·),这些自由基的产生将导致生物膜脂过氧化、蛋白质变性、核酸降解以及光合受阻等多种有害的细胞学效应,从而使细胞膜透性增加,细胞功能失常,植物细胞遭受氧化胁迫[13, 50]。植物体内的抗氧化防御系统是由一些清除活性氧的酶类和抗氧化物质组成,如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、还原型抗坏血酸(AsA)和谷胱甘肽(GSH)等[53]。SOD作为植物活性氧代谢的关键酶,负责催化植物体内分子氧活化的第1个中间产物O2•-的歧化反应而形成 H2O2和O2,而CAT和POD主要负责清除H2O2,从而保证较低的活性氧水平[54]。MDA含量和细胞膜相对透性反映了细胞膜脂过氧化的程度[13]。本研究发现,干旱胁迫显著增加了供试苜蓿根系的MDA含量和质膜相对透性,说明供试苜蓿的膜脂过氧化水平均随干旱胁迫程度增加而显著增加,这与以往的研究结果一致[20, 22]。此外,供试苜蓿根系的活性氧含量的变化规律与MDA含量、质膜相对透性一致,说明活性氧产生与膜脂过氧化程度密切相关。相比之下,陇中苜蓿根系的MDA含量低于陇东苜蓿和甘农3号,说明陇中苜蓿根系膜系统受到外界环境的伤害较小,能够保持较高的细胞膜相对完整性,间接地体现出较好的抗旱性。
抗旱品种的耐旱能力也与其体内有效的酶促清除系统密切相关。干旱胁迫下,抗旱性强的苜蓿品种叶片中的CAT、POD和SOD活性存有率高[55]。Shahidi等[12]研究表明,重度干旱胁迫会显著降低高羊茅和黑麦草的CAT活性和SOD活性,明显减弱其清除体内活性氧的能力。本研究发现,供试苜蓿根系活性氧的产生与清除系统的激活均因品种和胁迫程度不同而异。陇中苜蓿和陇东苜蓿的CAT活性及甘农3号根系的O2•-产生速率均在-0.4 MPa胁迫显著增加;而陇中苜蓿和陇东苜蓿根系的O2•-产生速率和甘农3号根系的CAT活性则在-1.2 MPa胁迫时显著增加。此外,干旱胁迫显著增加了供试苜蓿根系的H2O2含量、SOD活性、AsA含量和GSH含量。重度胁迫(-1.6 MPa至-2.0 MPa)时,陇中苜蓿的H2O2含量显著低于陇东苜蓿和甘农3号,而SOD活性增幅却高于陇东苜蓿和甘农3号。以上试验结果说明干旱胁迫下,甘农3号根系内活性氧含量变化较敏感,而陇中苜蓿和陇东苜蓿则最先启动抗氧化系统;当超过一定胁迫程度(水势低于-1.2 MPa)时,陇东苜蓿和甘农3号根系抗氧化系统清除体内多余活性氧的能力减弱,根系内H2O2含量显著增加,根系细胞的膜质过氧化程度增加;而陇中苜蓿仍能维持较高的SOD活性和较低的H2O2含量。整个胁迫期间,陇中苜蓿的抗氧化酶(SOD、POD和CAT)活性和抗氧化剂(AsA和GSH)含量增幅均高于陇东苜蓿和甘农3号。-2.0 MPa胁迫时,陇中苜蓿根系的POD活性和CAT活性显著高于陇东苜蓿,陇中苜蓿根系的AsA含量和GSH含量显著高于甘农3号。说明干旱胁迫下,相比陇东苜蓿和甘农3号,强抗旱陇中苜蓿具有较强的酶促及非酶促防御系统,能有效地清除活性氧,以保证体内较低的膜脂过氧化程度。前人在其他植物的研究中[12, 37, 54, 56]也发现抗旱植物品种体内具有较强的酶促及非酶促抗氧化系统以有效控制体内活性氧的水平。
3.3 干旱胁迫下不同抗旱性苜蓿品种根系的阶段性响应策略
Hsiao[57]和安玉艳等[58]认为植物应对干旱胁迫的反应会因胁迫程度和胁迫时间呈现出明显的阶段性特点,不同阶段植物抗旱策略的着重点不同。本研究发现,轻度胁迫(0 MPa至-0.4 MPa)下,强抗旱和中等抗旱苜蓿品种最先通过根系生长特征(如根体积和根尖数的变化)来适应干旱胁迫;而弱抗旱苜蓿品种甘农3号根系的膜系统的稳定性最先遭到破坏,膜脂过氧化程度增加。中度胁迫(-0.4 MPa至-1.2 MPa)下,陇中苜蓿的MDA含量最先受到影响;陇东苜蓿通过改变根系生长特征(根系平均直径和根系总表面积)及活性氧代谢相关指标(O2•-和CAT)来适应干旱;而弱抗旱苜蓿品种甘农3号主要通过改变根系活力及渗透调节物质的积累量来适应干旱。重度胁迫(-1.2 MPa至-2.0 MPa)下,陇中苜蓿通过增加根系长度和AsA含量适应干旱;陇东苜蓿主要通过增加根系生物量及启动酶促及非酶促系统中的关键指标抵御干旱;而甘农3号则通过增加根尖数及GSH含量来适应干旱。说明重度胁迫下,抗氧化剂(AsA和GSH)在苜蓿根系的抗氧化代谢中发挥着重要作用,但其对苜蓿抗旱性的影响程度因品种不同而异。以上试验结果表明,不同胁迫程度下,不同抗旱性苜蓿品种会启动不同的防御机制以响应干旱胁迫,而这些不同的防御机制的启动可能是由于品种本身适应或响应干旱胁迫的生理及分子机制差异造成[9]。因此,有关不同抗旱性苜蓿品种响应干旱胁迫的各生理指标间的相互作用机制及与不同生理特性相关的分子调控机制还需进一步深入研究。
4 结论
干旱胁迫会显著影响苜蓿的根系生长特征及生理特性。不同抗旱性苜蓿品种在形态特征和生理特性上对干旱胁迫存在相同和不同的生长及生理响应策略。轻度和中度胁迫(0—-1.2 MPa)下,强抗旱和中抗旱苜蓿品种主要通过改变根系生长特征(根系总长度、根体积和根尖数)及降低膜质过氧化程度来响应干旱,弱抗旱苜蓿品种则通过改变细胞膜系统稳定性、根系活力及渗透调节能力来适应干旱;重度胁迫(-1.2—-2.0 MPa)下,不同抗旱能力苜蓿品种均可通过改变根系生长特征和启动抗氧化系统来抵御干旱,其中强抗旱苜蓿品种主要通过增加根长和AsA含量来适应干旱,而中等抗旱和弱抗旱苜蓿品种主要通过增加根尖数和GSH含量来适应干旱。
[1] ANJUM S A, ASHRAF U, ZOHAIB A, TANVEER M, NAEEM M, ALI I, TABASSUM T, NAZIR U. Growth and developmental responses of crop plants under drought stress: a review., 2017, 104(3): 267-276.
[2] FANG Y, XIONG L. General mechanisms of drought response and their application in drought resistance improvement in plants., 2015, 72(4): 673-689.
[3] 潘晓迪, 张颖, 邵萌, 马黎明, 郭新宇. 作物根系结构对干旱胁迫的适应性研究进展. 中国农业科技导报, 2017, 19(2): 51-58.
PAN X D, ZHANG Y, SHAO M, MA L M, GUO X Y. Research progress on adaptive response of crop root structure to drought stress., 2017, 19(2): 51-58. (in Chinese)
[4] MORAN J F, BECANA M, ITURBE-ORMAETXE I, FRECHILLA S, KLUCAS R V, APARICIO-TEJO P. Drought induces oxidative stress in pea plants., 1994, 194(3): 346-352.
[5] 郭正刚, 张自和, 王锁民, 田福平. 不同紫花苜蓿品种在黄土高原丘陵区适应性的研究. 草业学报, 2003, 12(4): 45-50.
GUO Z G, ZHANG Z H, WANG S M, TIAN F P. Study on adaptability of nine lucerne varieties in hills and valleys of Loess Plateau., 2003, 12(4): 45-50. (in Chinese)
[6] BOYER J S. Plant productivity and environment., 1982, 218(4571): 443-448.
[7] BASBAG M, AYDIN A, SAKIROGLU M. Evaluating agronomic performance and investigating molecular structure of drought and heat tolerant wild alfalfa (L.) collection from the southeastern Turkey., 2017, 55(1): 1-14.
[8] 刘海臣, 杨文军, 张春兰, 霍红雁, 王澜, 张继星. 非生物胁迫下植物根系的蛋白质组学研究进展. 河南农业科学, 2016, 45(1): 8-14.
LIU H C, YANG W J, ZHANG C L, HUO H Y, WANG L, ZHANG J X. Advance in proteomics of plant roots under abiotic stress., 2016, 45(1):8-14. (in Chinese)
[9] 胡承伟, 张学昆, 邹锡玲, 程勇, 曾柳, 陆光远. PEG 模拟干旱胁迫下甘蓝型油菜的根系特性与抗旱性. 中国油料作物学报, 2013, 35(1): 48-53.
HU C W, ZHANG X K, ZOU X L, CHENG Y, ZENG L, LU G Y. Root structure and drought tolerance of rapeseed under PEG imposed drought., 2013, 35(1): 48-53. (in Chinese)
[10] 厉广辉, 万勇善, 刘风珍, 张昆. 不同抗旱性花生品种根系形态及生理特性. 作物学报, 2014, 40(3): 531-541.
LI G H, WAN Y S, LIU F Z, ZHANG K. Morphological and physiological traits of root in different drought resistant peanut cultivars., 2014, 40(3): 531-541. (in Chinese)
[11] WANG J P, BUGHRARA S S, NELSON C J. Morpho-physiological responses of several fescue grasses to drought stress., 2008, 43(3): 161-173.
[12] SHAHIDI R, YOSHIDA J, COUGNON M, REHEUL D, LABEKE M C V. Morpho-physiological responses to dehydration stress of perennial ryegrass and tall fescue genotypes., 2017, 44(6): 612-623.
[13] FAROOQ M, WAHID A, KOBAYASHI N, FUJITA D, BASRA S M A. Plant drought stress: Effects, mechanisms and management., 2009, 29(1): 185-212.
[14] 李文娆, 张岁岐, 山仑. 苜蓿叶片及根系对水分亏缺的生理生化响应. 草地学报, 2007, 15(4): 299-305.
LI W R, ZHANG S Q, SHAN L. Physiological and biochemical responses of leaves and roots of alfalfa (L.) to water stress., 2007, 15(4): 299-305. (in Chinese)
[15] 郭正刚, 张自和, 肖金玉, 侯扶江, 陆妮. 黄土高原丘陵沟壑区紫花苜蓿品种间根系发育能力的初步研究. 应用生态学报, 2002, 13(8):1007-1012.
GUO Z G, ZHANG Z H, XIAO J Y, HOU F J, LU N. Root system development ability of several alfalfa cultivars in the hilly and valley regions of Loess Plateau.,2002, 13(8): 1007-1012. (in Chinese)
[16] ERICE G, LOUAHLIA S, IRIGOYEN J J, SANCHEZDIAZ M, AVICE J C. Biomass partitioning, morphology and water status of four alfalfa genotypes submitted to progressive drought and subsequent recovery., 2010, 167(2): 114-120.
[17] 陈积山, 李锦华, 常根柱. 不同苜蓿品种根系形态结构的抗旱性分析. 内蒙古草业, 2008, 20(2): 41-44.
CHEN J S, LI J H, CHANG G Z. Drought resistance analysis of root morphology and structure of different alfalfa cultivars., 2008, 20(2): 41-44. (in Chinese)
[18] 王富贵, 于林清, 田自华, 苏东, 孙娟娟. 18个苜蓿品种根系特征及与地上生物量关系的研究. 中国草地学报, 2011, 33(4): 51-57.
WANG F G, YU L Q, TIAN Z H, SU D, SUN J J. Root characteristics and the relationship with yield of 18 alfalfa cultivars., 2011, 33(4): 51-57. (in Chinese)
[19] HAMIDI H, SAFARNEJAD A. Effect of drought stress on alfalfa cultivars (L.) in germination stage.-, 2010, 8(6):705-709.
[20] QUAN W L, LIU X, WANG H Q, CHAN Z L. Comparative physiological and transcriptional analyses of two contrasting drought tolerant alfalfa varieties., 2015, 6: 1-16.
[21] 韩瑞宏, 田华, 高桂娟, 卢欣石. 干旱胁迫下紫花苜蓿叶片水分代谢与两种渗透调节物质的变化. 华北农学报, 2008, 23(4): 140-144.
HAN R H, TIAN H, GAO G J, LU X S. Change of water metabolism and two osmotic adjustment substances in the leaves of alfalfa under drought stress., 2008, 23(4): 140-144. (in Chinese)
[22] BOLDAJI S A H, SAJEDI R H, FAHIMI H, SAADATMAND S. Water availability effects on antioxidant enzyme activities, lipid peroxidation, and reducing sugar contents of alfalfa (L.)., 2012, 34(3): 1177-1186.
[23] TANG L, CAI H, ZHAI H, BAI X. Overexpression ofWRKY20 enhances both drought and salt tolerance in transgenic alfalfa (L.)., 2014, 118(1): 77-86.
[24] MA Q L, KANG J M, LONG R C, CUI Y J, ZHANG T J, XIONG J B, YANG Q C, SUN Y. Proteomic analysis of salt and osmotic-drought stress in alfalfa seedlings., 2016, 15(10): 2266-2278.
[25] 李文娆, 张岁岐, 丁圣彦, 山仑. 干旱胁迫下紫花苜蓿根系形态变化及与水分利用的关系. 生态学报, 2010, 30(19): 5140-5150.
LI W R, ZHANG S Q, DING S Y, SHAN L. Root morphological variation and water use in alfalfa under drought stress., 2010, 30(19): 5140-5150. (in Chinese)
[26] KANG Y, HAN Y, TORRES-JEREZ I, WANG M, TANG Y, MONTEROS M, UDVARDI M. System responses to long-term drought and re-watering of two contrasting alfalfa varieties., 2011, 68(5): 871-889.
[27] KANG Y, UDVARDI M. Global regulation of reactive oxygen species scavenging genes in alfalfa root and shoot under gradual drought stress and recovery., 2012, 7(5): 539-543.
[28] 万素梅, 胡守林, 黄勤慧, 王龙昌,赵书珍,胡建宏. 不同紫花苜蓿品种根系发育能力的研究. 西北植物学报, 2004, 24(11): 2048-2052.
WAN S M, HU S L, HUANG Q H, WANG L C, ZHAO S Z, HU J H. Study on root system development ability of alfalfa cultivars., 2004 , 24(11): 2048-2052. (in Chinese)
[29] FAN J W, DU Y L, TURNER N C, WANG B R, FANG Y, XI Y, GUO X R, LI F M. Changes in root morphology and physiology to limited phosphorus and moisture in a locally-selected cultivar and an introduced cultivar ofL. growing in alkaline soil., 2015, 392(1/2): 215-226.
[30] 李超, 王育青, 高丽, 闫志坚. 九个苜蓿品种叶绿素荧光参数与叶水势日变化研究. 中国草地学报, 2012, 34(2): 23-29.
LI C, WANG Y Q, GAO L, YAN Z J. Studies on chlorophyll fluorescence characters and leaf water potential in nine alfalfa varieties., 2012, 34(2): 23-29. (in Chinese)
[31] 穆怀彬, 伏兵哲, 德英. PEG-6000胁迫下10个苜蓿品种幼苗期抗旱性比较. 草业科学, 2011, 28(10): 1809-1814.
MU H B, FU B Z, DE Y. Drought tolerance of alfalfa seedlings of 10 varieties under PEG-6000 stress., 2011, 28(10): 1809-1814. (in Chinese)
[32] NAGY Z, GALIBA G. Drought and salt tolerance are not necessarily linked: A study on wheat varieties differing in drought tolerance under consecutive water and salinity stresses., 1995, 145(1/2): 168-174.
[33] MICHEL B E, KAUFMANN M R. The osmotic potential of polyethylene glycol 6000., 1973, 51(5): 914-916.
[34] 邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2007.
ZOU Q.. Beijing: China Agriculture Press, 2007. (in Chinese)
[35] 李锦树, 王洪春, 王文英, 朱亚芳. 干旱对玉米叶片细胞透性及膜脂的影响. 植物生理学报, 1983(3): 223-229.
LI J S, WANG H C, WANG W Y, ZHU Y F. Effect of drought on the permeability and membrane lipid composition from maize leaves., 1983(3): 223-229. (in Chinese)
[36] WILLEKEN H, CHAMNONGPOL S, DAVEY M, SCHRAUDNER M, LANGEBARTELS C, VAN M M, INZE D, VAN C W. Catalase is a sink for H2O2and is indispensable for stress defence in C3 plants., 1997, 16(16): 4806-4816.
[37] LIU Y J, ZHAO Z G, SI J, DI C X, HAN J, AN L Z. Brassinosteroids alleviate chilling-induced oxidative damage by enhancing antioxidant defense system in suspension cultured cells of., 2009, 59(3): 207-214.
[38] ELSTNER E F, HEUPEL A. Formation of hydrogen peroxide by isolated cell walls from horseradish (Gilib.)., 1976, 130(2): 175-180.
[39] DE AZEVEDO NETO A D, PRISCO J T, ENEAS-FILHO J, MEDEIROS J V, GOMES-FILHO E. Hydrogen peroxide pre- treatment induces salt-stress acclimation in maize plants., 2005, 162(10): 1114-1122.
[40] GIANNOPOLITIS C N, RIES S K. Superoxide dismutases. I. Occurrence in higher plants., 1977, 59(2): 309-314.
[41] BEERS R F, SIZER I W. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase., 1952, 195(1): 133-140.
[42] LAW M Y, CHARLES S A, HALLIWELL B. Glutathione and ascorbic acid in spinach () chloroplasts. The effect of hydrogen peroxide and of paraquat., 1983, 210(3): 899-903.
[43] GRIFFITH O W. Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine., 1980, 106(1): 207-212.
[44] CHEN C W, YANG Y W, LUR H S, TSAI Y G, CHANG M C. A novel function of abscisic acid in the regulation of rice (L.) root growth and development., 2006, 47(1): 1-13.
[45] 丁红, 张智猛, 戴良香, 宋文武, 康涛, 慈敦伟. 不同抗旱性花生品种的根系形态发育及其对干旱胁迫的响应. 生态学报, 2013, 33(17): 5169-5176.
DING H, ZHANG Z M, DAI L X, SONG W W, KANG T, CI D W. Responses of root morphology of peanut varieties differing in drought tolerance to water-deficient stress., 2013, 33(17): 5169-5176. (in Chinese)
[46] PIRNAJMEDIN F, MAJIDI M M, GHEYSARI M. Root and physiological characteristics associated with drought tolerance in Iranian tall fescue., 2015, 202(1):141-155.
[47] 马富举, 李丹丹, 蔡剑, 姜东, 曹卫星, 戴廷波. 干旱胁迫对小麦幼苗根系生长和叶片光合作用的影响. 应用生态学报, 2012, 23(3): 724-730.
MA F J, LI D D, CAI J, JIANG D, CAO W X, DAI T B. Responses of wheat seedlings root growth and leaf photosynthesis to drought stress., 2012, 23(3): 724-730. (in Chinese)
[48] MORGAN J M, CONDON A G. Water use, grain yield, and osmoregulation in wheat., 1986, 13(4): 523-532.
[49] BEN R K, ABDELLY C, SAVOURE A. How reactive oxygen species and proline face stress together., 2014, 80: 278-284.
[50] GRIFFITHS H, PARRY M A J. Plant responses to water stress., 2002, 89(7): 801-802.
[51] MAJID M. Effect of salinity on sodium and chloride uptake, proline and soluble carbohydrate contents in three alfalfa varieties., 2012, 1(6): 1-6.
[52] 余玲, 王彦荣, Garnett T, Augicht G, 韩德梁. 紫花苜蓿不同品种对干旱胁迫的生理响应. 草业学报, 2006, 15(3): 75-85.
YU L, WANG Y R, GARNETT T, AUGICHT G, HAN D L. A study on physiological responses of varieties ofand their relationship with the drought resistance capacity under drought stress., 2006, 15(3): 75-85. (in Chinese)
[53] MITTLER R. Oxidative stress, antioxidants and stress tolerance., 2002, 7(9): 405-410.
[54] KARATAS I, ÖZTURK L, DEMIR Y, UNLUKARA A, KURUNC A, DUZDEMIR O. Alterations in antioxidant enzyme activities and proline content in pea leaves under long-term drought stress., 2014, 30(8): 693-700.
[55] 张新兰. 不同品种苜蓿叶片离体干旱胁迫过程中抗氧化酶活性动态. 草业科学, 2008, 25(2): 77-83.
ZHANG X L. Study on activity of antioxidative enzymes and drought resistance of alfalfa leaf under drought stress., 2008, 25(2): 77-83. (in Chinese)
[56] ABEDI T S U, PAKNIYAT H S U. Antioxidant enzyme changes in response to drought stress in ten cultivars of oilseed rape (L.)., 2010, 46(1): 27-34.
[57] HSIAO T C. Plant responses to water stress., 1973, 24: 519-570.
[58] 安玉艳, 梁宗锁. 植物应对干旱胁迫的阶段性策略. 应用生态学报, 2012, 23(10): 2907-2915.
AN Y Y, LIANG Z S. Staged strategy of plants in response to drought stress., 2012, 23(10): 2907-2915. (in Chinese)
(责任编辑 杨鑫浩)
Effects of Drought Stress on Root and Physiological Responses of Different Drought-Tolerant Alfalfa Varieties
ZHANG CuiMei, SHI ShangLi, WU Fang
(College of Grassland Science, Gansu Agricultural University/Key Laboratory of Grassland Ecosystem, Ministry of Education/Pratacultural Engineering Laboratory of Gansu Province/Sino-US Centers for Grazingland Ecosystem Sustainability, Lanzhou 730070)
【Objective】This study aimed to understand the differential growth and physiological response in roots of different drought-tolerant alfalfa varieties to drought stress, and to provide theoretical basis for further clarifying the molecular mechanism of alfalfa against drought and for improving drought tolerance and water use efficiency in alfalfa.【Method】In a sand culture experiment, three different drought-tolerant alfalfa varieties, includingL. cv. Longzhong (strong drought-tolerant),L. cv. Longdong (moderate drought-tolerant), andL. cv. Gannong No.3 (drought-susceptible), weretreated with drought stress induced by polyethylene glycol-6000 (PEG-6000) solutions of different osmotic potentials (0.0, -0.4, -0.8, -1.2, -1.6 and -2.0 MPa). The root growth characters of total root length, total root surface area, average root diameter, root volume, root tip number and root dry weight, root activity, the contents of free proline, soluble protein, and soluble sugar, relative permeability of plasma (RPP), the levels of malondialdehyde (MDA) and reactive oxygen species (ROS), the activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT), and reduced ascobate (AsA) and reduced glutathione (GSH) contents were measured at seedling stage. Moreover, stepwise regression analysis was used to establish the optimal regression equation that could select the influential indices for drought-tolerance of the alfalfa varieties under different drought stress levels.【Result】Drought stress has an obvious effect on growth and physiological traits of the alfalfa varieties.With increasing drought stress, the free proline contents, the levels of MDA, RPP and ROS (H2O2, OH· and O2•-), and CAT activity in roots of three alfalfa varieties were significantly increased, while root dry weight, root activity, and the contents of soluble sugar and GSH were firstly increased and then decreased. Additionally, as the osmotic potentials of solutions decreased, average root diameter, root volume, root tip number, POD and SOD activities of Longzhong increased first and then decreased, whereas the above first four indicators and total root surface area of Longdong and Gannong No.3decreased continuously. Moreover, with the increase of stress, the AsA content of Longzhong continuously increased but that of the other two varieties increased first and then decreased. Overall, total root length, total root surface area and root dry weight in roots of Longzhong were significantly greater than those of Longdong and Gannong No.3, while the H2O2and OH· levels in roots of Longzhong were significantly lower than those of Gannong No.3. The contents of soluble protein, soluble sugar and MDA in roots of Longzhong and Longdong were obviously lower than those of Gannong No.3. Underthe drought stress from -1.2 to -2.0 MPa, the H2O2and OH· contents in roots of Longzhong were significantly lower than those of Longdong. Under -2.0 MPa, the AsA and GSH contents and POD activity in roots of Longzhong were significantly higher than those of Gannong No.3. The result of stepwise regression analysis showed that root activity, root volume, total root length, MDA and AsA were the most influential indices for drought-tolerance of Longzhong; Root tip number, average root diameter, total root surface area, root dry weight, O2•-, GSH and CAT were the most influential indices for drought-tolerance of Longdong; and root activity, root tip number, free proline, soluble sugar, MDA, RPP and GSH were the most influential indices for drought-tolerance of Gannong No.3.【Conclusion】The alfalfa varieties with different drought-tolerance exhibit common and divergent responses to drought stress at the morphological and physiological levels. Under light and mild drought stress conditions (osmotic potentials decreased from 0 MPa to -1.2 MPa), drought-tolerant alfalfa varieties mainly adapted to drought by increasing the root length, root volume and root tip number and reducing the degree of membrane lipid peroxidation, while drought-susceptible alfalfa varieties adapted to drought by changing cell membrane stability, root activity and osmotic adjustment. Under severe drought stress (osmotic potentials declined from -1.2 MPa to -2.0 MPa), the alteration of root growth and activation of antioxidant system were common response mechanisms of tested alfalfa varieties. Furthermore, strong drought-tolerant alfalfa variety increased total root length and AsA content against drought stress, while moderate drought-tolerant and drought-susceptible alfalfa varieties increased root tip number and GSH content in response to drought stress.
alfalfa (L.); root system; PEG stress; root characteristics; physiological traits; differentiated response strategy
2017-07-14;
2017-12-06
牧草种质资源保护与利用(NB2130135)
张翠梅,E-mail:Zhangcm1710@163.com。
师尚礼,E-mail:shishl@gsau.edu.cn
