低中危组急性早幼粒细胞白血病患者双诱导治疗后加入细胞毒性药物时机的早期临床分析研究
2018-03-22李连文刘北忠陈建斌姚仕菲陈敏赵毅刘路钟梁
李连文 ,刘北忠,,陈建斌,姚仕菲,陈敏,赵毅,刘路,钟梁*
急性早幼粒细胞白血病(APL)是外周血、骨髓中异常早幼粒细胞增多、凝血功能异常、出现特异性染色体易位即t(15;17)(q22;q21)为特征的一类特殊类型急性白血病。随着全反式维甲酸(ATRA)及砷剂的引入,APL已由一类高致死性疾病发展为可获得较高治愈率的恶性血液肿瘤。如今,ATRA和三氧化二砷(ATO)已成为美国国立综合癌症网络(NCCN)推荐的APL诱导治疗一线用药[1]。虽然目前中国急性早幼粒细胞白血病诊疗指南(2014年版)中已明确诱导治疗过程仅高危组可加用细胞毒性药物[2],但仍普遍存在低中危组APL加用细胞毒性药物的情况,这是鉴于
ATRA和ATO双诱导治疗后存在早幼粒细胞的进一步分化,白细胞总数增高,有发生分化综合征(DS)的高风险,因此在ATRA和ATO双诱导治疗期间加用细胞毒性药物也是非常有必要的。但是,目前NCCN指南和APL中国诊疗指南并未明确指出何时使用细胞毒性药物,因此本研究就低中危组双诱导基础上何时加用细胞毒性药物进行分析探讨,以期发现更优的化疗方案,为临床治疗提供观点。
1 对象与方法
1.1 研究对象 选取2011年3月—2017年4月重庆医科大学附属第一医院收治的初诊APL患者36例。纳入标准:(1)符合中国急性早幼粒细胞白血病诊疗指南(2014年版)中关于APL的诊断标准[2];(2)符合低中危组危险分层即诱导治疗前外周血白细胞计数(WBC)≤10×109/L,血小板计数(PLT)≤40×109/L;(3)PML/RARA融合基因阳性;(4)无使用细胞毒性药物及ATO的心脏禁忌证;(5)无严重肝肾功能损害;(6)必须使用ATRA+ATO双诱导治疗。排除标准:(1)尚未进入诱导缓解治疗或者诱导治疗开始3 d死亡的APL患者;(2)诱导缓解阶段未使用细胞毒性药物;(3)单用ATO诱导或者单用ATRA诱导治疗。
1.2 临床资料搜集 回顾性收集研究对象的临床资料,包括性别、年龄、诱导缓解治疗方案以及每两天进行1次血常规检查、每3天进行1次凝血功能检测〔纤维蛋白原(FIB)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、D-二聚体、FIB降解产物(FDP)〕、每周进行1次肝肾功能检测等。患者均于治疗前行骨髓形态学和PML/RARA融合基因检测,并于治疗后28~30 d再次检测骨髓形态学。
1.3 分组 根据加入细胞毒性药物时外周血WBC,以不同的标准对患者进行分组:(1)(10~20)×109/L组 和 >20×109/L组;(2)(10~ 25)×109/L组和>25×109/L组;(3)(10~30)×109/L组和>30×109/L 组。
1.4 诱导治疗方案 ATRA 25~45 mg·(m2)-1·d-1口服28~40 d,ATO 10 mg/d静脉滴注28~35 d,两药均于骨髓形态学诊断APL当天使用。细胞毒性药物单加蒽环类患者:在双诱导治疗开始3 d后使用柔红霉素(DNR),最大量可达135 mg/m2,分3 d给予。蒽环类与阿糖胞苷类联用患者:蒽环类药物使用与单加蒽环类患者一致,阿糖胞苷100~200 mg·(m2)-1·d-1,使用7 d。
1.5 诱导化疗期间的支持治疗目标 维持PLT≥30×109/L;维持血红蛋白>70 g/L;输注新鲜冰冻血浆或冷沉淀纠正凝血功能,维持纤维蛋白原>1.5 g/L。
1.6 DS DS又称维甲酸综合征,临床表现为不明原因的发热、体质量增加超过5 kg、呼吸窘迫、肌肉骨骼疼痛、肺间质浸润、胸腔积液、心包积液、皮肤水肿、低血压、急性肾衰竭甚至死亡[3]。具备上诉至少两项临床症状,并排除肺出血、感染性休克、肺炎及心功能衰竭可考虑DS。针对DS的治疗包括:预防性应用糖皮质激素、暂停ATRA或者ATO的应用。
1.7 完全缓解(CR) 目前APL的CR标准为:白血病的症状和体征消失,外周血中性粒细胞绝对值≥1.5×109/L,PLT≥100×109/L,白细胞分类中无白血病细胞;骨髓中原粒+早幼粒≤5%,无Auer小体,红细胞及巨核细胞系正常;无髓外白血病[4]。
1.8 观察指标 治疗后28 d开始进行疗效评估,评估指标:(1)CR情况:各组CR率,达CR所需时间;生存情况:各组中早期死亡率、死亡原因;凝血功能异常持续时间。(2)诱导期间的不良反应:①各组平均WBC峰值;②肝功异常;③化疗药物使用后DS发生情况;④3~4级骨髓抑制发生情况,骨髓抑制的诊断标准参考世界卫生组织(WHO)抗癌药物急性及亚急性毒性反应分度标准[5]。
1.8.1 凝血功能异常 凝血功能指标参考范围:FIB 2.0~4.4 g/L,PT 9~12 s,APTT 28~41 s,凝血酶原活动度(PTA)80%~160%,国际标准化比值(INR)0.8~1.4,D-二聚体0~1.0 mg/L,PLT(100~300)×109/L,凝血酶时间(TT)16~18 s。当PT延长3 s或APTT延长10 s或其他项目超过参考范围即为凝血功能异常。
1.8.2 肝功异常 肝功指标参考范围:丙氨酸氨基转移酶(ALT)10~40 U/L,天冬氨酸氨基转移酶(AST)10~40 U/L,总胆红素3.4~17.1 μmol/L,γ-谷氨酸转移酶(GGT):11~50 U/L(男性)或7~32 U/L(女性),碱性磷酸酶(AKP):<500 U/L(1~12岁)或40~150 U/L(女性>12岁)或<700 U/L(男性12~15岁)或40~150 U/L(男性>15岁)。超过正常范围即为异常。
1.9 统计学方法 采用SPSS 18.0软件进行统计学分析,符合正态分布的计量资料以(x± s)表示,两组间比较采用独立样本t检验;非正态分布的计量资料以中位数(M)表示,两组间比较采用秩和检验;计数资料的分析采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 基本情况 36例患者中男12例,女24例;年龄(29.1±11.9)岁;初诊时 WBC(1.38±0.80)×109/L,PLT(29.3±9.5)×109/L,感染8例(22.2%),肝功异常4例(11.1%);病程中感染30例(83.3%),肝功异常26例(72.2%),发生DS 12例(33.3%),3~4级骨髓抑制23例(63.9%),无一例诱导期间死亡。(10~20)×109/L组和>20×109/L组、(10~25)×109/L组和>25×109/L组、(10~30)×109/L组和>30×109/L组性别、年龄、初诊时WBC、PLT、感染发生率、肝功异常率比较,差异均无统计学意义(P>0.05,见表1)。
2.2 诱 导 缓 解 情 况 (10~20)×109/L组 和>20×109/L组达CR所需时间比较,差异有统计学意义(P<0.05);两组CR率、凝血功能异常持续时间比较,差异均无统计学意义(P>0.05)。(10~25)×109/L组和>25×109/L组、(10~30)×109/L组和>30×109/L组CR率、达CR所需时间、凝血功能异常持续时间比较,差异均无统计学意义(P>0.05,见表2)。2.3 不 良 反 应 情 况 (10~20)×109/L组 和>20×109/L组、(10~25)×109/L组和>25×109/L组、(10~30)×109/L组和>30×109/L组平均WBC峰值比较,差异均有统计学意义(P<0.050);(10~20)×109/L组和>20×109/L组、(10~25)×109/L组和>25×109/L组、(10~30)×109/L组和>30×109/L组DS发生率、感染发生率、肝功异常率、3~4级骨髓抑制发生率比较,差异均无统计学意义(P>0.05,见表3)。
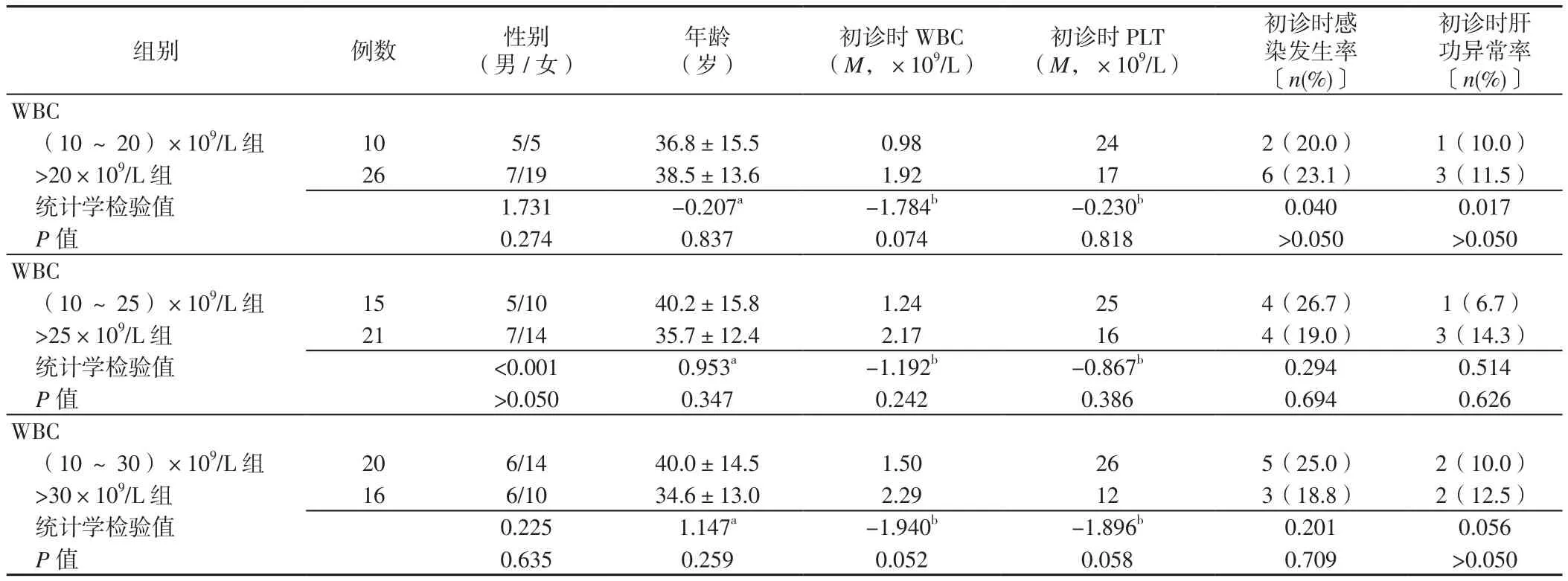
表1 不同分组标准的APL患者临床特征比较Table 1 Comparison of clinical characteristics of APL patients with different grouping criteria
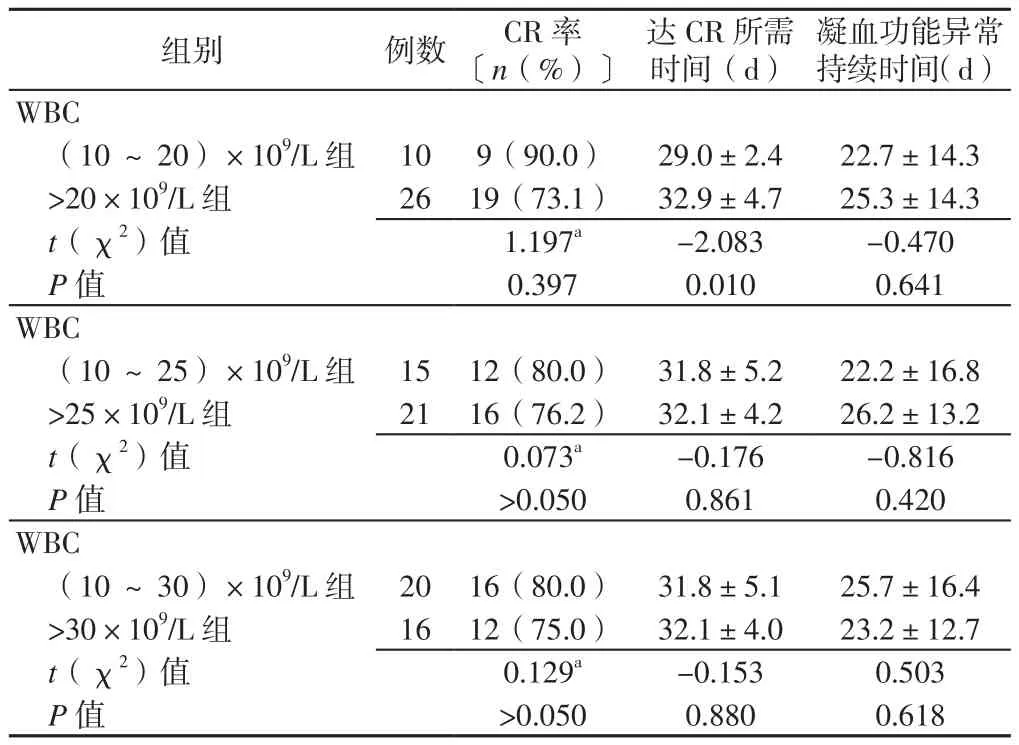
表2 不同分组标准的APL患者诱导缓解情况比较Table 2 Comparison of induction of remission in APL patients with different grouping criteria
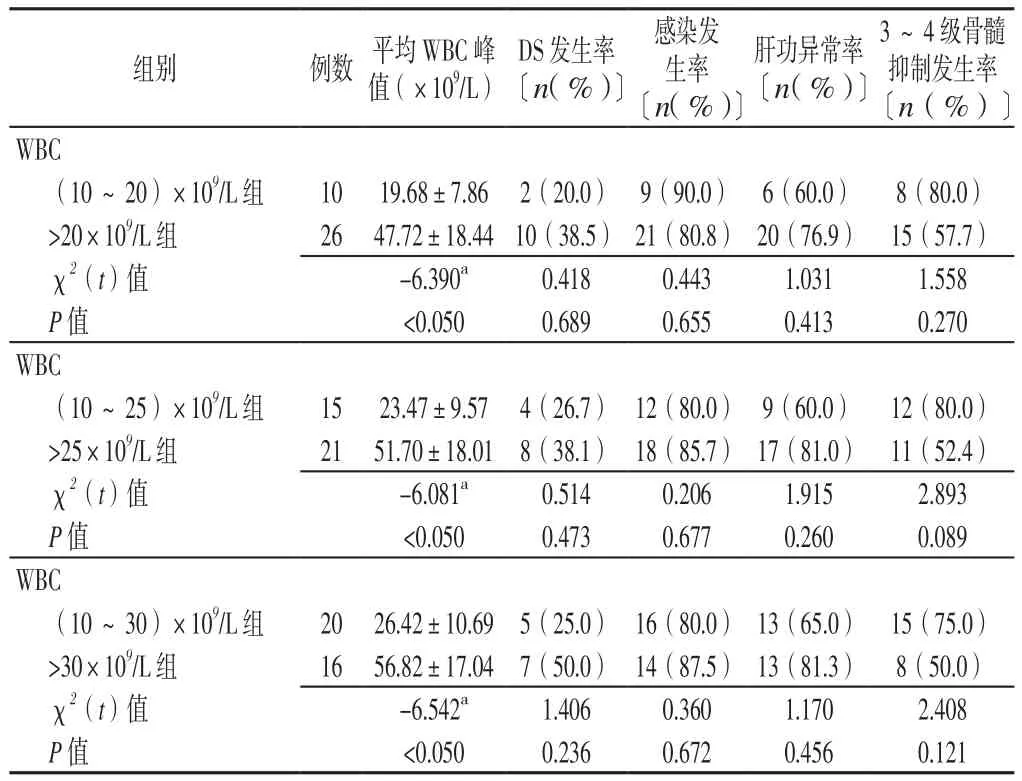
表3 不同分组标准的APL患者不良反应情况比较Table 3 Comparison of adverse reactions in APL patients with different grouping criteria
3 讨论
尽管低中危组APL患者治疗前外周血WBC≤10×109/L,但随着ATO以及ATRA诱导分化治疗后骨髓中大量白细胞释放入外周血,而使外周血WBC快速上升,有相关研究显示93%的患者病程中的最高值出现在诱导缓解治疗后[6],而外周血WBC越高,就越容易发生DS、中枢浸润、出血和感染,严重者还可导致死亡[7-9],因此不管是低中危组还是高危组APL患者在ATO以及ATRA诱导治疗后加入细胞毒性药物是很有必要的。
虽然当前的APL中国诊疗指南将ATRA以及ATO联合细胞毒性药物作为APL诱导化疗的一类推荐方案,但关于以蒽环类药物为主的细胞毒性药物在低中危组中的具体给药时机也未给出具体说明[2]。目前国内外关于低中危诱导治疗期间何时予以细胞毒性药物尚缺乏相关研究报道,较早前有研究认为低中危患者应以外周血WBC>5×109/L 时予以化疗[10],许芳[11]的研究证明外周血WBC诱导分化至(4~15)×109/L时予以细胞毒性药物化疗可获得最佳早期生存受益,但国内目前仍以外周血WBC>10×109/L时加用细胞毒性药物居多,且鉴于外周血WBC在(4~10)×109/L为正常水平,而细胞毒性药物不良反应大,为避免不必要的临床用药以及保证患者利益最大化,故本研究重新针对低中危APL患者的化疗时机进行分析,从CR情况、凝血象异常持续时间、外周血WBC峰值、DS发生率、感染发生率、肝功异常率以及3~4级骨髓抑制率进行探讨细胞毒性药物可能的最佳给予时机。
本研究中DS发生率为33.3%,稍高于大型临床试验LPA96与LPA99报道的DS发生率为24.8%[12],这可能与DS最低诊断标准的不一致以及区域间的医疗资源不对等而导致临床试验数据有所差异。本研究结果显示:当WBC在(10~20)×109/L时予以细胞毒性药物可获得较短的达CR所需时间和较低的WBC峰值,王怀宇等[6]研究也证实APL整个病程中各时间点的外周血WBC均与患者早期死亡率密切相关,有效控制外周血WBC可能降低APL早期死亡率;此外在此时给药还可获得相对较高的CR率以及较低的DS发生率,而在凝血功能异常持续时间、感染发生率、肝功异常率以及3~4级骨髓抑制率均无差异。而当WBC>20×109/L再给药,虽然感染发生率、肝功异常率以及3~4级骨髓抑制率稍微有所降低,但差异无统计学意义,其DS发生率也随之升高,凝血功能异常持续时间也有所延长,同时也可使WBC峰值、DS发生率升高,而使CR率下降,达CR所需时间延长。再者,许芳[11]研究已证明在外周血WBC<4×109/L时加用细胞毒性药物虽降低DS相关的早期死亡风险,但同时也会增加患者感染风险从而影响CR率。因此可见WBC在(10~20)×109/L时加用细胞毒性药物可获得相对较佳的早期疗效。
出现以上结果的原因可能有:(1)WBC诱导至过高水平时才予以细胞毒性药物使大量分化后的白细胞释放入血后,可致外周血WBC在短时间内极大升高,导致DS发生的风险也升高,而高白细胞血症所致的凝血功能紊乱也会持续存在,不易纠正[13-14];(2)由于细胞毒性药物较强的细胞免疫抑制作用,在(10~20)×109/L时予以细胞毒性药物可快速降低外周血WBC及PLT水平,因此导致3~4级骨髓抑制发生率稍有升高,但可予以粒细胞刺激因子以及输注血制品而加以纠正,因此患者对骨髓抑制可耐受;(3)相关的多因素研究分析显示发病时危险度分层并非DS发生、早期死亡以及早期诱导治疗失败的独立危险因素,最重要的影响因素仍然是细胞毒性药物给药时的外周血WBC[10]。此外,本研究提示病程中感染发生率以及肝功异常率较初诊时明显升高,可能与ATO的肝脏毒性以及诱导治疗后免疫力低下有关[10,15]。
因此,对低中危APL患者进行ATO和ATRA双诱导治疗至外周血WBC介于(10~20)×109/L时予以细胞毒性药物治疗可获得最佳的早期生存受益。但鉴于目前关于APL的治疗争议较多,本研究仅对低中危APL诱导缓解治疗阶段的疗效进行了分析,且本研究为回顾性分析,样本量少,结果有待进一步考证。
作者贡献:李连文作为试验设计和试验研究的执行人,完成数据分析,论文初稿的写作;姚仕菲、陈敏、赵毅、刘路参与试验设计、试验结果分析;刘北忠、陈建斌参与指导试验设计;钟梁为项目的构思者及负责人,指导数据分析、论文写作与修改。
本文无利益冲突。
[1]O'DONNELL M R,TALLMAN M S,ABBOUD C N,et al.Acute myeloid leukemia,Version 3.2017,NCCN Clinical Practice Guidelines in Oncology[J].J Natl Compr Canc Netw,2017,15(7):926-957.DOI:10.6004/jnccn.2017.0116.
[2]中华医学会血液学分会,中国医师协会血液科医师分会.中国急性早幼粒细胞白血病诊疗指南(2014年版)[J].中华血液学杂志,2014,35(5):475-477.DOI:10.3760/cma.j.issn.0253-2727.2014.05.024.Chinese Society of Hematology,Chinese Medical Association& Chinese Society of Hematologist,Chinese Medical Doctor Association.Chinese guidelines for diagnosis and treatment of acute promyelocytic leukemia(2014)[J].Chinese Journal of Hematology,2014,35(5):475-477.DOI:10.3760/cma.j.issn.0253-2727.2014.05.024.
[3]FRANKEL S R,EARDLEY A,HELLER G,et al.All-transretinoic acid for acute promyelocyticleukemia.Results of the New York Study[J].Ann Intern Med,1994,120(4):278-286.DOI:10.7326/0003-4819-120-4-199402150-00004.
[4]葛均波,徐永健.内科学[M].8版.北京:人民卫生出版社,2013:584.GE J B,XU Y J.Internal medicine[M].8th ed.Beijing:People's Medical Publishing House,2013:584.
[5]抗癌药急性及亚急性毒性反应分度标准(WHO标准)[J].癌症,1992(3):254.
[6]王怀宇,张欣欣,张慧云,等.急性早幼粒细胞白血病患者外周血白细胞计数与早期死亡率关系[J].中国实验血液学杂志,2017,25(3):718-722.DOI:10.7534 /j.issn.1009-2137.2017.03.015.WANG H Y,ZHANG X X,ZHANG H Y,et al.Relationship between peripheral blood white blood cell count andearly death rate in patients with acute promyelocytic leukemia[J].Journal of Experimental Hematology,2017,25(3):718-722.DOI:10.7534 /j.issn.1009-2137.2017.03.015.
[7]LO-COCO F,CICCONI L,BRECCIA M.Current standard treatment of adult acute promyelocytic leukaemia[J].Br J Haematol,2016,172(6):841-854.DOI:10.1111/bjh.13890.
[8]FALANGA A,RUSSO L,TARTARI C J.Pathogenesis and treatment of thrombo-hemorrhagic diathesis in acute promyelocytic leukemia[J].Mediterr J Hematol Infect Dis,2011,3(1):e2011068.DOI:10.1016/S0049-3848(14)50019-9.
[9]SANZ M A,MONTESINOS P.Open issues on bleeding and thrombosis in acute promyelocyticleukemia[J].Thromb Res,2010,125(Suppl 2):S51-54.DOI:10.1016/S0049-3848(10)70013-X.
[10]TALLMAN M S,ALTMAN J K.How I treat acute promyelocytic leukemia [J].Blood,2009,114(25):5126-5135.DOI:10.1182/blood-2009-07-216457.
[11]许芳.急性早幼粒细胞白血病诱导治疗优化策略的探讨[D].广州:南方医科大学,2015.XU F.Optimization of induction treatment in new diagnosed acute promyelocytic leukemia[D].Guangzhou:Southern Medical University,2015.
[12]MONTESINOS P,BERGUA J M,VELLENGA E,et al.Differentiation syndrome in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline chemotherapy:characteristics,outcome,and prognostic factors[J].Blood,2009,113(4):775-783.DOI:10.1182/blood-2008-07-168617.
[13]YANADA M,MATSUSHINTA T,ASOU N,et al.Severe hemorrhagic complications during remission induction therapy for acute promyelocytic leukemia:incidence,risk factors,and influence on outcome[J].Eur J Haematol,2007,78(3):213-219.DOI:10.1111/j.1600-0609.2006.00803.x.
[14]DALLY N,HOFFMAN R,HADDAD N,et al.Predictive factors of bleeding and thrombosis during induction therapy in acute promyelocytic leukemia-a single center experience in 34 patients[J].Thromb Res,2005,116(2):109-114.DOI:10.1016/j.thromres.2004.11.001.
[15]隋美娟,张卓,周晋.亚砷酸治疗急性早幼粒细胞白血病时肝功能损害的特点及保肝药物应用现状[J].医学综述,2015,21(5):831-833.DOI:10.3969 /j.issn.1006-2084.2015.05.023.SUI M J,ZHANG Z,ZHOU J.Characteristics of hepatic impairment in APL patients treated by arseniteand the application ofhepatoprotective drugs[J].Medical Recapitulate,2015,21(5):831-833.DOI:10.3969 /j.issn.1006-2084.2015.05.023.
