果蔬中多酚类化合物双向调控Nrf2/Keap1信号通路的研究进展
2018-03-20赖灯妮赵玲艳邓放明
赖灯妮,覃 思,赵玲艳,邓放明*
(湖南农业大学食品科学技术学院,湖南 长沙 410128)
Nrf2(NF-E2-related factor2)是调控细胞抵抗外来异物和氧化损伤、维持细胞内氧化还原平衡的关键转录因子。Nrf2的缺失或激活障碍导致氧化应激源的细胞毒性增强,引起细胞功能障碍、凋亡甚至死亡,从而与许多疾病的发生有着密切联系[1-3]。因此,激活Nrf2信号通路有利于人体健康和疾病的预防。但是随着研究的深入,有研究者发现Nrf2的激活可能阻碍癌症的治疗,如在某些癌症的化疗和放疗中,Nrf2的激活增强了癌细胞的抗药性[4-7],所以如何在癌细胞中抑制Nrf2的活性也是目前的研究热点之一。
果蔬中含有丰富的多酚化合物,其酚羟基中邻位酚羟基极易被氧化,且有较强捕捉活性氧等自由基的能力,因此能够清除自由基和淬灭活性氧[8]。目前有近1 000 种果蔬多酚化合物被证明利于人体健康和预防疾病(如癌症、糖尿病、神经性疾病等)[9]。果蔬多酚化合物能显著调控Nrf2/Keap1(Kelch-like ECH-associated protein 1)信号通路,然而其作用的分子机制尚未阐明。本文系统介绍了Nrf2/Keap1信号通路及其调节方式,讨论了Nrf2化学预防肿瘤和促进癌症发生的双重作用,详细总结和分析了关于果蔬中多酚类物质对Nrf2/Keap1的激活或抑制作用的研究进展和基本规律。
1 Nrf2信号通路及其调节
1.1 Nrf2/Keap1信号通路及其调节
Nrf2是细胞调节氧化应激反应的重要转录因子,属于CNC(cap’-n’-collar)转录因子家族成员[10]。Nrf2含有7 个不同的功能区(图1),分别命名为Neh1到Neh7(Nrf2-ECH homology)。Neh1区中CNC-bZIP(leucime zipper bZIP)亮氨酸拉链结构,bZIP与Maf蛋白(包括MafG、MafK、MafF)形成异二聚体。此二聚体是Nrf2识别抗氧化反应元件(antioxidant response element,ARE)上DNA基序(GCTGAGTCA)并与之结合、启动下游抗氧化基因转录的重要物质。Neh2区上的DLG和ETGE基序是Nrf2与胞浆蛋白Keap1结合区,DLG和ETGE缺失或突变影响Nrf2与Keap1结合,负调控Nrf2信号通路。在Neh1与Neh2之间,存在Neh4、Neh5、Neh7和Neh6,Neh3在靠近Neh1的末端且结构复杂。Neh4和Neh5与共激活因子CREB结合蛋白(cyclic AMP-response elememt binding protein (CREB) binding protein,CBP),促使CBP协同参与激活Nrf2的转录活性并增强下游抗氧化基因的表达。Neh6存在着绑定F-box蛋白家族β-TrCP(β-transducing repeats-containing proteins)的区域和DSGIS目的区域,合成糖原酶激酶(glycogen synthase kinase 3,GSK3)β和磷酸化Nrf2上的两个位点,Ser335和Ser338,形成与β-TrCP连接泛素酶的结构,独立于Keap1起负调控作用。Neh7存在着一个视黄受体(retinoic X receptor α,RXRα)的一个绑定区域,与RXRα相互作用[11]。
目前认为Nrf2/Keap1信号通路由3 个部分组成:Keap1、Nrf2、ARE[12-16]。Keap1是Keap1-Cullin 3(Cul3)-Ring box1(Rbx1)E3泛素连接酶的底层调节蛋白,与Nrf2结合并且抑制其活性。ARE是机体内重要的保护性顺式应答元件,其核心序列是5’-TA/CANNA/GTGAC/TNNNGCAG-3’,存在于大部分细胞保护基因的近端启动子区域,是抗氧化蛋白和Ⅱ相脱毒酶基因上游的一段转录调控片段[17]。
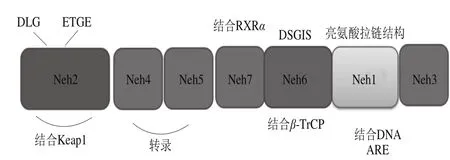
图1 Nrf2结构功能示意图Fig.1 Functional structure of Nrf2
在一般正常生理状态下,细胞质中Nrf2中Neh2片段上的ETGE和DLG位点与Keap1结合。Keap1和Cul-Rbx-E3泛素连接酶偶联Neh2赖氨酸残基从而使Nrf2被泛素化标记,最后被引导进入蛋白酶体进行降解。因此,正常情况下细胞质中Nrf2蛋白含量较低[12,18]。在氧化应激和亲电反应中,Keap1中半胱氨酸残基的结构改变从而不能与Neh2偶联,因此不能泛素化降解掉Nrf2。这样会导致细胞质中Nrf2大量积累并转移到细胞核中,然后在分子伴侣Maf的协助下与ARE结合形成二聚体,启动Ⅱ相脱毒酶和抗氧化蛋白相关基因的表达和蛋白的合成,从而提高细胞抗氧化应激能力[19]。当半胱氨酸残基的结构恢复到稳定状态时,Keap1又能与Nrf2形成泛素化体系,从而酶解掉Nrf2以恢复其正常水平[20-21]。
目前调节Nrf2/Keap1信号通路主要有两种假说:铰链和门闩模式和Cul3-Keap1解偶联模式(图2)。
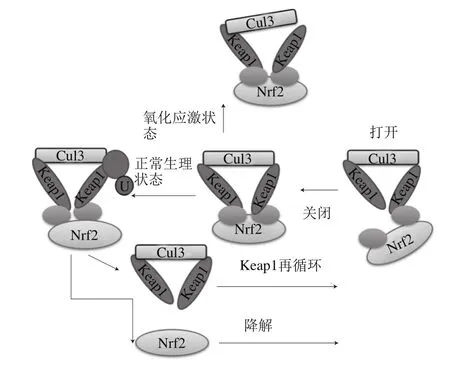
图2 Nrf2/Keap1信号调节模型Fig.2 Regulatory model of Nrf2/Keap1 signaling pathway
1.1.1 铰链和门闩模式
在铰链和门闩模式中,Keap1连接Nrf2中高亲和性ETGE位点形成二聚体,称为“打开”结构。随后Keap1与Nrf2中DLG位点结合形成“关闭”结构。在生理状态下,Nrf2/Keap1关闭结构使得Nrf2在细胞质中被泛素化标记从而被蛋白酶降解,解链的Keap1则进入下一个与Nrf2结合的循环。但在氧化应激状态下,活性氧自由基和电子修饰Keap1中IVR区半胱氨酸残基结合从而使其结构变化。虽然结构变化的Keap1依旧能连接Nrf2的ETGE和DLG位点,但是与E2泛素结合酶却不能在一条直线上连接,因此Nrf2不被降解并得到积累[22-24]。
1.1.2 Cul3-Keap1解偶联模式
Cul3-Keap1解偶联模式中,一些诱导剂(如叔丁基对苯二酚或二十五烯酸影响Cul3和Keap1结合。Keap1中BTB区的C151是这个模式中的关键位点,它结构的改变使Cul3不能与之偶联从而Nrf2不被泛素化。在两种模式中Nrf2是否泛素化是其积累和核转运的关键[25-27]。
1.2 独立于Keap1的Nrf2调节通路
虽然Keap1是调节Nrf2-ARE通路的重要因素,但其他因素也影响Nrf2通路,主要包括蛋白激酶、转录因子以及表观遗传调节。
1.2.1 蛋白激酶
蛋白激酶是依赖一类胞内信使,且在蛋白质磷酸化过程中起中介和放大作用并协助完成信号传递的酶。磷酸化是影响Nrf2信号通路的重要因素,其中主要的蛋白激酶包括PKC蛋白激酶C、PI3K磷脂酰肌醇激酶、MAPKs丝裂酶原激活蛋白酶(细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)/p38)[28]。研究发现果蔬多酚化合物的木犀草素、花色苷、表儿茶素能够磷酸化ERK;原花青素B2、表儿茶素能够磷酸化p38;苏木查尔醇能够磷酸化JNK;阿魏酸、表儿茶素以及黑茶茶多酚能够磷酸化PI3K通路并激活Nrf2通路。早期研究发现Nrf2中Ser40、Ser568位点磷酸化使Nrf2表达增强,但Ser215、Ser408、Ser577位点磷酸化却抑制着Nrf2通路的激活[29-31]。PKC磷酸化Nrf2中Ser40位点,使Nrf2与Keap1分离,诱导其转入胞核[32]。目前针对MAPKs调控Nrf2的研究结果充满争议,有研究结果表明MAPKs对Nrf2有正向调控作用,Nrf2诱导剂叔丁基对苯二酚和莱菔硫烷抑制MAPKs的ERK和p38活性,降低ARE相关基因的表达[33]。而有些报道则发现MAPKs对Nrf2有负向调控作用,在A549细胞中ERK抑制剂抑制Nrf2的Ser40磷酸化从而阻止其核转录,p38抑制剂SB203580促进Nrf2与Keap1解偶联从而使其泛素化,在HepG2细胞中,发现p38负调控Nrf2[34-36]。PI3K激酶控制Nrf2的激活,PI3K激酶的抑制剂阻止Nrf2的核转移和氧化应激蛋白的诱导[37]。从上述文献可以看出:部分蛋白激酶的磷酸化是多酚调控Nrf2信号通路的前提和必要条件;其中,果蔬多酚化合物磷酸化PKC蛋白激酶从而激活Nrf2-ARE信号通路,而磷酸化MAPKs激酶的果蔬多酚化合物对Nrf2信号通路的调节目前尚未有一致的报道,磷酸化PI3K激酶的果蔬多酚则激活Nrf2信号通路。
1.2.2 转录因子
转录因子是指能够结合在某基因上游特异核苷酸序列上的蛋白质,这些蛋白质能调控其基因的转录。这些转录因子一般由DNA结合域、转录调控域(包括激活域或抑制域)、寡聚化位点以及核定位信号等4 个功能区域组成。转录因子功能差异主要由激活域和抑制域决定,其中包括激活因子和抑制因子[38]。
Nrf2的转录因子调控机制非常复杂,它们是独立于Keap1调控Nrf2通路的因子。例如Maf蛋白通过改变Nrf2亮氨酸拉链结构以及同源延伸区从而影响其二聚化,敲掉Maf蛋白会影响Nrf2的激活以及抗氧化蛋白的诱导[39]。另外,核内共同激活因子3(amplified in breast 1,AIB1)通过增强转录活性影响Nrf2的激活[40]。其中Nrf2激活因子包括重组人Jun二聚化蛋白2(Jun dimerization protein 2,JDP2)、Jun、CBP、BRG1、p21[41-44]。而Nrf2抑制因子包括cFos、p53、p65、Fra1、Bach1、C/EBPα、ATF1、ATF3 ER、SFERRβ、PPAR-Y、RAR-α[45-48]。
1.2.3 表观遗传学调控
表观遗传学是在细胞核内DNA序列没有改变的情况下基因功能可逆的可遗传改变[49]。正常细胞CpG岛处于非甲基化或低甲基化。研究表明在人体和小鼠中Nrf2启动子上CpG甲基化抑制Nrf2的表达[50-51]。在BEAS-2B细胞中,Keap1启动子的CpG甲基化负调节Keap1的表达[52]。组蛋白乙酰化由组蛋白乙酰基转移酶和组蛋白去乙酰化酶(histonedeacetylases,HDACs)两个家族的酶调控。HDACs对于Nrf2的调控首先发现于炎症模型中。研究发现脂多糖(lipopolysaccharides,LPS)通过刺激HDACs降低组蛋白H3和H4的乙酰化导致Nrf2通路失活,然而通过HDACs抑制剂此过程可逆[53]。在BEAS-2B细胞中或者在HDAC2敲除的细胞中,HDACs抑制剂可使得Nrf2通路失活,这说明HDACs调节Nrf2是一个复杂的过程[50]。
由于Nrf2在生理学上的重要作用,Nrf2的调控机制的研究已成为肿瘤学和药物学研究的热点。Nrf2不仅受Keap1调控,而且受独立于Keap1的蛋白激酶、转录因子以及表观遗传学等因素的调控。在某些情况下,Nrf2独立于Keap1的调控机制在慢性疾病中起着至关重要的作用。因此,研究多重调控Nrf2的机制在治疗慢性疾病中有着深远的意义。
2 Nrf2/Keap1信号通路的双重功效:癌症的化学预防和促进作用
Nrf2对癌症有化学预防和促进癌症进程的双重作用:一方面,Nrf2对健康机体癌变的化学预防有着至关重要的作用[54];另一方面,Nrf2异常表达和持续性活跃能促进癌变进程,或者减弱针对癌症的化疗和放疗效果[55]。因此寻求一种在正常机体激活Nrf2信号通路且在肿瘤中抑制Nrf2信号通路的多酚化合物是目前研究的热点。
2.1 Nrf2/Keap1对癌症的化学预防作用
目前认为Nrf2/Keap1的激活是细胞抗氧化还原反应和抑制肿瘤的关键步骤。在敲除基因Nrf2-/-小鼠体内实验中,利用化学毒素刺激小鼠,发现肺部、肝脏和肾脏中出现严重损伤。乙酰氨基酚刺激Nrf2-/-小鼠从而引起急性肝脏毒性[56];丁羟甲苯或氧过多诱导Nrf2-/-小鼠导致其肺部损害[57-58]。另外,Nrf2-/-小鼠更易得氧化相关的疾病和癌症[59]。研究发现人体Nrf2的启动子的单核苷酸多态性使得Nrf2的表达下降,从而使肺癌患病几率提高,具体地来说,Nrf2基因的上游启动子区域(rs6721961)的变异削弱了Nrf2与ARE结合力从而使得肺癌患病率显著上升[60]。因此激活Nrf2被认为是癌症化学预防的有效途径。大量的研究表明Nrf2-ARE的激活剂通过诱导Nrf2/Keap1的表达和提高抗氧化水平从而达到抵御相关疾病的目的[61-62]。
2.2 Nrf2/Keap1促进癌症的作用
2.2.1 Nrf2/Keap1促进癌症发展
以往对Nrf2/Keap1的研究都集中于它对细胞的抗氧化性和解毒功能,认为其在癌症预防中发挥着至关重要的作用。然而最新研究发现Nrf2持续异常激活将促进癌症发生同时阻碍癌症治疗,如化疗和放疗作用[63]。在肝、肺、乳腺、膀胱、卵巢、胰腺、子宫癌的研究中发现Nrf2的表达增强[64-66]。Nrf2/Keap1的激活受到不同因素影响,如磷脂酰肌醇激酶(PI3K/Akt)、抗细胞凋亡蛋白(B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2))、自噬通路、炎症因子(核转录因子κB(nuclear factor kappa B,NF-κB))以及致癌基因(kRas和bRaf)[64,67]。
Nrf2/Keap1上调节下游抗氧化、解毒酶的表达以及抑制细胞凋亡的功能对癌细胞起到保护和增殖作用[68]。如癌细胞中Nrf2通过PI3K/Akt通路、表皮生长因子促进癌细胞的增殖和新陈代谢[69]。此外,Nrf2/Keap1直接诱导抗凋亡基因Bcl-2、Bcl-xL干扰癌细胞的凋亡[70]。肝癌细胞中发现Nrf2持续异常激活与肿瘤的新陈代谢密切相关[66],然而敲除Nrf2的癌细胞能够减缓细胞的转移及肿瘤的新陈代谢[67]。
2.2.2 Nrf2/Keap1抗化疗和放疗的作用
治疗癌症过程中,化疗和放疗起着非常重要的作用。在肿瘤细胞中Nrf2/Keap1的异常激活阻碍着化疗和放疗的作用[71]。RNA干扰技术使Nrf2表达沉默或者Keap1过量表达导致癌细胞对药物或者化疗放疗的敏感性[4]。目前研究者对肿瘤细胞Nrf2的异常激活从而阻碍化疗和放疗的现象提出了多种假设:1)Nrf2下游抗氧化蛋白和解毒酶如HO-1和GST阻碍细胞的死亡从而起到抗化疗和放疗的作用[72];2)Nrf2诱导抗药物蛋白(MRPs)削弱药物对癌细胞的作用[73];3)Nrf2与细胞凋亡之间的交互作用[32];4)Nrf2诱导癌细胞中的蛋白酶,从而达到保护癌细胞的目的[74];5)一些抗癌药物通过与Keap1的Cys151位点结合,激活Nrf2抑制某些蛋白酶从而达到抗化疗的作用[75]。
目前Nrf2作为预测和评价治疗癌症是否有效的生物指标,Nrf2/Keap1是否高水平表达已经成为临床治疗中药物有效与否的评判标准,因此对Nrf2的研究在临床诊断和治疗中发挥着至关重要的作用。
3 果蔬中多酚化合物调节Nrf2/Keap1通路
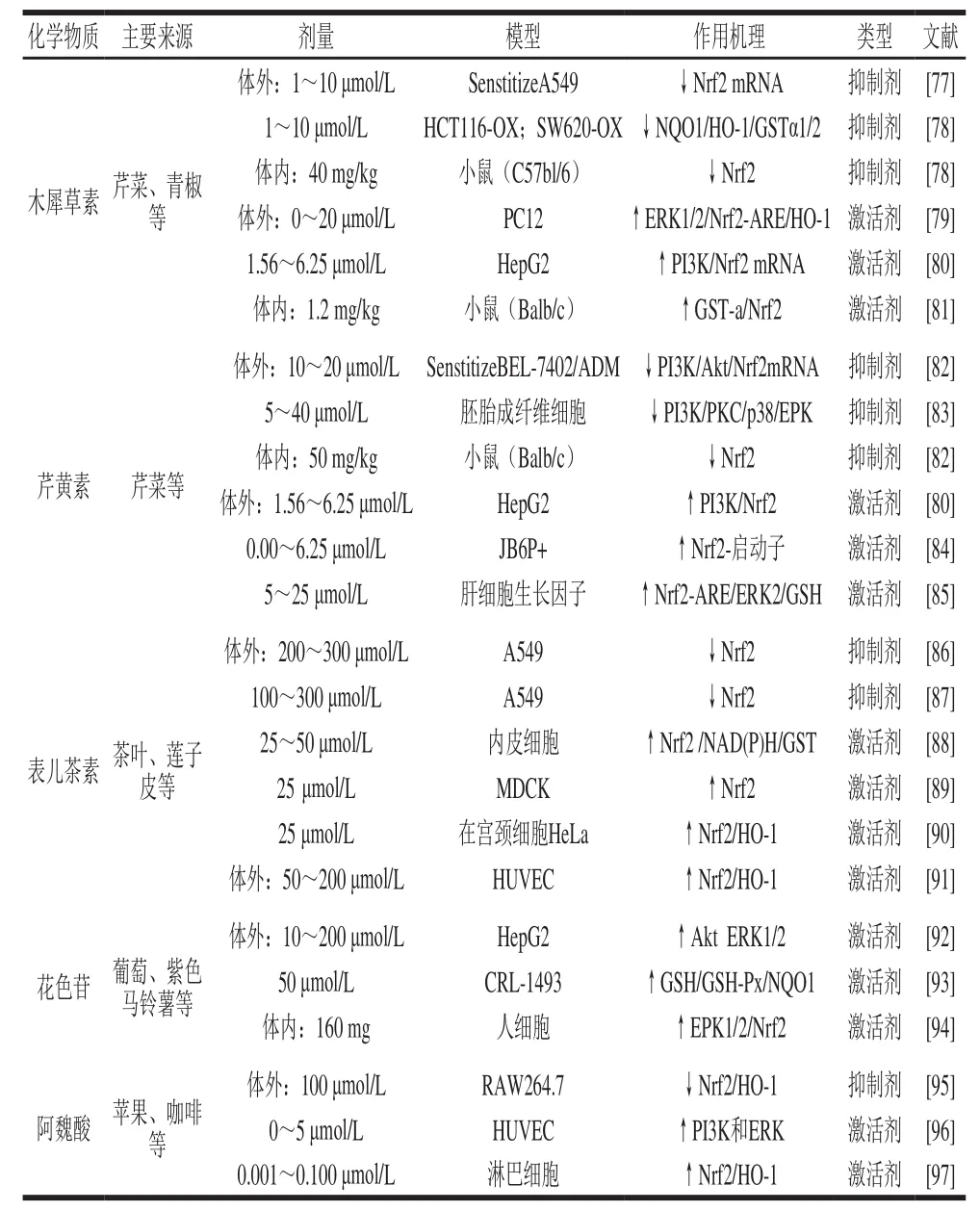
表1 果蔬中几种典型多酚对Nrf2/Keap1通路的影响Table1 Regulatory effect of typical dietary polyphenols on Nrf2/Keap1 signaling
多酚化合物广泛存在于水果、蔬菜等植物性食物中,具有抗炎症、肿瘤、氧化以及治疗心血管疾病和骨质疏松等多种生物活性。多酚类植物化合物中能激活或者促进Nrf2的表达的,称为激活剂;而抑制或者削弱Nrf2的表达的称为抑制剂[76]。但是随着研究的深入,我们发现不同剂量的果蔬多酚在不同细胞或动物模型中,调控Nrf2信号通路效果复杂多变。在体外实验中多酚化合物调控Nrf2信号通路的剂量效应基本呈现倒U型曲线,即低剂量时多酚类化合物能够激活Nrf2信号通路,当剂量超过阈值则抑制Nrf2信号通路(表1)。
3.1 木犀草素
木犀草素是一种天然3,4,5,7-四羟基黄酮类化合物,广泛存在于蔬菜和水果中,如芹菜、胡椒、青椒、苹果皮和洋葱的叶子等。在肺癌细胞A549中,木犀草素通过独立于Keap1信号通路降低Nrf2的mRNA和蛋白质的表达从而下调Nrf2-ARE信号通路。研究发现1 μmol/L的木犀草素刺激A549细胞30 min后Nrf2的mRNA水平降低了34%,且提高了A549对药物的敏感性。然而利用RNA干扰技术使Nrf2基因在细胞中表达沉默后,木犀草素诱导的细胞对药物的敏感性消失[77]。在结肠癌细胞HCT116和SW620中,木犀草素通过降低NQO1/HO-1/GSTα1/GSTα2的表达从而抑制Nrf2通路[78]。在体内实验中发现通过木犀草素治疗的小鼠的Nrf2蛋白含量降低,肝脏和肠的肿瘤变小[78]。这说明在肺癌细胞A549、结肠癌细胞HCT116和SW620以及在小鼠模型中,木犀草素作为Nrf2的抑制剂通过使Nrf2表达下降从而达到提高抗癌药物敏感性的作用。在神经性细胞PC12中,木犀草素通过独立于Keap1的磷酸化通路ERK增强Nrf2-ARE信号通路以及下游HO-1的mRNA的表达[79]。在肝癌细胞HepG2中,木犀草素通过独立于Keap1的磷酸化通路PI3K增强Nrf2的表达[80]。用1.2 mg/(kg·d)木犀草素喂养氧化偶氮甲烷诱导的小鼠肠癌模型中发现Nrf2表达增加从而达到治疗肿瘤的目的[81]。这说明木犀草素作为Nrf2的激活剂,促进Nrf2在细胞中的表达。
在体外实验中,可以发现1~10 μmol/L的木犀草素刺激癌细胞A549、HCT116和SW620后,降低了细胞中Nrf2蛋白的表达[75,78]。但是1.56~6.25 μmol/L的木犀草素刺激癌细胞HepG2后,发现其Nrf2蛋白的表达增强了[80]。在体内实验中:用40 mg/kg的木犀草素喂养小鼠,发现抑制了Nrf2蛋白的表达[78];而用1.2 mg/kg的木犀草素喂养小鼠后,发现激活了Nrf2蛋白的表达[81]。但是0~20 μmol/L的木犀草素刺激正常细胞PC12,激活了Nrf2蛋白的表达[79](表1)。从以上数据可以看出,高剂量的木犀草素在癌细胞和体外实验中都是Nrf2的抑制剂,而低剂量的木犀草素则是Nrf2的激活剂。然而,木犀草素在正常细胞中对Nrf2的影响则没有以上规律。在肠道中木犀草素以糖苷或硫酸盐形式被吸收,虽然木犀草素在血浆中的含量较低且持续时间较短,但依旧表现出较强的生物活性。
3.2 芹黄素
芹黄素是一种天然的4,5,7-三羟基黄酮类化合物,广泛存在于芹菜等果蔬中。大量文献报道芹黄素的作用机理是通过PI3K/Akt通路抑制Nrf2[80-82]。芹黄素在肝癌细胞BEL-7402中通过负调控PI3K/Akt通路降低Nrf2的mRNA和蛋白表达从而提高其对抗肿瘤药物敏感性[82]。芹黄素刺激胚胎成纤维细胞通过下调PI3K/PKC/p38/ERK通路使Nrf2以及下游蛋白HO-1表达下降[83]。在体内实验中,通过芹黄素治疗肝癌小鼠发现其肿瘤变小[82]。研究发现芹黄素刺激肝癌细胞HepG2通过PI3K通路增强Nrf2蛋白表达[80]。芹黄素通过CpG去甲基化削弱DNA的甲基化和组蛋白脱乙酰基化,从而激活皮肤表皮JB6P+细胞Nrf2的表达[84]。芹黄素刺激肝细胞通过增强细胞核内Nrf2与ARE的绑定与磷酸化ERK2从而提高GSH蛋白的表达[85]。
在体外实验中,10~20 μmol/L芹黄素刺激肝癌细胞BEL-7402发现抑制Nrf2表达[82],但是1.56~6.25 μmol/L芹黄素刺激肝癌细胞H e p G 2激活N r f 2表达[80]。5~40 μmol/L芹黄素刺激胚胎成纤维细胞发现抑制Nrf2信号通路[83]。0.00~6.25 μmol/L芹黄素刺激上皮细胞JB6P+、5~25 μmol/L芹黄素刺激肝细胞Hepatocyte发现都激活Nrf2的表达[84-85](表1)。从以上数据可以发现:无论是在癌细胞还是正常细胞中芹黄素激活Nrf2的剂量都低于抑制Nrf2的剂量;芹黄素作为Nrf2的激活剂,刺激癌细胞的剂量比正常细胞的低。
木犀草素和芹黄素是日常饮食中微量的小分子物质。分子结构上木犀草素比芹黄素多一个羟基,因此木犀草素的抗氧化能力较强。大鼠口服单一剂量菊花提取物(200 mg/kg),其中木犀草素和芹黄素含量分别为5.2%和7.6%。芹黄素和木犀草素吸收达到最高值分别为237.6、23.03 μg·h/mL且均小于4 h(芹黄素3.9 h,木犀草素1.1 h)。这两种多酚类化合物72 h后在粪便和尿液中总回收率低于Ⅱ相代谢产物50%。芹黄素和木犀草素的分布体积、肾清除率以及消除半衰期分别为13.78 L/kg、0.856 9 L/(kg/h)、3.4 h和65.12 L/kg、8.473 L/(kg/h)、2.7 h,且在浓度1.56~6.25 μmol/L范围内,木犀草素显示出更强激活Nrf2的能力[80]。
3.3 表儿茶素
表儿茶素主要存在于茶叶、莲子皮、葡萄等果蔬中,主要通过抑制活性氧簇和丙二醛的产生和提高GSH-Px活性从而达到抗氧化和抗肿瘤的作用。高浓度的表儿茶素在肺癌细胞A549中通过抑制Nrf2-ARE的绑定和下游蛋白HO-1蛋白的表达从而诱导细胞凋亡[86]。从肉桂中提取的表儿茶素通过下调Nrf2调节酶从而抑制肺癌细胞A549中Nrf2的过量表达,且提高细胞对阿霉素和依托泊苷药物的敏感性和细胞内的药物累积[87]。这些结果表明表儿茶素通过降低Nrf2的过量表达从而有效降低肺癌细胞对抗癌药物的耐药性。目前发现抑制Nrf2的过量表达是协助治疗肺癌的一种新方法。
通过表儿茶素诱导内皮细胞发现GST和NQO1蛋白表达增强,这暗示着Nrf2表达上调[88]。在狗肾细胞MDCK中,表儿茶素通过诱导细胞质以及细胞核中Nrf2的表达增强使得抗氧化酶活性增加,利用干扰siRNA技术敲除基因Nrf2从而表儿茶素的作用消失[89]。在宫颈癌细胞HeLa中,表儿茶素增强Nrf2信号通路以及下游蛋白HO-1的表达以提高对药物顺铂的敏感性[90]。表儿茶素刺激HUVEC增强Nrf2和HO-1的表达[91]。这些结果表明表儿茶素作为Nrf2的激活剂,可以起到抗氧化和辅助治疗癌症的作用。
在体外实验中,高剂量的表儿茶素(大于200 μmol/L)处理A549细胞,能够抑制其Nrf2的表达[86],而低剂量的表儿茶素处理细胞则能够激活Nrf2的表达[87]。如表1所示,以25~50 μmol/L的表儿茶素刺激内皮细胞,25 μmol/L表儿茶素刺激MDCK和宫颈癌细胞,以及50~200 μmol/L的表儿茶素刺激HUVEC,这些低剂量的表儿茶素均能激活细胞中Nrf2的表达[88,90-91]。
3.4 花色苷
自然状态下,花色素常与各种糖原结合形成糖苷的形式,称为花色苷。目前已知近百种花色素,较为常见的花色素有6 种,即矢车菊素、飞燕草素、天竺葵素、牵牛色素、芍药色素和锦葵色素。目前研究认为花色苷作为Nrf2的激活剂,还没有相关抑制Nrf2的活性的报道。紫色马铃薯中提取的花色苷诱导DMN处理的HepG2细胞,通过激活Nrf2途径从而上调HO-1、GST和NAD(P)H表达[92]。Shih等[93]发现矢车菊素、飞燕草色素、锦葵色素不仅可以激活Nrf2作用于ARE,诱导Ⅱ相抗氧化蛋白谷胱甘肽还原酶、GSH-Px、NQO1等的表达,从而抑制半胱天冬酶-3的活性,而且能抑制LPS、IFN-γ诱导的NF-κB活化,通过作用于PI3K和MAPKs途径,抑制前列腺素E2和一氧化氮的产生。花色苷在人体上皮细胞中通过ERK1/2通路激活Nrf2从而达到抗氧化作用[94](表1)。
3.5 阿魏酸
阿魏酸含有不饱和双键和羟基的酚酸结构,是苹果、咖啡等果蔬中主要的多酚化合物。它主要的功效为抗氧化和清除自由基、抑制血栓形成、抗血小板凝聚等。在巨噬细胞Raw264.7中,阿魏酸主要通过降低Nrf2的表达从而下调NF-κB的核转录,且通过IKK/NF-κB的信号通路达到抗炎症的作用[95]。研究表明HUVEC中通过阿魏酸激活PI3K和ERK信号通路使得Nrf2从细胞质转移到细胞核,且增强下游蛋白GSH和NAD(P)H表达[96]。在淋巴球细胞中阿魏酸显著上调HO-1的mRNA以及蛋白水平,诱导Nrf2的核转运[97]。
0.2 ~5.0 μmol/L阿魏酸刺激HUVEC、0.001~0.100 μmol/L刺激淋巴细胞都是激活Nrf2的表达[96-97],但是100 μmol/L阿魏酸刺激巨噬细胞则是抑制Nrf2的表达[95](表1)。根据以上数据,发现体外实验低剂量的阿魏酸在正常的细胞中是Nrf2的激活剂,高剂量的阿魏酸则为其抑制剂。
目前发现果蔬中的多酚化合物大部分双向调节Nrf2,在体外实验中,同种多酚化合物作为Nrf2抑制剂浓度普遍比激活剂浓度高。推测果蔬多酚化合物双向调节Nrf2剂量呈倒U型曲线,即当浓度低于阈值对于Nrf2起到激活作用,但超过阈值则起抑制作用。体内实验发现当摄入50 mg多酚化合物糖苷配基时,总代谢物在血浆中的浓度为0~4 μmol/L,尿排泄为摄入剂量的0.3%~43.0%,且不同的多酚化合物的代谢浓度不同:其中吸收最好的多酚是没食子酸和异黄酮,其次是儿茶素、黄烷酮和槲皮素糖苷,但具有不同的动力学;吸收最少的多酚是原花色素、没食子酰化的儿茶素和花青素[98]。体内实验中多酚类物质被动物或人体吸收后的血清浓度与大部分体外实验细胞模型起作用的浓度相差较大,这可能是目前制约多酚在人体临床上应用的最大原因。
4 结 语
果蔬多酚化合物不仅双向调控Nrf2/Keap1信号通路,并且调控炎症通路、细胞凋亡和自噬,Nrf2/Keap1和其他通路之间的交互作用的机制研究能够给预防和治疗慢性疾病带来新方法。所以Nrf2/Keap1与炎症通路、细胞凋亡和自噬之间的交互作用也是目前研究的热点。NF-κB和Nrf2之间的相互作用影响细胞黏附分子和谷胱甘肽的体内平衡[99]。NF-κB的异常激活与炎症和疾病的产生有着密不可分的联系[100]。Nrf2是重要的转录和免疫调节因子,它通常能抑制或者抵消NF-κB信号。例如敲除Nrf2的小鼠引起炎症的几率更大[101]。最新研究发现NF-κB能够直接抑制Nrf2的转录水平,NF-κB与Nrf2位点存在CBP竞争从而影响Nrf2信号通路的表达[102]。
一系列研究发现Nrf2通过诱导Ⅱ相酶表达来调节细胞凋亡与自噬。由于Keap1是Nrf2信号通路泛素化的必要元件,任何影响Keap1的因素都影响Nrf2-ARE通路。Keap1与细胞凋亡密切相关的PGAM5(phosphoglycerate mutase 5)、ProTα、FAC1(fetal Alz-50 clone1)、P62(SQSTM1)蛋白结合,势必会引起Nrf2信号通路与细胞凋亡之间的交互作用[103]。另外,有研究发现Nrf2阻碍LPS诱导的PC12细胞自噬[104]。
应用Nrf2调节体内氧化平衡,已经成为疾病预防以及靶位点治疗的新策略。随着研究的深入,发现Nrf2在癌症治疗上有双重作用,Nrf2的抑制剂和激活剂在预防和治疗癌症上具有重要的意义。多酚化合物作为日常饮食果蔬中富含的成分,对于诱导抗氧化蛋白和Ⅱ相代谢酶的表达、减轻氧化应激损伤起着积极有效的作用。大量的研究表明果蔬多酚化合物作用于Nrf2转录、翻译、降解以及细胞核运输阶段(图3),但是其具体的分子机制以及剂量效应仍需要更加深入的阐明。这对拓展果蔬多酚化合物最新的研究领域和范围具有重要意义。
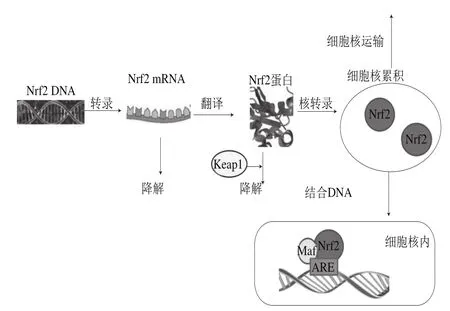
图3 Nrf2转录、翻译、表达机理Fig.3 Mechanisms of Nrf2 transcription, translation and expression
[1] ITOH K, ISHII T, WAKABAYASHI N, et al. Regulatory mechanisms of cellular response to oxidative stress[J]. Free Radical Research,1999, 31(4): 319-324. DOI:10.1080/10715769900300881.
[2] MIMURA J, ITOH K. Role of Nrf2 in the pathogenesis of atherosclerosis[J]. Free Radical Biology & Medicine, 2015, 88: 221-232. DOI:10.1016/j.freeradbiomed.2015.06.019.
[3] TAO S, PARK S L, MR D L V, et al. Systemic administration of the apocarotenoid bixin protects skin against solar UV-induced damage through activation of NRF2[J]. Free Radical Biology & Medicine,2015, 89: 690-700. DOI:10.1016/j.freeradbiomed.2015.08.028.
[4] CHO J M, MANANDHAR S, LEE H R, et al. Role of the Nrf2-antioxidant system in cytotoxicity mediated by anticancer cisplatin:implication to cancer cell resistance[J]. Cancer Letters, 2008, 260(1/2):96-108. DOI:10.1016/j.canlet.2007.10.022.
[5] KIM W D, KIM Y W, CHO I J, et al. E-cadherin inhibits nuclear accumulation of Nrf2: implications for chemoresistance of cancer cells[J]. Journal of Cell Science, 2012, 125(5): 1284-1295.DOI:10.1242/jcs.095422.
[6] ZHANG P, SINGH A, YEGNASUBRAMANIIAN S, et al. Loss of Kelch-like ECH-associated protein 1 function in prostate cancer cells causes chemoresistance and radioresistance and promotes tumor growth[J]. Molecular Cancer Therapeutics, 2010, 9(2): 336-346.DOI:10.1158/1535-7163.MCT-09-0589.
[7] SUKUMARIRAMESH S, PRASSAD N, ALLEYNE C H, et al.Overexpression of Nrf2 attenuates carmustine-induced cytotoxicity in U87MG human glioma cells[J]. BMC Cancer, 2015, 15(1): 1-10.DOI:10.1186/s12885-015-1134-z.
[8] FRAGA C G. Plant polyphenols: how to translate their in vitro antioxidant actions to in vivo conditions[J]. IUBMB Life, 2007,59(4/5): 308-315. DOI:10.1080/15216540701230529.
[9] FRASER G E. Vegetarian diets: what do we know of their effects on common chronic diseases?[J]. American Journal of Clinical Nutrition,2009, 89(5): 1607S-1612S. DOI:10.3945/ajcn.116.146357.
[10] 何金莲. 五味子经Nrf2信号通路调节肝脏药物代谢酶及转运体的研究[D]. 广州: 广州中医药大学, 2014: 1-12.
[11] BAIRD L, SWIFT S, LLÈRES D, et al. Monitoring Keap1-Nrf2 interactions in single live cells[J]. Biotechnology Advances, 2014,32(6): 1133-1144. DOI:10.1016/j.biotechadv.2014.03.004.
[12] ZHANG D D, LO S C, CROSS J V, et al. Keap1 is a redox-regulated substrate adaptor protein for a Cul3-dependent ubiquitin ligase complex[J]. Molecular & Cellular Biology, 2004, 24(24): 10941-10953. DOI:10.1128/MCB.24.24.10941-10953.2004.
[13] KOBAYASHI A, KANG M I, OKAWA H, et al. Oxidative stress sensor keap1 functions as an adaptor for Cul3-based E3 ligase to regulate proteasomal degradation of Nrf2[J]. Molecular & Cellular Biology, 2004, 24(16): 7130-7139. DOI:10.1128/MCB.24.16.7130-7139.2004.
[14] CULLINAN S B, GORDAN J D, JIN J, et al. The Keap1-BTB protein is an adaptor that bridges Nrf2 to a Cul3-based E3 ligase: oxidative stress sensing by a Cul3-Keap1 ligase[J]. Molecular & Cellular Biology, 2004, 24(19): 8477-8486. DOI:10.1128/MCB.24.19.8477-8486.2004.
[15] FURUKAWA M, YUE X. BTB protein Keap1 targets antioxidant transcription factor Nrf2 for ubiquitination by the Cullin 3-Roc1 ligase[J]. Molecular & Cellular Biology, 2005, 25(1): 162-171.DOI:10.1128/MCB.25.1.162-171.2005.
[16] CANNING P, SORRELL F J, BULLOCK A N. Structural basis of Keap1 interactions with Nrf2[J]. Free Radical Biology & Medicine,2015, 88: 101-107. DOI:10.1016/j.freeradbiomed.2015.05.034.
[17] 宋亚颀, 王汉东. 转录因子NF-E2相关因子2-抗氧化转录元件信号路径细胞保护作用的研究进展[J]. 医学研究生学报, 2009, 22(4):431-433; 437. DOI:10.3969/j.issn.1008-8199.2009.04.026.
[18] ITOCH K, WAKABAYASHI N, KATOH Y, et al. Keap1 represses nuclear activation of antioxidant responsive elements by Nrf2 through binding to the amino-terminal Neh2 domain[J]. Genes & Development,1999, 13(1): 76-86. DOI:10.1101/gad.13.17.2328.
[19] ZHANG D D, HANNINK M. Distinct cysteine residues in Keap1 are required for Keap1-dependent ubiquitination of Nrf2 and for stabilization of Nrf2 by chemo preventive agents and oxidative stress[J]. Molecular & Cellular Biology, 2003, 23(22): 8137-8151.DOI:10.1128/MCB.23.22.8137-8151.2003.
[20] SUN Zheng, WU Tongde, ZHAO Fei, et al. KPNA6 (importin α7)-mediated nuclear import of Keap1 represses the Nrf2-dependent antioxidant response[J]. Molecular & Cellular Biology, 2011, 31(9):1800-1811. DOI:10.1128/MCB.05036-11.
[21] SUN Z, ZHANG S, CHAN J Y, et al. Keap1 controls postinduction repression of the Nrf2-mediated antioxidant response by escorting nuclear export of Nrf2[J]. Molecular & Cellular Biology, 2007, 27(18):6334-6349. DOI:10.1128/MCB.00630-07.
[22] BAIRD L, LLERES D, SWIFT S, et al. Regulatory fl exibility in the Nrf2-mediated stress response is conferred by conformational cycling of the Keap1-Nrf2 protein complex[J]. Proceedings of the National Academy of Sciences, 2013, 110(38): 15259-15264. DOI:10.1073/pnas.1305687110.
[23] HARDER B, JIANG T, WU T D, et al. Molecular mechanisms of Nrf2 regulation and how these inf l uence chemical modulation for disease intervention[J]. Biochemical Society Transactions, 2015, 43(4):680-686. DOI:10.1042/BST20150020.
[24] DINKOVAI-KOSTOVA A T, ABRAMOV A Y. The emerging role of Nrf2 in mitochondrial function[J]. Free Radical Biology & Medicine,2015, 88: 179-188. DOI:10.1016/j.freeradbiomed.
[25] RACHAKONDA G, XIONG Y, SEKHAR K R, et al. Covalent modif i cation at Cys151 dissociates the electrophile sensor Keap1 from the ubiquitin ligase CUL3[J]. Chemical Research in Toxicology, 2008,21(3): 705-710. DOI:10.1021/tx700302s.
[26] GAO L, WANG J K, SEKHAR K R, et al. Novel n-3 fatty acid oxidation products activate Nrf2 by destabilizing the association between Keap1 and Cullin3[J]. Journal of Biological Chemistry, 2007,282(4): 2529-2537. DOI:10.1074/jbc.M607622200.
[27] SUZUKI T, YAMAMOTO M. Molecular basis of the Keap1-Nrf2 system[J]. Free Radical Biology & Medicine, 2015, 88: 93-100.DOI:10.1016/j.freeradbiomed.2015.06.006.
[28] NGUYEN T, SHERRATT P J, HUANG H C, et al. Increased protein stability as a mechanism that enhances Nrf2-mediated transcriptional activation of the antioxidant response element. degradation of Nrf2 by the 26 Sproteasome[J]. Journal of Biological Chemistry, 2003, 278(7):4536-4541. DOI:10.1074/jbc.M207293200.
[29] JAIN A K, JAISWAL A K. Phosphorylation of tyrosine 568 controls nuclear export of Nrf2[J]. Journal of Biological Chemistry, 2006,281(17): 12132-12142. DOI:10.1074/jbc.M511198200.
[30] HUANG H C, NGUYEN T, PICKETT C B. Phosphorylation of Nrf2 at Ser-40 by protein kinase C regulates antioxidant response elementmediated transcription[J]. Journal of Biological Chemistry, 2002,277(45): 42769-42774. DOI:10.1074/jbc.M206911200.
[31] LI B J, WANG X Y, RASHEED N, et al. Distinct roles of c-Abl and Atm in oxidative stress response are mediated by protein kinase C delta[J]. Genes & Development, 2004, 18(15): 1824-1837.DOI:10.1101/gad.1223504.
[32] ZHU J Y, WANG H H, CHEN F, et al. An overview of chemical inhibitors of the Nrf2-ARE signaling pathway and their potential applications in cancer therapy[J]. Free Radical Biology & Medicine,2016, 99: 544-556. DOI:10.1016/j.freeradbiomed.2016.09.010.
[33] NUMAZAWA S, ISHIKAWA M, YOSHID A, et al. Atypical protein kinase C mediates activation of NF-E2-related factor 2 in response to oxidative stress[J]. American Journal of Physiology-Cell Physiology,2003, 285(2): 334-342. DOI:10.1152/ajpcell.00043.2003.
[34] ALAM J, WICKS C, STEWART D, et al. Mechanism of heme oxygenase-1 gene activation by cadmium in MCF-7 mammary epithelial cells. role of p38 kinase and Nrf2 transcription factor[J].Journal of biological Chemistry, 2000, 275(36): 27694-27702.DOI:10.1074/jbc.m004729200.
[35] TIAN H, ZHANG D, GAO Z, et al. MDA-7/IL-24 inhibits Nrf2-mediated antioxidant response through activation of p38 pathway and inhibition of ERK pathway involved in cancer cell apoptosis[J].Cancer Gene Therapy, 2014, 21(10): 416-426. DOI:10.1038/cgt.2014.45.
[36] YU R, CHEN C, MO Y Y, et al. Activation of mitogen-activated protein kinase pathways induces antioxidant response elementmediated gene expression via a Nrf2-dependent mechanism[J]. Journal of Biological Chemistry, 2000, 275(51): 39907-39913. DOI:10.1074/jbc.m004037200.
[37] NAKASO K, YANO H, FUKUHARA Y, et al. PI3K is a key molecule in the Nrf2-mediated regulation of antioxidative proteins by hemin in human neuroblastoma cells[J]. Febs Letters, 2003, 546(2): 181-184.DOI:10.1016/s0014-5793(03)00517-9.
[38] MARTIN C, PAZ-ARES J. MYB transcription factors in plants[J]. Trends in Genetics, 1997, 13(2): 67-73. DOI:10.1016/S0168-9525(96)10049-4.
[39] BAIRD L, DINKOVAINK-KOSTOVA A T. The cytoprotective role of the Keap1-Nrf2 pathway[J]. Archives of Toxicology, 2011, 85(4):241-272. DOI:10.1007/s00204-011-0674-5.
[40] KIM J H, YU S W, CHEN J D, et al. The nuclear cofactor RAC3/AIB1/SRC-3 enhances Nrf2 signaling by interacting with transactivation domains[J]. Oncogene, 2012, 32(4): 514-527.DOI:10.1038/onc.2012.59.
[41] HAYES J D, MCMAHON M, CHOWDHRY S, et al. Cancer chemoprevention mechanisms mediated through the Keap1-Nrf2 pathway[J]. Antioxidants & Redox Signaling, 2010, 13(11): 1713-1748. DOI:10.1089/ars.2010.3221.
[42] TANIGAWA S, LEE C H, LIN C S, et al. Jun dimerization protein 2 is a critical component of the Nrf2/Maf K complex regulating the response to ROS homeostasis[J]. Cell Death & Disease, 2013, 4(11):175-177. DOI:10.1038/cddis.2013.448.
[43] TSUJI Y. JunD activates transcription of the human ferritin H gene through an antioxidant response element during oxidative stress[J].Oncogene, 2005, 24(51): 7567-7578. DOI:10.1038/sj.onc.1208901.
[44] CHEN W M, SUN Z, WANG X J, et al. Direct interaction between Nrf2 and p21Cip1/WAF1upregulates the Nrf2-mediated antioxidant response[J]. Molecular Cell, 2009, 34(6): 663-673. DOI:10.1016/j.molcel.2009.04.029.
[45] FARAONIO R, VERGARA P, MARZO D D, et al. p53 suppresses the Nrf2-dependent transcription of antioxidant response genes[J]. Journal of Biological Chemistry, 2006, 281(52): 39776-39784. DOI:10.1074/jbc.M605707200.
[46] YU M, LI H, LIU Q M, et al. Nuclear factor p65 interacts with Keap1 to repress the Nrf2-ARE pathway[J]. Cellular Signalling, 2011, 23(5):883-892. DOI:10.1016/j.cellsig.2011.01.014.
[47] ZHANG Q, KLEEBERGER S R, REDDY S P. DEP-induced fra-1 expression correlates with a distinct activation of AP-1-dependent gene transcription in the lung[J]. Ajp Lung Cellular & Molecular Physiology, 2004, 286(2): 427-436. DOI:10.1152/ajplung.00221.2003.
[48] IWASAKI K, HAILEMARIAM K, TSUJI A Y. PIAS3 interacts with ATF1 and regulates the human ferritin H gene through an antioxidantresponsive element[J]. Journal of Biological Chemistry, 2007, 282(31):22335-22343. DOI:10.1074/jbc.M701477200.
[49] OOI S K, BESTOR T H. The colorful history of active DNA demethylation[J]. Cell, 2008, 133(7): 1145-1148. DOI:10.1016/j.cell.2008.06.009.
[50] KHOR T O, FUENTES F, SHU L, et al. Epigenetic DNA methylation of antioxidative stress regulator NRF2 in human prostate cancer[J]. Cancer Prevention Research, 2014, 7(12): 1186-1197.DOI:10.1158/1940-6207.CAPR-14-0127.
[51] GUO Y, YU S W, ZHANG C Y, et al. Epigenetic regulation of Keap1-Nrf2 signaling[J]. Free Radical Biology & Medicine, 2015, 88: 337-349.DOI:10.1016/j.freeradbiomed.2015.06.013.
[52] SHANKAR S, KUMAR D, SRIVASTAVA R K. Epigenetic modif i cations by dietary phytochemicals: implications for personalized nutrition[J]. Pharmacology & Therapeutics, 2013, 138(1): 1-17.DOI:10.1016/j.pharmthera.2012.11.002.
[53] LIU G H, QU J, SHEN X. NF-kappaB/p65 antagonizes Nrf2-ARE pathway by depriving CBP from Nrf2 and facilitating recruitment of HDAC3 to MafK[J]. Biochimica et Biophysica Acta, 2008, 1783(5):713-727. DOI:10.1016/j.bbamcr.2008.01.002.
[54] LAU A, ZHENG Y, TAO S S, et al. Arsenic inhibits autophagic flux, activating the Nrf2-Keap1 pathway in a p62-dependent manner[J]. Molecular & Cellular Biology, 2013, 33(12): 2436-2446.DOI:10.1128/MCB.01748-12.
[55] HU X F, YAO J, GAO S G, et al. Nrf2 overexpression predicts prognosis and 5-FU resistance in gastric cancer[J]. Asian Pacific Journal of Cancer Prevention Apjcp, 2013, 14(9): 5231-5235.DOI:10.7314/APJCP.2013.14.9.5231.
[56] ENOMOTO A, ITOH K, NAGAYOSHI E, et al. High sensitivity of Nrf2 knockout mice to acetaminophen hepatotoxicity associated with decreased expression of ARE-regulated drug metabolizing enzymes and antioxidant genes[J]. Toxicological Sciences, 2001, 59(1): 169-177. DOI:10.1093/toxsci/59.1.169.
[57] CHAN K M, KAN Y W. Nrf2 is essential for protection against acute pulmonary injury in mice[J]. Proceedings of the National Academy of Sciences, 1999, 96(22): 12731-12736. DOI:10.1073/pnas.96.22.12731.
[58] CHO H Y, JEDLICKAA A E, REDDY S P M, et al. Role of NRF2 in protection against hyperoxic lung injury in mice[J]. American Journal of Respiratory Cell & Molecular Biology, 2012, 26(2): 175-182.DOI:10.1165/ajrcmb.26.2.4501.
[59] XUE P, HOU Y Y, CHEN Y Y, et al. Adipose def i ciency of Nrf2 in ob/ob mice results in severe metabolic syndrome[J]. Diabetes, 2013,62(3): 845-854. DOI:10.2337/db12-0584.
[60] SUZUKI T, SHIBATAA T, TAKAYA K, et al. Regulatory nexus of synthesis and degradation deciphers cellular Nrf2 expression levels[J]. Molecular & Cellular Biology, 2013, 33(12): 2402-2412.DOI:10.1128/MCB.00065-13.
[61] LEE S, SURHY J. Nrf2 as a novel molecular target for chemoprevention[J]. Cancer Letters, 2005, 224(2): 171-184. DOI:10.1016/j.canlet.2004.09.042.
[62] HAYES J D, MCMAHON M, CHOWDHRY S, et al. Cancer chemoprevention mechanisms mediated through the Keap1-Nrf2 pathway[J]. Antioxidants & Redox Signaling, 2010, 13(11): 1713-1748. DOI:10.1089/ars.2010.3221.
[63] MOON E J, GIACCIA A. Dual roles of NRF2 in tumor prevention and progression: possible implications in cancer treatment[J]. Free Radical Biology & Medicine, 2015, 79: 292-299.DOI:j.freeradbiomed.2014.11.009.
[64] HAYES A J, SKOURAS C, HAUGK B, et al. Keap1-Nrf2 signalling in pancreatic cancer[J]. International Journal of Biochemistry & Cell Biology, 2015, 65: 288-299. DOI:10.1016/j.biocel.2015.06.017.
[65] SINGH A, BOLDINADAMSKY S, THIMMULAPA R K, et al.RNAi-mediated silencing of nuclear factor erythroid-2: related factor 2 gene expression in non-small cell lung cancer inhibits tumor growth and increases efficacy of chemotherapy[J]. Cancer Research, 2008,68(19): 7975-7984. DOI:10.1158/0008-5472.
[66] DECALF J, DA SILVA R B, WERNEKE S, et al. Comment on“NRF2 activation by antioxidant antidiabetic agents accelerates tumor metastasis”[J]. Science Translational Medicine, 2016, 8: 334-351.DOI:10.1126/scitranslmed.aad6095.
[67] KANSANEN E, KUOSMANEN S M, LEINONEN H, et al. The Keap1-Nrf2 pathway: mechanisms of activation and dysregulation in cancer[J]. Redox Biology, 2013, 1(1): 45-49. DOI:10.1016/j.redox.2012.10.001.
[68] GANAN-GOMEZ I, WEI Y, YANG H, et al. Oncogenic functions of the transcription factor Nrf2[J]. Free Radical Biology & Medicine,2013, 65: 750-764. DOI:j.freeradbiomed.2013.06.041.
[69] YAMADORI T, ISHII Y, HOMMA S, et al. Molecular mechanisms for the regulation of Nrf2-mediated cell proliferation in non-small-cell lung cancers[J]. Oncogene, 2012, 31(45): 4768-4777. DOI:10.1038/onc.2011.628.
[70] JIA Y, CHEN J, ZHU H, et al. Aberrantly elevated redox sensing factor Nrf2 promotes cancer stem cell survival via enhanced transcriptional regulation of ABCG2 and Bcl-2/Bmi-1 genes[J]. Oncology Reports,2015, 34(5): 2296-2304. DOI:10.3892/or.2015.4214.
[71] JI X J, WANG H D, ZHU J H, et al. Knockdown of Nrf2 suppresses glioblastoma angiogenesis by inhibiting hypoxia-induced activation of HIF-1α[J]. International Journal of Cancer, 2014, 135(3): 574-584.DOI:10.1002/ijc.28699.
[72] FURFARO A L, PIRAS S, PASSALACQUA M, et al. HO-1 up-regulation: a key point in high-risk neuroblastoma resistance to bortezomib[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2014, 1842(4): 613-622. DOI:10.1016/j.bbadis.2013.12.008.
[73] YANG B, MA Y F, LIU Y. Elevated expression of Nrf-2 and ABCG2 involved in multi-drug resistance of lung cancer SP cells[J]. Drug Research, 2014, 65(10): 526-531. DOI:10.1055/s-0034-1390458.
[74] ARLT A, BAUERR I, SCHAFMAYER C, et al. Increased proteasome subunit protein expression and proteasome activity in colon cancer relate to an enhanced activation of nuclear factor E2-related factor 2(Nrf2)[J]. Oncogene, 2009, 28(45): 3983-3996. DOI:10.1038/onc.2009.264.
[75] WANG X J, LI Y Y, LUO L, et al. Oxaliplatin activates the Keap1/Nrf2 antioxidant system conferring protection against the cytotoxicity of anticancer drugs[J]. Free Radical Biology & Medicine, 2014, 70(3):68-77. DOI:10.1016/j.freeradbiomed.2014.02.010.
[76] SURH Y J. Cancer chemoprevention with dietary phytochemicals[J].Nature Reviews Cancer, 2003, 3(10): 768-780. DOI:10.1038/nrc1189.
[77] TANG X W, WANG H Y, FAN L F, et al. Luteolin inhibits Nrf2 leading to negative regulation of the Nrf2/ARE pathway and sensitization of human lung carcinoma A549 cells to therapeutic drugs[J]. Free Radical Biology & Medicine, 2011, 50(11): 1599-1609.DOI:10.1016/j.freeradbiomed.2011.03.008.
[78] CHIAN S, LI Y Y, WANG X J, et al. Luteolin sensitizes two oxaliplatin-resistant colorectal cancer cell lines to chemotherapeutic drugs via inhibition of the Nrf2 pathway[J]. Asian Pacific Journal of Cancer Prevention Apjcp, 2014, 15(6): 2911-2916. DOI:10.7314/APJCP.2014.15.6.2911.
[79] LIN C W, WU M J, LIU I Y C, et al. Neurotrophic and cytoprotective action of luteolin in PC12 cells through ERK-dependent induction of Nrf2-driven HO-1 expression[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4477-4486. DOI:10.1021/jf904061x.
[80] PAREDES-GONZALEZ X, FUENTES F, JEFFERY S, et al.Induction of Nrf2-mediated gene expression by dietary phytochemical flavones apigenin and luteolin[J]. Biopharmaceutics & Drug Disposition, 2015, 36(7): 440-451. DOI:10.1002/bdd.1956.
[81] PANDURANGAN A K, ANANDA SADAGOPAN S K,DHAMALINGAMP, et al. Luteolin, a bioflavonoid inhibits azoxymethane-induced colorectal cancer through activation of Nrf2 signaling[J]. Toxicology Mechanisms & Methods, 2014, 24(1): 13-20.DOI:10.3109/15376516.2013.843111.
[82] GAO A M, ZHANG X Y, KE Z P, et al. Apigenin sensitizes doxorubicin-resistant hepatocellular carcinoma BEL-7402/ADM cells to doxorubicin via inhibiting PI3K/Akt/Nrf2 pathway[J].Carcinogenesis, 2013, 32(8): 241-247. DOI:10.1093/carcin/bgt108.
[83] ABATE A, YANG G, WONGR J, et al. Apigenin decreases heminmediated heme oxygenase-1 induction[J]. Free Radical Biology &Medicine, 2005, 39(6): 711-718. DOI:10.1002/bdd.1956.
[84] PAREDES-GONZALEZX, FUENTES F, SU Z Y, et al. Apigenin reactivates Nrf2 anti-oxidative stress signaling in mouse skin epidermal JB6P+ cells through epigenetics modifications[J]. The AAPS Journal,2014, 16(4): 727-735. DOI:10.1208/s12248-014-9613-8.
[85] HUANG C S, LII C K, LIN A H, et al. Protection by chrysin, apigenin,and luteolin against oxidative stress is mediated by the Nrf2-dependent up-regulation of heme oxygenase 1 and glutamate cysteine ligase in rat primary hepatocytes[J]. Archives of Toxicology, 2013, 87(1): 167-178. DOI:10.1007/s00204-008-0332-8.
[86] KWEON M H, ADHAMI V M, LEE J S, et al. Constitutive overexpression of Nrf2-dependent heme oxygenase-1 in A549 cells contributes to resistance to apoptosis induced by epigallocatechin 3-gallate[J]. Journal of Biological Chemistry, 2006, 281(44): 33761-33772. DOI:10.1074/jbc.M604748200.
[87] SAHIN K, TUZCU M, GENCOGLU H, et al. Epigallocatechin-3-gallate activates Nrf2/HO-1 signaling pathway in cisplatin-induced nephrotoxicity in rats[J]. Life Sciences, 2010, 87(7/8): 240-245.DOI:10.1016/j.lfs.2010.06.014.
[88] HAN S G, HAN S S, TOBOREK M, et al. EGCG protects endothelial cells against PCB 126-induced inflammation through inhibition of AhR and induction of Nrf2-regulated genes[J]. Toxicology &Applied Pharmacology, 2012, 261(2): 181-188. DOI:10.1016/j.taap.2012.03.024.
[89] KANLAYA R, KHAMCHUN S, KAPINCHARANON C, et al.Protective effect of epigallocatechin-3-gallate (EGCG) via Nrf2 pathway against oxalate-induced epithelial mesenchymal transition(EMT) of renal tubular cells[J]. Scientific Reports, 2016, 6: 1-13.DOI:10.1038/srep30233.
[90] KILIC U, SAHIN K, TUZCU M, et al. Enhancement of cisplatin sensitivity in human cervical cancer: epigallocatechin-3-gallate[J].Frontiers in Nutrition, 2014, 1: 28-37. DOI:10.3389/fnut.2014.00028.
[91] YANG G Z, WANG Z J, BAI F, et al. Epigallocatechin-3-gallate protects HUVECs from PM2.5-induced oxidative stress injury by activating critical antioxidant pathways[J]. Molecules, 2015, 20(4):6626-6639. DOI:10.3390/molecules20046626.
[92] HWANG Y P, CHIO J H, YUN H J, et al. Anthocyanins from purple sweet potato attenuate dimethylnitrosamine-induced liver injury in rats by inducing Nrf2-mediated antioxidant enzymes and reducing COX-2 and iNOS expression[J]. Food & Chemical Toxicology, 2011, 49(1):93-99. DOI:10.1016/j.fct.2010.10.002.
[93] SHIH P H, YEH C T, YENG C. Anthocyanins induce the activation of phase II enzymes through the antioxidant response element pathway against oxidative stress-induced apoptosis[J]. Journal of Agricultural and Food Chemistry, 2007, 55(23): 9427-9435. DOI:10.1021/jf071933i.
[94] CIMINO F, SPECIALE A, ANWAR S, et al. Anthocyanins protect human endothelial cells from mild hyperoxia damage through modulation of Nrf2 pathway[J]. Genes & Nutrition, 2013, 8(4): 391-399. DOI:10.1007/s12263-012-0324-4.
[95] MA Z C, HONG Q, WANG Y G, et al. Ferulic acid protects human umbilical vein endothelial cells from radiation induced oxidative stress by phosphatidylinositol 3-kinase and extracellular signal-regulated kinase pathways[J]. Biological & Pharmaceutical Bulletin, 2009,33(1): 29-34. DOI:10.1248/bpb.33.29.
[96] MA Z C, HONG Q, WANG Y G, et al. Ferulic acid induces heme oxygenase-1 via activation of ERK and Nrf2[J]. Drug Discoveries &Therapeutics, 2011, 5(6): 299-305. DOI:10.5582/ddt.2011.v5.6.299.
[97] LAMPIASI N, MONTANA G. The molecular events behind ferulic acid mediated modulation of IL-6 expression in LPS-activated Raw264.7 cells[J]. Immunobiology, 2015, 221(3): 486-493.DOI:10.1016/j.imbio.2015.11.001.
[98] MANACH C, WILLIAMSON G C, SCALBERT A, et al.Bioavailability and bioeff i cacy of polyphenols in humans I. review of 97 bioavailability studies[J]. American Journal of Clinical Nutrition,2005, 81(Suppl 1): 230S-242S. DOI:10.1021/jo070579k.
[99] YANG H, MAGILNICK N, LEE C, et al. Nrf1 and Nrf2 regulate rat glutamate-cysteine ligase catalytic subunit transcription indirectly via NF-κB and AP-1[J]. Molecular & Cellular Biology, 2005, 25(14):5933-5946. DOI:10.1128/MCB.25.14.5933-5946.2005.
[100] YAMAMOTO Y, GAYNORA R B. Therapeutic potential of inhibition of the NF-κB pathway in the treatment of inf l ammation and cancer[J].Journal of Clinical Investigation, 2001, 107(2): 135-142. DOI:10.1172/JCI11914.
[101] ITOH K, MOCHIZUKI M, ISHII Y, et al. Transcription factor Nrf2 regulates inflammation by mediating the effect of 15-deoxydelta(12,14)-prostaglandin j(2)[J]. Molecular & Cellular Biology,2004, 24(1): 36-45. DOI:10.1128/MCB.24.1.36-45.2004.
[102] WU T Y, KHOR T O, SU Z Y, et al. Epigenetic Modif i cations of Nrf2 by 3,3’-diindolylmethane in vitro in TRAMP C1 cell line and in vivo TRAMP prostate tumors[J]. The AAPS Journal, 2013, 15(3): 864-874.DOI:10.1208/s12248-013-9493-3.
[103] STEPKOWSKI T M,KRUSZESKI M K. Molecular cross-talk between the NRF2/KEAP1 signaling pathway, autophagy, and apoptosis[J]. Free Radical Biology & Medicine, 2011, 50(9):1186-1195. DOI:10.1016/j.freeradbiomed.2011.01.033.
[104] KHODAGHOLI F, TUSI S K. Stabilization of Nrf2 by tBHQ prevents LPS-induced apoptosis in differentiated PC12 cells[J]. Molecular and Cellular Biochemistry, 2011, 354(1): 97-112. DOI:10.1007/s11010-011-0809-2.
