小檗碱活化AMPK-eNOS减轻油酸所致人主动脉内皮细胞损伤
2018-03-20侯文锋王尧清张文彦马成俊孟庆国孙喜灵王振华
周 慧,刘 敬,侯文锋,王尧清,张文彦,许 波,马成俊,李 忌,孟庆国,孙喜灵,王振华,*
(1.烟台大学生命科学学院,线粒体与健康衰老研究中心,山东 烟台 264005;2.石河子大学药学院,新疆特种植物药资源教育部重点实验室,新疆 石河子 832002;3.烟台大学 新型制剂与生物技术药物研究山东省高校协同创新中心,分子药理和药物评价教育部重点实验室,山东 烟台 264005;4.滨州医学院 山东省中医证候研究重点实验室,山东 烟台 264003)
高脂饮食导致的肥胖成为21世纪威胁人类健康的重要因素之一,肥胖是引起Ⅱ型糖尿病、心血管疾病的主要因素,肥胖所引发的全身性、低水平的慢性炎症可引起胰岛素抵抗、高血压、高血脂等一系列代谢综合征。越来越多的证据显示,脂毒性所导致的血管内皮结构功能障碍在其中发挥了桥梁作用。
血管内皮在维持血管的结构和功能方面有着重要的作用。生理状态下内皮细胞通过合成分泌一氧化氮(nitric oxide,NO)、环前列腺素和内皮素等调节血管的张力,抑制血小板聚集和炎性细胞黏附[1-2]。外源性和内源性因子导致血管内皮细胞结构功能异常在包括动脉粥样硬化[3]、糖尿病[4]、中风[5]等诸多严重心脑血管事件中起关键作用。心脑血管事件最主要的危险因素是以高血脂为特征的脂代谢紊乱,血中高水平游离脂肪酸(free fatty acids,FFAs)导致的内皮细胞损害可能是其始动因素。
食品中FFAs在腊肉、火腿、奶酪等风味形成中起重要作用[6]。但肥胖和代谢综合征等人群中血浆高FFAs与胰岛素抵抗、代谢紊乱、慢性炎症、NO信号通路异常以及内皮功能障碍密切相关[7]。油酸(oleic acid,OA)是一种不饱和脂肪酸,可抑制血管内皮细胞中内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性,诱导内皮细胞线粒体合成过量活性氧(reactive oxygen species,ROS),造成氧化胁迫损伤[8]。
小檗碱又称黄连素,是一种季铵型异喹啉生物碱,它存在于毛茛科黄连(Coptis chinensis Franch.)及小檗科等4 个科10 个属的许多植物中,在传统医药中被广泛应用于痢疾和感染腹泻的治疗[9]。Lau等[10]发现小檗碱具有正性肌力抗心律失常作用。Kong等[11]发现其活化细胞外调节蛋白激酶上调低密度脂蛋白受体的表达,降低胆固醇。Wu等[12]发现小檗碱能够减少脂多糖引发的白细胞与血管内皮细胞黏附。Zhang Ming等[13]发现小檗碱可激活人脐静脉内皮细胞能量感受器——单磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK),从而轻微改善棕榈酸致脐静脉内皮细胞eNOS下调和NO分泌障碍(P<0.05),但未能明显改善棕榈酸所致脐静脉内皮细胞增殖抑制的作用。考虑到FFAs致动脉内皮结构功能障碍在心血管事件发生中起关键作用,本研究考察了小檗碱对油酸所致人主动脉内皮细胞(human aorta endothelial cells,HAEC)增殖抑制和NO分泌受损及氧化胁迫的影响,以期为其用于改善脂毒性所致动脉内皮结构功能障碍提供初步数据。
1 材料与方法
1.1 材料与试剂
HAEC购自中国科学院上海细胞库,由烟台大学线粒体与健康衰老中心传代保存,复苏后10 代以内用于实验。
盐酸小檗碱水合物、OA 阿拉丁试剂(上海)有限公司;DMEM培养基、胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;兔抗Thr172磷酸化AMPK(p-AMPK)、总AMPK抗体 美国Cell Signaling公司;鼠抗β-actin抗体、兔抗p-eNOS(ser1177)抗体、鼠抗eNOS抗体 美国Abcam公司;甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)试剂盒 南京建成生物工程研究所;100 mmol/L苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)溶液(ST506)、RIPA裂解液(P0013B)、P0009增强型二喹啉甲酸(bicinchoninic acid,BCA)蛋白质量浓度测定试剂盒、BeyoECL Plus P0018超敏ECL化学发光试剂盒 上海碧云天生物技术公司。
1.2 仪器与设备
AE-31型荧光倒置显微镜 麦克奥迪实业集团有限公司;SpectraMax Paradigm型多功能酶标仪 美国美谷分子仪器有限公司;电泳槽、电泳仪 北京伯乐仪器厂;5200凝胶成像系统 上海天能科技有限公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 细胞培养
用含体积分数10% FBS、100 U/mL青霉素、100 µg/mL链霉素的DMEM高糖完全培养基于37 ℃、5% CO2条件下培养细胞。
1.3.2 MTT法检测细胞活力
[1 4]方法,取对数生长期细胞,以5×104mL-1的密度接种于96 孔板,每孔加100 μL,待细胞贴壁后,加入不同浓度的油酸(150、300、450、900 μmol/L)分别处理24、48、72 h,另设不含油酸的培养基作为正常对照组。小檗碱处理组:不同浓度(0、1、5、10、20 μmol/L)小檗碱处理24 h;小檗碱与油酸处理组:不同浓度小檗碱(0、1、5、10、20 μmol/L)预处理2 h,加入300 μmol/L的油酸继续处理24 h,另设不含小檗碱与油酸的完全培养基作为正常对照组,并以正常对照组为1进行数据处理。每孔加入10 μL MTT(0.5 mg/mL)在37 ℃条件下继续孵育4 h后,弃上清液,每孔加150 μL DMSO,37 ℃条件下振荡15 min,使结晶物充分溶解,多功能酶标仪在490 nm波长处测量吸光度。细胞活力按下式计算。

1.3.3 脂质水平的测定
HAEC接种于6 孔板,长至80%融合,以不同浓度的油酸处理24 h后,弃去孔内培养液,用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗1 遍,吸净PBS,加入500 μL含1 mmol/L PMSF的RIPA裂解液,刮下孔内的细胞,全部收集于1.5 mL离心管中,冰浴超声30 s,按试剂盒说明书测定细胞内TC、TG水平,采用BCA法测定蛋白质量浓度,以1 mg蛋白质校正TG、TC水平。
1.3.4 油红O染色检测HAEC脂滴形成
参照文献[15]采用油红O染色检测HAEC脂滴形成。称取油红O干粉1.8 g加入到300 mL异丙醇中密封,置于37 ℃水浴中加热,磁力搅拌器上充分搅拌使其溶解,过滤,母液可长期室温保存,检测时将油红O与三蒸水以3∶2(V/V)的比列混合。药物处理后,细胞用4%的多聚甲醛溶液固定30 min,用PBS清洗3 次,加油红O检测液染色1 h,再加入70%乙醇溶液浸洗1 min,PBS清洗2 次,显微镜观察拍照。
1.3.5 NO含量的测定
NO含量的测定参照文献[16]。HAEC培养于24 孔板,待细胞生长至80%融合时,更换含盐酸小檗碱水合物的无血清培养基,处理2 h后,按照试剂盒说明书吸取细胞培养液进行测定。
1.3.6 DCFH-DA探针检测细胞ROS
参照文献[17],利用2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorodi-hydrof l uorescein diacetate,DCFH-DA)探针检测细胞ROS。HAEC培养于96 孔底透板,待细胞生长至80%融合时,加盐酸小檗碱水合物处理30 min后,弃原培养液,PBS润洗3 次,加入100 μL 5 μmol/L DCFH-DA PBS,37 ℃条件下避光孵育30 min,PBS清洗3 次,以除去未结合的荧光染料,用荧光酶标仪(Ex/Em=485/530 nm)测定各孔荧光值。
1.3.7 Western Blotting分析
HAEC接种于6 孔板,待细胞生长至80%融合,以不同浓度小檗碱预处理2 h后,补充油酸至终浓度为300 μmol/L,继续孵育6 h,用预冷的PBS洗涤2 次,加入500 μL含1 mmol/L PMSF的RIPA裂解液,刮下孔内的细胞,全部收集至1.5 mL离心管中,冰浴超声处理30 s,10 000×g离心10 min,收集上清液,BCA法检测蛋白质量浓度。样品煮沸10 min致蛋白变性后,取30 μg蛋白样品用于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析。根据胶的分离范围,AMPK采用10%分离胶、eNOS采用8%的分离胶,统一采用5%浓缩胶分离蛋白进行分析。300 mA转膜100 min至聚偏二氟乙烯膜,用5%脱脂乳粉封闭2 h,用1∶1 000稀释的兔抗p-AMPK抗体和p-eNOS抗体4 ℃孵育过夜,TBST(tris buffered saline with Tween)溶液清洗3 次,每次10 min,再用1∶2 000稀释的辣根过氧化物酶标二抗室温孵育1 h,TBST溶液洗涤3 次后,BeyoECL Plus试剂盒显影,5200凝胶成像系统拍照,Gis ID软件分析蛋白条带的相对光密度值。
1.4 数据处理
所有实验每个处理均设3 个平行孔,每组实验重复3 次,结果以表示,用SPSS 22.0分析软件进行数据统计分析。组间统计学差异比较采用独立样本t检验,其中P<0.05为具有统计学显著性差异,P<0.01为具有统计学极显著差异。
2 结果与分析
2.1 油酸暴露对HAEC活力的影响
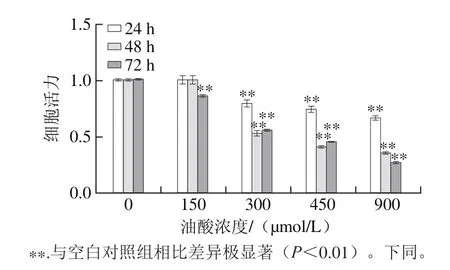
图1 油酸处理对HAEC增殖活力的影响Fig.1 Effect of oleic acid on proliferation viability of HAECs
由图1可知,HAEC暴露于150~900 μmol/L油酸中,MTT比色测定显示细胞增殖受到油酸浓度依赖性抑制,且随暴露时间延长,细胞增殖抑制加剧。300 μmol/L的油酸处理HAEC 48 h,细胞增殖活力仅为0.52(P<0.01)。
2.2 油酸处理对HAEC中TC和TG含量的影响
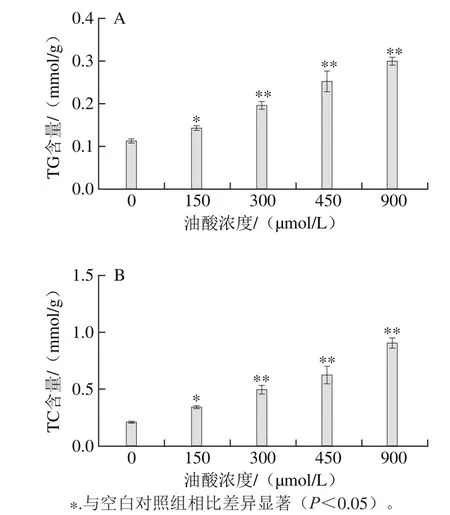
图2 油酸处理对HAEC中TG(A)和TC(B)含量的影响Fig.2 Effect of oleic acid on TG (A) and TC (B) contents in HAECs
不同浓度的油酸处理HAEC,用TG、TC试剂盒测定其脂质堆积情况,由图2可知,油酸可浓度依赖性地增加HAEC内TG和TC的含量,且具有统计学差异。
2.3 小檗碱对油酸致细胞增殖的干预作用
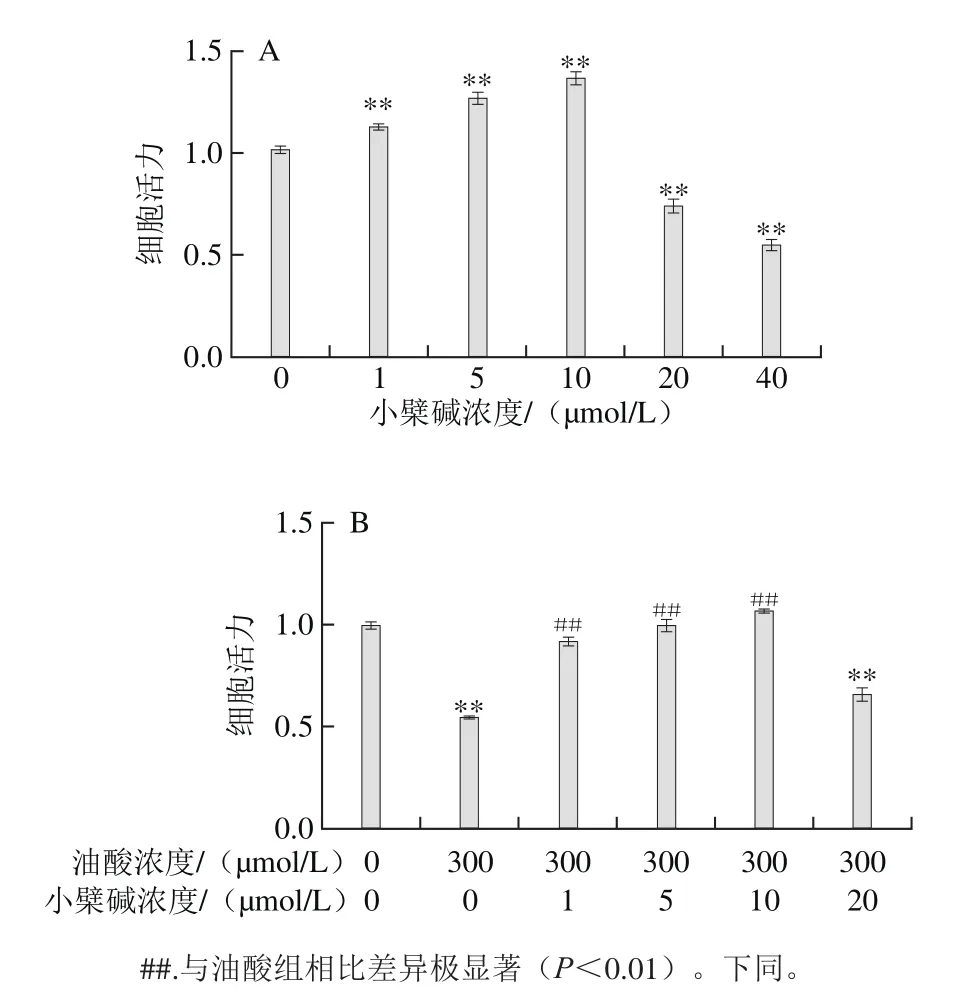
图3 小檗碱单独(A)和小檗碱联合油酸(B)对HAEC增殖的影响Fig.3 Effect of berberine alone and in combination oleic acid on the proliferation of HAECs
由图3A可知,用不同浓度的小檗碱处理HAEC 24 h后,浓度为1、5、10 μmol/L的小檗碱能够促进细胞的增殖,但20、40 μmol/L小檗碱可明显抑制HAEC增殖,表明过高浓度的小檗碱有一定的细胞毒性。由图3B可知,小檗碱与300 μmol/L油酸联合处理HAEC后,浓度为1、5、10 μmol/L的小檗碱可明显改善油酸对HAEC增殖的抑制作用(P<0.01),然而20 μmol/L小檗碱未表现出类似效果,表明低浓度小檗碱对油酸所致内皮细胞增殖抑制有改善作用。
2.4 小檗碱对油酸所致HAEC内TC、TG和脂滴形成的影响
由图4可知,300 μmol/L油酸致HAEC内TC和TG水平均明显升高(P<0.01);小檗碱与油酸联合处理,可浓度依赖性地抑制油酸暴露所致HAEC内TG和TC水平的升高。
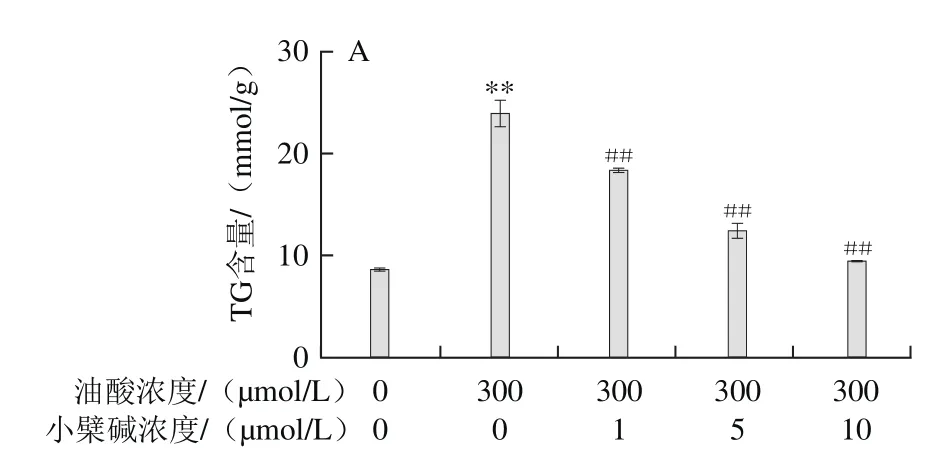
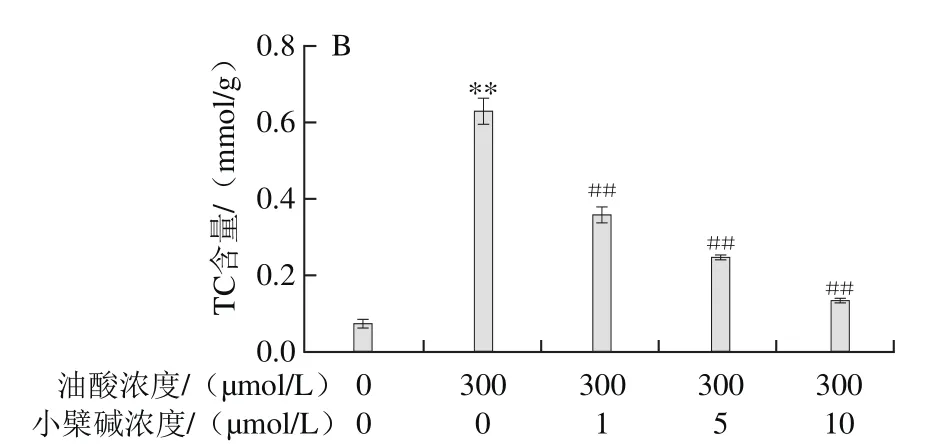
图4 小檗碱对油酸所致HAEC内TG (A)、TC(B)含量升高的影响Fig.4 Effect of berberine on the increase of TG (A) and TC (B)induced by oleic acid in HAECs
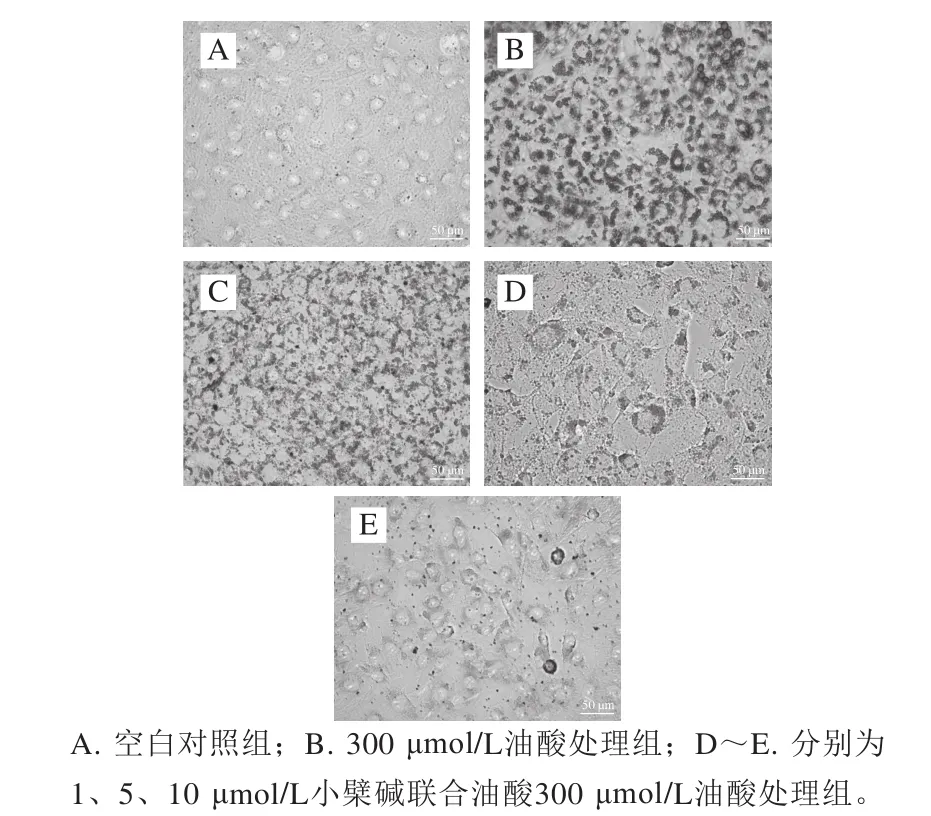
图5 小檗碱对油酸所致的HAEC内皮细胞脂质形成的影响(400×)Fig.5 Effect of berberine (BER) on intracellular lipid accumulation induced by oleic acid (OA) in HAECs (400 ×)
由图5可知,油红O染色显示空白对照组细胞基本不着色,300 μmol/L油酸处理24 h后HAEC着色明显;小檗碱联合油酸共同处理后,细胞内脂滴密度和着色均明显低于油酸处理组。结果表明,小檗碱可抑制油酸诱导的HAEC脂肪合成。
2.5 小檗碱对油酸所致HAEC的NO合成障碍的影响
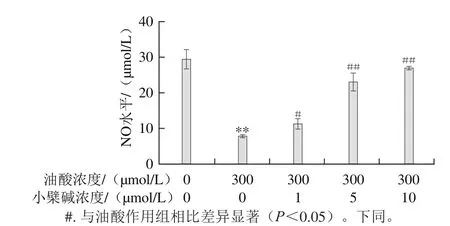
图6 小檗碱对油酸所致HAEC的NO合成障碍的影响Fig.6 Effect of berberine on NO secretion impairment induced by oleic acid in HAECs
合成和分泌NO是血管内皮细胞的重要功能。由图6可知,300 μmol/L油酸处理HAEC 2 h,可明显降低细胞培养上清液中的NO含量(P<0.01);小檗碱与油酸联合处理后,明显改善了油酸所致HAEC的NO含量降低(P<0.01),且改善效果呈浓度依赖性。
2.6 小檗碱对油酸所致HAEC生成ROS的影响
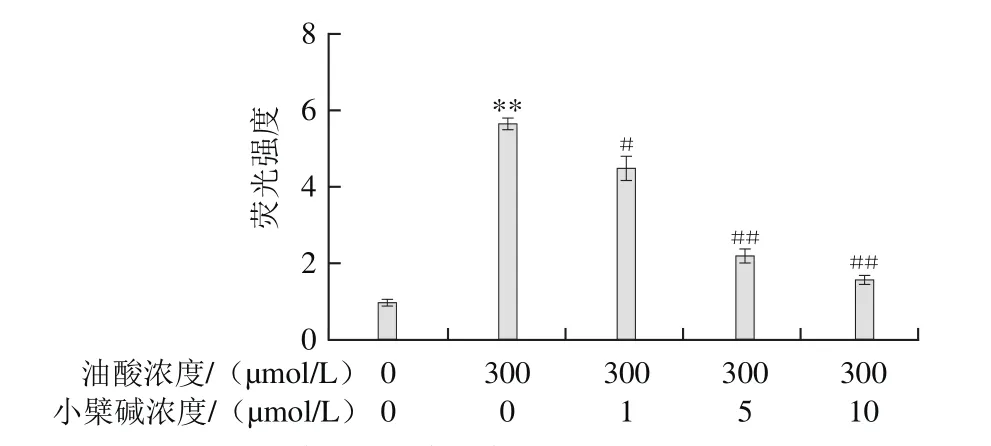
图7 小檗碱对油酸所致HAEC生成ROS的影响Fig.7 Effect of berberine on the increase of ROS induced by oleic acid in HAECs
血管内皮细胞合成适量的ROS可作为信号分子调控多种重要的生理活动,但过量ROS可致内皮细胞受氧化胁迫损伤。本实验采用DCFH-DA荧光探针测定了HAEC内ROS水平。图7结果表明,以300 μmol/L油酸处理HAEC 30 min后,细胞内荧光强度明显升高(P<0.01);而小檗碱与油酸联合处理,可浓度依赖性抑制油酸所致的荧光强度升高,表明小檗碱可改善油酸所致HAEC内的氧化胁迫状态。
2.7 小檗碱对油酸所致AMPK/eNOS通路下调作用的影响
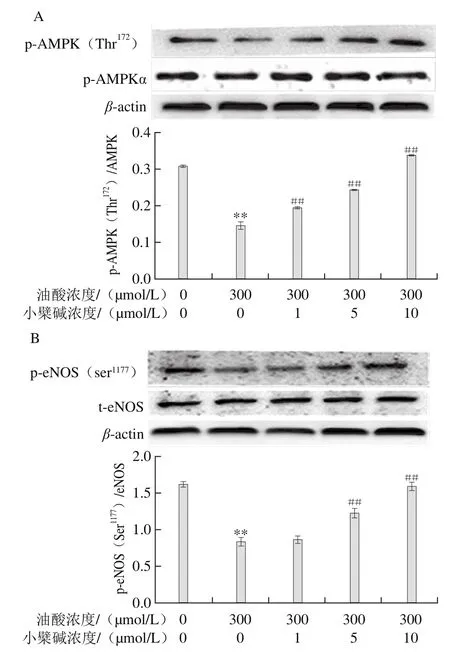
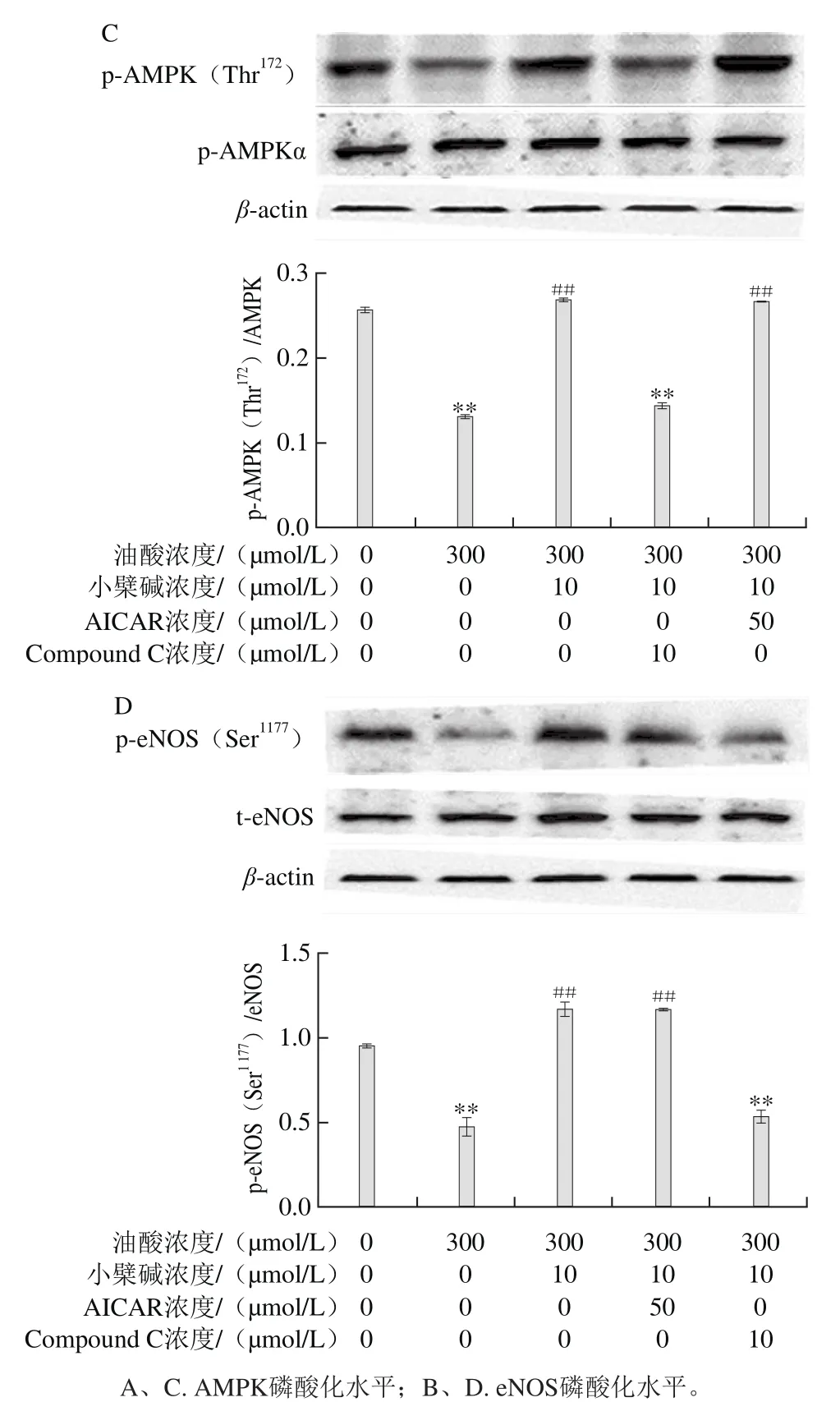
图8 小檗碱对油酸所致AMPK/eNOS通路下调作用的影响Fig.8 Effect of berberine on the down-regulation of the AMPK/eNOS signaling pathway induced by oleic acid in HAECs
AMPK是细胞能量代谢的感受器,在调控糖脂代谢偶联和氧化还原平衡状态方面起核心作用。在Ca2+-钙调素存在下,AMPK可直接磷酸化eNOS的Ser 1177位点,激活其合成NO[18]。由图8可见,HAEC暴露于油酸后,AMPK和eNOS的磷酸化水平均明显降低(P<0.01),小檗碱可浓度依赖性地改善油酸对AMPK/eNOS活化的下调作用。AMPK抑制剂Compound C与小檗碱联合应用,完全抑制了小檗碱对AMPK和eNOS磷酸化的上调作用,AMPK激活剂AICAR与小檗碱联用,未进一步增强小檗碱活性,表明小檗碱激活eNOS和促进NO合成与激活AMPK相关。
3 讨 论
完整的血管内皮系统作为血液与组织的一线屏障,在维护血管通透性、分泌多种血管活性物质调控血流动力学等方面起关键作用。动脉血管内皮细胞结构功能受损是血管反应性降低,动脉粥样硬化及血栓形成的始动因素。血浆中高FFAs导致的动脉血管内皮系统损害与胰岛素抵抗、慢性炎症应激、高血压和心脑血管事件发生具有直接相关性,但脂毒性介导的血管内皮结构功能损害的确切机制仍未阐明,临床亦未有理想的干预措施。油酸作为食品中广泛存在的单链不饱合脂肪酸,近年亦发现其损害微血管内皮细胞合成NO的能力,促进线粒体ROS生成,造成血管内皮细胞损害[19]。氧分子通过单电子还原生成的超氧离子()可与NO直接反应形成ONOO-,降低NO的生物利用度,也可导致ROS解偶联后生成更多的。因此,本研究选用油酸暴露使HAEC受脂毒性损害,考察了油酸对细胞增殖、脂质合成、NO释放和ROS生成的影响,发现油酸可浓度依赖性地抑制HAEC的增殖,300 μmol/L油酸明显促进HAEC内脂质合成,提高细胞内ROS水平,抑制NO分泌,表明油酸可造成HAEC结构和功能的损害。
近年来发现细胞能量感受器AMPK信号系统在维持细胞能量稳态和适应性反应中扮演关键角色[21]。在肥胖、代谢综合征和糖尿病等代谢性疾病中,活化AMPK能够抑制脂肪酸和TG的合成,并且刺激脂肪酸氧化和线粒体的生物合成,从而抑制氧化应激状态和胰岛素抵抗发生,改善腹型肥胖和高血压等病理进程[22]。Deng等[23]研究证实脂联素可以通过AMPK/eNOS通路来改善肥胖大鼠血管内皮功能紊乱。Guo等[24]发现小分子AMPK激活剂可明显改善代谢综合征动物模型脂代谢紊乱的症状,降低血液和肝脏中TG和TC水平。本研究中发现油酸处理HAEC对总AMPK蛋白表达未有明显影响,但可明显下调其磷酸化水平,同时eNOS磷酸化水平也相应下调,小檗碱可浓度依赖性地改善油酸对AMPK/eNOS活化的抑制作用。Wang Qilong等[25]对比研究了敲除AMPKα2对高脂饮食致ApoE-/-小鼠动脉硬化形成的影响及小檗碱的干预作用,发现AMPKα2介导的线粒体生物合成和解偶联蛋白UCP2表达与小檗碱减少动脉硬化的形成相关。Zhang Ming等[13]采用人脐静脉内皮细胞作为受试对象,初步证实了小檗碱通过活化AMPK/eNOS通路,改善了棕榈酸对脐静脉内皮细胞NO分泌及氧化胁迫损害的干预作用,但仍缺乏小檗碱对动脉内皮细胞脂毒性干预作用的证据。但Guo Ting等[26]在采用小檗碱干预高脂喂养小鼠所致肝脏脂肪变性的研究中,未观察到小檗碱对AMPK磷酸化水平有明显影响,仅见其对JNK1磷酸化的下调作用。Chen Weijia等[27]发现小檗碱预处理可明显改善脑缺血再灌注损伤所导致的脑损伤及神经元凋亡,但下调了AMPK的磷酸化水平。目前,尚未阐明小檗碱调控不同组织AMPK差异的分子机制,值得深入探究。
高水平FFAs可通过活化NF-κB炎症信号通路,下调血管内皮细胞胰岛素受体亚基1对eNOS的磷酸化,抑制NO合成,介导了血管内皮的脂毒性损害[28]。本研究中观察到油酸下调了AMPK和eNOS的磷酸化水平,而小檗碱可明显抑制油酸对AMPK/eNOS磷酸化的下调作用,从而剂量依赖性地促进HAEC分泌NO。AMPK抑制剂Compound C可明显拮抗小檗碱活化AMPK/eNOS,但AMPK激活剂AICAR未能进一步增强小檗碱对AMPK的活化作用,表明小檗碱通过激活AMPK信号活化了eNOS,从而改善了油酸对HAEC的脂毒性。
综上所述,小檗碱可以改善油酸导致的HAEC损伤,其机制与其拮抗油酸下调AMPK/eNOS信号通路和促进内源性NO合成相关。小檗碱一方面可减少血管内皮细胞内的脂质堆积;另一方面可抑制ROS生成,增加NO分泌,这些结果为小檗碱防治肥胖相关心血管疾病的发生提供了重要的实验依据。
参考文献:
[1] TRIGGLE C R, DING H. A review of endothelial dysfunction in diabetes: a focus on the contribution of a dysfunctional eNOS[J].Journal of the American Society of Hypertension, 2010, 4(3): 102-115.DOI:10.1016/j.jash.2010.02.004.
[2] KOJDA G, HARRISON D. Interactions between NO and reactive oxygen species: pathophysiological importance in atherosclerosis,hypertension, diabetes and heart failure[J]. Cardiovascular Research,1999, 43(3): 562-571. DOI:10.1016/S0008-6363(99)00169-8.
[3] DAVIGNON J, GANZ P. Role of endothelial dysfunction in atherosclerosis[J]. Circulation, 2004, 109(23 Suppl 1): 27-32.DOI:10.1161/01.CIR.0000131515.03336.f8.
[4] GIUGLIANO D, CERIELLO A, PAOLISSO G. Oxidative stress and diabetic vascular complications[J]. Diabetes Care, 1996, 19(3):257-267. DOI:10.2337/diacare.19.3.257.
[5] HIGASHI Y, NOMA K, YOSHIZUMI M, et al. Endothelial function and oxidative stress in cardiovascular diseases[J]. Circulation Journal Off i cial Journal of the Japanese Circulation Society, 2009, 73(3): 411-418.DOI:10.1253/circj.CJ-08-1102.
[6] 邓文辉, 赵燕, 李建科, 等. 游离脂肪酸在几种常见食品风味形成中的作用[J]. 食品工业科技, 2012, 33(11): 422-425. DOI:10.13386/j.issn1002-0306.2012.11.105.
[7] PRIETO D, CONTRERS C, SANCHEZ A. Endothelial dysfunction,obesity and insulin resistance[J]. Current Vascular Pharmacology,2014, 12(3): 412-426. DOI:10.2174/1570161112666140423221008.
[8] GREMMELS H, BEVERS L M, FLEDDERUS J O, et al. Oleic acid increases mitochondrial reactive oxygen species production and decreases endothelial nitric oxide synthase activity in cultured endothelial cells[J]. European Journal of Pharmacology, 2015, 751:67-72. DOI:10.1016/j.ejphar.2015.01.005.
[9] 刘丹. 小檗碱缓解伊立替康对肠道免疫系统损伤的机制研究[D].大连: 大连医科大学, 2014: 61-67.
[10] LAU C W, YAO X Q, CHEN Z Y, et al. Cardiovascular actions of berberine[J]. Cardiovascular Therapeutics, 2001, 19(3): 234-244.DOI:10.1111/j.1527-3466.2001.tb00068.
[11] KONG W, WEI J, ABIDI P, et al. Berberine is a novel cholesterollowering drug working through a unique mechanism distinct from statins[J]. Nature Medcine, 2004, 10(12): 1344-1351. DOI:10.1038/nm1135.
[12] WU Y H, CHUANG S Y, HONG W C, et al. Berberine reduces leukocyte adhesion to LPS-stimulated endothelial cells and VCAM-1 expression both in vivo and in vitro[J]. International Journal of Immunopathology and Pharmacology, 2012, 25(3): 741-750.DOI:10.1177/039463201202500320.
[13] ZHANG Ming, WANG Chunmei, LI Jing, et al. Berberine protects against palmitate-induced endothelial dysfunction: involvements of upregulation of AMPK and eNOS and downregulation of NOX4[J]. Mediators of Inflammation, 2013, 2013: 1-8.DOI:10.1155/2013/260464.
[14] AL-RUZZEH S, SCHMIDT I, NAKAMURA K, et al. Cerivastatin does not prevent oxidative injury of human aortic endothelial cells[J].Texas Heart Institute Journal, 2004, 31(2): 127-131.
[15] 邱理红, 王占洋, 李雅娟, 等. 异甘草素对3T3-L1前脂肪细胞分化的抑制作用[J]. 食品科学, 2016, 37(1): 157-162. DOI:10.7506/spkx1002-6630-201601028.
[16] ZHENG Z Q, YU S P, ZHANG W, et al. Genistein attenuates monocrotaline-induced pulmonary arterial hypertension in rats by activating PI3K/Akt/eNOS signaling[J]. Histology and Histopathology,2017, 32(1): 35-41. DOI:10.14670/HH-11-768.
[17] ISHIKI M, NISHIDA Y, ISHIBASHI H, et al. Impact of divergent effects of astaxanthin on insulin signaling in L6 cells[J].Endocrinology, 2013, 154(8): 2600-2612. DOI:10.1210/en.2012-2198.
[18] CHEN Z P, MITCHELHILL K I, MICHELL B J, et al. AMP-activated protein kinase phosphorylation of endothelial NO synthase[J]. FEBS Letters, 1999, 443(3): 285-289. DOI:1016/s0014-5793(98)01705-0.
[19] GREMMELS H, BEVERS L M, FLEDDERUS J O, et al. Oleic acid increases mitochondrial reactive oxygen species production and decreases endothelial nitric oxide synthase activity in cultured endothelial cells[J]. European Journal of Pharmacology, 2015, 751:67-72. DOI:10.1016/j.ejphar.2015.01.005.
[20] MARITIM A C, SANDERS R A, WATKINS J B, et al. Diabetes,oxidative stress, and antioxidants: a review[J]. Journal of Biochemical and Molecular Toxicology, 2003, 17(1): 24-38. DOI:10.1002/jbt.10058.
[21] DAVAL M, FOUFELLE F, FERRÉ P, et al. Functions of AMP-activated protein kinase in adipose tissue[J]. Journal of Physiology,2006. 574(1): 55-62. DOI:10.1113/jphysiol.2006.111484.
[22] HARDIE D G. AMPK: a key regulator of energy balance in the single cell and the whole organism[J]. International Journal of Obesity, 2008,32(Suppl 4): S7-S12 . DOI:10.1038/ijo.2008.116.
[23] DENG G, LONG Y, YU Y R, et al. Adiponectin directly improves endothelial dysfunction in obese rats through the AMPK-eNOS pathway[J]. International Journal of Obesity, 2010, 34(1): 165-171.DOI:10.1038/ijo.2009.205.
[24] GUO H, LIU G, ZHONG R, et al. Cyanidin-3-O-β-glucoside regulates fatty acid metabolism via an AMP-activated protein kinase-dependent signaling pathway in human HepG2 cells[J]. Lipids in Health and Disease, 2012, 11(1): 10. DOI:10.1186/1476-511X-11-10.
[25] WANG Qilong, ZHANG Miao, LIANG Bin, et al. Activation of AMP-activated protein kinase is required for berberine-induced reduction of atherosclerosis in mice: the role of uncoupling protein 2[J]. PLoS ONE, 2011, 6(9): e25436. DOI:10.1371/journal.pone.0025436.
[26] GUO Ting, WOO S L, GUO Xin, et al. Berberine ameliorates hepatic steatosis and suppresses liver and adipose tissue inflammation in mice with diet-induced obesity[J]. Scientific Reports, 2016: 1-11.DOI:10.1038/serp22612.
[27] CHEN Weijia, WEI Shengnan, YU Yang, et al. Pretreatment of rats with increased bioavailable berberine attenuates cerebral ischemiareperfusion injury via down regulation of adenosine-5’ monophosphate kinase activity[J]. European Journal of Pharmacology, 2016, 779:80-90. DOI:10.1016/j.ejphar.2016.03.015.
[28] KIM F, TYSSELING K A, RICE J, et al. Free fatty acid impairment of nitric oxide production in endothelial cells is mediated by IKKβ[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2005, 25(5):989-994. DOI:10.1161/01.ATV.0000160549.60980.a8.
