鲍内脏蛋白肽抗氧化和免疫调节活性
2018-03-20何传波魏好程熊何健吴国宏吴建勇
何传波,邵 杰,魏好程,熊何健,吴国宏,马 英*,吴建勇
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.集美大学水产学院,福建 厦门 361021;3.香港理工大学应用生物与化学科技学系,香港 999077)
鲍属于单壳海洋贝类,腹足纲,前鳃亚纲,原始腹足目,鲍科。自古以来鲍就是我国的名贵食材,因其肉质鲜美,营养丰富,享有“海味之冠”的美誉,深受人们的喜爱[1]。据统计,2014年,我国鲍年产量达12万 t左右,总产值达142.3亿 元,其中,福建省鲍养殖量占全国的75%以上,位居第一[2]。目前,市场上经过加工的鲍产品主要有速冻鲍、罐头鲍、干制鲍、鲍调味品和鲍营养保健品[3]。然而,在鲍加工过程中会产生大量的鲍内脏,这些内脏占鲍质量的25%以上,而鲍内脏中含有丰富的蛋白质、多糖、脂肪酸等营养成分和对人身体有益的生物活性物质[4-6],直接废弃既浪费资源又污染环境。
由于海洋生物生存的环境与陆地生物完全不同,如高压、低温、高温和高盐等,为适应这些极端的海洋环境,海洋生物蛋白质无论氨基酸的组成还是氨基酸的序列都与陆地生物蛋白有很大的不同,因此海洋生物是新型活性肽的丰富来源[7]。大量文献报道证实,海洋生物活性肽具有抗菌、抗肿瘤、降血压、抗氧化、降血脂、降血糖等诸多生理功能[8-11]。然而,天然存在的活性肽大部分含量微少,又难提取,不足以大量生产供给所需,因此,近年来人们更多地把目光投向开发蛋白酶解产物获得海洋活性肽这条途径上来。低值鱼类、水产加工下脚料是我国的大宗低值蛋白质资源,是获取活性肽的首选原料,其高值化综合利用已成为我国水产高技术发展的重要研究内容。
本研究以福建养殖的皱纹盘鲍(Haliotis discus hannai Ino)内脏为原料,利用碱性蛋白酶酶解和超滤技术联合制备鲍内脏蛋白肽(abalone visceral protein peptide,AVPP),对其抗氧化和免疫调节活性进行探讨,以期为鲍内脏功能性食品的开发利用提供实验依据。同时,实验结果对促进海洋动物源蛋白资源的高值化开发利用、减少环境污染、延长鲍加工产业链具有积极意义。
1 材料与方法
1.1 动物、材料与试剂
冷冻皱纹盘鲍内脏由厦门岛之源生物科技有限公司提供,冻干、粉碎后于-18 ℃贮藏备用。
SPF级雄性KM小鼠、SPF级雄性BALB/c小鼠,体质量(18±2)g,均购于上海斯莱克实验动物有限责任公司,许可证号SCXK(沪)2012-0002。分笼饲养,每天光照12 h,动物房环境温度20~25 ℃,相对湿度50%~60%,自由进食进水,每天更换饲料、饮水和垫料,进行7 d适应性喂养。小鼠维持饲料,A级,合格证号:SCXK(京)2014-0010,购自北京科澳协力饲料有限公司。
碱性蛋白酶(1.53×105U/g) 诺维信(中国)生物技术有限公司;二苯基苦味酰基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、细胞色素c、抑肽酶、生长抑制素、氧化型谷胱甘肽(oxidized glutathione,GSSG)、还原型谷胱甘肽(reduced glutathione,GSH),均为色谱纯 美国Sigma公司;羟自由基试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽试剂盒、丙二醛(malonaldehyde,MDA)试剂盒、蛋白质羰基试剂盒 南京建成生物工程研究所;绵羊血红细胞(sheep red-blood cell,SRBC) 南京森贝伽生物科技有限公司;印度墨汁 厦门鹭隆生物科技有限公司;其余化学试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
JDG-0.2T真空冻干机 兰州科近真空冻干技术有限公司;RNF0460-011 多功能卷式膜小试设备 厦门福美科技有限公司;XLY2-23-0.75酶解罐 国贸集团;TDL-5离心机 上海安亭科学仪器厂;UV-8000A紫外-可见分光光度计 上海尤尼柯仪器有限公司;BS-124S电子天平、M35电子水分测定仪 德国赛多利斯股份有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;pH211台式酸度测定仪 北京哈纳科技有限公司;Ultimate3000高效液相色谱仪 美国DIONEX公司;MSI微型漩涡振荡器 广州科技实验室技术有限公司;SX2-10-13马弗炉 上海石研电炉有限公司;SHA-B水浴恒温振荡器 金坛市国旺仪器有限公司。
1.3 方法
1.3.1 AVPP的制备
取鲍内脏原料粉1 kg,按照料液比1∶50(m/V)加入50 L的水混合于100 L的酶解罐中,先用碱性蛋白酶酶解,酶解完成后95 ℃灭酶、冷却,酶解液过200 nm的微滤膜除杂,取一部分直接冻干即为鲍内脏酶解粗产物(abalone viscera crude extracts,AVCE);余下的酶解液过10 kDa的超滤膜,收集透过液冻干后即为AVPP样品。
1.3.2 理化指标的检测
多糖含量测定采用苯酚硫酸法[12];粗蛋白含量测定参照GB 5009.5—2010《食品中蛋白质的测定》;水分含量测定参照GB 5009.3—2010《食品中水分的测定》;脂肪含量测定参照GB/T 5009.6—2003《食品中脂肪的测定》;灰分含量测定参照GB 5009.4—2010《食品中灰分的测定》。
1.3.3 鲍内脏多肽分子质量的测定
参照GB/T 22729—2008《海洋鱼低聚肽粉》,色谱条件:本实验使用的凝胶柱为TSKgel G2000SWXL(7.8 mm×300 mm);流动相为乙腈-超纯水-三氟乙酸(45∶55∶0.1,V/V),流速0.5 mL/min;检测波长为220 nm;柱温30 ℃。校正曲线所用的标准品:GSH(分子质量307 Da)、GSSG(分子质量613 Da)、生长抑制素(分子质量1 636.7 Da)、抑肽酶(分子质量6 512 Da)、细胞色素c(分子质量12 384 Da)。
1.3.4 DPPH自由基清除率测定方法
称取20 mg的DPPH用无水乙醇溶解定容于500 mL容量瓶中。实验分为样品组(2 mL DPPH溶液+2 mL样品溶液)、对照组(2 mL乙醇+2 mL样品溶液)和空白组(2 mL DPPH溶液+2 mL溶剂)。不同的样品液充分混匀,静置30 min后在517 nm波长处测定吸光度[13]。DPPH自由基清除率根据式(1)计算。
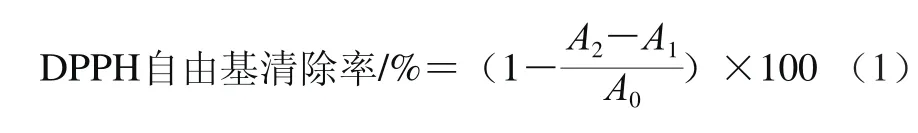
式中:A0、A1、A2分别为空白组、对照组、样品组的吸光度。
1.3.5 ·OH清除率测定
根据Fenton反应所产生的羟自由基(·OH)含量与H2O2浓度成正比,当给予电子受体后,用Griess试剂显色,形成红色物质,其呈色与·OH含量的多少成正比关系。严格按照试剂盒说明操作,VC及样品不同浓度下的·OH清除率分别根据式(2)、(3)计算。
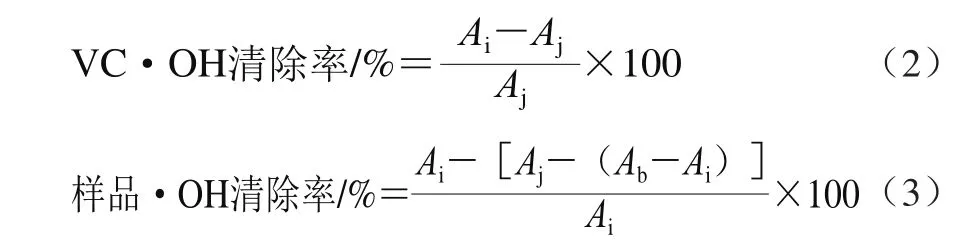
式中:Aj、Ai、Ab分别为样品管、对照管、空白管在550 nm波长处的吸光度。
1.3.6 动物分组及给药
1.3.6.1 体内抗氧化活性实验的动物分组及给药
KM小鼠适应环境后,随机分为7 组,每组10 只。分别为空白对照组,模型对照组,阳性对照组,AVPP低、中、高剂量组,AVCE组。空白对照组和模型对照组每天灌胃等体积的生理盐水,以VC为阳性对照组。参考文献[14],剂量设为VC 10 mg/(kg·d),AVPP低、中、高剂量组分别为300、600、1 200 mg/(kg·d),AVCE组为600 mg/(kg·d)。连续灌胃30 d后,除空白对照组外,其他各组小鼠禁食16 h,然后一次性灌胃给予50%乙醇溶液12 mL/kg mb,6 h后取材[15],测定小鼠肝组织中丙二醛含量、蛋白质羰基含量、GSH含量以及SOD活力。
1.3.6.2 免疫调节活性实验动物的分组及给药
BALB/c小鼠适应环境后,随机分为6 组,每组16 只。分别为空白对照组(生理盐水),阳性对照组(25 mg/(kg·d)盐酸左旋咪唑),AVPP低、中、高剂量组(300、600、1 200 mg/kg·d),AVCE组(600 mg/(kg·d)),灌胃给药。
1.3.7 抗氧化活性指标测定
SOD活力、GSH、MDA及蛋白质羰基含量均按照各试剂盒说明书方法进行测定。
1.3.8 免疫活性指标测定
迟发型变态反应、小鼠血清溶血素含量、小鼠碳廓清能力、吞噬指数的测定分别参照《增强免疫力功能评价方法》中足跖增厚法、血凝法、小鼠碳廓清实验等方法进行测定[16];免疫器官指数的测定:将小鼠处死,解剖后取出脾脏和胸腺,用滤纸吸干后,称质量。胸腺指数和脾脏指数分别按式(4)、(5)计算。

1.4 数据统计分析
采用SPSS 17.0软件对各组数据进行单因素方差分析,Duncan法进行多重比较,结果用 ±s表示。
2 结果与分析
2.1 原料和样品的基本成分分析
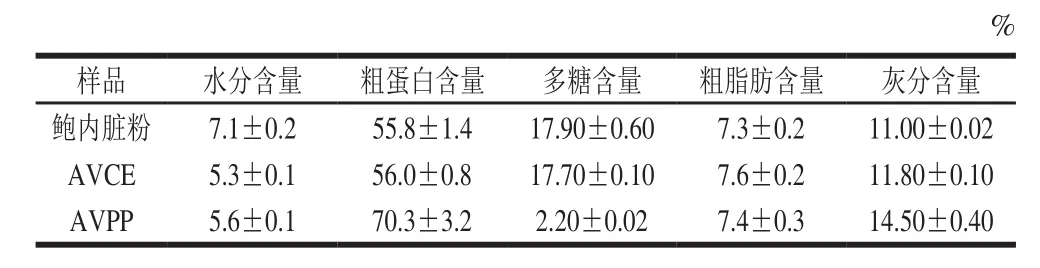
表1 原料和AVPP的基本成分Table1 Proximate compositions of abalone viscera and AVPP
由表1可知,原料鲍内脏粉及AVCE组成成分近似,均以蛋白质为主,含量大于55%,其次为多糖,占比接近18%,原料中灰分含量较高,这主要是与其生存的海洋环境有关。与前两者相比,AVPP的粗蛋白含量大幅增加,占比70.3%,而多糖含量显著降低,仅有2.20%,这表明实验采用的制备工艺是有效可行的,通过超滤可以将AVCE简单地按分子质量大小进行分离。
2.2 AVPP的分子质量分布
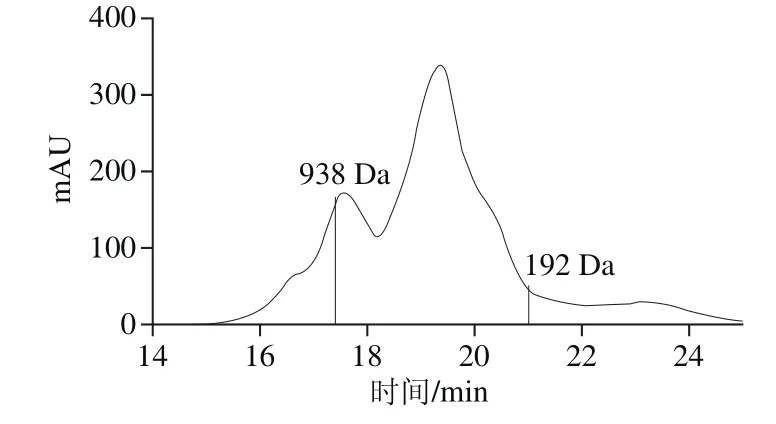
图1 AVPP的分子质量分布Fig.1 Molecular mass distribution of AVPP
为了研究AVPP的分子质量分布,本实验选用了5 种标准品,分别为GSH、GSSG、生长抑制素、抑肽酶和细胞色素c。通过标准品过凝胶柱的色谱图,测定酶解产物中AVPP样品的分子质量。标准品对应的洗脱时间如图1所示。其中细胞色素c洗脱时间为11.62 min,抑肽酶为13.56 min,生长抑制素为15.7 min,GSSG为18.38 min,GSH为19.58 min。相同条件下测定AVPP的分子质量,其分子质量的分布如图1所示。AVPP的分子质量主要分布在192~938 Da,这部分的峰面积占总面积的76.3%。
2.3 AVPP的体外抗氧化活性分析
2.3.1 AVPP对DPPH自由基的清除作用
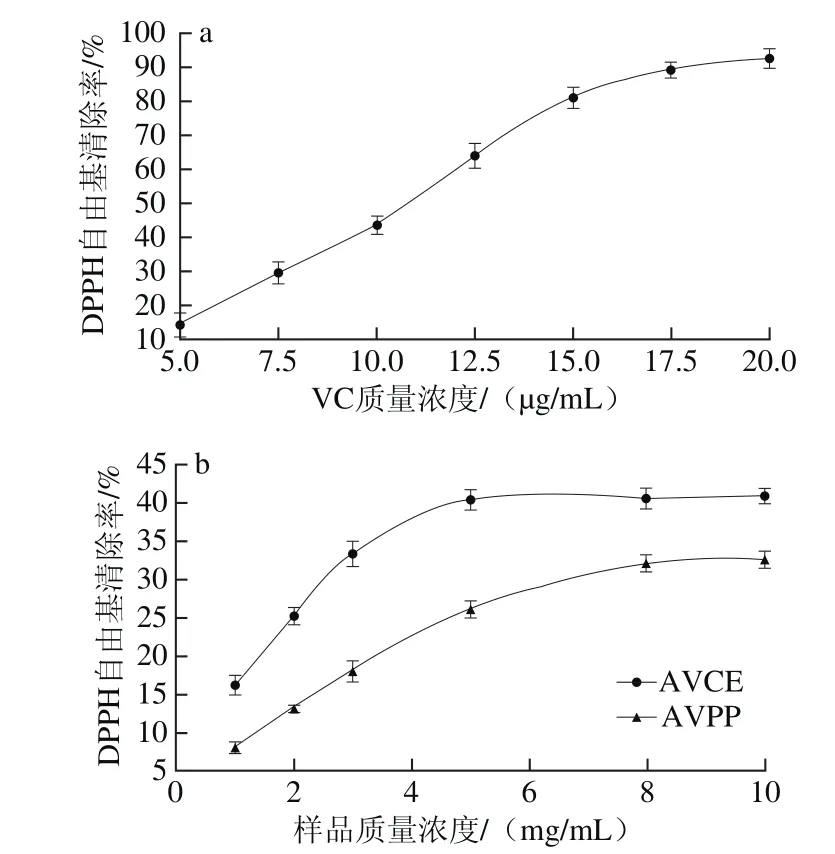
图2 VC(a)和AVPP(b)对DPPH自由基的清除作用Fig.2 DPPH radical scavenging activity of VC (a) and AVPP (b)
由图2可知,VC具有很强的DPPH自由基清除活性,AVCE和AVPP的清除活性相对较弱。随着样品质量浓度的增加,两者清除率也随之增加,且AVCE的DPPH自由基清除率高于AVPP。当质量浓度为5 mg/mL时,AVCE的清除率达到最大值为40.5%,之后基本保持平衡;当质量浓度为10 mg/mL时,AVPP的DPPH自由基清除率达到最大值,为32.7%。说明AVPP和AVCE均具有一定的清除DPPH自由基的作用,且AVCE的清除能力较好。
2.3.2 AVPP对·OH的清除作用
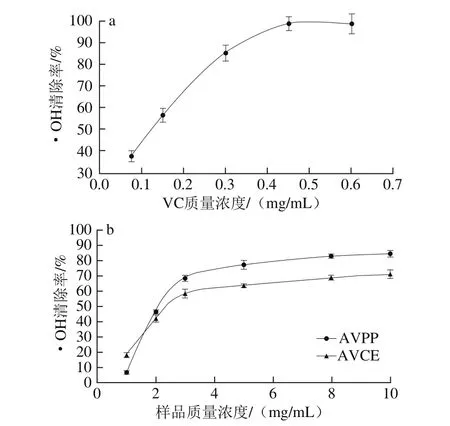
图3 VC(a)和AVPP(b)对·OH的清除作用Fig.3 Hydroxyl radical scavenging activity of VC (a) and AVPP (b)
由图3可知,与VC相比,AVCE和AVPP清除·OH的能力相对较弱。随着样品质量浓度的增加,两者清除·OH的能力也随之升高。当质量浓度低于1 mg/mL时,AVCE清除·OH的能力大于AVPP,当质量浓度为2 mg/mL时,二者的清除效果相近;当质量浓度大于2 mg/mL时,AVPP清除·OH的能力大于AVCE。对二者的曲线做回归方程并计算半抑制浓度(half maximal inhibitory concentration,IC50),AVPP的IC50为2.1 mg/mL,AVCE为2.4 mg/mL。说明AVPP和AVCE均具有一定的清除·OH能力,且AVPP的清除作用优于AVCE。
2.4 AVPP对小鼠体质量的影响
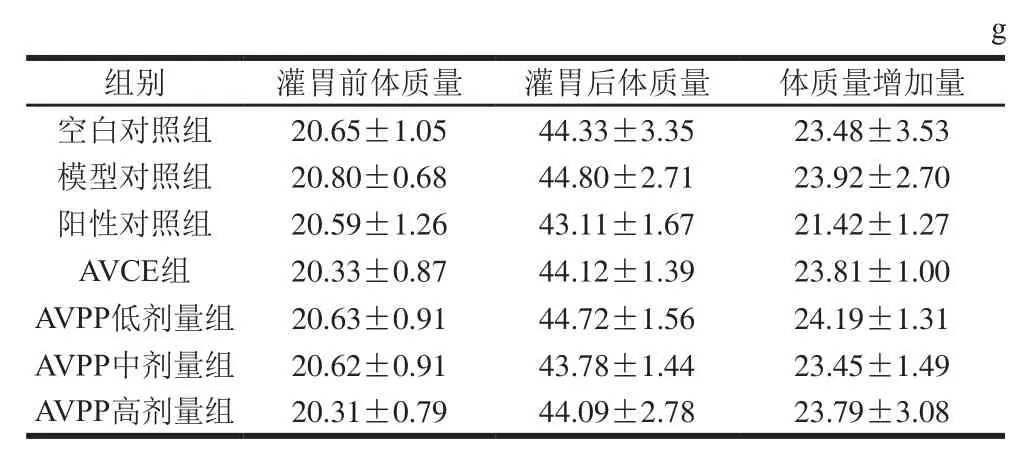
表2 AVPP对小鼠体质量的影响Table2 Effect of AVPP on body weights of mice
由表2可知,与空白对照组相比,各组小鼠灌胃前体质量无明显差异(P>0.05),说明实验具有统计学意义。连续灌胃30 d后,各组小鼠之间的体质量均无明显差异(P>0.05),各组小鼠灌胃前后体质量的增加量也无明显差异(P>0.05),由此说明,AVPP和AVCE均不会影响小鼠体质量的正常增长,对小鼠没有毒副作用。
2.5 AVPP的体内抗氧化活性分析
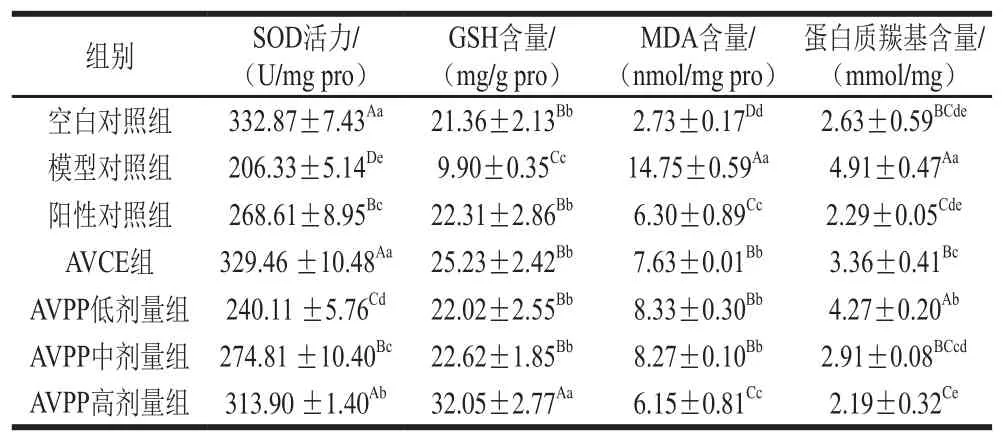
表3 AVPP对小鼠体内抗氧化指标的影响Table3 Effect of AVPP on antioxidant indexes of mice
采用小鼠乙醇氧化损伤模型,考察AVPP的体内抗氧化活性,小鼠肝组织中MDA、蛋白质羰基、GSH含量和SOD活力分别反映脂质氧化产物、蛋白质氧化产物、抗氧化物质和抗氧化酶4 项指标。由表3可知,与空白对照组相比,模型对照组小鼠肝脏内SOD活力、GSH含量均极显著降低(P<0.01),MDA和蛋白质羰基含量均高于空白对照组,且具有极显著差异(P<0.01),说明利用乙醇氧化损伤造模成功。
从抗氧化酶和抗氧化物质两项指标看,AVCE和AVPP各剂量组SOD活力和GSH含量均极显著高于模型对照组(P<0.01),且随着AVPP剂量的增大,均有不同幅度的增加,呈现一定的量效关系。与模型对照组比较,AVCE组和AVPP中剂量组SOD活力分别提高了59.7%和33.2%,GSH含量分别提高了1.5 倍和1.3 倍,已接近或超过了阳性对照的水平。说明AVCE和AVPP都能有效增强受伤小鼠体内SOD活力和GSH含量,减轻或避免超氧阴离子自由基的损伤,帮助氧化损伤机体内的抗氧化酶和抗氧化物质含量恢复正常水平,提高机体的抗氧化能力,且AVCE效果更好,这可能与AVCE中其他抗氧化物质如多糖、不饱和脂肪酸及它们与AVPP的协同作用有关。从脂质氧化产物和蛋白质氧化产物两项指标看,AVCE和AVPP各剂量组MDA和蛋白质羰基含量均明显低于模型对照组,且AVPP各剂量组之间存在一定的剂量-效应关系。AVCE组和AVPP中剂量组MDA含量比模型对照组分别降低了48.3%和43.9%,蛋白质羰基含量则分别降低了31.6%和40.7%。AVPP高剂量组的两项指标已经优于阳性对照组。这表明AVCE和AVPP均能有效降低受损机体内脂质过氧化程度和蛋白质的氧化损伤程度,且AVPP表现出更好的活性。
2.6 AVPP的免疫调节活性分析
通过测定小鼠迟发型变态反应(足跖增厚)、血清溶血素水平(抗体水平)、碳廓清能力(吞噬指数)、免疫器官指数(脾脏指数、胸腺指数)等指标,从细胞免疫、体液免疫、非特异性免疫及免疫器官4 个方面探究AVPP的免疫调节活性。迟发型变态反应是由致敏性T细胞介导的一种细胞免疫反应,测定各组小鼠的局部肿胀程度(足跖增厚)可以反映变态反应的强度。通过用SRBC免疫动物后,使小鼠体内B细胞增殖分化产生抗SRBC抗体(溶血素),利用其凝集SRBC的程度来检测溶血素的水平[17],以此来评价机体的体液免疫功能。碳廓清法常被用来检测单核/巨噬细胞吞噬能力的高低[18],通过给小鼠注射印度墨汁,测定吞噬指数来评价非特异性免疫功能。免疫器官指数是胸腺或脾脏的相对质量,可反映机体免疫细胞的生长发育、增殖及功能状态,对脾脏和胸腺指数的考察也是对机体免疫功能评价的一项重要指标[19]。
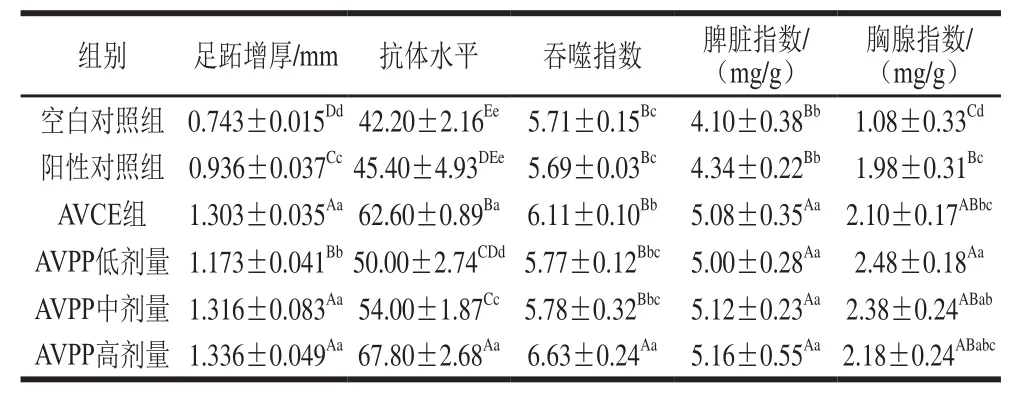
表4 AVPP对小鼠免疫指标的影响Table4 Effect of AVPP on immune indexes of mice
由表4数据可知,AVPP各剂量组和AVCE的各项免疫活性指标均比空白对照组有不同程度的提高,并且要高于阳性对照组的相应指标。其中,足跖增厚、抗体水平、脾脏指数和胸腺指数4 个指标,AVCE和AVPP各剂量组均极显著地高于空白对照组(P<0.01),与空白对照组相比,AVPP中剂量组和AVCE组小鼠足跖增厚分别提高了77.1%和75.4%,抗体水平分别提高了28.0%和48.3%,脾脏指数分别提高24.9%和23.9%,胸腺指数分别提高了1.2 倍和0.9 倍。而对于吞噬指数这一指标,AVPP中剂量组和空白对照组相近,AVCE组比空白对照组提高了7%,只有AVPP高剂量组极显著高于空白对照组(P<0.01)。比较AVPP不同剂量组的各项指标发现,除了两个免疫器官指数外,其余3 个指标均呈现一定的量效关系。表4数据反映,AVPP和AVCE均能从细胞免疫、体液免疫、非特异性免疫和免疫器官4 个方面增强小鼠的免疫活性,且效果优于阳性对照。
3 讨 论
自由基是机体内代谢氧化还原网络中的重要一环,在免疫细胞所产生的细胞因子网络中起介导、调节、信号转导作用,也是抵御外来致病因素的有利武器[20]。免疫细胞在应答免疫反应时,可通过多种自由基机制表达其防御反应,如通过还原型辅酶Ⅰ氧化酶系统诱导的免疫细胞呼吸爆发所产生的活性氧及其所衍生自由基,能逸出细胞外,引起组织损伤,甚至导致疾病的发生[21]。生物体内过量的自由基会攻击机体的蛋白质、脂质、糖类、DNA等,使其氧化损伤,从而加快机体氧化衰老进程,引发各类疾病[22]。海洋生物活性物质如多酚类、多糖类、多肽类等具有很好的抗氧化功能,通过清除体内自由基和抑制脂质过氧化反应,保护生物大分子免受氧化损伤,与人工合成的抗氧化剂相比具有种类多、来源广、安全性高、抗氧化效果显著等优点。本研究考察了AVPP的抗氧化及免疫调节活性,试图为研究机体免疫与清除自由基抗氧化作用之间的相关性及海洋生物活性肽的应用提供数据支持。
采用碱性蛋白酶酶解,结合超滤方法,制备了AVPP样品,未经超滤处理的AVCE蛋白含量56.0%,多糖含量17.70%,经过超滤处理的AVPP样品蛋白含量大幅增加到70.3%,而多糖含量则降低到2.2%。但无论原料还是AVCE或AVPP样品,灰分含量都较高,均大于10%;因此,采用何种方法有效脱盐去除灰分成为后续关系到AVPP开发应用亟待解决的问题。
肽的分子质量大小与其活性有很大的影响,林燕等[23]利用不同孔径大小的超滤膜,制备了分子质量小于3 kDa、3~10 kDa及大于10 kDa的多肽组分,发现不管还原能力还是体外清除自由基能力,分子质量小于3 kDa组分都显著高于其他组分。Tang Xueyan等[24]在玉米醇溶蛋白水解物抗氧化活性研究中发现,经过超滤分级后的小分子在清除DPPH自由基和超氧阴离子活性方面显著高于其他组分。目前,一般认为具有较高抗氧化活性的肽段分子质量较小,这可能是因为小分子肽空间位阻小,更易与自由基接触。本实验制备的AVPP经HPLC检测,分子质量主要分布在192~938 Da,占总产物的76.3%。
有研究表明,多肽的抗氧化机理可能有猝灭单线态氧、自由基清除和金属离子螯合作用3 种[25],因此本研究首先考察了AVPP的体外自由基清除能力,结果表明,AVCE对DPPH自由基的清除效果要优于AVPP,最大清除率分别为40.5%和32.7%,而对羟自由基的清除效果AVPP要优于AVCE,两者的IC50分别为2.1 mg/mL和2.4 mg/mL。随AVPP剂量的增加,对两种自由基清除能力也随之增加,但两者对自由基的清除效果都要远低于VC,说明制备的AVPP具有一定的体外自由基清除能力。这与Zhou Dayong等[26]得到的鲍内脏酶解产物的体外抗氧化活性结果相符;另外,赵莎莎等[27]从青蛤中、曹荣等[28]从刺参肠和性腺得到的多肽以及其他多篇文献都证实了海洋生物来源的多肽具有一定的体外抗氧化活性。
为考察AVPP的体内抗氧化活性,根据保健食品抗氧化功能评价方法,选取SOD、MDA、GSH和蛋白质羰基4 项评定指标。其中,SOD是体内重要的抗氧化酶,GSH是生物体内重要的还原剂,MDA是脂质过氧化的主要产物,蛋白质羰基作为蛋白质氧化的产物,是机体内蛋白质遭到自由基攻击的重要标志[29]。本研究结果显示,AVPP能极显著增强受伤小鼠体内SOD活力和GSH含量,AVPP中剂量组SOD活力和GSH含量分别提高了33.2%和1.3 倍,而脂质氧化产物MDA和蛋白质氧化产物蛋白质羰基含量均明显低于模型对照组,中剂量组MDA和蛋白质羰基含量分别降低43.9%和40.7%,各项指标均已接近或超过了阳性对照的水平,且呈现一定的剂量-效应关系。根据保健食品抗氧化功能评价方法结果判定,动物实验中脂质氧化产物、蛋白质氧化产物、抗氧化酶、抗氧化物质4 项指标中3 项阳性,可判定该受试样品具有抗氧化功能,本研究中4 项指标均为阳性,因此可判定AVPP具有抗氧化活性,且AVCE与AVPP抗氧化效果进行综合比较,无显著性差异。许多其他海洋生物来源的活性肽同样表现出较好的抗氧化活性,Mendis等[30]从一种乌贼体内提取得到一种活性肽具有很好的脂质过氧化抑制效果,其活性高于VE,与二丁基羟基甲苯相当;林琳等[31]研究发现,秘鲁鱿鱼皮胶原蛋白肽可以提高小鼠体内SOD和GSH-Px的活力,降低MDA含量;王天明等[32]从海地瓜中分离得到3 种多肽,能够明显增强细胞抗H2O2氧化损伤能力,其中分子质量小于3 kDa的多肽抗氧化活性最高。
海洋生物来源的免疫活性肽因具有较高的生物活性、较弱的免疫原性、稳定性好等优点,而被人们广泛关注。Wang Yukai等[33]把酶解产生的含有寡肽的牡蛎水解液用于S180荷瘤小鼠后,小鼠胸腺和脾脏指数,自然杀伤细胞的活性、脾脏淋巴细胞的增殖及巨噬细胞的吞噬作用都有显著增加;杜正彩等[34]研究表明,文蛤多肽对地塞米松造成的免疫抑制小鼠具有免疫调节恢复作用。本研究考察了AVPP的免疫活性,结果表明,除了反应非特异性免疫功能的吞噬指数外,其余指标均极显著高于空白对照组(P<0.01),与空白对照组相比,AVPP中剂量组小鼠足跖增厚提高77.1%,抗体水平提高28.0%,脾脏指数提高24.9%,胸腺指数提高1.2 倍。并且除了免疫器官指数外,其余3 个指标均呈现一定的量效关系。这表明,AVPP可以从细胞免疫、体液免疫、非特异性免疫和免疫器官4 个方面增强小鼠免疫功能,且效果优于阳性对照。
本研究通过生物酶解和超滤技术联合制备AVPP,并通过动物实验证实了其抗氧化活性和免疫促进活性。但对于超滤处理中被截留的大分子部分尚未进行分析研究,结合文献报道及实际测定的组成成分,可以推测,被截留的部分中应以多糖成分为主,而海洋生物来源的多糖同样具有多种生物活性,是具有很大开发潜力的功能因子;因此,后续应进一步完善制备工艺,对超滤截留的大分子部分的组成及活性进行研究。最终的研究成果一方面可以为工业化开发鲍内脏系列功能食品提供数据支持;另一方面,鲍内脏的有效利用可以极大地减少优质海洋生物资源的浪费和环境污染,对提高鲍产品附加值、完善加工产业链将起到积极的推动作用。
[1] 叶燕军, 陈俊, 翁武银. 超滤膜分离鲍鱼内脏酶解物及其体外抗氧化活性的研究[J]. 现代食品科技, 2015, 31(5): 130-136; 284.DOI:10.13982/j.mfst.1673-9078.2015.5.021.
[2] 吴欢欢, 黄倩雯, 熊夏玲, 等. 鲍鱼养殖技术[J]. 现代农业科技,2014(17): 298. DOI:10.3969/j.issn.1007-5739.2014.17.177.
[3] 薛长湖, 林洪, 曾名勇, 等. 我国水产品加工的现状和未来[J]. 科学养鱼, 2002(2): 6-7.
[4] 林国荣, 吴明霞, 张泽生, 等. 南日鲍营养成分分析及评价[J].营养学报, 2015, 37(1): 99-101. DOI:10.13325/j.cnki.acta.nutr.sin.2015.01.034.
[5] ZHU B W, LI D M, ZHOU D Y, et al. Structural analysis and CCK-releasing activity of a sulphated polysaccharide from abalone (Haliotis discus Hannai Ino) viscera[J]. Food Chemistry, 2011, 125(4): 1273-1278. DOI:10.1016/j.foodchem.2010.10.065.
[6] 刘艳青, 李兆杰, 李国云, 等. 雌、雄皱纹盘鲍内脏脂肪酸及磷脂组成的比较分析[J]. 食品科学, 2013, 34(10): 184-186. DOI:10.7506/spkx1002-6630-201310040.
[7] 郑惠娜, 章超桦, 曹文红. 海洋蛋白酶解制备生物活性肽的研究进展[J]. 水产科学, 2008, 27(7): 370-373. DOI:10.3969/j.issn.1003-1111.2008.07.013.
[8] KLEEKAYAI T, HARNEDY P A, O’KEEFFE M B, et al. Extraction of antioxidant and ACE inhibitory peptides from Thai traditional fermented shrimp pastes[J]. Food Chemistry, 2015, 176: 441-447.DOI:10.1016/j.foodchem.2014.12.026.
[9] NGUYEN V T, QIAN Z J, RYU B M, et al. Matrix metalloproteinases(MMPs) inhibitory effects of an octameric oligopeptide isolated from abalone Haliotis discus hannai[J]. Food Chemistry, 2013, 141(1): 503-509. DOI:10.1016/j.foodchem.2013.03.038.
[10] LIU Z Y, ZENG M Y, DONG S Y, et al. Effect of an antifungal peptide from oyster enzymatic hydrolysates for control of gray mold (Botrytis cinerea) on harvested strawberries[J]. Postharvest Biology and Technology, 2007, 46(1): 95-98. DOI:10.1016/j.postharvbio.2007.03.013.
[11] ZHU C F, PENG H B, LIU G Q, et al. Beneficial effects of oligopeptides from marine salmon skin in a rat model of type 2 diabetes[J]. Nutrition, 2010, 26(10): 1014-1020. DOI:10.1016/j.nut.2010.01.011.
[12] JIN Y, ZHANG L N, ZHANG M, et al. Antitumor activities of hetyeropolysaccharides of Porta rows mycelia from different strains and culture media[J]. Carbohydrate Research, 2003, 338(14): 1517-1521. DOI:10.1016/S0008-6215(03)00198-8.
[13] 刘帅涛, 陶慧林, 李锦艳, 等. 4 种黄酮小分子对DPPH自由基的清除作用及构效关系研究[J]. 分析测试学报, 2012, 31(1): 71-75.DOI:10.3969/j.issn.1004-4957.2012.01.013.
[14] 卢晓燕. PEF结合酶法提取鲍鱼脏器粗多糖及其抑菌、免疫活性研究[D]. 福州: 福建农林大学, 2012: 41.
[15] 张扬, 孙和平, 刘卓, 等. 紫苏油在乙醇诱导氧化损伤模型小鼠体内的抗氧化作用[J]. 食品科学, 2015, 36(23): 279-282. DOI:10.7506/spkx1002-6630-201523051.
[16] 国家食品药品监督管理局保健食品化妆品监管司. 增强免疫力功能评价方法(征求意见稿)及修订说明[EB/OL]. (2012-11-02) [2017-03-20]. http://www.docin.com/p-554888103.html.
[17] 李晓梅, 鞠玉琳. 中药“FH”对小鼠血清溶血素和淋巴细胞转化的影响[J]. 延边大学农学学报, 2005, 27(3): 197-200. DOI:10.3969/j.issn.1004-7999.2005.03.009.
[18] 张珣, 王静凤, 李冰, 等. 阿胶对小鼠免疫功能的影响[J]. 食品工业科技,2011, 32(11): 400-402; 433. DOI:10.13386/j.issn1002-0306.2011.11.024.
[19] SUSZKO A, SZCZYPKA M, LIS M, et al. Inf l uence of polysaccharide fraction C isolated from Caltha palustris L. on T and B lymphocyte subsets in mice[J]. Central-European Journal of Immunology, 2012,37(3): 193-199. DOI:10.5114/ceji.2012.30792.
[20] 方允中, 郑荣梁. 自由基生物学的理论与应用[M]. 北京: 科学出版社, 2002: 122-161.
[21] UTHAISANGSOOK S, DAY N K, BAHNA S L, et al. Innate immunity and its role against infections[J]. Annals of Allergy,Asthma & Immunology, 2002, 88(3): 253-265. DOI:10.1016/S1081-1206(10)62005-4.
[22] HARMAN D. Aging: a theory based on free radical and radiation chemistry[J]. Journal of Gerontology, 1956, 11(3): 298-300.DOI:10.1093/geronj/11.3.298.
[23] 林燕, 陈计峦, 胡小松, 等. 酶解核桃蛋白制备抗氧化肽的研究[J].食品工业科技, 2011, 32(4): 204-207; 212. DOI:10.13386/j.issn1002-0306.2011.04.052.
[24] TANG Xueyan, HE Zhiyong, DAI Yanfeng, et al. Peptide fractionation and free radical scavenging activity of zein hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 587-593. DOI:10.1021/jf9028656.
[25] 王瑞雪, 孙洋, 钱方, 等. 抗氧化肽及其研究进展[J]. 食品科技, 2011,36(5): 83-86. DOI:10.13684/j.cnki.spkj.2011.05.039.
[26] ZHOU Dayong, ZHU Beiwei, QIAO Lu, et al. In vitro antioxidant activity of enzymatic hydrolysates prepared from abalone (Haliotis discus hannai Ino) viscera[J]. Food and Bioproducts Processing, 2012,90(2): 148-154. DOI:10.1016/j.fbp.2011.02.002.
[27] 赵莎莎, 潘欣, 赵玉勤, 等. 青蛤酶解多肽体外抗氧化活性的研究[J].浙江海洋学院学报(自然科学版), 2015, 34(1): 45-49. DOI:10.3969/j.issn.1008-830X.2015.01.009.
[28] 曹荣, 李冬燕, 刘淇, 等. 刺参肠、性腺酶解多肽体外抗氧化作用研究[J]. 南方水产科学, 2013, 9(6): 47-51. DOI:10.3969/j.issn.2095-0780.2013.06.008.
[29] ZHANG Yingcai, ZHANG Qi, LI Hua, et al. Prognostic factors for late mortality after liver transplantation for benign end-stage liver disease[J]. Chinese Medical Journal, 2011, 124(24): 4229-4235.DOI:10.3760/cma.j.issn.0366-6999.2011.24.020.
[30] MENDIS E, RAJAPAKSE N, BYUN H G, et al. Investigation of jumbo squid (Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects[J]. Life Sciences, 2005, 77(17): 2166-2178.DOI:10.1016/j.lfs.2005.03.016.
[31] 林琳, 李八方. 鱿鱼皮胶原蛋白水解肽抗氧化活性研究[J]. 中国海洋药物, 2006, 25(4): 48-51. DOI:10.3969/j.issn.1002-3461.2006.04.012.
[32] 王天明, 苏意钢, 马永钧, 等. 海地瓜多肽分离及抗氧化活性研究[J]. 现代食品科技, 2014, 30(5): 75-81; 166. DOI:10.13982/j.mfst.1673-9078.2014.05.022.
[33] WANG Yukai, HE Hailun, WANG Guofan, et al. Oyster (Crassostrea gigas) hydrolysates produced on a plant scale have antitumor activity and immunostimulating effects in BALB/c mice[J]. Marine Drugs,2010, 8(2): 255-268. DOI:10.3390/md8020255.
[34] 杜正彩, 侯小涛, 邓家刚, 等. 文蛤粗多肽对免疫抑制小鼠TNF-α,IL-2及IFN-γ的影响[J]. 广西中医药, 2014, 37(5): 71-74.
