蛋白溶出与变性结合消减虾仁致敏性
2018-03-20王星璇胡志和柳澜昱王丽娟吴子健
王星璇,胡志和*,柳澜昱,王丽娟,薛 璐,吴子健
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
南美白对虾(Penaeus vannamei)不仅产量高,也是百姓餐桌上常见的美味佳肴[1-3]。然而,这样的美味却是潜在的食物过敏原,在过敏人群中,就有20%会对其过敏[4],严重影响了过敏体质人群的生活质量。采用何种方法可以在保存虾仁完整结构和风味的基础上,消除其致敏性,让过敏群体安全地享受虾的美味,已经成为研究的热点。
超高静压技术(high hydrostatic pressure processing,HPP)是一种冷杀菌技术,其作用是纯物理过程,液体传压、各向压力均等的特点能够保留受压物体的外观形状[5-6];只作用于构成空间结构的氢键、离子键、疏水键等非共价键,不会影响共价键[7];由于加工过程产生的热量很小,可以保持食品原有的营养成分、色泽和天然风味[8-9]。自1899年美国化学家Hite[10]将超高压技术用于牛乳的保藏研究以来,目前该技术已经用于乳品[11-13]、果汁[14-15]、果酱[16]、水产品[17-19]、肉类[20-22]、谷物[23-24]和蔬菜[25]等的加工。
由于超高静压能够改变蛋白质分子的空间构象[26-27]和促进溶质扩散[28],因此也用于消减过敏食物的致敏性。Kato等[29]将精白米置于蒸馏水中并在100~400 MPa的压力下对其进行加压处理,可使大量的过敏性蛋白质溶出。Peñas等[30-31]在200 MPa 和300 MPa条件下处理大豆蛋白,可大幅度降低其致敏性。Husband等[32]研究了热和高压对苹果的2 个主要过敏原(Mal d 1、Mal d 3)及Bet v 1(类似芹菜中过敏原Api g 1)的影响,发现通过加热或提高压力可以有效降低其主要过敏原。张悦等[33]将虾仁在100 MPa、25 ℃条件下处理15 min,虾仁的致敏性降低了67.09%,且与处理过程中蛋白溶出量有关。蔡秋凤等[34]研究发现超高压使蛋白质三级结构遭到破坏,与Ca2+结合能力变弱,导致小清蛋白的免疫活性降低,从而达到了对鱼类过敏原消减的效果。
本研究利用超高静压能够促进溶质扩散和引发蛋白质空间构象变化的性能,采用超高静压处理南美白对虾的鲜虾仁,在保留虾仁结构完整的基础上,消减其致敏性,为利用超高压技术降低水产品致敏性提供参考。
1 材料与方法
1.1 材料与试剂
南美白对虾 天津市韩家墅水产市场。
兔抗南美白对虾原肌球蛋白免疫球蛋白(immunoglobulin,Ig)G抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG抗体和羊抗人IgE抗体 美国Sigma公司;Page Ruler Prestained Protein Ladder标准蛋白 美国Thermo公司;酶标板美国Corning Costar公司;其他化学试剂均为分析纯。
1.2 仪器与设备
UV-2100紫外分光光度计 上海尤尼柯仪器有限公司;HPP.L2-1000/1型超高压设备 华泰森淼生物工程技术有限公司;3-18K型离心机 美国Sigma公司;SpectraMax190型酶标分析仪 美国美谷分子仪器有限公司;UNIVERSAL HOOD Ⅱ凝胶电泳成像仪 美国Bio-Rad公司;24DN型电泳槽、DYY-8C型电泳仪北京市六一仪器厂;FD-2冷冻干燥机 北京博医康实验仪器有限公司;UDK159全自动凯氏定氮仪 意大利VELP公司。
1.3 方法
1.3.1 虾仁的超高压处理
将新鲜南美白对虾清洗,去头、尾、壳以及肠线,制成虾仁。并按照1 个孔/cm2的密度对虾仁进行扎孔,称质量。将虾仁与质量分数0.9% NaCl溶液按照质量比1∶4混合,然后用聚乙烯袋真空密封。采用超高压设备处理真空密封的样品。压力传递介质为葵二酸二辛酯,处理温度为室温,压力范围为0.1~900.0 MPa,保压时间为10~50 min。
1.3.2 高压处理后虾仁的溶出蛋白及残留蛋白含量测定
将处理的虾仁从溶液中取出,将溶液在4 000 r/min条件下离心15 min,取50 mL上清液检测溶出蛋白质量浓度;取处理后湿基虾仁1 g进行虾仁溶出蛋白和残留蛋白含量的测定。溶出蛋白质量浓度、溶出蛋白含量、残留蛋白含量均采用GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》[35]凯氏定氮法测定。
1.3.3 高压处理后虾仁的溶出蛋白及虾仁残留蛋白质的分子质量分布
不同压力(0.1~900.0 MPa)处理30 min后,将虾仁取出,溶液4 ℃、4 000 r/min离心15 min,上清液经透析(截留分子质量3 500 Da)、冻干后获得溶出蛋白。
虾仁残留蛋白的制备参考李振兴[36]的方法并进行修改。将高压处理(0.1~900.0 MPa)后的虾仁匀浆,每克组织用1 mL的生理盐水悬浮,悬浮液置于冰上5 min后加入4 倍体积冷丙酮(-20 ℃预冷过夜),充分混匀,置于0 ℃条件下30 min,期间混匀数次,于4 000 r/min、4 ℃离心15 min,收集沉淀物。将沉淀物再次用冷丙酮悬浮、混匀,在4 ℃、4 000 r/min条件下离心15 min,将沉淀物移至干净滤纸上自然风干,制得虾蛋白丙酮粉。再将丙酮粉与含有0.5 mmol/L二硫苏糖醇的1 mol/L KCl抽提液按1∶10(m/V)的比例混合进行抽提过夜,4 ℃、4 000 r/min离心30 min,取上清液,沉淀物用抽提液按1∶10(m/V)抽提4 h,离心取上清液,将两次的上清液合并后透析(截留分子质量3 500 Da),截留物经冷冻干燥,获得虾仁粗提蛋白。
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析蛋白质种类。电泳条件:15%分离胶,5%浓缩胶,上样溶液质量浓度5 mg/mL,上样量10 μL。
利用凝胶电泳成像仪分析电泳胶片,用随机Quantity One软件分析蛋白质的分子质量分布。
1.3.4 过敏血清来源
血清样品采集于12 个虾过敏患者,分别来自山东省荣成市石岛人民医院、河北省唐山市开滦医院和甘肃省天水市第一人民医院及天津商业大学校医院。性别分布为7 男,5 女;年龄分布20~23 岁7 人,35~40 岁4 人,52岁1 人。通过临床诊断为虾类过敏,采用皮肤点刺实验,其检测结果大于阳性对照范围的1/2为“++”,将所有患者的血清混合;另外,采集20 名非过敏人的血清(天津商业大学校医院),作为阴性对照。所有血清样品置于-80 ℃冰箱冻存。
1.3.5 IELISA法检测高压处理后虾仁蛋白及溶出蛋白的致敏性
从不同条件处理后的虾仁中提取蛋白,分别用兔抗原肌球蛋白的IgG抗体、对虾过敏的人血清为一抗,以未处理组虾仁中提取的蛋白为对照,采用间接酶联免疫吸附测定(indirect enzyme-linked immunosorbent assay,IELISA)法检测虾仁的致敏性[37],通过抗体与抗原结合的光密度值变化,表示致敏性的变化。具体操作如下。
将高压处理虾仁的蛋白提取物或溶出蛋白用pH 9.6的Na2CO3/NaHCO3缓冲液配制成质量浓度为0.5 mg/mL的溶液,向酶标板中每孔加入100 μL,4 ℃下包被26 h。弃掉抗原稀释液,用磷酸盐吐温缓冲液(phosphate buffered saline with Tween 20,PBST)(1 000 mL pH 7.4的磷酸盐缓冲液中含1 mL吐温20)洗板,拍干后每孔加入封闭液(含质量分数1%的牛血清白蛋白的PBST)200 μL,37 ℃下保温2.5 h。弃去封闭液,用PBST洗板,拍干。每孔加入100 μL抗体溶液(虾过敏患者血清用封闭液1∶160(V/V)稀释,兔抗南美白对虾原肌球蛋白IgG抗体用封闭液1∶750(V/V)稀释),37 ℃下孵育2 h,弃去孔中液体,用PBST洗板。每孔加100 μL二抗溶液(HRP标记的羊抗人IgE抗体用封闭液1∶800(V/V)稀释,HRP标记的羊抗兔IgG抗体用封闭液1∶1 000(V/V)稀释),37 ℃下孵育1 h。弃去孔中液体,用PBST洗板,拍干。每孔加入100 μL邻苯二胺底物液(0.1 mol/L柠檬酸4.86 mL、0.2 mol/L Na2HPO45.14 mL、4 mg邻苯二胺、3% H2O250 μL),37 ℃下闭光放置15 min,然后每孔加入50 μL 2 mol/L H2SO4终止液。用酶标仪在492 nm波长处测定其光密度值(OD492nm)。所有实验设3 个平行。
包被在酶标板中的抗原与抗体(虾仁中提取的蛋白)结合后形成抗原-抗体复合物,与再加入酶标二抗反应,通过显色液显色,用酶标仪测定其光密度值。光密度值可以反映出抗原和抗体结合的程度。虾仁蛋白致敏性的消减率按照下式计算。

1.3.6 高压下蛋白溶出与变性结合消减虾仁致敏性
将真空密封后的虾仁,在200 MPa室温保压30 min的条件下进行处理。然后在600 MPa室温保压不同时间(10~30 min)条件下进行高压处理,检测每次处理后虾仁致敏性变化。
1.4 数据处理
所有实验数据采用SPSS 16.0统计软件分析,显著性分析采用单因素方差分析方法,实验结果均以表示,图表制作利用软件Origin 8和Excel 2007。
2 结果与分析
2.1 高压处理时间对虾仁蛋白质溶出量的影响
将真空密封的虾仁,在室温和300.0 MPa压力下分别处理10、20、30、40、50 min,通过凯氏定氮法检测处理后溶出液中蛋白质含量,结果如图1所示。
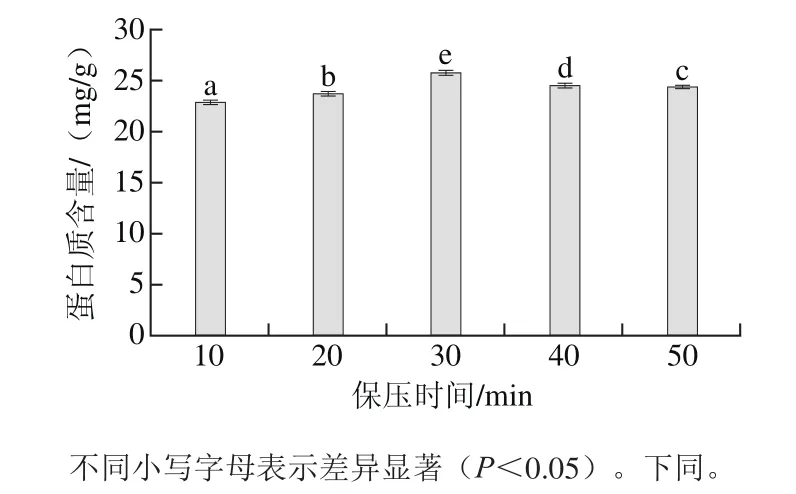
图1 室温、300.0 MPa条件下不同保压时间对虾仁蛋白质溶出量的影响Fig.1 Effect of treatment time at 300.0 MPa and at room temperature on protein solubilization
由图1可知,不同保压时间处理的虾仁蛋白质溶出量均有显著性差异(P<0.05)。在室温、300.0 MPa下,保压时间在10~30 min内,随着保压时间的延长,蛋白质溶出量增多,当保压时间为30 min时,蛋白质溶出量最高,为25.69 mg/g;在30~50 min范围内,随着保压时间的延长,其蛋白质的溶出量逐渐降低。出现该现象的原因可能是随着时间的延长,虾仁蛋白质的变性导致溶解性的变化[38]。
2.2 压力对虾仁的蛋白质溶出量及剩余量的影响
在室温下,用不同压力(0.1~900.0 MPa)处理虾仁30 min,虾仁和溶出液中蛋白质含量的结果如图2所示。
超高压处理会使虾仁中蛋白质溶出,各压力下蛋白质溶出量均高于对照组(0.1 MPa);当压力小于200.0 MPa时,随压力提高,溶出蛋白量逐渐增高;当压力大于200.0 MPa时,随压力增大,蛋白溶出量逐渐降低(图2)。在实验的压力范围内,200.0 MPa时蛋白溶出量最多,为37.9 mg/g。另外,虾仁中残留的蛋白质含量在200.0 MPa时最低,为146.1 mg/g;因此,200.0 MPa的处理条件有利于蛋白质的溶出。其原因可能是因为当压力在200.0 MPa时,蛋白质极性基团的暴露增多,蛋白质的水化作用增强,溶解性得到极大提高,导致虾仁蛋白质更多地溶出[39-40]。随着压力的继续增大(300.0~900.0 MPa),虾仁蛋白溶出量随压力增大而减小。过高的压力导致蛋白质凝胶发生破裂,大分子蛋白聚合体解聚,疏水位点与新的二硫键暴露,产生不同组分的聚集变性[41-43]。
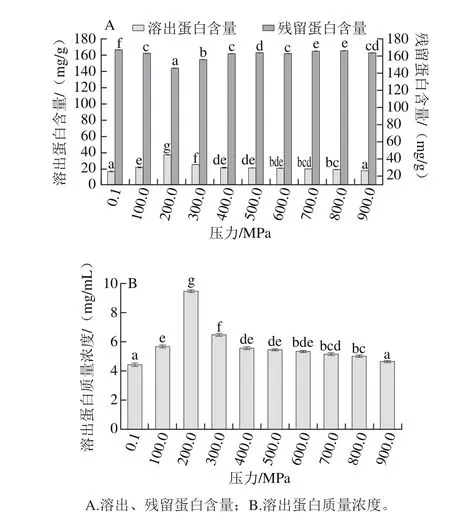
图2 室温下不同压力处理30 min对虾仁的蛋白质溶出量的影响Fig.2 Effect of pressure at room temperature for 30 min on protein solubilization
2.3 不同压力下虾仁溶出蛋白质的分子质量分布
不同压力对蛋白质空间构象产生影响,从而导致蛋白质分子某些性质变化,其中包括其溶解性能。不同压力处理虾仁,溶出蛋白SDS-PAGE结果见图3,电泳图经凝胶电泳成像仪分析其分子质量分布,结果见表1。结果表明,对照组虾仁共有26 种蛋白质溶出,与虾仁粗提蛋白种类一致。经超高压处理后,压力为100.0 MPa时,没有分子质量为106.7 kDa的蛋白质溶出;在200.0~300.0 MPa压力处理条件下,虾仁溶出蛋白种类一致,有2 种蛋白(106.7 kDa和191 kDa)没有溶出;压力不低于400.0 MPa时,分子质量超过106 kDa的5 种蛋白没有溶出;当压力为500.0 MPa时,有14 种蛋白没有溶出;当压力在600.0~900.0 MPa之间时,溶出蛋白种类相同,有17 种蛋白没有溶出。造成这一现象的原因,可能是在高压作用下蛋白质水合作用发生变化,导致其溶解性变化[38-44]。
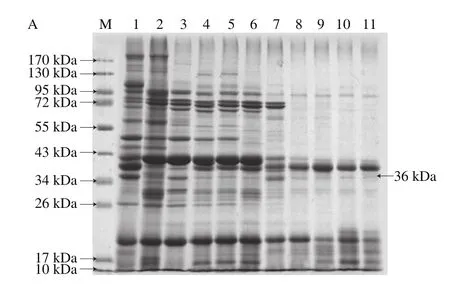
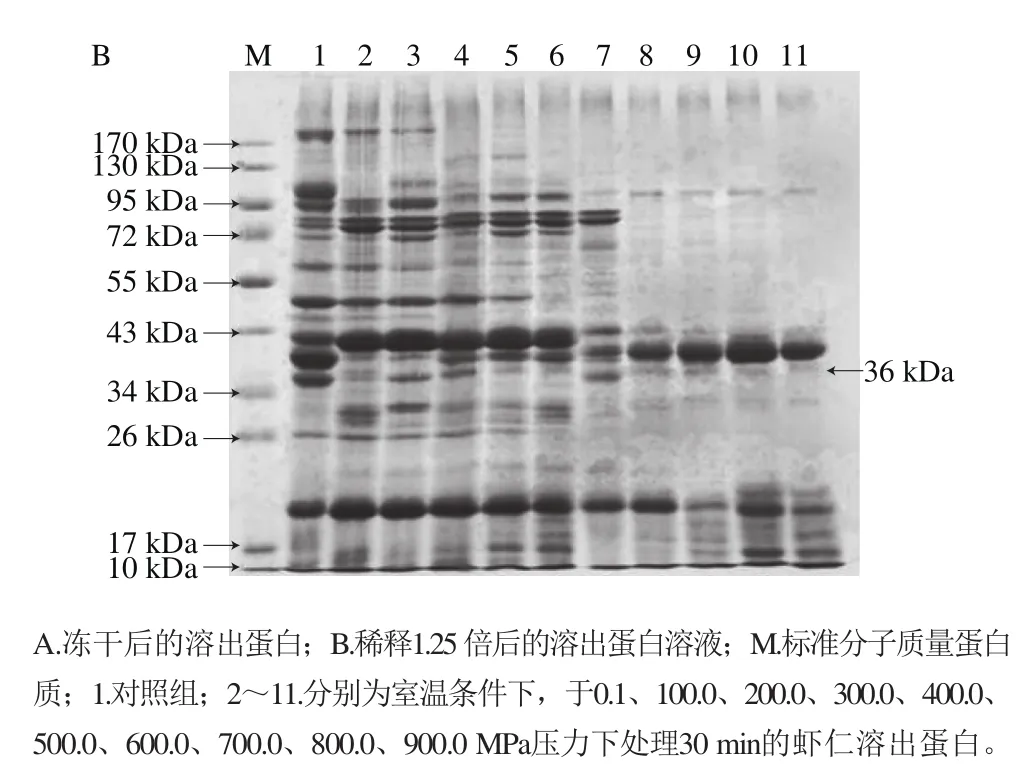
图3 不同压力下溶出蛋白的SDS-PAGE图Fig.3 SDS-PAGE analysis of protein solubilization after treatment at different pressures for 30 min at room temperature

表1 不同条件下处理的溶出蛋白分子质量分布Table1 Molecular weight distribution of proteins from shelled shrimp treated at different pressures
另外,虾类主要的过敏原蛋白为分子质量36 kDa的原肌球蛋白[45],在各种压力下均有溶出。采用凝胶电泳成像仪对电泳图谱(图3B)的分析发现,在200.0 MPa下处理虾仁,溶出蛋白中36 kDa蛋白占较高的比例(图4);这一结果为高压溶出消减虾仁致敏性提供了理论依据。
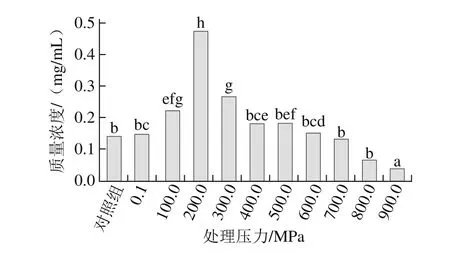
图4 不同压力下溶出蛋白液中分子质量为36 kDa的蛋白质质量浓度Fig.4 Concentration of 36 kDa proteins from shelled shrimp treated at different pressures
2.4 高压处理后虾仁提取蛋白及溶出蛋白的致敏性变化
2.4.1 高压处理后虾仁提取蛋白的致敏性变化
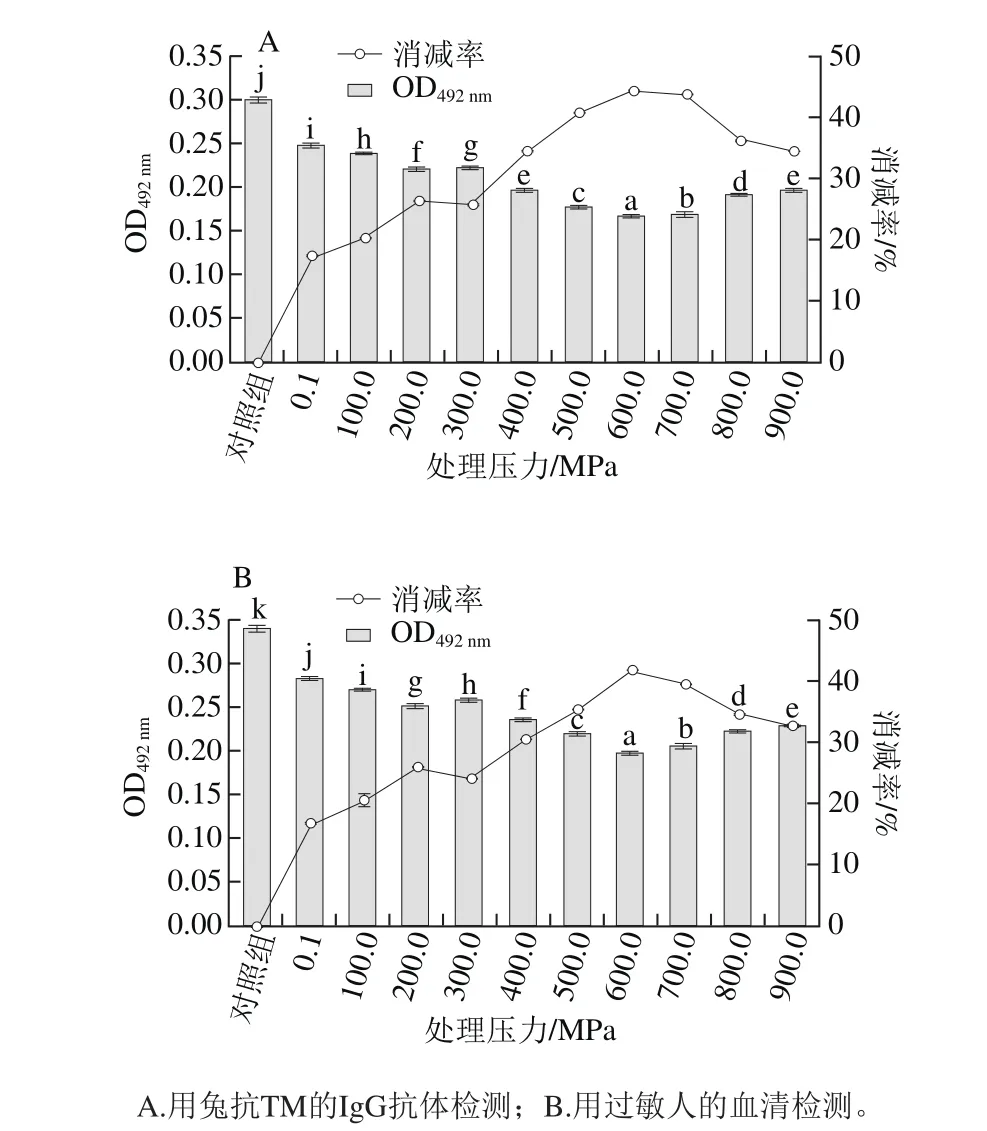
图5 不同压力作用下虾仁致敏性消减结果Fig.5 Effect of HHP treatment at different pressures on allergenicity of shelled shrimp
由图5可知,加压可以降低虾仁的致敏性,不同的高压条件下虾仁致敏性的消减率有显著差异(P<0.05)。压力在100.0~600.0 MPa的范围内,随着压力的增加,抗体与抗原结合的OD492nm随之减小;当压力在600.0~900.0 MPa范围内,抗体与抗原结合的OD492nm随压力增大而提高,且采用兔抗TM的IgG为一抗抗体(图5A)和用过敏者血清为一抗抗体(图5B)检测结果的趋势一致。在600.0 MPa下致敏性消减效果最好,与未处理的虾仁提取蛋白(OD492nm为0.34)相比,用过敏者血清为一抗检测,致敏性消减了41.82%(图5B);用兔抗TM的IgG为一抗检测,致敏性消减了44.15%(图5A)。
此外,比较不同压力下虾仁致敏性(图5)与虾仁残留蛋白含量或溶出蛋白含量(图2A)之间关系可以发现,当压力在0.1~300.0 MPa范围内,其致敏性变化与虾仁中残留蛋白含量正相关,与溶出蛋白含量负相关;压力在400.0~900.0 MPa之间,其致敏性变化与虾仁蛋白的残留量和溶出量无关。因此,可以推断在0.1~300.0 MPa范围内,虾仁致敏性消减与虾仁蛋白溶出有关;在400.0~900.0 MPa范围内,致敏性变化与虾仁蛋白变性有关。
2.4.2 高压处理后蛋白溶出量及变性与致敏性关系
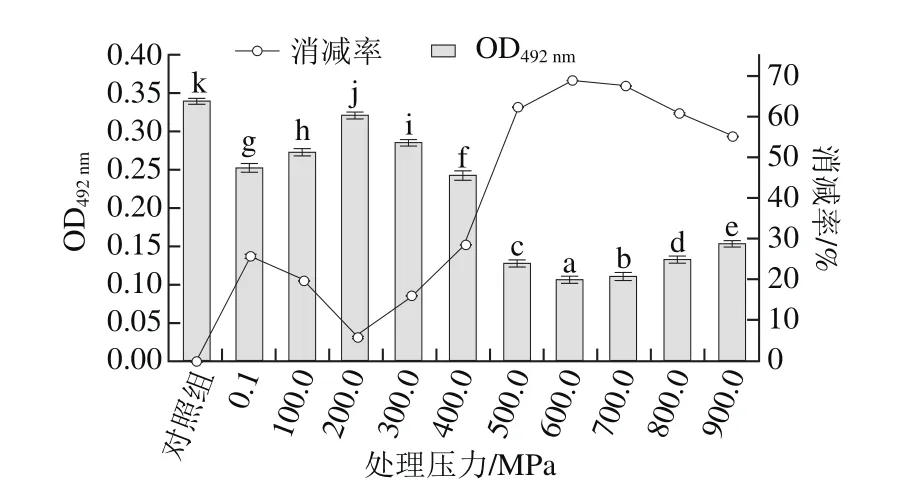
图6 不同压力处理的蛋白溶出液稀释12.5 倍后致敏性变化Fig.6 Allergenicity of 12.5-fold diluted proteins from shelled shrimp treated at different pressures
比较图6和图2可知,压力在0.1~300.0 MPa范围内,其致敏性变化与蛋白溶出量正相关;在100.0、400.0 MPa和500.0 MPa下处理的虾仁的溶出蛋白含量无显著差异(图2A),但溶出蛋白的致敏性存在显著差异(图6);因此,当压力大于400.0 MPa时,虾仁蛋白的致敏性与溶出量无关,与其构象的变化(变性)有关[46]。
将溶出蛋白冷冻干燥,配制成0.5 mg/mL的溶液后进行包被,检测其致敏性(用过敏者血清为一抗检测),研究溶出蛋白致敏性与变性的关系,结果见图7。压力在0.1~600.0 MPa范围内,随着压力的增大,其致敏性逐渐降低,在600.0 MPa时,致敏性最低,与未处理虾仁蛋白相比,消减率为59.85%,且100.0 MPa和200.0 MPa时致敏性无显著差异;当压力在600.0~900.0 MPa范围内,随压力的增加,其致敏性反而增大。
比较图7与图3可知,高压处理会改变蛋白构象,从而导致其某些性质的变化,包括溶解性(图3),进而导致致敏性变化(图7);但蛋白构象变化程度(变性程度)不同,导致其溶解性及致敏性变化程度不同,在较低的压力下(≤300.0 MPa),虾仁蛋白只有2 种蛋白不能溶出(图3),致敏性消减率只有25.53%(300.0 MPa);400.0 MPa压力下,有5 种蛋白没有溶出,且均为大分子蛋白(分子质量大于等于106 kDa)(图3),致敏性消减率为29.41%;但当压力大于500.0 MPa时,有14~17 种蛋白没有溶出(图3),且致敏性消减率为54.18%(500.0 MPa)。因此,引起虾仁多种蛋白变性的压力应不低于500.0 MPa,且在600.0 MPa下致敏性消减较好(致敏性消减率为68.79%)。
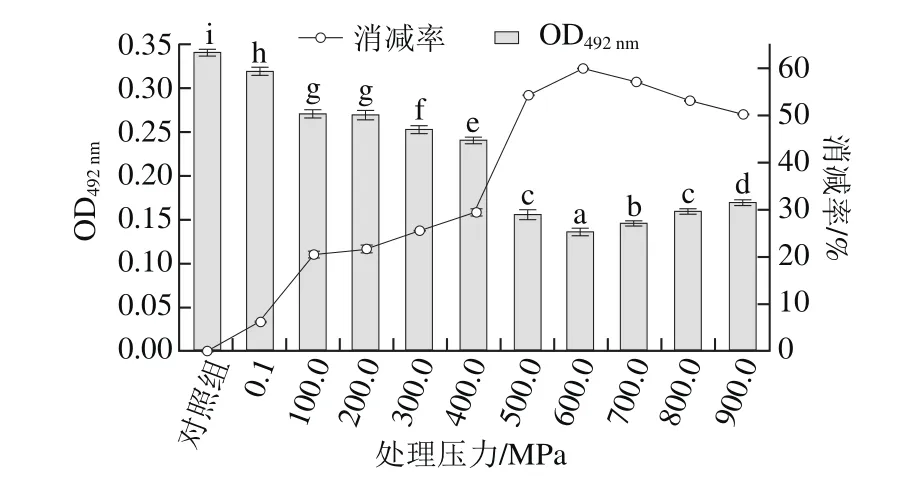
图7 不同压力处理后的虾仁溶出蛋白的致敏性Fig.7 Allergenicity of proteins from shelled shrimp treated at different pressures
2.5 蛋白溶出与变性相结合消减虾仁致敏性
综合不同高压条件下虾仁蛋白溶出量(图2)、变性与致敏性关系(图7),采用200.0 MPa和600.0 MPa相结合的处理方式,消减虾仁的致敏性。
2.5.1 在200.0 MPa下多次处理对虾仁致敏性的消减
将虾仁在200.0 MPa保压处理30 min的条件下,进行多次处理,蛋白溶出质量浓度变化和虾仁残留蛋白致敏性变化见图8。处理4、5、6 次的蛋白溶出量和虾仁致敏性均无显著性差异(P>0.05),与处理3 次相比,存在显著差异(P<0.05)。因此,从蛋白溶出量分析,处理4 次即可。综上,200.0 MPa、室温、保压处理30 min,经4 次处理,虾仁的致敏性降低到较平稳水平(OD492nm为0.107),与未处理虾仁蛋白(OD492nm为0.340)相比,致敏性消减率为68.53%。
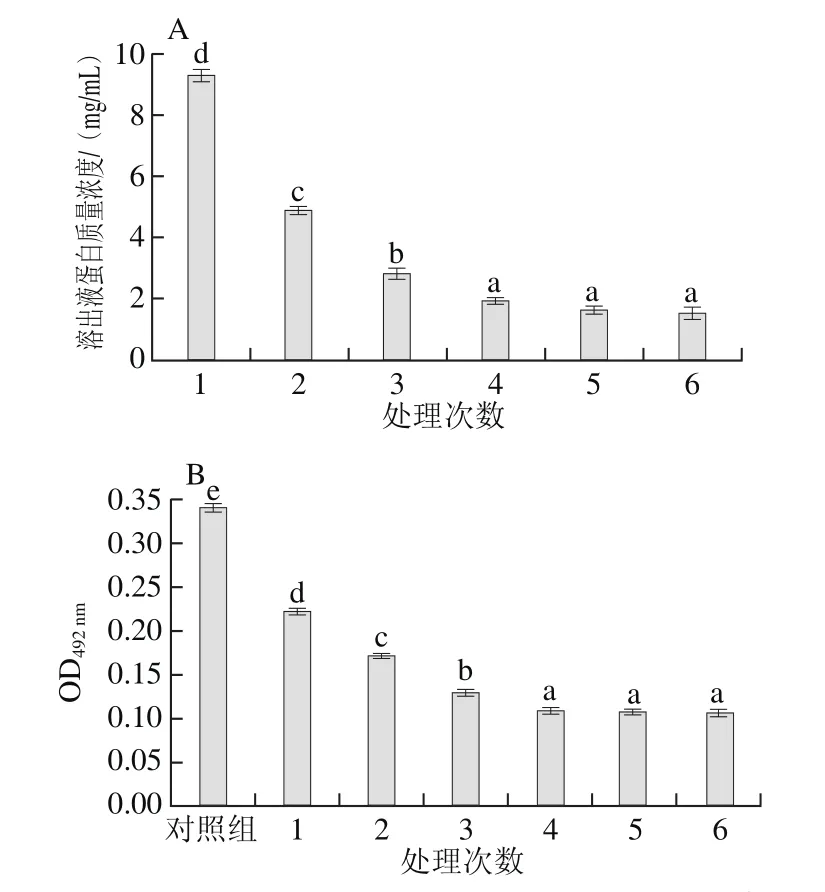
图8 在200.0 MPa下处理次数对溶出液蛋白质量浓度(A)和虾仁残留蛋白致敏性(B)的影响Fig.8 Effect of number of 200.0 MPa treatments on protein solubilization (A) and allergenicity of shelled shrimp (B)
2.5.2 蛋白溶出与变性结合处理对虾仁致敏性消减效果
虾仁在200.0 MPa室温保压30 min的条件下处理后,再经600.0 MPa、室温保压处理,每次处理后提取虾仁蛋白,用过敏者血清为一抗,检测致敏性变化,结果见表2。采用单一蛋白溶出(200.0 MPa)或蛋白变性(600.0 MPa)均不能较好地消减虾仁的致敏性,而采用二者结合,先用200.0 MPa处理30 min,再用600.0 MPa处理20~30 min,就能够较好地降低虾仁的致敏性,虾仁在200.0 MPa下处理30 min后,再用600.0 MPa处理30 min,虾仁的致敏性消减率大于80%。
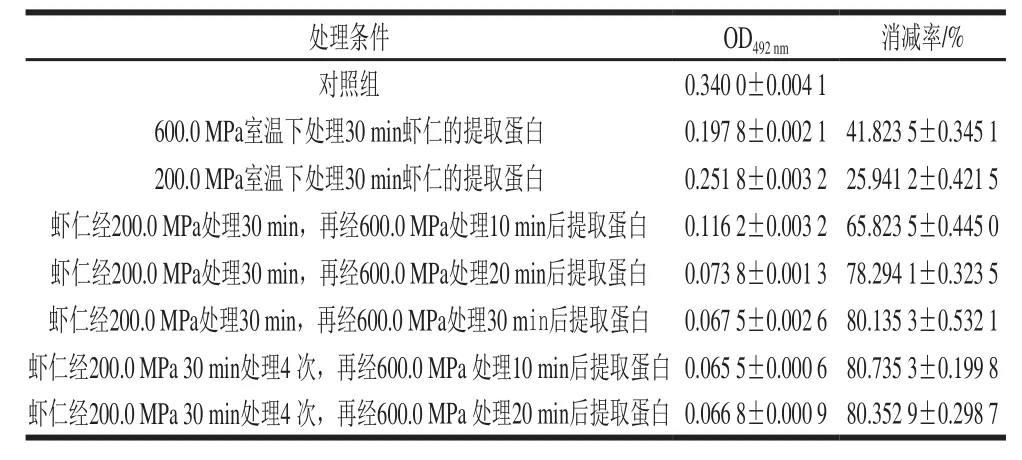
表2 经200.0 MPa处理后再经600.0 MPa处理对虾仁致敏性的影响(n= 3)Table2 Effect of sequential treatment at 200.0 MPa followed by 600.0 MPa on allergenicty of shelled shrimp (n= 3)
根据实验结果,即使采用两种方法相结合的方式,也不能彻底消除虾仁蛋白的致敏性。其原因在于,采用蛋白溶出的方式,由于溶解平衡,不能够彻底溶出所有过敏原蛋白;采用蛋白变性的方式,只是通过改变蛋白空间构象从而改变其致敏性[47]。另外,高压处理是物理过程,只能改变过敏原蛋白的构象表位,不会破坏其一级结构,即不会影响线性表位;因此,采用高压处理,不能完全消除虾仁蛋白的致敏性。
3 结 论
采用超高压处理技术,能够有效地消减虾仁蛋白的致敏性。在处理过程中,不同压力对虾仁蛋白致敏性消减的作用方式不同,当压力在100.0~300.0 MPa的范围内,可促进虾仁中致敏性蛋白的溶出,从而使得虾仁的致敏性降低;压力400.0~900.0 MPa范围,可促进虾仁致敏性蛋白结构的改变,从而使虾仁的致敏性发生变化。采用适合虾仁致敏性蛋白溶出和构象改变的压力相结合的方式处理虾仁,能够更好地消减虾仁致敏性。
[1] 崔宏博, 刘鑫, 薛勇, 等. 南美白对虾虾壳软化及其制品的研究[J].食品与发酵工业, 2010, 36(5): 52-56. DOI:10.13995/j.cnki.11-1802/ts.2010.05.023.
[2] 王吉桥. 南美白对虾生物学研究与养殖[M]. 北京: 海洋出版社,2003: 12-18.
[3] 陈晓汉, 陈琴, 谢达祥. 南美白对虾含肉率及肌肉营养价值的评定[J]. 水产科技情报, 2001, 28(4): 165-168. DOI:10.3969/j.issn.1001-1994.2001.04.015.
[4] 吕相征, 刘秀梅, 杨晓光. 健康人群食物过敏状况的初步调查[J].中国食品卫生杂志, 2005, 17(2): 119-121. DOI:10.3969/j.issn.1004-8456.2005.02.008.
[5] RIVALAIN N, ROQUAIN J, DEMAZEAU G. Development of high hydrostatic pressure in biosciences: pressure effect on biological structures and potential applications in Biotechnologies[J].Biotechnology Advances, 2010, 28(6): 659-672. DOI:10.1016/j.biotechadv.2010.04.001.
[6] TEREFE N S, MATTHIES K, SIMONS L, et al. Combined high pressure-mild temperature processing for optimal retention of physical and nutritional quality of strawberries (Fragaria × ananassa)[J].Innovative Food Science and Emerging Technologies, 2009, 10(3):297-307. DOI:10.1016/j.ifset.2008.12.003.
[7] DEMAZEAU G. High pressure and chemical bonding in materials chemistry[J].ChemInform, 2006, 37(39): 799-807. DOI:10.1515/znb-2006-0705.
[8] SEREGÉLY Z, FARKAS J, TUBOLY E, et al. Investigating the properties of egg white pasteurised by ultra-high hydrostatic pressure and γ irradiation by evaluating their NIR spectra and chemosensor array sensor signal responses using different methods of qualitative analysis[J]. Chemometrics and Intelligent Laboratory Systems, 2006,82(1): 115-121. DOI:10.1016/j.chemolab.2005.04.012.
[9] SANCHO F, LAMBERT Y, DEMAZEAU G, et al. Effect of ultrahigh hydrostatic pressure on hydrosoluble vitamins[J]. Journal of Food Engineering, 1999, 39(3): 247-253. DOI:10.1016/S0260-8774(98)00143-5.
[10] HITE B H. The effect of pressure in the preservation of milk: a preliminary report[M]. Morgantown: West Virginia Agricultural Experiment Station, 1899: 15-35.
[11] EVELYN, SILVA F V M. High pressure processing of milk: modeling the inactivation of psychrotrophic Bacillus cereus spores at 38-70 ℃[J].Journal of Food Engineering, 2015, 165: 141-148. DOI:10.1016/j.jfoodeng.2015.06.017.
[12] BRAVO F I, FELIPE X, LÓPEZ-FANDIÑO R, et al. Skim milk protein distribution as a result of very high hydrostatic pressure[J].Food Research International, 2015, 72: 74-79. DOI:10.1016/j.foodres.2015.03.014.
[13] RODRÍGUEZ-ALCALÁ L M, CASTRO-GÓMEZ P, FELIPE X, et al.Effect of processing of cow milk by high pressures under conditions up to 900 MPa on the composition of neutral, polar lipids and fatty acids[J]. LWT-Food Science and Technology, 2015, 62(1): 265-270.DOI:10.1016/j.lwt.2014.12.052.
[14] ABID M, JABBAR S, HU B, et al. Synergistic impact of sonication and high hydrostatic pressure on microbial and enzymatic inactivation of apple juice[J]. LWT-Food Science and Technology, 2014, 59(1):70-76. DOI:10.1016/j.lwt.2014.04.039.
[15] YU Y, LIN Y, ZHAN Y, et al. Effect of high pressure processing on the stability of anthocyanin, ascorbic acid and color of Chinese bayberry juice during storage[J]. Journal of Food Engineering, 2013,119(3): 701-706. DOI:10.1016/j.jfoodeng.2013.06.036.
[16] DERVISI P, LAMB J, ZABETAKIS I. High pressure processing in jam manufacture: effects on textural and colour properties[J]. Food Chemistry, 2001, 73(1): 85-91. DOI:10.1016/S0308-8146(00)00289-2.
[17] ERKAN N, ÜRETENER G, ALPAS H, et al. The effect of different high pressure conditions on the quality and shelf life of cold smoked fish[J]. Innovative Food Science & Emerging Technologies, 2011,12(2): 104-110. DOI:10.1016/j.ifset.2010.12.004.
[18] YI J J, ZHANG L, DING G W, et al. High hydrostatic pressure and thermal treatments for ready-to-eat wine-marinated shrimp:an evaluation of microbiological and physicochemical qualities[J].Innovative Food Science & Emerging Technologies, 2013, 20: 16-23.DOI:10.1016/j.ifset.2013.09.006.
[19] CRUZ-ROMERO M, KERRY J P, KELLY A L. Changes in the microbiological and physicochemical quality of high-pressure-treated oysters (Crassostrea gigas) during chilled storage[J]. Food Control,2008, 19(12): 1139-1147. DOI:10.1016/j.foodcont.2007.12.004.
[20] SUN X D, HOLLEY R A. High hydrostatic pressure effects on the texture of meat and meat products[J]. Journal of Food Science, 2010,75(1): 17-23. DOI:10.1111/j.1750-3841.2009.01449.x.
[21] OMER M K, PRIETO B, RENDUELES E, et al. Microbiological,physicochemical and sensory parameters of dry fermented sausages manufactured with high hydrostatic pressure processed raw meat[J]. Meat Science, 2015, 108: 115-119. DOI:10.1016/j.meatsci.2015.05.002.
[22] CAPPELLETTI M, FERRENTINO G, SPILIMBERGO S. High pressure carbon dioxide on pork raw meat: inactivation of mesophilic bacteria and effects on colour properties[J]. Journal of Food Engineering, 2015, 156: 55-58. DOI:10.1016/j.jfoodeng.2015.02.009.
[23] BOLUDA-AGUILAR M, TABOADA-RODRÍGUEZ A, LÓPEZGÓMEZ A, et al. Quick cooking rice by high hydrostatic pressure processing[J]. LWT-Food Science and Technology, 2013, 51(1): 196-204. DOI:10.1016/j.lwt.2012.09.021.
[24] DENG Y, ZHONG Y, YU W, et al. Effect of hydrostatic high pressure pretreatment on flavor volatile profile of cooked rice[J]. Journal of Cereal Science, 2013, 58(3): 479-487. DOI:10.1016/j.jcs.2013.09.010.[25] DE ROECK A, DUVETTER T, FRAEYE I, et al. Effect of highpressure/high-temperature processing on chemical pectin conversions in relation to fruit and vegetable texture[J]. Food Chemistry, 2009,115(1): 207-213. DOI:10.1016/j.foodchem.2008.12.016.
[26] BALNY C, MASSON P, HEREMANS K. High pressure effects on biological macromolecules: from structural changes to alteration of cellular processes[J]. Biochimica et Biophysica Acta (BBA):Protein Structure and Molecular Enzymology, 2002, 1595(1): 3-10.DOI:10.1016/S0167-4838(01)00331-4.
[27] 李仁杰, 廖小军, 胡小松, 等. 超高压对蛋白质的影响[J]. 高压物理学报, 2014, 28(4): 498-506. DOI:10.11858/gywlxb.2014.04.017.
[28] 王章存, 田卫环, 崔胜文, 等. 高压处理对大米蛋白溶解性及分子结构特征的影响[J]. 高压物理学报, 2013, 27(4): 609-615.
[29] KATO T, KATAYAMA E, MATSUBARA S, et al. Release of allergenic proteins from rice grains induced by high hydrostatic pressure[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8):3124-3129. DOI:10.1021/jf000180w.
[30] PEÑAS E, RESTANI P, BALLABIO C, et al. Assessment of the residual immunoreactivity of soybean whey hydrolysates obtained by combined enzymatic proteolysis and high pressure[J]. European Food Research and Technology, 2006, 222(3/4): 286-290. DOI:10.1007/s00217-005-0108-9.
[31] PEÑAS E, PRÉSTAMO G, POLO F, et al. Enzymatic proteolysis,under high pressure of soybean whey: analysis of peptides and the allergen Gly m 1 in the hydrolysates[J]. Food Chemistry, 2006, 99(3):569-573. DOI:10.1016/j.foodchem.2005.08.028.
[32] HUSBAND F A, ALDICK T, VAN DER PLANCKEN I, et al. Highpressure treatment reduces the immunoreactivity of the major allergens in apple and celeriac[J]. Molecular Nutrition & Food Research, 2011,55(7): 1087-1095. DOI:10.1002/mnfr.201000566.
[33] 张悦, 胡志和, 谢丹丹, 等. 高压结合酶法消减南美白对虾虾仁致敏性[J]. 食品科学, 2014, 35(4): 6-10. DOI:10.7506/spkx1002-6630-201404002.
[34] 蔡秋凤, 王锡昌, 郭城, 等. 加工处理对鲢小清蛋白免疫活性的影响[J]. 水产学报, 2013, 37(2): 297-302. DOI:10.3724/SP.J.1231.2013.38222.
[35] 卫生部. 食品安全国家标准 食品中蛋白质的测定方法: GB/T 5009.5—2010[S]. 北京: 中国质检出版社, 2010: 1-4.
[36] 李振兴. 虾(Penaeus Vannamei)过敏原免疫活性的研究[D]. 青岛: 中国海洋大学, 2006: 18-25.
[37] CARNÉS J, FERRER Á, HUERTAS Á J, et al. The use of raw or boiled crustacean extracts for the diagnosis of seafood allergic individuals[J]. Annals of Allergy, Asthma & Immunology, 2007,98(4): 349-354. DOI:10.1016/S1081-1206(10)60881-2.
[38] SILVA J L, FOGUEL D. Hydration, cavities and volume in protein folding, aggregation and amyloid assembly[J]. Physical Biology, 2009,6(1): 015002. DOI:10.1088/1478-3975/6/1/015002.
[39] ZHANG H K, LI L, TATSUMI E, et al. High-pressure treatment effects on proteins in soy milk[J]. LWT-Food Science and Technology,2005, 38(1): 7-14. DOI:10.1016/j.lwt.2004.04.007.
[40] TORREZAN R, THAM W P, BELL A E, et al. Effects of high pressure on functional properties of soy protein[J]. Food Chemistry,2007, 104(1): 140-147. DOI:10.1016/j.foodchem.2006.11.013.
[41] MOLINA E, PAPADOPOULOU A, LEDWARD D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids, 2001, 15(3): 263-269. DOI:10.1016/S0268-005X(01)00023-6.
[42] KAJIYAMA N, ISOBE S, UEMURA K, et al. Changes of soy protein under ultra-high hydraulic pressure[J]. International Journal of Food Science & Technology, 1995, 30(2): 147-158. DOI:10.1111/j.1365-2621.1995.tb01366.x.
[43] CRUZ N, CAPELLAS M, HERNÁNDEZ M, et al. Ultra high pressure homogenization of soymilk: microbiological, physicochemical and microstructural characteristics[J]. Food Research International, 2007,40(6): 725-732. DOI:10.1016/j.foodres.2007.01.003.
[44] GRIGERA J R, MCCARTHY A N. The behavior of the hydrophobic effect under pressure and protein denaturation[J]. Biophysical Journal,2010, 98(8): 1626-1631. DOI:10.1016/j.bpj.2009.12.4298.
[45] LEHRER S B, AYUSO R, REESE G. Seafood allergy and allergens: a review[J]. Marine Biotechnology, 2003, 5(4): 339-348. DOI:10.1007/s10126-002-0082-1.
[46] JIN Y F, DENG Y, QIAN B J, et al. Allergenic response to squid(Todarodes pacificus) tropomyosin Tod p1 structure modifications induced by high hydrostatic pressure[J]. Food and Chemical Toxicology, 2015, 76: 86-93. DOI:10.1016/j.fct.2014.12.002.
[47] 胡志和, 王星璇, 张晴青, 等. 高压处理诱发虾原肌球蛋白结构变化与致敏性的关系[J]. 食品科学, 2017, 38(11): 33-39. DOI:10.7506/spkx1002-6630 -201711006.
