2-L-天冬氨酸-2-脱氧-D-葡萄糖的合成及热裂解分析
2018-03-20芦昶彤陈芝飞马宇平付瑜锋郑峰洋李成刚孙志涛高明奇
芦昶彤,陈芝飞,马宇平,*,侯 佩,付瑜锋,郑峰洋,李成刚,孙志涛,高明奇,张 展
(1.河南中烟工业有限责任公司技术中心,河南 郑州 450000;2.郑州轻工业学院食品与生物工程学院,河南 郑州 450002)
美拉德反应又称非酶促棕色化反应,是糖和氨基化合物经缩合、脱水、降解、聚合等一系列复杂反应而生成类黑素的过程[1]。在食品加工及贮藏过程中,都不同程度地发生美拉德反应,该反应是食品风味形成的重要途径之一[2-3]。美拉德反应初级阶段产生的Amadori化合物(1-氨基-1-脱氧-2-酮糖)和Heyns化合物(2-氨基-2-脱氧-1-醛糖)是重要的潜香物质,该类物质化学性质稳定,没有气味,但经加热不仅可裂解产生大量致香物质,而且可增加食品的烘焙香和甜香[4-8]。
Amadori化合物的合成及分析国内外已有相关报道。Abrams等[9]报道了甘氨酸型等Amadori化合物的合成方法;Alexis等[10]研究了脯氨酸型Amadori化合物的热裂解;Nicole等[11]从美拉德反应物粗提物中分离出4 种Amadori化合物;郑毅男等[12-13]在红参中发现了2 种精氨酸型Amadori化合物,该物质是人参生长及加工过程中的重要代谢产物,具有增强细胞免疫功能、改善末梢微循环及改善糖尿病患者症状等作用。曹国军等[14]建立了人参加工品中精氨酸Amadori化合物的定量分析方法,发现其含量高达6.11%。然而,关于另一种重要美拉德反应中间体Heyns化合物的研究鲜有报道;迄今为止,国内外尚鲜见2-L-天冬氨酸-2-脱氧-D-葡萄糖合成及分析和表征方面的研究报道。
本研究以D-果糖和L-天冬氨酸单钾盐为原料,经缩合、脱水和重排反应制备了一种Heyns重排产物,即2-L-天冬氨酸-2-脱氧-D-葡萄糖;采用热重-微商热重(thermo gravimetry-derivative thermo gravimetry,TG-DTG)和在线裂解气相色谱-质谱联用(pyrolysis gas chromatography-mass spectrometry,Py-GC-MS)技术,对其进行热裂解研究,并进行了抗氧化性能测定,旨在为Heyns重排产物合成及应用提供参考。
1 材料与方法
1.1 材料与试剂
D-果糖(99.5%) 上海阿拉丁化学试剂公司;L-天冬氨酸单钾盐、1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-picrylhydrazyl,DPPH)(98.0%)、所有裂解化合物对比标准品 美国Sigma-Aldrich公司;无水甲醇、无水乙醇、氢氧化钾、乙酸、L-抗坏血酸、铁氰化钾、三氯化铁、三氯乙酸、磷酸二氢钠、磷酸氢二钠国药集团化学试剂有限公司。
1.2 仪器与设备
Avatar 370傅里叶变换红外光谱(Fourier transform infrared,FTIR)仪 美国Nicolet公司; Avance AMX-400核磁共振(nuclear magnetic resonance,NMR)仪美国Bruker公司;Exactive Orbitrp高分辨率质谱仪美国Thermo公司;7890A+5975C气质联用仪 美国Agilent公司;Netzsch STA449C热分析仪 德国Netzsch公司;CDS 5200热裂解器 美国CDS公司;UV1101紫外-可见分光光度计 天美(中国)科学仪器有限公司;H1650R型高速离心机 湘仪离心机仪器有限公司;HH-6恒温水浴锅 江苏金坛市宏华仪器厂。
1.3 方法
1.3.1 2-L-天冬氨酸-2-脱氧-D-葡萄糖的制备
2-L-天冬氨酸-2-脱氧-D-葡萄糖的合成路线见图1。
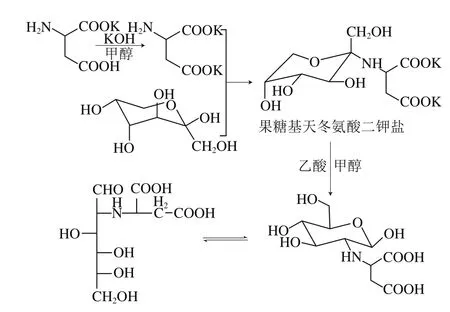
图1 2-L-天冬氨酸-2-脱氧-D-葡萄糖的合成路线Fig.1 Synthetic route of 2-L-aspartic acid-2-deoxy-D-glucose
向装有温度计、冷凝管的三口瓶中加入14.1 g(0.251 mol)氢氧化钾和150 mL无水甲醇,磁力搅拌至溶解。加入43.0 g(0.251 mol)L-天冬氨酸单钾盐,室温下反应0.5 h后,加入450 mL无水甲醇和27.0 g(0.150 mol)D-果糖,回流反应3.0 h。冷却至室温,将反应液浓缩至150 mL,过滤除去未反应的氨基酸钾盐,滤液冷却至0 ℃,边搅拌边逐滴加入乙醇,收集沉淀并在甲醇-乙醇中重结晶2 次后,真空干燥得到白色晶体果糖基天冬氨酸二钾盐(Ⅰ),其产率为83.90%。
将60 mL无水甲醇和6.0 g(0.016 mol)化合物(Ⅰ)加入到200 mL三口瓶中,磁力搅拌30 min后,加入2 mL乙酸并回流反应1.5 h,结束反应并冷却至0 ℃,加入40 mL无水乙醇,收集沉淀并在无水甲醇中重结晶,真空干燥得到白色晶体2-L-天冬氨酸-2-脱氧-D-葡萄糖(Ⅱ),其产率为75.60%。
1.3.2 结构表征
分别采用FTIR、1H NMR、13C NMR和高分辨率质谱(high resolution mass spectrometer,HRMS)对2-L-天冬氨酸-2-脱氧-D-葡萄糖进行结构表征。
1.3.3 TG-DTG分析
称取4.000 mg化合物(Ⅱ)于三氧化二铝坩埚内,调整热重分析仪的温度区间为30~700 ℃,保护气体为氮气,流速为20 mL/min,线性升温速率为10 ℃/min。
1.3.4 Py-GC/MS分析
称取5 mg化合物(Ⅱ)样品,置于中空小石英管中,分别在200、400、600、800 ℃进行瞬间裂解,裂解产物由载气氦气直接导入GC/MS中进行分离鉴定。
裂解条件为:裂解氛围:10%氧气和90%氮气;传输线温度:280 ℃;阀箱温度:280 ℃;吸附阱温度:280 ℃;升温程序:初始温度设定为50 ℃,升温速率为20 ℃/ms,分别设定200、400、600、800 ℃,保持10 s。
G C/M S条件为:色谱柱:D B-5 M S色谱柱(30 m×250 μm,0.25 μm);进样口温度:250 ℃;升温程序:初始温度设定为40 ℃,保持1 min,升温速率为20 ℃/min,升至280 ℃,保持10 min;载气:高纯氦气;流速:1 mL/min;分流比:100∶1。离子源:电子轰击离子源;电子能量:70 eV;离子源温度:230 ℃;四极杆温度:150 ℃;扫描方式:全扫描;扫描范围:30~1 000 amu。
1.3.5 抗氧化性能的测定
1.3.5.1 DPPH自由基清除率
DPPH自由基清除率测定按照参考文献[15]的方法。以体积分数95%乙醇-水溶液为溶剂,将2-L-天冬氨酸-2-脱氧-D-葡萄糖和L-抗坏血酸分别配制成质量浓度为0.01、0.05、0.10、0.50、1.00、1.50、2.00 mg/mL的样品溶液,分别加入2.0 mL浓度为0.000 1 mol/L的DPPH无水乙醇溶液和2.0 mL样品溶液,混匀后室温下避光静置0.5 h,于517 nm波长处分别测定上述样品混合液、2.0 mL去离子水和2.0 mL DPPH溶液混合溶液、2.0 mL样品溶液和2.0 mL无水乙醇混合溶液的吸光度,分别记作A1、A2、A3。上述实验重复3 次,最终结果以3 次数据的算数平均值确定。DPPH自由基清除率按照下式计算。
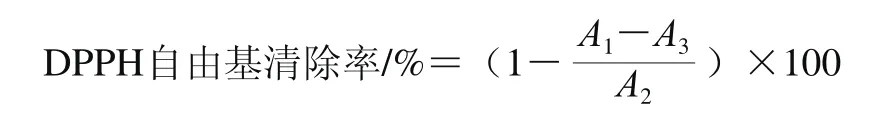
1.3.5.2 还原能力
还原能力测定按照参考文献[16]的方法进行。以体积分数95%乙醇-水溶液为溶剂,将2-L-天冬氨酸-2-脱氧-D-葡萄糖和L-抗坏血酸分别配制成质量浓度为0.10、0.25、0.50、1.00、1.50、2.00 mg/mL的样品溶液。取2.5 mL不同质量浓度的样品溶液,加入pH 6.60、0.2 mol/L磷酸盐缓冲液和1 g/100 mL铁氰化钾溶液各2.5 mL,混匀,50 ℃水浴20 min,取出后迅速放于冰水中冷却,加入2.5 mL 10 g/100 mL三氯乙酸溶液,混匀后在3 000 r/min条件下离心10 min,取上清液2.5 mL,加入2.5 mL去离子水和0.5 mL 0.1 g/100 mL的三氯化铁溶液,静置10 min后在700 nm波长处测定吸光度。吸光度越大,还原能力越强。上述实验重复3 次,最终结果以3 次数据的算数平均值确定。
2 结果与分析
2.1 结构表征
分别采用FTIR、1H NMR、13C NMR和HRMS对2-L-天冬氨酸-2-脱氧-D-葡萄糖进行结构表征,结果列于表1。结果表明,化合物(Ⅱ)与目标化合物结构吻合。
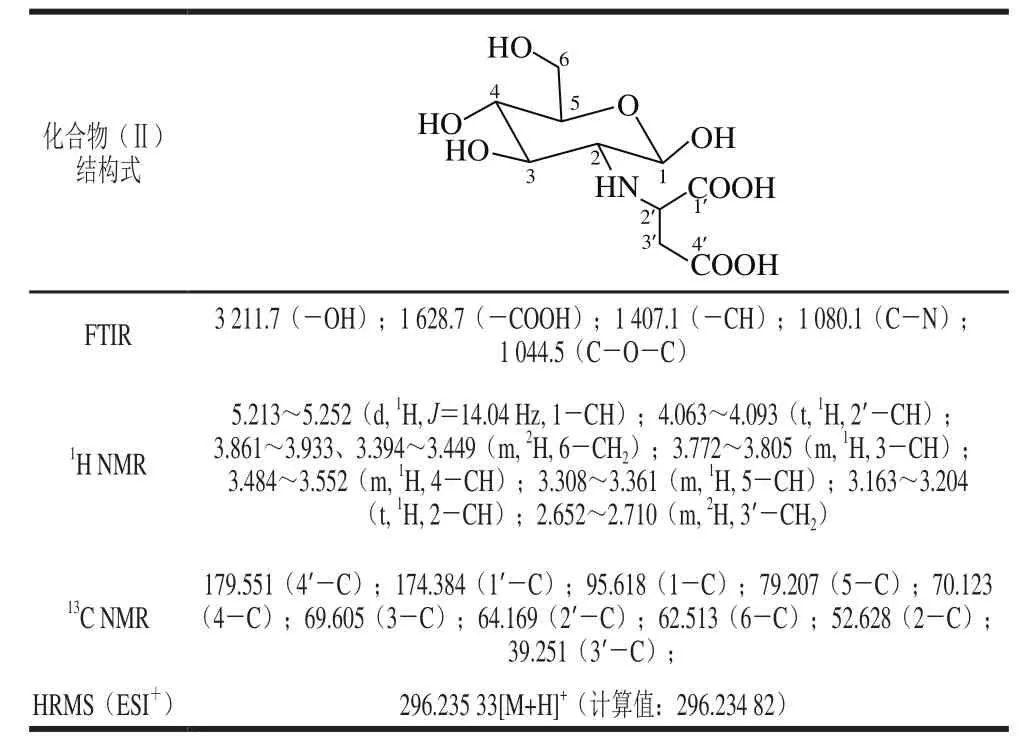
表1 2-L-天冬氨酸-2-脱氧-D-葡萄糖的FTIR、1H NMR、13C NMR和HRMS数据Table1 FTIR, 1H NMR, 13C NMR and HRMS data of 2-L-aspartic acid-2-deoxy-D-glucose
2.2 TG-DTG分析
2-L-天冬氨酸-2-脱氧-D-葡萄糖在10 ℃/min的升温速率下的TG-DTG曲线见图2。
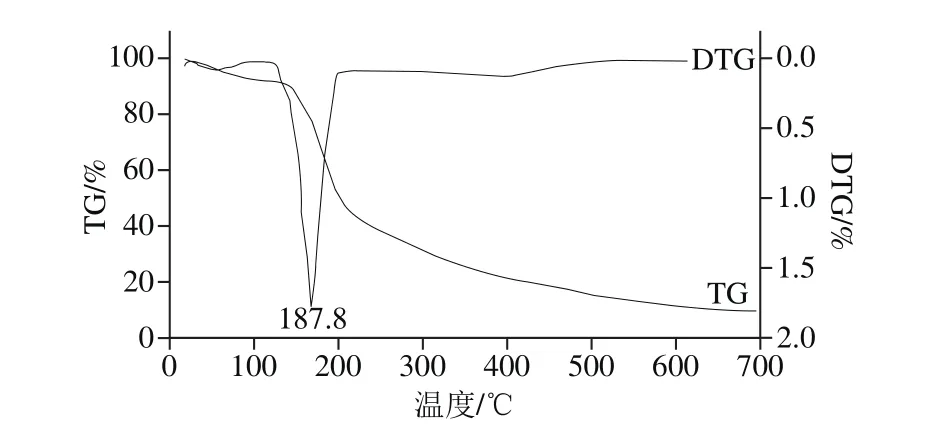
图2 2-L-天冬氨酸-2-脱氧-D-葡萄糖TG-DTG曲线图Fig.2 TG-DTG curve of 2-L-aspartic acid-2-deoxy-D-glucose
由图2中TG曲线可知,化合物(Ⅱ)从25 ℃加热到700 ℃过程中,有2 次明显的失重过程,第1次失重过程发生在126~220 ℃,第2次失重过程发生在220~500 ℃,第一次失重过程中样品失重由7.78%增加到51.11%,变化率达43.33%;第二次失重过程中样品失重由51.11%增加到83.86%,变化率为32.75%;温度达700 ℃时,样品总失重达到91.26%。由DTG曲线可知,样品在187.8 ℃处有1 个明显的峰,表明在此温度下样品失重速率达到最大。综合TG-DTG曲线分析可知,2-L-天冬氨酸-2-脱氧-D-葡萄糖为没有熔点化合物,裂解温度为187.8 ℃。
2.3 Py-GC/MS产物分析
由TG-DTG分析结果可知,化合物(Ⅱ)在700 ℃时就已基本完全裂解,因此,考虑研究的连续性和完整性,选择在200、400、600、800 ℃条件下分别对2-L-天冬氨酸-2-脱氧-D-葡萄糖进行热裂解实验,并对裂解产物进行定性分析。其中在相同实验条件下,通过考察标准品混合标样的保留时间和质谱图对2-甲基呋喃等38 种化合物进行定性分析,其他裂解产物采用检索NIST02质谱数据库进行定性分析,各组分的相对含量采用峰面积归一法测定。为了保证实验重复性,每个温度下平行实验3 次并计算裂解产物相对含量的相对标准偏差,各裂解产物相对标准偏差分布范围为0.69%~9.28%,表明裂解实验具有很好的重复性,结果见表2。
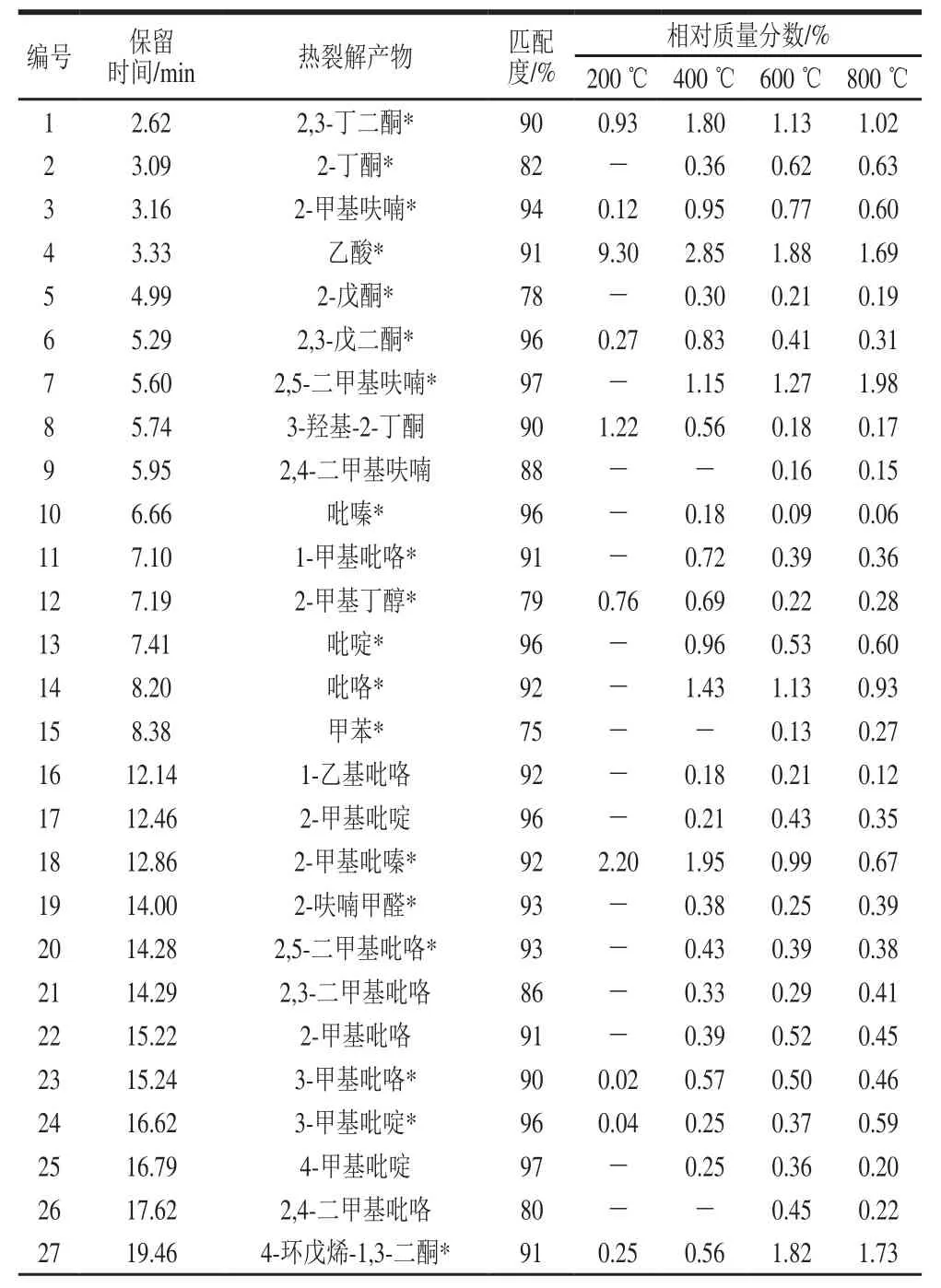
表2 不同温度条件下2-L-天冬氨酸-2-脱氧-D-葡萄糖的热裂解产物Table2 Pyrolytic products of 2-L-aspartic acid-2-deoxy-D-glucose at different temperatures
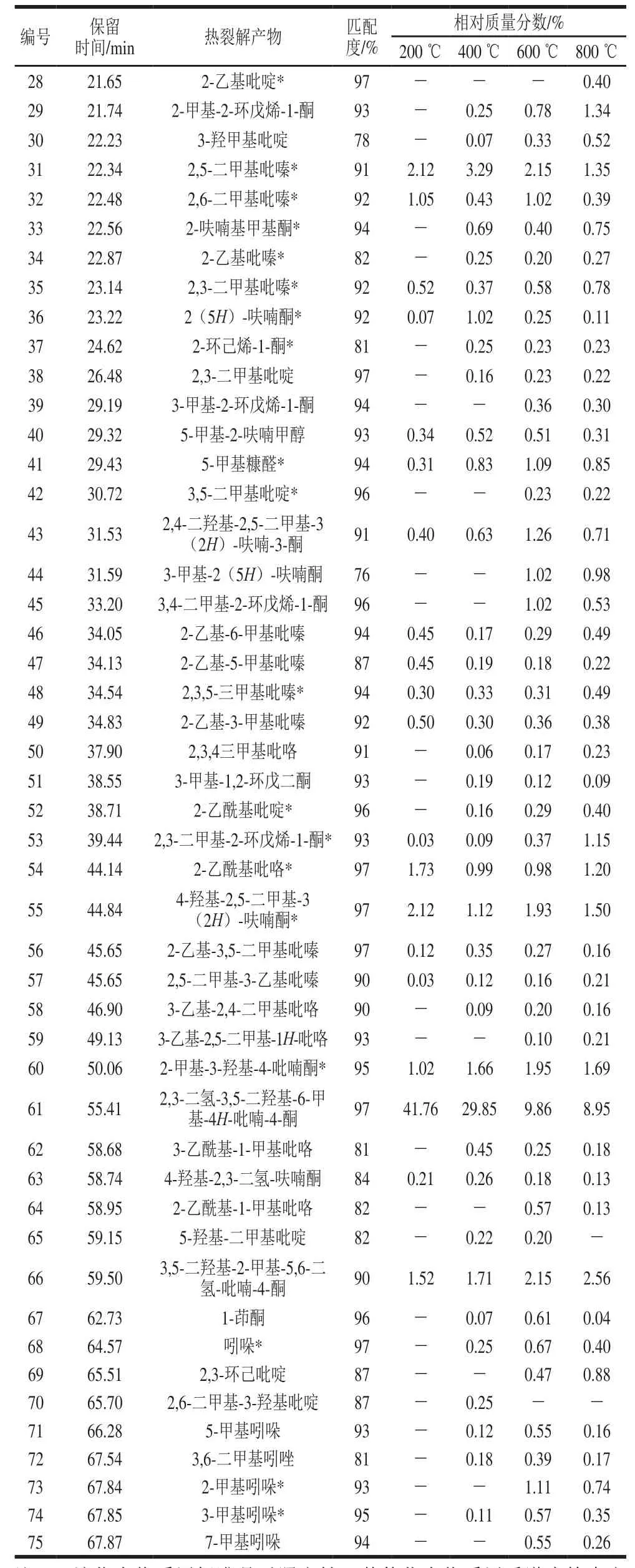
续表2
由表2可知,裂解温度对化合物(Ⅱ)裂解产物的数量有显著影响,裂解产物的数量随温度的升高而增多,在200、400、600、800 ℃下,分别鉴定出30、62、73、73 种化合物。其中,化合物(Ⅱ)在200 ℃下裂解时,产生杂环类物质(包括呋喃类、吡喃酮类、呋喃酮类、吡啶类、吡嗪类和吡咯类)23 种(57.40%)、酮类物质5 种(2.70%)、羧酸类物质1种(乙酸)(9.30%)、醇类物质1 种(2-甲基丁醇)(0.76%)。裂解产物中相对含量最高的依次为2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮(2,3-dihydro-3,5-dihydroxy-6-methyl-4H-pyran-4-one,DDMP)(41.76%)、乙酸(9.30%)、2-甲基吡嗪(2.20%)、2,5-二甲基吡嗪(2.12%)、4-羟基-2,5-二甲基-3(2H)-呋喃酮(菠萝酮)(2.12%)、2-乙酰基吡咯(1.73%)、3,5-二羟基-2-甲基-5,6-二氢-吡喃-4-酮(1.52%)、3-羟基-2-丁酮(1.22%)和2,6-二甲基吡嗪(1.05%)。
400 ℃下化合物(Ⅱ)主要裂解产生杂环类物质(包括呋喃类、吡喃酮类、呋喃酮类、吡啶类、吡嗪类、吡咯类和吲哚类)49 种(57.53%)、酮类物质(包括丁酮、戊酮、环戊烷酮、环戊烯酮)10 种(5.19%)、羧酸类物质1 种(乙酸)(2.85%)、醇类物质1 种(2-甲基丁醇)(0.69%)、芳烃类物质1 种(1-茚酮)(0.07%)。裂解产物中相对含量最高的依次为DDMP(29.85%)、2,5-二甲基吡嗪(3.29%)、乙酸(2.85%)、2-甲基吡嗪(1.95%)、2,3-丁二酮(1.80%)、3,5-二羟基-2-甲基-5,6-二氢-吡喃-4-酮(1.71%)、2-甲基-3-羟基-4-吡喃酮(1.66%)、2,5-二甲基呋喃(1.15%)和4-羟基-2,5-二甲基-3(2H)-呋喃酮(菠萝酮)(1.12%)。与200 ℃下裂解产物相比,400 ℃下裂解产物数量增加32 种,其中杂环类化合物数量明显增加,增加了26 种。
600 ℃下化合物(Ⅱ)的裂解产物中,杂环类物质(包括呋喃类、吡喃酮类、呋喃酮类、吡啶类、吡嗪类、吡咯类和吲哚类)57 种(43.08%)、酮类物质(包括丁酮、戊酮、环戊烷酮和环戊烯酮)12 种(7.25%)、羧酸类物质(乙酸)1 种(1.88%)、醇类物质(2-甲基丁醇)1 种(0.22%)、芳烃类物质2 种(0.74%)。裂解产物中相对含量最高的依次为DDMP(9.86%)、3,5-二羟基-2-甲基-5,6-二氢-吡喃-4-酮(2.15%)、2,5-二甲基吡嗪(2.15%)、2-甲基-3-羟基-4-吡喃酮(1.95%)、4-羟基-2,5-二甲基-3(2H)-呋喃酮(1.93%)、乙酸(1.88%)、4-环戊烯-1,3-二酮(1.82%)、2,5-二甲基呋喃(1.27%)和2,4-二羟基-2,5-二甲基-3(2H)-呋喃-3-酮(1.26%)。与400 ℃下裂解产物相比,600 ℃下裂解产物增加了11 种化合物,其中杂环类增加8 种,酮类增加2 种,芳烃类增加1 种。
800 ℃下化合物(Ⅱ)的裂解产物中,杂环类物质(包括呋喃类、吡喃酮类、呋喃酮类、吡啶类、吡嗪类、吡咯类和吲哚类)57 种(39.03%)、酮类物质(包括丁酮、戊酮、环戊烷酮和环戊烯酮)12 种(7.69%)、羧酸类物质(乙酸)1 种(7.69%)、醇类物质(2-甲基丁醇)1 种(0.28%)、芳烃类物质2 种(0.31%)。裂解产物中相对含量最高的依次为DDMP(8.95%)、3,5-二羟基-2-甲基-5,6-二氢-吡喃-4-酮(2.56%)、2,5-二甲基呋喃(1.98%)、4-环戊烯-1,3-二酮(1.73%)、乙酸(1.69%)、2-甲基-3-羟基-4-吡喃酮(1.69%)、4-羟基-2,5-二甲基-3(2H)-呋喃酮(1.50%)、2,5-二甲基吡嗪(1.35%)、2-甲基-2-环戊烯-1-酮(1.34%)和2-乙酰基吡咯(1.20%)。800 ℃与700 ℃下裂解产物的数量相同。
2.4 裂解产物致香成分分析及产生途径
化合物(Ⅱ)裂解产生75 种化合物,其中绝大多数为烘焙食品或烟草中的重要致香成分,根据文献报道及香料香气分类方法,其裂解化合物表现为焦甜香、甜香、烘焙香、花香和奶香等香韵[17-18],结果列于表3。

表3 主要热裂解产物的香气特征Table3 Aroma characteristics of major pyrolysates
乙酸存于烟气中,有利于烟气酸碱平衡,可改善卷烟口感舒适性[19]。在4 个裂解温度下,化合物(Ⅱ)主要裂解产物为DDMP,含量分别达到41.76%、29.85%、9.86%、8.95%,该化合物为美拉德反应的重要中间体,存在于食品烹饪、烘烤过程中,裂解可产生大量致香物质,对卷烟香气和味觉均具有明显改善作用[20-21]。
DDMP是糖残基降解标志性产物,在裂解产物中含量最高,其产生途径为化合物(Ⅱ)2,3-位发生不可逆地烯醇化,从2-位消去氨基降解产生脱氧二羰基化合物——1-脱氧-2,3-己二酮糖,该化合物为非常活泼的反应中间体,经环化及一系列异构化后脱水产生DDMP[22-23]。脱氧二羰基化合物可进一步转化并裂解产生酸类和酮类化合物,包括乙酸、2,3-戊二酮和3-羟基-2-丁酮等[19]。DDMP经水解、脱水或氧化产生2-甲基-3-羟基-4-吡喃酮(麦芽酚)[24-25]、3,5-二羟基-2-甲基-5,6-二氢-吡喃-4-酮(5-羟基麦芽酚)[26]和4-羟基-2,5-二甲基-3(2H)-呋喃酮(菠萝酮)等物质[27-29]。呋喃类化合物产生为化合物(Ⅱ)1,2-位烯醇化并消去3-位羟基,经加水生成3-脱氧己糖酮,再经脱水反应产生[30]。2-L-天冬氨酸-2-脱氧-D-葡萄糖主要裂解产物的形成途径如图3所示。
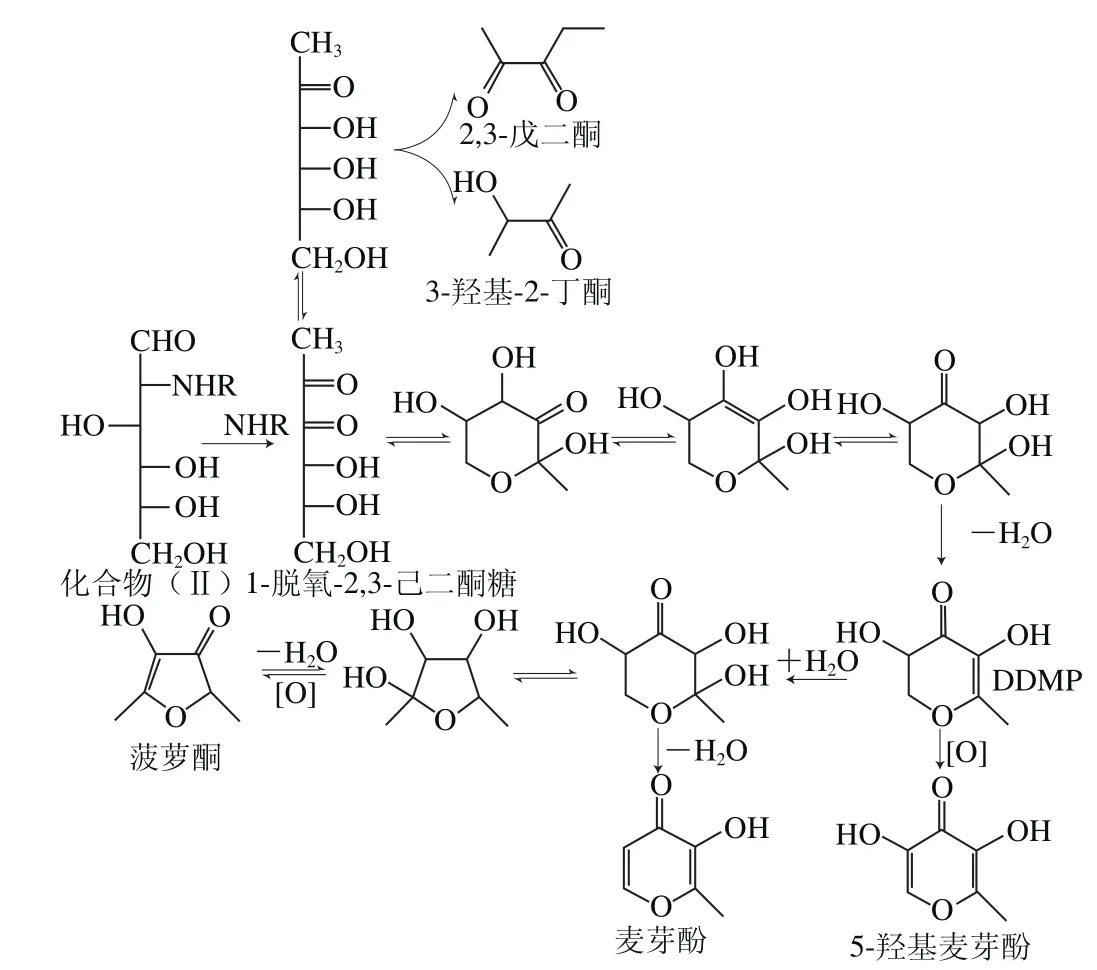
图3 2-L-天冬氨酸-2-脱氧-D-葡萄糖主要裂解产物形成途径Fig.3 Formation pathways of major pyrolytic products of 2-L-aspartic acid-2-deoxy-D-glucose
吡嗪类化合物主要由斯特勒克醛或酮(α-氨基醛或酮)缩合而成,如2,5-二甲基吡嗪由2 分子α-氨基丙酮缩合产生,2-乙基-3,5-二甲基吡嗪由α-氨基丙醛与α-氨基戊酮缩合而成,2,3,5-三甲基吡嗪由α-氨基丙酮和α-氨基丁酮缩合产生,α-氨基丙酮与α-氨基乙醛或α-氨基丙醛缩合分别产生2-甲基吡嗪和2,6-二甲基吡嗪[19]。
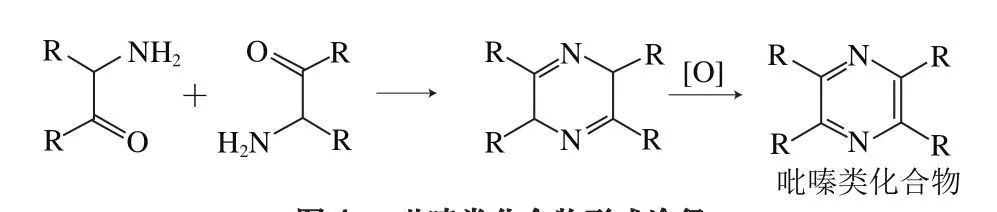
图4 吡嗪类化合物形成途径Fig.4 Formation pathways of pyrazine compounds
吡咯类化合物主要由斯特勒克醛降解和氨基酸残基裂解产生的醛和α-氨基醛或酮经烯醇化后脱水产生[31]。吡啶、2-乙酰基吡啶、吲哚和2-甲基吲哚等杂环类化合物由醇醛缩合、醛氨缩合产生。4-环戊烯-1,3-二酮等环戊烯酮类可能由化合物(Ⅱ)烯醇化后碳键发生断裂产生五碳醛糖,五碳醛糖再经环化脱水后产生[19-32]。
2.5 抗氧化性能分析
2.5.1 对DPPH自由基的清除能力
DPPH自由基较稳定,在乙醇溶液中显紫色,在517 nm波长处有特征吸收,当DPPH自由基与抗氧化试剂反应时,其孤对电子被配对并产生无色产物,导致溶液该处的吸收峰下降,吸光度变小,故可利用分光光度法定量分析。2-L-天冬氨酸-2-脱氧-D-葡萄糖和抗坏血酸清除DPPH自由基的能力如图5所示。
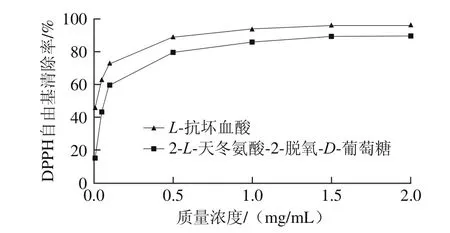
图5 2-L-天冬氨酸-2-脱氧-D-葡萄糖对DPPH自由基的清除能力Fig.5 DPPH radical scavenging activity of 2-L-aspartic acid-2-deoxy-D-glucose
由图5可知,在实验质量浓度范围内,样品的DPPH自由基清除率与其质量浓度呈正相关,随着质量浓度上升,2-L-天冬氨酸-2-脱氧-D-葡萄糖和L-抗坏血酸对DPPH自由基有清除率逐渐增大,当质量浓度达到2 mg/mL时,2-L-天冬氨酸-2-脱氧-D-葡萄糖和L-抗坏血酸的清除率分别为89.20%和95.90%,半抑制浓度(the half maximal inhibitory concentration,IC50)(对自由基清除率为50%时所需质量浓度)分别为0.08 mg/mL和0.02 mg/mL,即2-L-天冬氨酸-2-脱氧-D-葡萄糖对DPPH自由基的清除能力略低于L-抗坏血酸。
2.5.2 还原能力
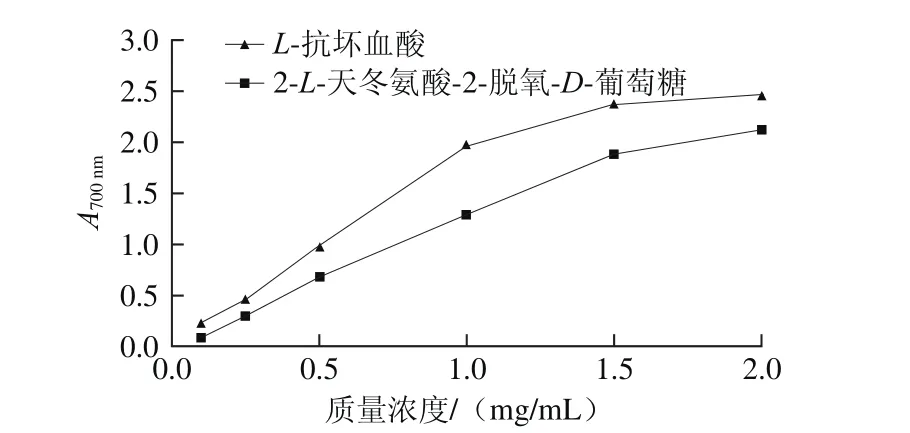
图6 2-L-天冬氨酸-2-脱氧-D-葡萄糖的还原能力Fig.6 Reducing capacity of 2-L-aspartic acid-2-deoxy-D-glucose
还原能力测定的实质是检测物质是否为良好的电子供应者,还原力强的物质可与自由基反应,使自由基转化为较稳定的物质。由图6可知,在测定质量浓度范围内,2-L-天冬氨酸-2-脱氧-D-葡萄糖具有还原能力,其还原能力与质量浓度呈正相关性,且随着质量浓度的增大还原能力也随之增强。在质量浓度为2.0 mg/mL时,2-L-天冬氨酸-2-脱氧-D-葡萄糖和L-抗坏血酸的A700nm分别为2.08和2.45,即2-L-天冬氨酸-2-脱氧-D-葡萄糖的还原能力约为L-抗坏血酸的85.00%,这与2 种化合物清除DPPH自由基的实验结果一致。
3 结 论
以D-果糖和L-天冬氨酸单钾盐为原料,合成了2-L-天冬氨酸-2-脱氧-D-葡萄糖,并利用FTIR、1H NMR、13C NMR和HRMS对化合物结构进行了表征。本法原料易得、操作简便。
采用TG-DTG和Py-GC/MS对2-L-天冬氨酸-2-脱氧-D-葡萄糖热裂解特性进行了研究,结果表明,2-L-天冬氨酸-2-脱氧-D-葡萄糖为无熔点化合物,裂解温度为187.8 ℃,700 ℃时总失重达到91.26%,裂解较完全;200~800 ℃条件下对样品进行热裂解,裂解产物数量随温度的升高而增多,裂解产物以杂环类化合物为主,同时产生一定量的酮类、羧酸类、醛类、烯烃类、醇类和芳烃类等化合物。裂解化合物具有焦甜香、甜香、烘焙香、花香和奶香等香韵。
抗氧化性能分析结果表明,2-L-天冬氨酸-2-脱氧-D-葡萄糖对DPPH自由基清除率和还原能力随质量浓度的升高而逐渐增大,当质量浓度达到2.0 mg/mL时,2-L-天冬氨酸-2-脱氧-D-葡萄糖和L-抗坏血酸的DPPH自由基清除率和A700nm分别为89.20%、2.08和95.90%、2.45;2-L-天冬氨酸-2-脱氧-D-葡萄糖对DPPH自由基的清除能力和还原能力略低于L-抗坏血酸,表明其具有较强的DPPH自由基清除能力和还原能力,是一种潜在的抗氧化剂。
[1] HUDSON B J F. Biochemistry of Food Proteins[M]. New York:Elsevier Applied Science, 1992: 99-153.
[2] 李亚丽, 刘晓徐, 郑培华, 等. 美拉德反应研究进展[J]. 食品科技,2012, 37(9): 82-87. DOI:10.13684/j.cnki.spkj.2012.09.037.
[3] 蔡妙颜, 肖凯军, 袁向华. 美拉德反应与食品工业[J]. 食品工业科技,2003, 38(7): 90-93. DOI:10.13386/j.issn1002-0306.2003.07.038.
[4] COLEMAN Ⅲ W M, CHUNG H L. Pyrolysis GC-MS analysis of Amadori compounds derived from selected amino acids and glucose[J]. Journal of Analytical and Applied Pyrolysis, 2002, 62(2):215-223. DOI:10.1016/S0165-2370(01)00118-8.
[5] 郑文华, 许旭. 美拉德反应的研究进展[J]. 化学进展, 2005, 17(1):122-129. DOI:10.3321/j.issn:1005-281X.2005.01.014.
[6] 芦昶彤, 白兴, 贾春晓, 等. 1-L-丙氨酸-1-脱氧-D-果糖的热裂解分析[J]. 郑州轻工业学院学报(自然科学版), 2011, 26(4): 35-40.DOI:10.3969/j.issn.1004-1478.2011.04.008.
[7] TATEYAMA M. Development of polymer-supported synthetic procedure for Heyns rearrangement products[D]. Montreal: McGill University, 1999: 3-19.
[8] SHIPAR M A H. DFT Studies on fructose and glycine Maillard reaction: formation of the Heyns rearrangement products in the initial stage[J]. Journal of the Iranian Chemical Society, 2011, 8(2): 433-448.DOI:10.1007/BF03249077.
[9] ABRAMS A, LOWY P H, BORSOOK H. Preparation of 1-amino-1-deoxy-2-ketohexoses from aldohexoses and α-amino acids[J].Journal of the American Chemical Society, 1955, 77(18): 4794-4796.DOI:10.1021/ja01623a030.
[10] ALEXIS H D, VAROUJAN A Y, ANAHITA K. Pyrolysis/GC/MS analysis of 1-[(2’-carboxyl)pyrrolidinyl]-1-deoxy-D-fructose (proline Amadori compound)[J]. Journal of Agricultural and Food Chemistry,1994, 42(11): 2519-2524. DOI:10.1021/jf00047a027.
[11] NICOLE M, BEMARD G, THAT V, et al. A fully automated high-performance liquid chromatographic procedure for isolation and purification of Amadori compounds[J]. Journal of Agricultural and Food Chemistry, 1982, 30(4): 782-786.DOI:10.1021/jf00112a043.
[12] 郑毅男, 松浦幸永, 韩立坤, 等. 红参中新化合物: 精氨酸衍生物的分离与结构鉴定[J]. 药学学报, 1996, 31(3): 191-195. DOI:10.16438/j.0513-4870.1996.03.007.
[13] 郑毅男, 张晶, 昆合典, 等. 精氨酸衍生物对微循环的作用[J]. 吉林农业大学学报, 1998, 20(4): 45-47. DOI:10.13327/j.jjlau.1998.04.011.
[14] 曹国军, 郑毅男, 许传莲, 等. 人参加工品中精氨酸衍生物测定方法研究[J]. 中国药学杂志, 2003, 38(1): 52-53. DOI:10.3321/j.issn:1001-2494.2003.01.021.
[15] JOSHI R, KAMAT J P, MUKHERJEE T. Free radical scavenging reactions and antioxidant activity of embelin: biochemical and pulse radiolytic studies[J]. Chemico-Biological Interactions, 2007, 167(2):125-134. DOI:10.1016/j.cbi.2007.02.004.
[16] 常飞, 杨雪果, 肖士成, 等. 脱脂羊脑蛋白酶解条件优化及酶解产物体外抗氧化活性[J]. 食品科学, 2015, 36(3): 114-121. DOI:10.7506/spkx1002-6630-201503022.
[17] 济南市轻工研究所. 合成食用香料手册[M]. 北京: 中国轻工业出版社, 1985: 302-765.
[18] 孙宝国, 刘玉平. 食用香料手册[M]. 北京: 中国石化出版社, 2004:75-387.
[19] 毛多斌, 马宇平, 梅业安. 卷烟配方和香精香料[M]. 北京: 化学工业出版社, 2001: 100-120.
[20] 徐华军, 陈良元, 徐迎波, 等. Maillard反应生成DDMP的影响因素[J]. 烟草科技, 2014, 20(2): 29-32. DOI:10.3969/j.issn.1002-0861.2014.02.008.
[21] MILLS F D, WEISLEDER D, HODGE J E. 2,3-Dihydro-3,5-dihydroxy-6-methyl-4(H)-pyran-4-one, a novel nonenzymatic browing product[J]. Tetrahedron Letters, 1970, 11(15): 1243-1246.DOI:10.1016/S0040-4039(01)91599-0.
[22] PAINE III J B, PITHAWALLA Y B, NAWORAL J D. Carbohydrate pyrolysis mechanisms from isotopic labeling: part 2. the pyrolysis of D-glucose: general disconnective analysis and the formation of C1 and C2 carbonyl compounds by electrocyclic fragmentation mechanisms[J]. Journal of Analytical and Applied Pyrolysis, 2008,82(1): 10-41. DOI:10.1016/j.jaap.2008.01.002.
[23] DILLS W L. Protein fructosylation: fructose and the Maillard reaction[J]. The American Journal of Clinical Nutrition, 1993, 58(5):779-787.
[24] AMEUR L A, REGA B, GIAMPAOLI P, et al. The fate of furfurals and other volatile markers during the baking process of a model cookie[J]. Food Chemistry, 2008, 111(3): 758-763. DOI:10.1016/j.foodchem.2007.12.062.
[25] KIM M O, BALTES W. On the role of 2,3-dihydro-3,5-dihydroxy-6-methyl-4(H)-pyran-4-one in the Maillard reaction[J]. Journal of Agricultural and Food Chemistry, 1996, 44(1): 282-289. DOI:10.1021/jf950208h.
[26] YAYLAYAN V A, MANDEVILLE S. Stereochemical control of maltol formation in Maillard reaction[J]. Journal of Agricultural and Food Chemistry, 1994, 42(3): 771-775. DOI:10.1021/jf00039a034.
[27] 陈永宽, 孔宁川, 武怡, 等. 2,3-二氢-3,5-二羟基-6-甲基-4(H)吡喃-4-酮的合成及热裂解行为[J]. 化学研究与应用, 2003, 15(1): 45-47.DOI:10.3969/j.issn.1004-1656.2003.01.011.
[28] BLANK I, DEVAUD S, MATTHEY D W, et al. Formation of odorants in Maillard model systems based on L-proline as affected by pH[J]. Journal of Agricultural and Food Chemistry, 2003, 51(12):3643-3650. DOI:10.1021/jf034077t.
[29] LEDL F, SCHLEICHER E. New aspects of the Maillard reaction in foods and in the human body[J]. Angewandte Chemie International Edition in English, 1990, 29(6): 565-594. DOI:10.1002/anie.199005653.
[30] PAINE Ⅲ J B, PITHAWALLA Y B, NAWORAL J D. Carbohydrate pyrolysis mechanisms from isotopic labeling: part4. the pyrolysis of D-glucose: formation of furans[J]. Journal of Agricultural and Applied Pyrolysis, 2008, 83(1): 37-63. DOI:10.1016/j.jaap.2008.05.008.
[31] PAINE Ⅲ J B, PITHAWALLA Y B, NAWORAL J D. Carbohydrate pyrolysis mechanisms from isotopic labeling: part3. the pyrolysis of D-glucose: formation of C3 and C4 carbonyl compounds and a cyclopentendion isomer by eletrocyclic fragmentation mechanisms[J].Journal of Agricultural and Applied Pyrolysis, 2008, 82(1): 42-69.DOI:10.1016/j.jaap.2007.12.005.
[32] PAINE Ⅲ J B, PITHAWALLA Y B, NAWORAL J D. Carbohydrate pyrolysis mechanisms from isotopic labeling: part2. the pyrolysis of D-glucose: general disconnective analysis and the formation of C1 and C2 carbonyl compounds by eletrocyclic fragmentation mechanisms[J].Journal of Agricultural and Applied Pyrolysis, 2008, 82(1): 10-41.DOI:10.1016/j.jaap.2008.01.002.
