脂肪氧化对肌原纤维蛋白氧化及其结构和功能性质的影响
2018-03-20张顺亮周慧敏李家鹏陈文华王守伟
赵 冰,张顺亮,李 素,周慧敏,任 双,李家鹏,陈文华,赵 燕,王守伟*
(北京食品科学研究院,中国肉类食品综合研究中心,肉类加工技术北京市重点实验室,北京 100068)
肉制品在加工和贮藏过程中会发生脂肪和蛋白质的氧化降解,其对肉制品的品质具有双重作用[1-3]:适度氧化可以提高产品的质构、色泽和风味等品质,过度的氧化造成产品品质劣变和腐败,脂肪和蛋白质的氧化和降解在肉制品中同时存在又相互影响[4-7]。
脂肪的氧化是自由基链式反应的复杂过程[8],脂肪酸在高温、光照和酶等物质的作用下发生反应,产生氢过氧化物,然后再分解成醛、酮和低级脂肪酸等化合物,低含量的氧化产物,特别是不饱和醛类物质的形成对产品风味的形成具有重要作用,高含量的氧化产物会产生难闻的酸败腐臭的刺激性气味,造成产品品质的劣变[9-12]。脂肪氧化与蛋白质氧化相互影响,并且一种物质氧化产生的物质会促进另一种物质的氧化。蛋白氧化被认为是一种类似于脂肪氧化的自由基链式反应,但是过程和产物更加复杂,自由基和金属离子等因素都能促进蛋白质的氧化。脂肪氧化与蛋白质氧化的关联性还与它们所处的环境有关,在羟自由基氧化系统中相关性较强,而在高铁肌红蛋白氧化系统尚未发现其相关性。这可能主要是由环境中的促氧化因子决定的。蛋白质的氧化产物主要体现为羰基基团的暴露、巯基的损失和蛋白质交联的形成[13-15],适度的蛋白氧化可以改善产品的凝胶特性[16];但是,过度的蛋白氧化又会造成凝胶特性的破坏,甚至产品的腐败[17-18]。近年来,对于蛋白氧化的研究越来越多,已经取得了一定的研究成果,但是对于蛋白氧化和脂肪氧化关系的研究还比较少,研究脂肪氧化和蛋白氧化的关系对于提高肉制品的质量安全具有重要意义。
肉制品是非常复杂的氧化反应机体,脂肪和蛋白质含量丰富,水、微生物和酶等影响因素同时存在,研究肉制品中脂肪氧化对蛋白氧化的影响必须建立相应的模拟体系,以消除其他因素的干扰。本实验以肌原纤维蛋白为对象,研究脂肪氧化对蛋白质氧化性质和微观结构的影响,以期为肉制品中脂肪氧化和蛋白氧化相互关系的研究提供技术支持。
1 材料与方法
1.1 材料与试剂
猪肉购于北京中瑞食品有限公司分割车间;菜籽油为市售。
乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、三羟甲基氨基甲烷(Tris)、NaCl、三氯乙酸和K2HPO4等(均为分析纯) 国药集团化学试剂有限公司;哌嗪-1,4-二乙磺酸(piperazine-1,4-bisethanesulfonic acid,PIPES) 美国Sigma公司。
1.2 仪器与设备
Nicolet iS10傅里叶变换红外光谱仪 美国Thermo Fisher Scientif i c公司;Discovery DHR-2流变仪 美国TA仪器公司。
1.3 方法
1.3.1 氧化模型的构建
1.3.1.1 氧化脂肪的制备
以菜籽油为对象,采用油脂氧化仪快速制备氧化油脂,配制不同氧化程度的油脂氧化模型,以硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)为指标,配制TBARS含量分别为0.5、1.0、1.5、2.0、2.5 mg/kg的油脂氧化模型[19]。
1.3.1.2 肌原纤维蛋白的提取
以猪肉中提取的肌原纤维蛋白为蛋白样品,肌原纤维蛋白的提取参考Xiong Youling L.等[20]的方法,取冷冻的新鲜猪通脊肉,4 ℃解冻,然后用5 倍体积的提取缓冲溶液(0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EDTA、10 mmol/L K2HPO4,pH 7.0)提取,于10 000 r/min高速匀浆,再在4 ℃条件下2 000×g离心10 min,用上述提取缓冲溶液重复洗涤沉淀4 次,直至洗出的溶液清澈,然后用4 层纱布过滤,并用0.1 mol/L的HCl将滤液调pH值为6.0。然后再次于2 000×g离心10 min,将得到的沉淀部分用缓冲溶液(15 mmol/L PIPES、0.6 mol/L NaCl,pH 6.0)溶解,得到肌原纤维蛋白溶液备用。
1.3.1.3 氧化反应模型的建立
以肌原纤维蛋白溶液为对象,将其质量浓度调整至约为10 mg/mL,通过添加不同氧化程度的脂肪建立不同的氧化模型体系[20]。氧化体系由以下试剂组成:肌原纤维蛋白溶液19.6 mL、1.3.1.1节制备的油脂氧化模型0.2 mL、吐温20试剂0.2 mL,通过高速匀浆机使其充分混匀。将反应体系混合均匀呈现出乳浊液状态,25 ℃反应4 h,检测蛋白质氧化程度及其相关性质,以未添加脂肪的蛋白溶液为对照。
1.3.2 蛋白质氧化程度检测
1.3.2.1 羰基含量的测定
羰基含量的测定参考Levine等[21]的方法,从不同氧化模型中取出1 mL溶液加入到50 mL离心管中,再加入4 mL含10 mmol/L 2,4-二硝基苯肼的2 mol/L HCl溶液,以不含2,4-二硝基苯肼的2 mol/L HCl溶液为空白,25 ℃反应1 h。然后每个样品中加入5 mL质量分数为20%的三氯乙酸溶液,振荡混合均匀,在4 ℃条件下,于11 000×g离心5 min,弃去上清液,沉淀部分用2 mL体积比为1∶1的乙醇-乙酸乙酯溶液洗涤4 次,以完全洗去未反应的2,4-二硝基苯肼,氮吹除去残留的有机溶液,然后加入2 mL 6 mol/L的盐酸胍溶液(pH 2.3),37 ℃保温30 min,然后在370 nm波长处测定吸光度,蛋白质溶液的质量浓度采用双缩脲法测定,计算蛋白质羰基含量的摩尔吸光系数为22 000 L/(mol•cm)。
1.3.2.2 巯基含量的测定
巯基含量的测定参考Ellman[22]的方法。从不同氧化模型中取出1 mL溶液加入到10 mL离心管中,然后加入1 mL缓冲溶液(6 mol/L盐酸胍、1 mmol/L EDTA、50 mmol/L Tris-HCl,pH 8.3),10 µL 10 mmol/L pH 7.6的5,5-二硫代双(2-硝基苯甲酸)(100 mmol/L Tris-HCl作为溶剂)溶液,振荡混合均匀,25 ℃反应25 min,在412 nm波长处测定吸光度,蛋白质溶液的质量浓度采用双缩脲法测定,计算蛋白质巯基含量的摩尔吸光系数为136 000 L/(mol•cm)。
1.3.2.3 二酪氨酸含量测定
二酪氨酸含量的测定参考Davies等[23]的方法,将不同氧化模型中的溶液11 000×g离心10 min,取上清液采用荧光光度计检测二酪氨酸的含量。测定条件:发射波长420 nm(狭缝10 nm),激发波长325 nm(狭缝10 nm),蛋白质溶液的质量浓度采用双缩脲法测定,最终的结果采用相对荧光强度表示,用荧光强度除以蛋白质溶液的质量浓度计算。
1.3.3 表面疏水性测定
蛋白质表面疏水性的测定参考Chelh等[24]的方法,从不同油脂氧化模型中取出2 mL溶液加入到10 mL离心管中,然后加入40 μL 1 mg/mL的溴酚蓝指示溶液,25 ℃搅拌10 min,然后4 ℃、4 000×g离心15 min,取上清液在595 nm波长处测定吸光度,最终的蛋白质表面疏水性结果以与蛋白质结合的溴酚蓝质量表示。以不添加油脂氧化模型为对照。
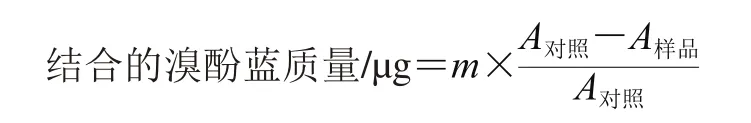
式中:m为添加溴酚蓝的质量/μg,本实验中添加了40 μg;A对照、A样品分别为对照组和样品在595 nm波长处的吸光度。
1.3.4 流变学性质测定
蛋白质流变学性质采用流变仪进行检测。测定参数:4 cm直径夹具,以2 ℃/min的速率从25 ℃上升至80 ℃,频率0.1 Hz,狭缝1 mm[25]。
1.3.5 傅里叶变换红外光谱测定蛋白质二级结构
根据参考文献[26]的方法。从不同氧化模型中取蛋白溶液直接加到检测样品台上进行测定,采用OMNIC软件对检测数据进行基线校正、去卷积和二阶求导处理,分析蛋白质α-螺旋、β-折叠、β-转角和无规卷曲二级结构的变化。
1.4 数据统计分析
实验中每组实验3 次平行,实验结果采用Microsoft Excel软件处理数据,SPSS 17.0统计分析软件中的单因素方差分析进行显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 脂肪氧化对蛋白质氧化程度的影响
2.1.1 脂肪氧化对蛋白质羰基含量的影响
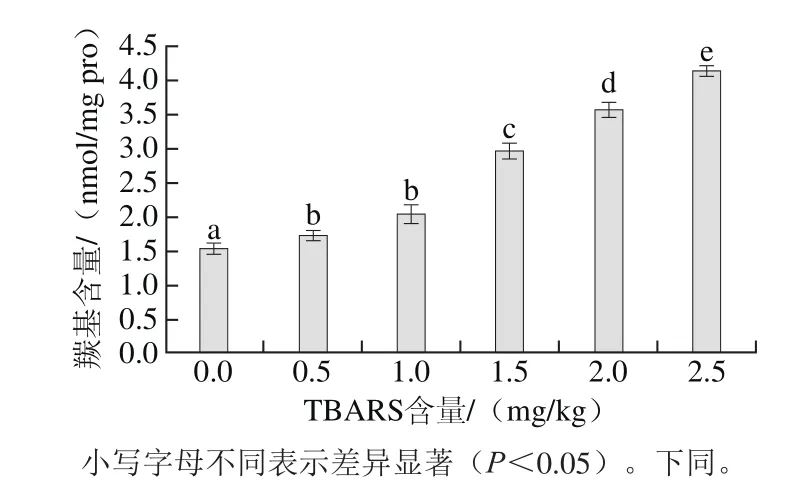
图1 脂肪氧化对羰基含量的影响Fig.1 Effect of lipid oxidation on carbonyl content
蛋白质中羰基含量的高低是反映蛋白质氧化程度的重要指标之一,主要是由易受自由基攻击的氨基酸侧链氧化断裂产生[27-29]。由图1可知,脂肪的氧化程度对蛋白质的氧化具有显著的促进作用,随着脂肪氧化程度的增加,蛋白质羰基含量显著增加,当TBARS含量为2.5 mg/kg时,蛋白羰基含量达到4.12 nmol/mg pro。这是由于脂肪的氧化反应是一个自由基的链式反应,氧化过程中自由基不但催化氧化脂肪,同时攻击蛋白质的敏感性氨基酸侧链,使蛋白质的氨基酸侧链暴露,进而发生蛋白质的聚合、变性等反应,羰基含量增加[30],说明自由基可以促进蛋白质氧化反应的进行,这与章银良等[26]的研究结果具有一致性。但是蛋白质的变性等作用同样造成羰基含量的升高,因此,不能仅以羰基含量作为蛋白质氧化程度的唯一参数,必须结合其他指标进行综合评定。
2.1.2 脂肪氧化对蛋白质巯基含量的影响
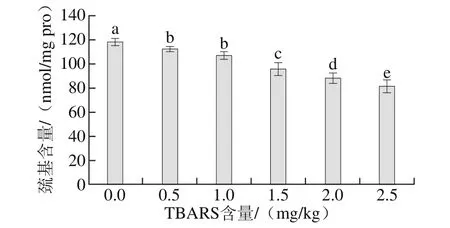
图2 脂肪氧化对巯基含量的影响Fig.2 Effect of lipid oxidation on sulphydryl content
半胱氨酸是蛋白质氧化过程中最敏感的氨基酸之一,在羰基含量不能完全表达蛋白质氧化程度的前提下,可以通过测定半胱氨酸含量的高低进一步反映蛋白质氧化的程度,半胱氨酸的含量可以通过测定巯基的含量来进行评价。由图2可知,随着脂肪氧化程度的增加,蛋白质巯基含量显著降低,当TBARS含量为2.5 mg/kg时,巯基含量为81.33 nmol/mg pro。说明半胱氨酸受到自由基的攻击,脂肪的氧化产生的自由基可以催化氧化蛋白质。这也与蛋白质和脂肪自由基促氧化的机理相一致。
2.1.3 脂肪氧化对蛋白质二酪氨酸含量的影响
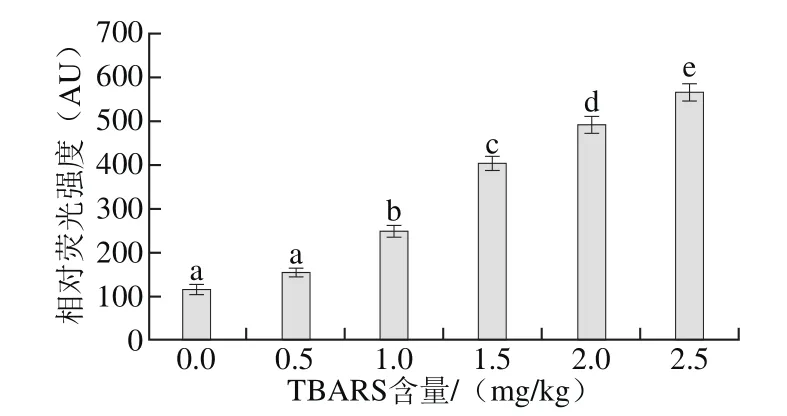
图3 脂肪氧化对二酪氨酸含量的影响Fig.3 Effect of lipid oxidation on bityrosine content
与半胱氨酸类似,酪氨酸也是自由基氧化蛋白质时的敏感氨基酸之一,酪氨酸在自由基的作用下发生氧化反应形成二酪氨酸,因此,可以通过检测二酪氨酸的含量评价蛋白质的氧化程度[31]。由图3可知,随着脂肪氧化程度的增加,二酪氨酸的含量显著增加,当TBARS含量为2.5 mg/kg时,二酪氨酸含量为563.36 AU。说明酪氨酸受到自由基的攻击发生氧化反应形成二酪氨酸,蛋白质的氧化程度逐渐增加。这也与前文羰基含量和巯基含量的变化趋势一致,共同反映出蛋白质氧化程度的变化规律。
因此,通过羰基含量、巯基含量和二酪氨酸含量的变化可以综合反映出脂肪氧化对蛋白质氧化的促进作用,证实了脂肪氧化产生的自由基同样可以催化蛋白质的氧化。
2.2 脂肪氧化对蛋白质表面疏水性的影响
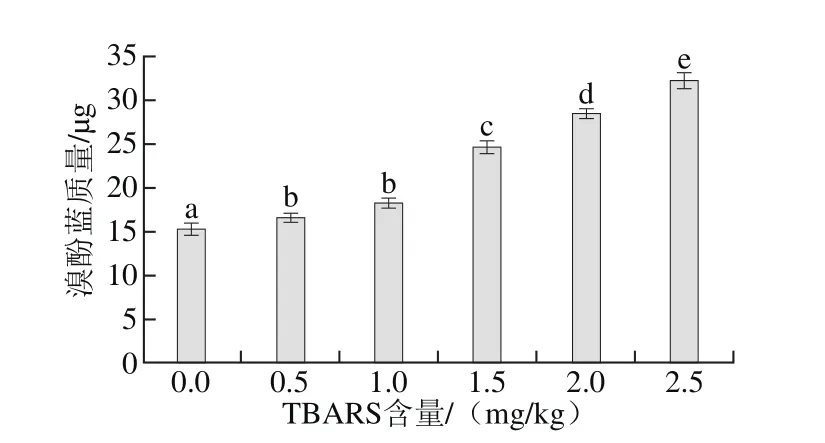
图4 脂肪氧化对蛋白质表面疏水性的影响Fig.4 Effect of lipid oxidation on surface hydrophobicity
脂肪氧化产生的自由基催化氧化蛋白质发生氧化反应,可能引起蛋白质分子结构发生变化,蛋白质的表面疏水性是维持蛋白质三级结构的主要作用力,对蛋白质结构和功能的稳定具有重要意义[19]。蛋白质氧化后,蛋白质分子发生折叠,肽腱断裂,使蛋白质分子内部的疏水性基团暴露,造成蛋白质表面疏水性增加,因此,蛋白质疏水性也可以反映蛋白质的氧化程度。由图4可知,随着脂肪氧化程度的增加,蛋白质表面疏水性增加,说明脂肪的氧化可以促进蛋白质氧化作用的进行。
2.3 脂肪氧化对蛋白质流变学性质的影响
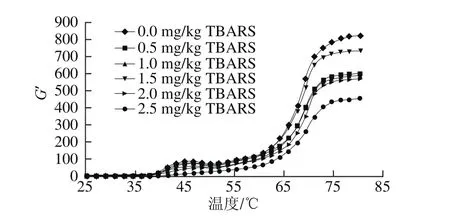
图5 脂肪氧化对蛋白质储能模量的影响Fig.5 Effect of lipid oxidation on protein gel storage modulus
随着温度的升高,蛋白质形成三维凝胶网络体系,通过测定蛋白质的流变学性质可以得到蛋白质的凝胶形成能力和凝胶弹性能力,可以用弹性模量或储能模量(G’)表示,G’越大,表明蛋白质形成凝胶的弹性越强。蛋白质氧化后肌原纤维的G’会受到明显的影响,疏水基团的暴露、肽腱的断裂和结构的变化等影响了蛋白质凝胶的形成[19]。肌原纤维蛋白的G’随着温度的升高表现出先升高再降低再升高的波峰波谷模式,这与肌原纤维蛋白的组成和性质有关。在温度上升初期,蛋白质与水处于平衡状态,随着温度的升高,在45~50 ℃会形成G’的波峰,这是肌球蛋白的变性温度,此时,蛋白质结构逐渐打开,蛋白质相互作用增强,促进了凝胶的形成。随着温度的上升,G’逐渐增加,直至加热的最终温度,同时可以发现后期G’的变化逐渐变缓,这是由于蛋白质后期逐步形成稳定的凝胶体系。由图5可知,随着脂肪氧化程度的增加,蛋白质的G’在第一个波峰处显示出下降的趋势,不含脂肪的蛋白质溶液在第一个波峰时G’最高,随着脂肪氧化程度的增加,G’逐渐减小,当TBARS含量为2.5 mg/kg时,G’在波峰处最低,这与李银等[27]的研究结果具有一致性。因此,脂肪氧化可以促进蛋白质发生氧化反应,蛋白氧化降低了凝胶的G’,所形成凝胶的弹性随着蛋白氧化程度的增加而降低。
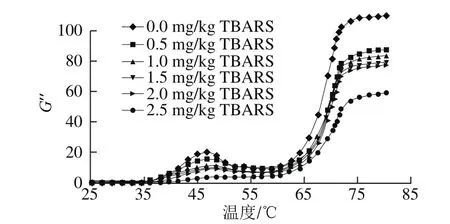
图6 脂肪氧化对蛋白质损失模量的影响Fig.6 Effect of lipid oxidation on protein gel loss modulus
在流变学性质检测过程中,与G’相对应的是损失模量(G”),用来表示蛋白质凝胶的黏性性状,G”与G’相对应,随着温度的升高表现出波峰波谷的模式,同时,G”始终低于G’,当温度高于70 ℃时,G”趋于稳定,说明蛋白质凝胶的黏性趋于稳定[32]。由图6可知,随着脂肪氧化程度的增加,45~50℃的波峰G”逐渐降低,这与G’的变化表现出一致性。说明脂肪氧化促进了蛋白氧化的进行,蛋白氧化降低了蛋白质的黏性。
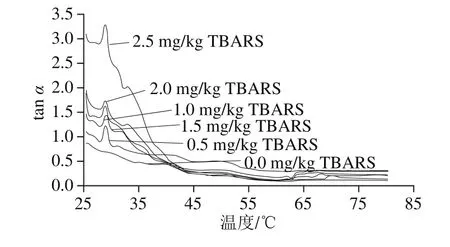
图7 脂肪氧化对蛋白质tan α的影响Fig.7 Effect of lipid oxidation on protein gel tan α
tan α是G”和G’之间的比值,是对样品黏弹性的综合评价指标,反映出每个振荡过程的能量损耗,其变化趋势可以反映蛋白凝胶网状结构特性,数值越低说明凝胶网状结构越好,反之越差。由图7可知,随着脂肪氧化程度的增加,tan α在相同温度下的值整体显示出增加的趋势,说明蛋白质的弹性降低,三维网状结构遭到破坏,结合上面蛋白氧化的结果,说明脂肪氧化促进蛋白氧化的进行且造成三维网状结构的破坏。
2.4 脂肪氧化对蛋白质二级结构变化的影响
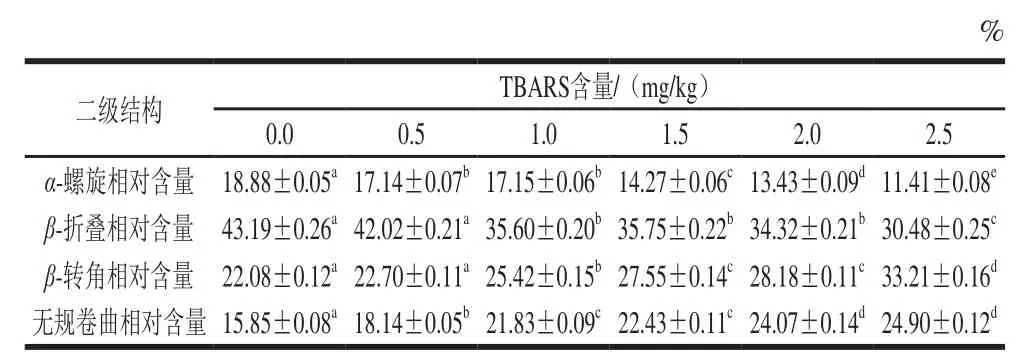
表1 脂肪氧化对蛋白质二级结构的影响Table1 Effect of lipid oxidation on secondary structures of the protein
通过蛋白质在红外光谱区的变化可以反映蛋白质二级结构的变化趋势,蛋白质和多肽的二级结构在红外光谱区域有9 个特征吸收带,其中,酰胺Ⅰ带是研究蛋白质二级结构的关键吸收带,这是由于蛋白质二级结构的α-螺旋、β-折叠、β-转角和无规卷曲可以通过酰胺Ⅰ带进行分析。酰胺Ⅰ带位于1 600~1 700 cm-1的波段范围内,在这个范围内,1 650~1 658 cm-1波段范围为α-螺旋的特征波段,1 600~1 640 cm-1波段范围为β-折叠的特征波段,1 660~1 695 cm-1波段范围为β-转角的特征波段,1 640~1 650 cm-1波段范围为无规卷曲的特征波段[33]。因此,分析蛋白质酰胺Ⅰ带的变化对研究蛋白质二级结构的变化具有重要意义。
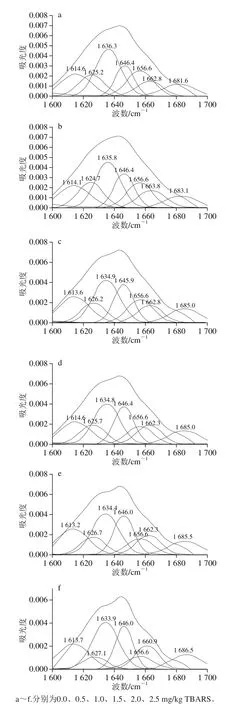
图8 蛋白质的傅里叶变换红外酰胺Ⅰ带分布Fig.8 Fourier transform infrared spectroscopy amide I band prof i les of myof i brillar protein at different TBARS contents
图8是不同TBARS含量模型的蛋白质溶液的傅里叶变换红外光谱通过对吸光度进行基线校正、去卷积、二阶求导和拟合分析处理得到的酰胺Ⅰ带分布图,通过傅里叶变换红外光谱仪的Omnic处理软件进行分析,得到表1和图8的结果。由图8可以发现,随着TBARS含量的增加,蛋白质酰胺Ⅰ带的图谱从平滑均匀逐渐变得杂乱,同时结合二级结构的特征吸收波段范围对照表1可以发现,随着TBARS含量的增加,α-螺旋和β-折叠的相对含量逐渐降低,而β-转角和无规卷曲的相对含量逐渐增加,这是由于随着TBARS含量的增加,脂肪氧化程度增加,产生的自由基攻击蛋白质,促进蛋白质发生氧化反应,蛋白质氧化过程中,其构象和二级结构不断发生变化,稳定的α-螺旋和β-折叠相对含量逐渐降低,转变成不规则的β-转角和无规卷曲,蛋白质的稳定结构遭到破坏,这也与章银良等[26]的研究结果相一致。
3 结 论
本实验以肌原纤维蛋白为研究对象,建立不同氧化程度的脂肪促蛋白氧化模型,研究脂肪氧化对蛋白氧化的影响,结果表明:脂肪氧化可以促进蛋白质氧化反应的发生,蛋白质的氧化程度随着脂肪氧化程度的增加而增加;在脂肪氧化的促进作用下,蛋白质的表面疏水性和流变学特性都随之发生变化,随着脂肪氧化程度的增加,蛋白质表面疏水性逐渐增加,G’和G”逐渐降低;蛋白氧化使蛋白质的二级结构发生变化,稳定的α-螺旋和β-折叠相对含量降低,向不规则的β-转角和无规卷曲转变,蛋白质稳定的结构遭到破坏。
[1] MA Y Y, XIONG Youling L., ZHAI J J, et al. Fractionation and evaluation of radical scavenging peptides from in vitro digests of buckwheat protein[J]. Food Chemistry, 2010, 118(3): 582-588.DOI:10.1016/j.foodchem.2009.05.024.
[2] JIANG J, CHEN J, XIONG Youling L.. Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J]. Journal of Agricultural and Food Chemistry,2009, 57(16): 7576-7583. DOI:10.1021/jf901585n.
[3] PEÑA-RAMOS E A, XIONG Youling L.. Whey and soy protein hydrolysates inhibit lipid oxidation in cooked pork patties[J]. Meat Science, 2003, 64(3): 259-263. DOI:10.1016/S0309-1740(02)00187-0.
[4] SAEED S, HOWELL N K. Effect of lipid oxidation and frozen storage on muscle proteins of Atlantic mackerel (Scomber scombrus)[J].Journal of the Science of Food and Agriculture, 2002, 82(5): 579-586.DOI:10.1002/jsfa.1080.
[5] KILINC B, CAKLI S. Chemical, microbiological and sensory changes in thawed frozen fi llets of sardine (Sardina pilchardus) during marination[J]. Food Chemistry, 2004, 88(2): 275-280. DOI:10.1016/j.foodchem.2004.01.044.
[6] LAURITZSEN K, AKSE L, JOHANSEN A, et al. Physical and quality attributes of salted cod (Gadus morhua L.) as affected by the state of rigor and freezing prior to salting[J]. Food Research International,2004, 37(7): 677-688. DOI:10.1016/j.foodres.2004.03.001.
[7] FENNEMA O R, POWRIE W D, MARTH E H. Low temperature preservation of foods and living matter[M]. New York: Marcel Dekker Inc, 1973, 80(5): 467-472.
[8] 徐芳, 卢立新. 油脂氧化机理及含油脂食品抗氧化包装研究进展[J]. 包装工程, 2008, 29(6): 23-26. DOI:10.3969/j.issn.1001-3563.2008.06.009.
[9] PARK S Y, KIM Y J, LEE H C, et al. Effects of pork meat cut and packaging type on lipid oxidation and oxidative products during refrigerated storage (8 ℃)[J]. Journal of Food Science, 2008, 73(3):127-134. DOI:10.1111/j.1750-3841.2007.00656.x.
[10] WOOD J D, NUTE G R, RICHARDSON R I, et al. Effects of breed,diet and muscle on fat deposition and eating quality in pigs[J]. Meat Science, 2004, 67(4): 651-667. DOI:10.1016/j.meatsci.2004.01.007.
[11] 霍晓娜, 李兴民, 刘毅, 等. 猪腿肉脂肪酸组成及脂肪氧化的研究[J]. 食品科学, 2006, 27(1): 101-104. DOI:10.3321/j.issn:1002-6630.2006.01.021.
[12] THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al. The effect of metal ions on lipid oxidation, colour and physi-cochemical properties of cuttlef i sh (Sepia pharaonis) subjected to multiple freezethaw cycles[J]. Food Chemistry, 2006, 95(4): 591-599. DOI:10.1016/j.foodchem.2005.01.040.
[13] PARKINGTON J K, XIONG Youling L., BLANCHARD S P, et al.Chemical and functional properties of oxidatively modif i ed beef heart surimi stored at 2 ℃[J]. Journal of Food Science, 2000, 65(3): 428-433. DOI:10.1111/j.1365-2621.2000.tb16021.x.
[14] DECKER E A, XIONG Youling L., CALVERT J T, et al. Chemical,physical, and functional properties of oxidized turkey white muscle myof i brillarproteins[J]. Journal of Agricultural and Food Chemistry,1993, 41(2): 186-189. DOI:10.1021/jf00026a007.
[15] PARK D, XIONG Youling L., ALDERTON A L. Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J]. Journal of Agricultural and Food Chemistry, 2006, 54(12):4445-4451. DOI:10.1021/jf0531813.
[16] XIONG Youling L., BLANCHARD S P, OOIZUMI T, et al. Hydroxyl radical and ferryl-generating systems promote gel network formation of myof i brillar protein[J]. Journal of Food Science, 2010, 75(2): 215-221. DOI:10.1111/j.1750-3841.2009.01511.x.
[17] 胡忠良, 邹玉峰, 林玉海, 等. 氧化程度对肌原纤维蛋白热凝胶及理化特性的影响[J]. 食品科学, 2013, 34(17): 19-22. DOI:10.7506/spkx1002-6630-201317005.
[18] 白艳红. 低温熏煮香肠腐败机理及生物抑菌研究[D]. 杨凌: 西北农林科技大学, 2005: 26-30.
[19] 张培培. 不同氧化油脂对中式香肠中蛋白质氧化的影响[D]. 扬州:扬州大学, 2014: 25-31.
[20] XIONG Youling L., BLANCHARD S P. Myof i brillar protein gelation:viscoelastic changes related to heating procedures[J]. Journal of Food Science, 1994, 59(4): 734-738. DOI:10.1111/j.1365-2621.1994.tb08115.x.
[21] LEVINE R L, GARLAND D, OLIVER C N, et al. Determination of carbonyl content in oxidatively modified proteins[J]. Methods in Enzymology, 1990, 186(1): 464-478. DOI:10.1016/0076-6879(90)86141-H.
[22] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. DOI:10.1016/0003-9861(59)90090-6.
[23] DAVIES K J, LIN S W, PACIFICI R E. Protein damage and degradation by oxygen radicals. IV. general aspects[J]. Journal of Biological Chemistry, 1987, 262(20): 9895-9901.
[24] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note: asimplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[25] LI J, ELEYA M M O, GUNASEKAREN S. Gelation of whey protein and xanthan mixture: effecct of heating rate on rheological properties[J]. Food Hydrocolloids, 2006, 20(5): 678-686.DOI:10.1016/j.foodhyd.2005.07.001.
[26] 章银良, 安巧云, 杨慧. 脂肪氧化对蛋白质结构的影响[J]. 食品科学,2012, 33(1): 25-30.
[27] 李银, 李侠, 张春晖, 等. 羟自由基导致肉类肌原纤维蛋白氧化和凝胶性降低[J]. 农业工程学报, 2013, 29(12): 286-292. DOI:10.3969/j.issn.1002-6819.2013.12.036.
[28] STADTMAN E R. Protein oxidation and aging[J]. Science, 1992, 257:1220-1224.
[29] DEAN R T, FU S L, STOCKER R, et al. Biochemistry and pathology of radical-mediated protein oxidation[J]. Biochemical Journal, 1997,324(1): 1-18. DOI:10.1042/bj3240001.
[30] 孔保华, 孔妍, 熊幼翎. 抗氧化剂对羟自由基引起的乳清分离蛋白氧化抑制效果的研究[J]. 食品科学, 2010, 31(3): 5-10.
[31] 吴伟. 蛋白质氧化对大豆蛋白结构和凝胶性质的影响[D]. 无锡: 江南大学, 2010: 36.
[32] CHEN H H, XU S Y, WANG Z. Interaction between flaxseed gum and meat protein[J]. Journal of Food Engineering, 2007, 80(4): 1051-1059. DOI:10.1111/j.1365-2621.1994.tb08115.x.
[33] BYLER D M, BROUILLETTE J N, SUSI H. Quantitative studies of protein structure by FT-IR spectral deconvolution and curve fi tting[J].Spectroscopy, 1986, 1(3): 29-32.
