Genome Shuffling选育普那霉素产生菌Streptomyces pristinaespiralis LS15
2018-03-16李靖靖李红梅
李靖靖,李红梅
(邹平县综合检验检测中心,山东邹平 256200)
近年来,随着临床上抗生素的普遍应用,很多感染性病菌的耐药性也逐渐增强,致使抗生素的剂量不断加大,如耐青霉素的肺炎球菌、耐万古霉素的肠球菌、耐甲氧西林的金黄色葡萄球菌等[1-2]。因此,迫切需要新型的抗生素来抵抗这些耐药菌株的感染,而普那霉素则成了新型抗生素的首选。普那霉素属于革兰氏阳性菌素类抗生素,由始旋链霉菌发酵产生,可以通过与核糖体结合从而抑制蛋白的合成,对大多数革兰氏阳性菌和部分革兰氏阴性菌有较强的抑制作用,是万古霉素的替代药物[3]。更重要的是,对普那霉素制剂的临床应用证明,只有极少数的细菌会对其产生微弱的耐药性,因此普那霉素在抵抗多重耐药菌方面起到了重要作用,具有广阔的市场前景[4]。
目前,国内对普那霉素的研究较少,菌株发酵尚处于较低的水平,一般效价不超过2 000 U/mL,发酵单位不超过1 500 mg/L[3]。为了进一步提升普那霉素的发酵水平,降低生产成本,试验对1株普那霉素产生菌Streptomyces pristinaespiralis LS15进行了Genome Shuffling的育种研究,以进一步提升其发酵能力,为后续研究工作提供性能优良的菌株。
1 材料与方法
1.1 试验材料
普那霉素产生菌S.pristinaespiralis LS15,土壤中筛选并由邹平县综合检验检测中心保藏。
琼脂培养基:可溶性淀粉10 g/L,黄豆饼粉2 g/L,酵母抽提物1 g/L,琼脂20 g/L,初始pH值7.0,121℃灭菌20 min。
再生培养基:琼脂培养基中加入蔗糖105 g/L。
发酵培养基:酵母抽提物6 g/L,葡萄糖30 g/L,KH2PO4·2H2O1.2 g/L,(NH4)2SO48 g/L,K2HPO4·2H2O 1.5 g/L,MgSO4·7H2O 0.8 g/L,FeSO4·7H2O 0.05 g/L,ZnSO4·7H2O 0.05 g/L,pH值7.0,115℃灭菌20 min。
1.2 试验方法
1.2.1 亚硝基胍(NTG) 诱变
在分析天平上称取NTG 30 mg,用pH值7.0的无菌磷酸盐缓冲液30 mL溶解,则NTG溶液质量浓度为1 mg/mL。刮取1环孢子,用无菌磷酸缓冲液10 mL混合振荡,分散均匀,再将孢子质量浓度稀释为107~108个/mL。吸取孢子悬液及NTG溶液各2 mL,于试管中混合均匀,则NTG的终质量浓度为0.5 mg/mL,将试管置于30℃水浴中,每隔10 min取样0.5 mL,稀释100倍后涂布平板。
1.2.2 发酵培养
从琼脂培养基上刮取孢子2环,无菌条件下接入50 mL/250 mL的种子培养基中,于30℃,200 r/min条件下摇床培养30 h。每株菌接入3个摇瓶,普那霉素产量取三者的平均值。
1.2.3 原生质体制备及融合
(1) 各NTG突变株的孢子接入发酵培养基,于30℃,200 r/min条件下培养30 h。
(2) 吸取种子液10 mL转入无菌离心管中,以转速5 000 r/min离心5 min。
(3)将上清液倒掉,加入10 mL无菌水,振荡洗涤菌体,重复离心弃上清液,再改用10 mLPB高渗液洗涤菌体2次,最后加入5 mLPB液,混匀菌丝体。
(4) 用质量浓度为5 mg/mL溶菌酶制备原生质体,在30℃条件下保温90 min,期间每隔10 min轻轻振荡混匀。
(5)将原生质体分成2份,1份在70℃条件下保温30 min钝化,1份在紫外线下照射60 min钝化。
(6) 2份原生质体再次混合均匀,以5 000 r/min转速离心15 min,倒掉上清液,加入PB高渗液1 mL,用移液枪轻轻吹洗沉淀,使其分散均匀。
(7) 加入质量分数为40%的PEG6000溶液3 mL,轻轻吹洗,使其混合均匀,然后将悬液置于37℃水浴中15 min,进行原生质体融合。
(8)用PB高渗液稀释悬液,双层琼脂法涂布再生平板。
1.3 发酵液中普那霉素含量测定
高效液相色谱法测定发酵液中普那霉素含量[3]。
1.4 酶活测定
己糖激酶(Hexokinase,HK)、丙酮酸激酶(Pyru vatekinase,PK)、天冬氨酸激酶(Aspartokinase,AK)、柠檬酸合成酶(Citrate synthase,CS) 的酶活测定参照相关文献[5-8]。
2 结果与分析
2.1 NTG诱变剂量的确定
NTG是一种烷化剂,具有多个活性烷基,它们容易取代DNA中的活泼氢原子,使DNA分子上的碱基和部分磷酸被烷化,DNA复制时导致碱基配对发生错误而引发突变,因而素有“超诱变剂”之称。试验采用质量浓度为0.5 mg/mL的NTG溶液对S.pristinaespiralis LS15的孢子处理不同时间,以不经诱变的孢子作为对照,涂布琼脂平板计算诱变致死率。
NTG诱变S.pristinaespiralis LS15孢子的致死率曲线见图1。
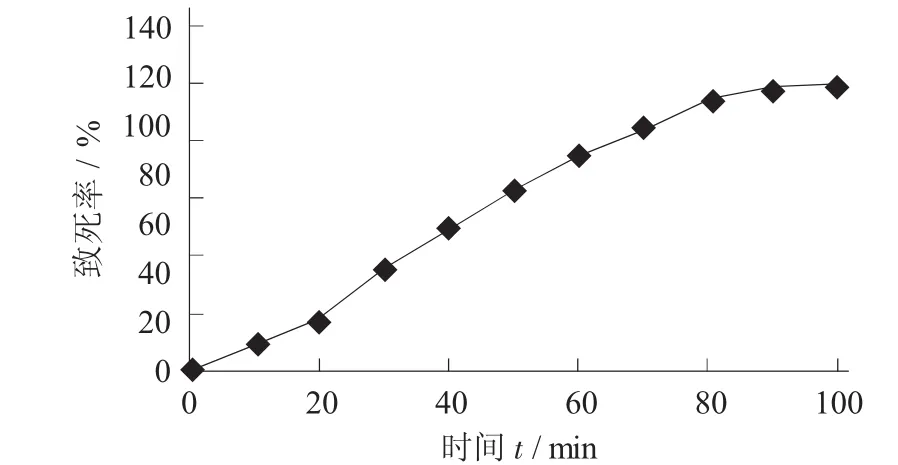
图1 NTG诱变S.pristinaespiralis LS15孢子的致死率曲线
根据图1可以看出,随着NTG处理时间的延长,菌株孢子的致死率也随之增加,一般选择致死率为80%左右为宜,所以将NTG的处理时间确定为70 min。
2.2 链霉素抗性浓度的确定
普那霉素是一种次级代谢产物,在放线菌产次级代谢产物的诱变研究中,“核糖体工程育种”是普遍采用的一种方法。微生物的核糖体是蛋白和酶的合成机器,其某些特定位点会被一些抗生素所结合从而降低活性,如链霉素、庆大霉素、利福霉素等,但是当编码核糖体的基因发生突变后,核糖体不再与抗生素结合,或者即使结合了也不会降低活性,菌株表现出抗性,从而导致次级代谢产物的过量合成[9-10]。基于上述原理,试验选取链霉素作为抗性指标对S.pristinaespiralis LS15进行诱变筛选。
S.pristinaespiralis LS15对链霉素的抗性见表1。
当链霉素质量浓度达到4 mg/mL时几乎完全抑制了S.pristinaespiralis LS15的生长。
2.3 诱变及筛选
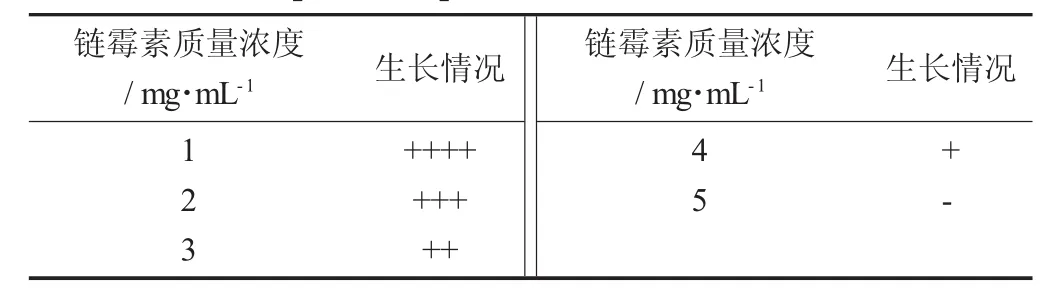
表1 S.pristinaespiralis LS15对链霉素的抗性
根据以上的试验结果,对S.pristinaespiralis LS15进行了基于链霉素抗性的NTG诱变及摇瓶筛选。采用质量浓度为0.5 mg/mL的NTG溶液对孢子处理70 min后,涂布梯度范围为0~10 mg/mL的链霉素抗性平板。在前期试验中已经证实S.pristinaespiralis LS15对链霉素的临界质量浓度为4 mg/mL,但经过NTG诱变后,在梯度平板的中上部(可以认为链霉素的质量浓度范围为5~10 mg/mL) 有部分菌株能够生长,说明该区域的菌株获得了链霉素抗性,属于突变菌株,证明了NTG诱变的有效性。
菌株在链霉素抗性平板上呈梯度分布见图2。
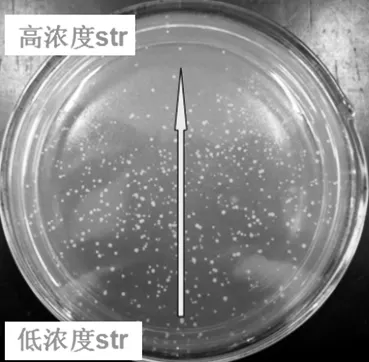
图2 菌株在链霉素抗性平板上呈梯度分布
从高质量浓度链霉素的区域挑选了生长速度较快的50个单菌落,转接到常规琼脂培养基中上培养,使其正常产孢子。每株菌接入3个摇瓶进行发酵,测定普那霉素含量以筛选正向突变菌株。最终获得了6株普那霉素摇瓶产量提高的菌株,分别为1.42,1.39,1.41,1.46,1.41,1.43 g/L,相比于初始菌株的1.12 g/L提高幅度为24.1%~30.3%。该结果说明不仅NTG诱变是有效的,以链霉素作为抗性指标也是切实可行的,该6株产量提高菌株可以作为后续的Genome Shuffling育种的出发菌株。
NTG诱变后筛选出的普那霉素产量提高菌株见图3。
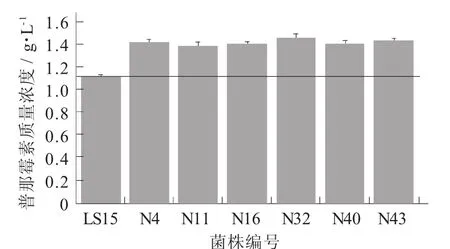
图3 NTG诱变后筛选出的普那霉素产量提高菌株
2.4 Genome Shuffling育种
将NTG诱变筛选得到的6株普那霉素产量提高菌株的孢子分别接入发酵培养基,培养30 h后获得种子。将6株菌的菌丝混合后制备原生质体,按照既定的方法进行原生质体的灭活、融合及再生,该过程为第1轮Genome Shuffling。
菌丝及原生质体的形态见图4。

图4 菌丝及原生质体的形态
在第1轮Genome Shuffling的原生质体再生过程中,选取再生速度、生长速度及菌丝孢子化速度较快的50个单菌落转接常规琼脂培养基,使其正常产孢子,然后每株菌接入3个摇瓶进行发酵,测定普那霉素含量以筛选产量提高菌株并最终获得了4株,摇瓶产量分别为1.62,1.69,1.61,1.66 g/L。将这4株菌作为出发菌株,再次接种培养制备原生质体,重复第1轮Genome Shuffling的过程,摇瓶筛选获得了5株普那霉素产量进一步提高的菌株,分别为1.92,1.89,1.94,1.94,1.86 g/L。再次重复进行第3轮Genome Shuffling,最终又筛选得到了2株普那霉素产量提升的融合子,摇瓶产量分别为2.06,2.15 g/L,相比于出发菌株的1.12 g/L提高幅度高达91.5%。
Genome Shuffling选育S.pristinaespiralis LS15的过程见图5。
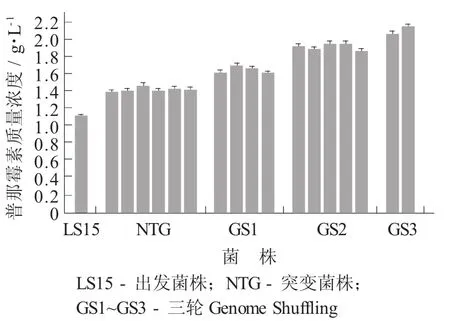
图5 Genome Shuffling选育S.pristinaespiralis LS15的过程
2.5 高产融合子与初始菌株的胞内酶活测定
为了初步解释Genome Shuffling育种获得的融合子S.pristinaespiralis GS3-26相比初始菌株LS15高产普那霉素,试验选取了菌株代谢途径中的一些关键酶进行了酶活测定,这些酶有糖酵解途径(EMP途径) 中的己糖激酶(Hexokinase,HK) 和丙酮酸激酶(Pyruvate kinase,PK),二氨基庚二酸途径(DAP途径)中的天冬氨酸激酶(Aspartokinase,AK)和三羧酸循环过程中(TCA)的柠檬酸合成酶(Citrate synthase,CS)。GS3-26与LS15在发酵培养基中分别培养30 h后,相同处理方式下测定4种酶的活力。
菌株S.pristinaespiralis LS15与GS3-26的酶活比较见表2。
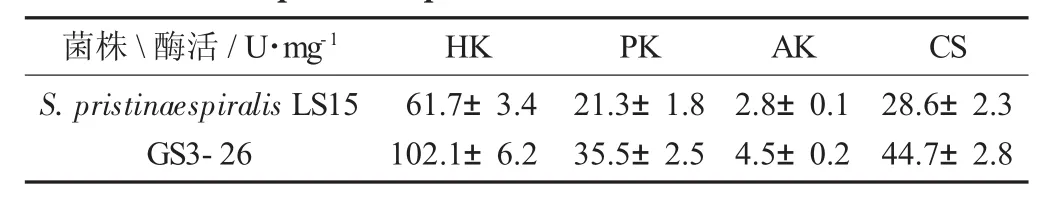
表2 菌株S.pristinaespiralis LS15与GS3-26的酶活比较
普那霉素的分子骨架由很多氨基酸残基聚合而成,因此菌体细胞中氨基酸的合成对于普那霉素的产量有重要的影响[4],而氨基酸的合成主要来自TCA循环。从表2的酶活比较中可以看出,高产融合子GS3-26的CS酶活在相比LS15提高了55.2%,CS作为TCA循环中的第1个关键酶,其酶活增强说明TCA循环在GS3-26中得到了强化。赖氨酸主要由DAP途径合成,而DAP途径中的关键酶AK在GS3-26中的活性也提高60.7%。TCA循环的增强势必需要上游EMP途径的增强,通过酶活比较可知,EMP途径中的HK与PK也确实有不同程度的酶活提升。
3 讨论
Genome Shuffling,也叫基因组改组或者基因组重排,该法首先以传统方法诱变菌株,筛选获得若干表型提高的突变株,然后将这些菌株混合后进行原生质体融合,并且重复多轮次,因而使各突变基因随机发生重组,最后筛选出目标菌株。Genome Shuffling育种的高效性已经在提高泰乐菌素[11]、羟基酸 (HCA)[12]、原始霉素[13]、ε-聚赖氨酸[14]产量等研究中得到了验证,在提高乳酸菌的耐葡萄糖、耐乳酸能力,提高酵母菌耐高温、耐乙醇能力等方面也发挥了巨大的作用[15]。从理论上而言,Genome Shuffling是整个基因组水平上的循环重组,可以将多个亲株的优良性状通过多轮的随机融合集中于同一个细胞中,与基因/代谢工程相比,其突出优点是不必了解整个基因组的序列数据和代谢网络的信息。本研究中,作者采用亚硝基胍诱变结合链霉素抗性对S.pristinaespiralis LS15产普那霉素进行了3轮Genome Shuffling育种,最终获得的融合子GS3-26,摇瓶发酵产量达到2.15 g/L,比原始菌株提高了91.5%,再次证明了Genome Shuffling育种的高效性,后续研究工作需要聚焦于培养基优化及发酵工艺调控方面,以进一步提升普那霉素的发酵水平。
[1]Barrett J F,Kuanbert D H.Is the new streptogramin derivative the answer to MRSA[J].Curr.Invest.Drugs,1993,2(3):245-253.
[2]Vazquez D.The streptogramin family of antibioties,In: Coreora JN,Hahn FE,eds[J].Antibioties,1975,4 (12):521-529.
[3]Bergeron M, Moniay G.The pharmacokineties of quinupristin/dalfopristinin laboratory animal sand in humans[J].J.Antimicrob.Chemother,1997,39 (23):129-135.
[4]Griswold M W,Lomaestro B M,Brioeland L L.Quinupristin/daffopristin ( RP59500) injectable streptogramin combination[J].Am.Healt.Syst.Pharm,1996(3):41-53.
[5]Teichgraber P,Biesold A,Pigereva D.Subcellular localization of Hexokinase in the rat cortex[J].Biokhimiya,1972(2):748-756.
[6]Hamano Y,Nicchu I.ε-Poly-L-lysine producer,Streptomyces albulus,has feedback inhibition resistant aspartokinase[J].Appl.Microbiol.Biotechnol,2007 (2):873-882.
[7]Jhadeswar M,William C,Plaxton D.Phosphoenolpyruvate carboxylase protein kinase from developing castor oil seeds:partial purification,characterization,and reversible control by photosynthate supply[J].Planta,2007 (5):1 299-1 310.
[8]James C K,Liang B B.Brain mitochondrial citrate synthase and glutamate dehydrogenase:differential inhibition by fatty acyl coenzyme A derivatives[J].Metabolic.Brain.Disease,1994(9):143-152.
[9]Hosoya Y,Okamoto S,Muramatsu H.Acquisition of certain streptomycin resistant(st)rmutations enhances antibiotic production in bacteria[J].Antimicrob.Agents.Chemother,1998 (5):2 041-2 047.
[10]Hu H,Ochi K.Novel approach for improving the productivity of antibiotic producing strains by inducing combined resistant mutations[J].Appl.Environ.Microbiol,2001 (7):1 885-1 892.
[11]Zhang Y X,Perry K,Vincy A.Genome shuffling leads to rapid phenotypic improvement in bacteria[J].Nat.Lett,2002 (10):644-646.
[12]Hida H,Yamada T,Yamada Y.Genome shuffling of Streptomyces sp.U121 for improved production of hydroxycitric acid[J].Appl.Microbiol.Biotechnol,2007(7):1 387-1 393.
[13]Xu B,Jin Z H,Wang H Z.Evolution of Streptomyces pristinaespiralis for resistance and production of pristinamycin by genome shuffling[J].Appl.Microbiol.Biotechnol,2008 (1):261-267.
[14]Shu L,Xu C,Liang W.Combining genome shuffling and interspecific hybridization among Streptomyces improved εpoly-L-lysine production [J].Appl.Biochem.Biotechnol,2013(4):338-350.
[15]Wang Y H,Yan L,Xiao P.Genome Shuffling improved acid tolerance and L-lacticacid volumetric productivity in Lactobacillus rhamnosus[J].Journ.Biotech,2007 (3):510-515.◇
