响应面法优化花生茎叶黄酮的提取工艺及其抗氧化活性研究
2018-03-14焦昆鹏马丽苹朱文学易军鹏樊金玲向进乐
焦昆鹏 马丽苹 朱文学 易军鹏 罗 磊 樊金玲 向进乐 海 闯
(河南科技大学食品与生物工程学院1,洛阳 471023) (河南省食品原料工程技术研究中心2,洛阳 471023)
黄酮类化合物在自然界中存在极其广泛,它们通常以苷类形式存在于植物内,各种黄酮苷类化合物因糖类的种类、连接位置、数量以及连接方式的不同而各异[1]。近年来,黄酮类物质一直备受关注,其因独特的结构而具有良好的抗氧化、抗癌、抗菌和抗炎等功能[2-5]。随着人们对人工合成食品抗氧化剂的质疑声越来越高,天然抗氧化剂的研究成为食品领域研究热点之一[6-7]。从自然界繁多的植物原料中选择合适材料并提取天然抗氧化剂是未来食品抗氧化剂的发展趋势[8-10]。
花生(ArachishypogaeaL)是我国重要的油料、经济作物之一,自古都被广泛种植[11]。而作为花生附属产物的花生茎叶除少部分入药和作为牛羊饲料外,多数都被废弃或直接燃烧,造成了资源的极大浪费和对环境的破坏[12]。邓保炜等[13]对花生植株不同部位的黄酮含量进行了研究,证明花生叶片中黄酮含量最高,茎蔓次之,花生壳和花生根黄酮含量最少,整株平均含量可达2.58%。由此可见,花生茎叶中黄酮类化合物含量极为丰富,以花生茎叶为原料提取黄酮,可实现废物再利用,提高资源的利用率,保护环境。
自古以来花生茎叶都被作为药物利用,所以关于花生茎叶提取物的降压、镇静催眠等药用功效研究较多。刘劲松等[14]在对花生茎叶的镇静催眠作用进行研究时发现花生茎叶的石油醚提取部分和乙酸乙酯提取部分的镇静催眠作用最强,能显著减少小鼠的自主活动次数。韦国锋等[15]对花生茎叶降压作用研究时发现降压功效成分主要是黄酮类物质。而关于花生茎叶黄酮的抗氧化性能少见报道。本实验优化了花生茎叶黄酮的提取工艺,并在此基础上研究了所提取总黄酮的抗氧化活性。经优化花生茎叶黄酮的提取率达到3.73%,且保持了良好的抗氧化活性。本研究为花生茎叶的综合利用和提取花生茎叶黄酮作为天然食品抗氧化剂等提供了理论基础。
1 材料与方法
1.1 材料与试剂
花生茎叶,采收自河南省南阳地区当年花生成熟茎叶,自然晾晒;芦丁标准品:上海金穗生物科技有限公司;1,1-二苯基苦基苯肼(DPPH·)自由基:Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FW177型高速粉碎机:北京永光明;TDZ5-WS型离心机:湖南湘仪;ΜV2400紫外可见分光光度计:上海舜宇恒平;XMTD-8222型鼓风干燥箱:上海精宏。
1.3 实验方法
1.3.1 花生茎叶黄酮提取液的制备
黄酮提取的基本流程:花生茎叶→烘干箱干燥→粉碎→过60目筛→乙醇提取→离心→上清液→定容→测定总黄酮含量。
1.3.2 黄酮含量的测定方法
采用分光光度法测定花生茎叶提取液中总黄酮含量,选用芦丁为标准品,同时对2种显色方法(亚硝酸钠-硝酸铝法[16]和三氯化铝法[17])显色前后的芦丁和花生茎叶提取液进行全波长扫描,以确定适合花生茎叶提取液的显色方法。
1.3.3 单因素实验
以乙醇浓度40%,提取时间2 h,提取温度60 ℃,液料比15:1为基本提取条件,依次变动单个因素的不同水平,以确定相关因素对提取液中总黄酮含量的影响。单因素变动设置如下:乙醇浓度(30%、40%、50%、60%、70%和80%的乙醇溶液),提取时间(1、1.5、2、2.5、3和3.5 h),提取温度(40、50、60、70、80和90 ℃),液料比(5:1、10:1、15:1、20:1、25:1和30:1)。
1.3.4 响应面分析法对花生茎叶黄酮提取工艺的优化
为了得到花生茎叶黄酮提取的最佳工艺,在单因素实验的基础上,采用Box-Behnken响应面实验设计,以花生茎叶黄酮的提取率为考察指标。对乙醇浓度、提取时间、液料比、提取温度4个变量A、B、C、D,进行响应面分析。实验因素及水平见表1。
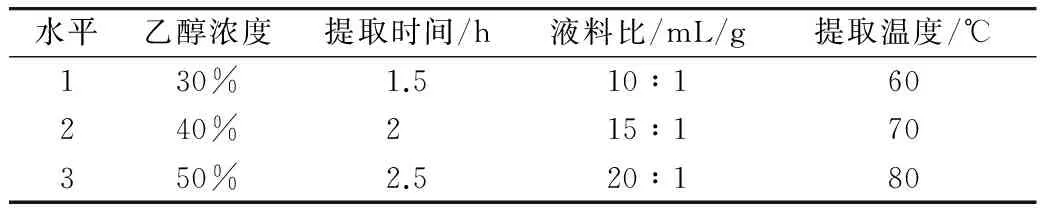
表1 Box-Behnken实验设计各因素的实验水平
1.3.5 花生茎叶黄酮的体外抗氧化实验
按照1.3.4方法中优化出的最优提取工艺提取花生茎叶黄酮,粗提液经旋转蒸发浓缩、离心后测定总黄酮浓度。然后将提取液稀释成不同总黄酮浓度的溶液备用。
1.3.5.1 DPPH自由基清除活性
DPPH自由基清除活性实验方法参照Liu等[18]方法进行,即将不同浓度的花生茎叶黄酮水溶液(0.98、1.95、3.91、7.81、15.63、31.25、62.50、125.00、250.00、500.00 μg)3 mL或VC阳性对照水溶液(浓度设置同花生茎叶黄酮)3 mL与1 mL DPPH(10-4mol/L,95%乙醇配制)溶液混匀,置于暗处反应40 min,用分光光度计在517 nm下测定吸光度Ai;用3 mL蒸馏水替代上述提取液或VC溶液,重复上述实验,测得吸光度Ac;用1 mL 95%乙醇替代上述反应中的DPPH溶液,测得吸光度值为Aj,按公式计算DPPH自由基清除率。
DPPH自由基清除率=[1-(Ai-Aj)/Ac]×100%
1.3.5.2 羟自由基清除活性[19]
在反应体系中依次加入0.6 mL FeSO4(6 mmoL/L)、2.0 mL不同浓度的花生茎叶黄酮溶液或VC溶液和0.6 mL H2O2(6 mmoL/L),充分震荡避光静置10 min,加入0.6 mL水杨酸(6 mmoL/L,无水乙醇配制)充分混合,再静置10 min,于波长510 nm处测定吸光度A1。保持其他操作不变,用无水乙醇替代上述体系中的水杨酸溶液,测定吸光度值A2。再用蒸馏水代替上述体系中的样品溶液,测定吸光度值A0。
羟自由基清除率=[1-(A1-A2)/A0]×100%
2 结果与分析
2.1 花生茎叶提取液黄酮含量的测定
图1显示不同染色方法对芦丁标准品和花生茎叶提取液进行显色后的全波长扫描的吸收光谱结果对照。由扫描图谱可知,芦丁和花生茎叶提取液的亚硝酸钠-硝酸铝显色法得到的图谱吸收峰不重叠,该显色方法不适用。二者经三氯化铝显色后在270 nm处最大吸收峰重叠。故本实验采用三氯化铝显色法测定270 nm处的吸光值,以芦丁标品做参照测定花生茎叶提取液黄酮的含量。
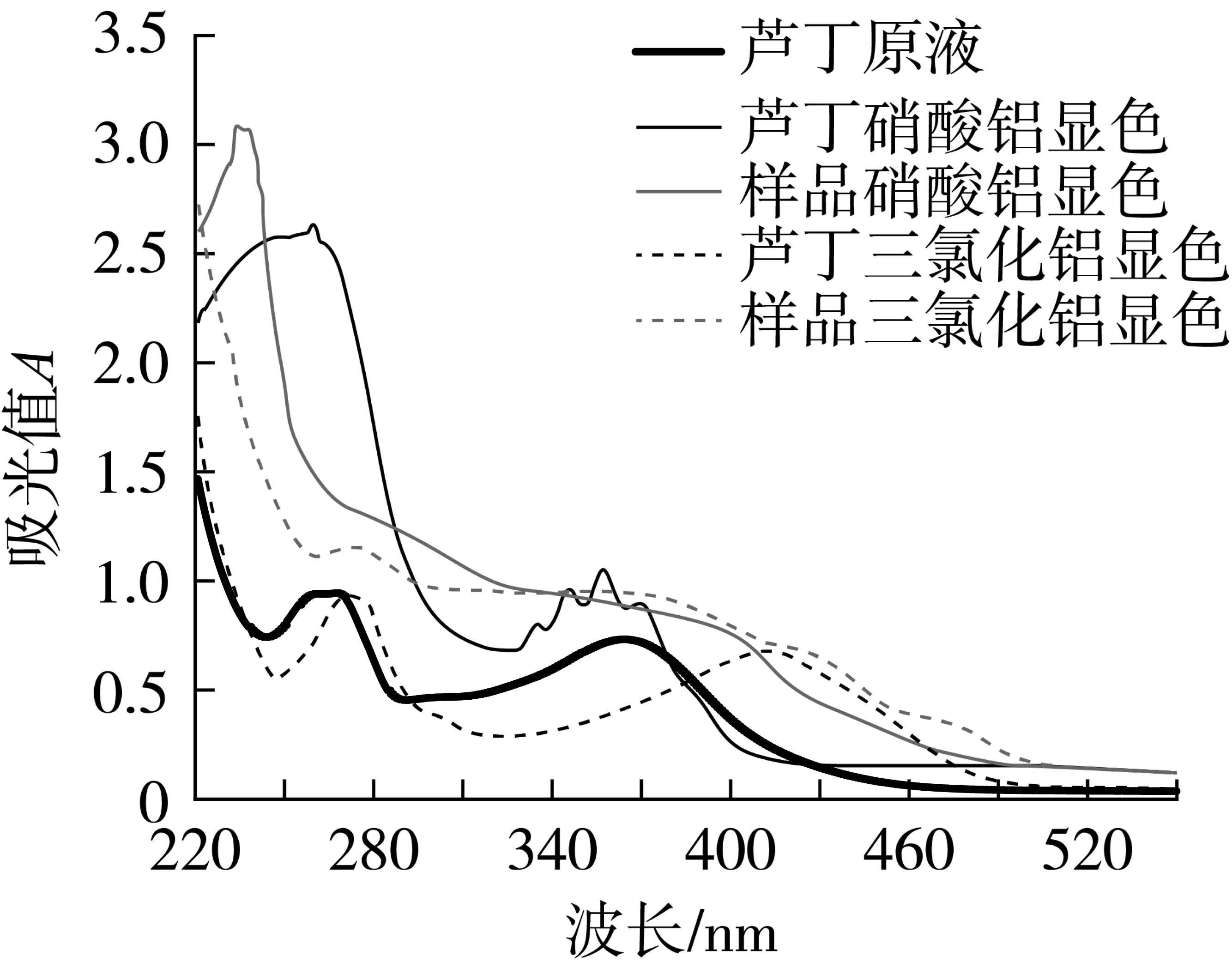
图1 芦丁及样品显色图谱
回归方程为:
y=0.036 5x-0.003 5
式中:x为黄酮浓度/mg/mL;y为吸光度,相关系数为R2=0.995 5。
黄酮提取量的公式计算:
黄酮提取量/mg/g=c×V/m
式中:c为提取液黄酮浓度/mg/mL;V为提取液体积/mL;m为花生茎叶干粉质量/g。
2.2 单因素实验结果
2.2.1 乙醇浓度对黄酮提取率的影响
图2显示了乙醇浓度对花生茎叶黄酮提取率的影响。总黄酮的提取率随着乙醇浓度的增高出现先增大后减小的现象,当乙醇体积分数为50%时,提取率达到最大:29.35 mg/g,低乙醇浓度时提取率的上升较平缓,乙醇体积分数为40%和50%时黄酮的提取率差异不大。综合实验数据和节约原则,选择40%的乙醇作为提取花生茎叶黄酮的最佳乙醇浓度。
因取代基团的数目、位置和性质的不同,黄酮类物质分子极性也不同。当提取液的极性和黄酮类物质的极性相同时,才能达到最大溶解度和提取率[20]。不同浓度的乙醇极性不用,这是花生茎叶提取率随乙醇浓度变化的主要原因。
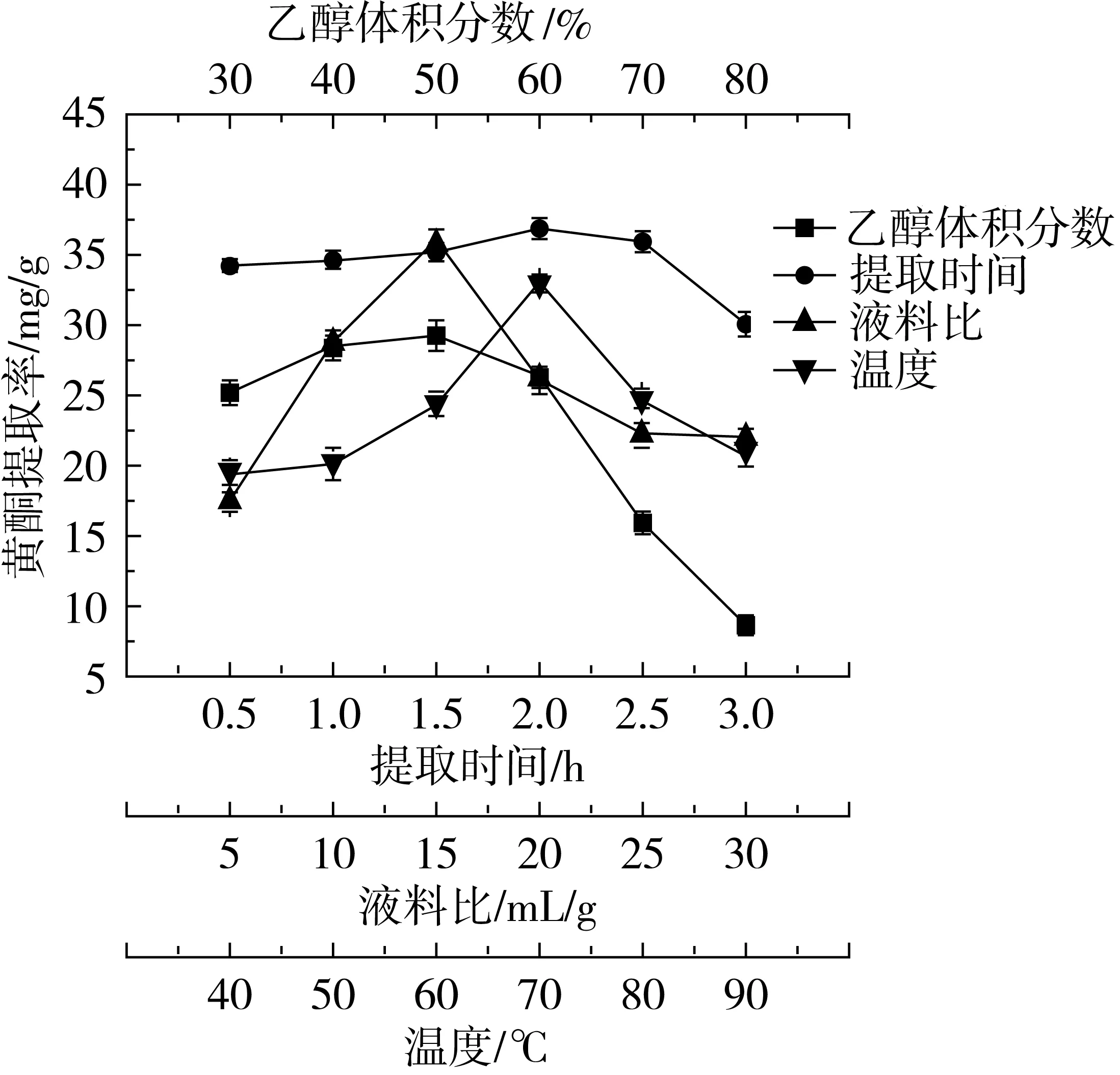
图2 乙醇浓度、提取时间、液料比和温度对黄酮提取率的影响
2.2.2 提取时间对黄酮提取率的影响
提取时间对黄酮提取率的影响结果见图2。从0.5~2 h范围内提取率仅有少量上升,超过2 h后,提取率开始下降,下降的速度随温度升高而加快。提取2 h时,花生茎叶中黄酮的提取率达到最大,为36.96 mg/g。随水浴时间继续增加,花生茎叶黄酮长时间受热引起的破坏增加是提取率下降的主要原因。故此,选择2 h作为后续实验的最佳提取时间。
2.2.3 液料比对黄酮提取率的影响
由图2可知,黄酮的提取率随液料比增大而增大,在液料比为15:1时黄酮的提取率达到最大,为36.1 mg/g。随着液料比继续增大,黄酮的提取率则逐渐降低。在较低液料比时,溶剂较少,溶出的黄酮类物质的浓度迅速增加,这影响了黄酮类物质进一步有效溶出,导致提取率较低。随着液料比的增大,黄酮类物质能够更加顺利的溶出,这提高了黄酮类物质的提取率。但是液料比继续增加时,一些醇溶性非黄酮类杂质的溶出量也将随之而增大,影响了花生茎叶中黄酮的溶出,故而在较大溶剂体积时,随着溶剂体积的增大黄酮的提取率反而降低。因此,选择液料比15:1为花生茎叶黄酮提取的最佳液料比。
2.2.4 提取温度对黄酮提取率的影响
图2显示了黄酮提取率受提取温度影响的结果,随着提取温度的升高,花生茎叶黄酮的提取率增大,在温度为70 ℃时,黄酮的提取率达到最大,为33.08 mg/g。当提取温度继续升高,花生茎叶黄酮的提取率转而下降。过高的提取温度对花生茎叶黄酮的破坏以及非黄酮类物质溶出量的增加是导致提取率下降主要原因。因此,选择70 ℃作为花生茎叶黄酮提取的最佳温度。
2.3 响应面分析
2.3.1 响应面实验方案与结果
在单因素实验的基础上,设计四因素三水平的响应面实验,对花生茎叶黄酮的提取工艺进行优化。响应面实验方案及结果见表2。

表2 响应面实验方案与结果
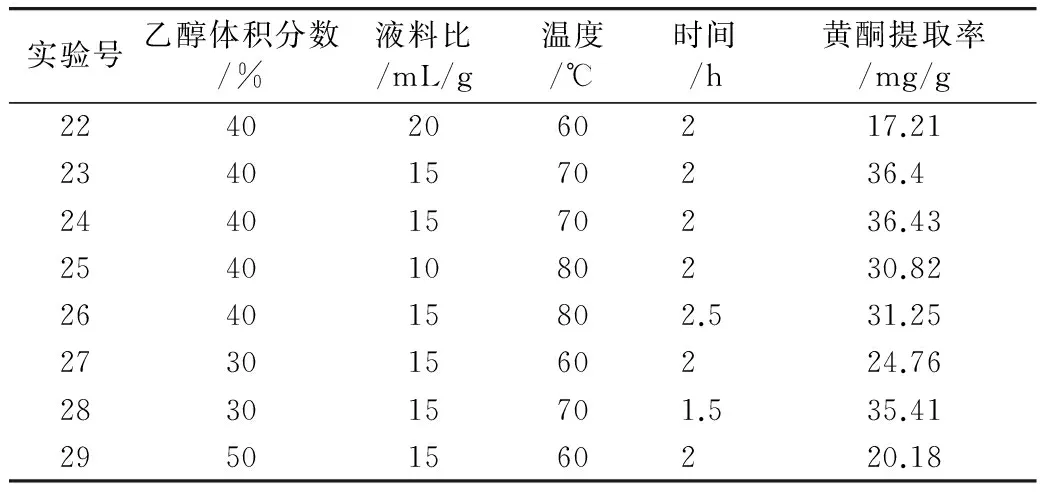
表2(续)
由表2的数据用Design-Expert 8.0分析可得回归方程为Y=34.67-1.61A-1.68B+4.96C+1.10D-0.23AB-0.093AC+7.88AD+3.06BC-5.71BD-2.23CD-2.85A2-3.87B2-3.70C2-3.89D2。
2.3.2 回归模型的方差分析
采用Design-Expert 8.0软件,对回归方程各项的方差作出分析。结果见表3。
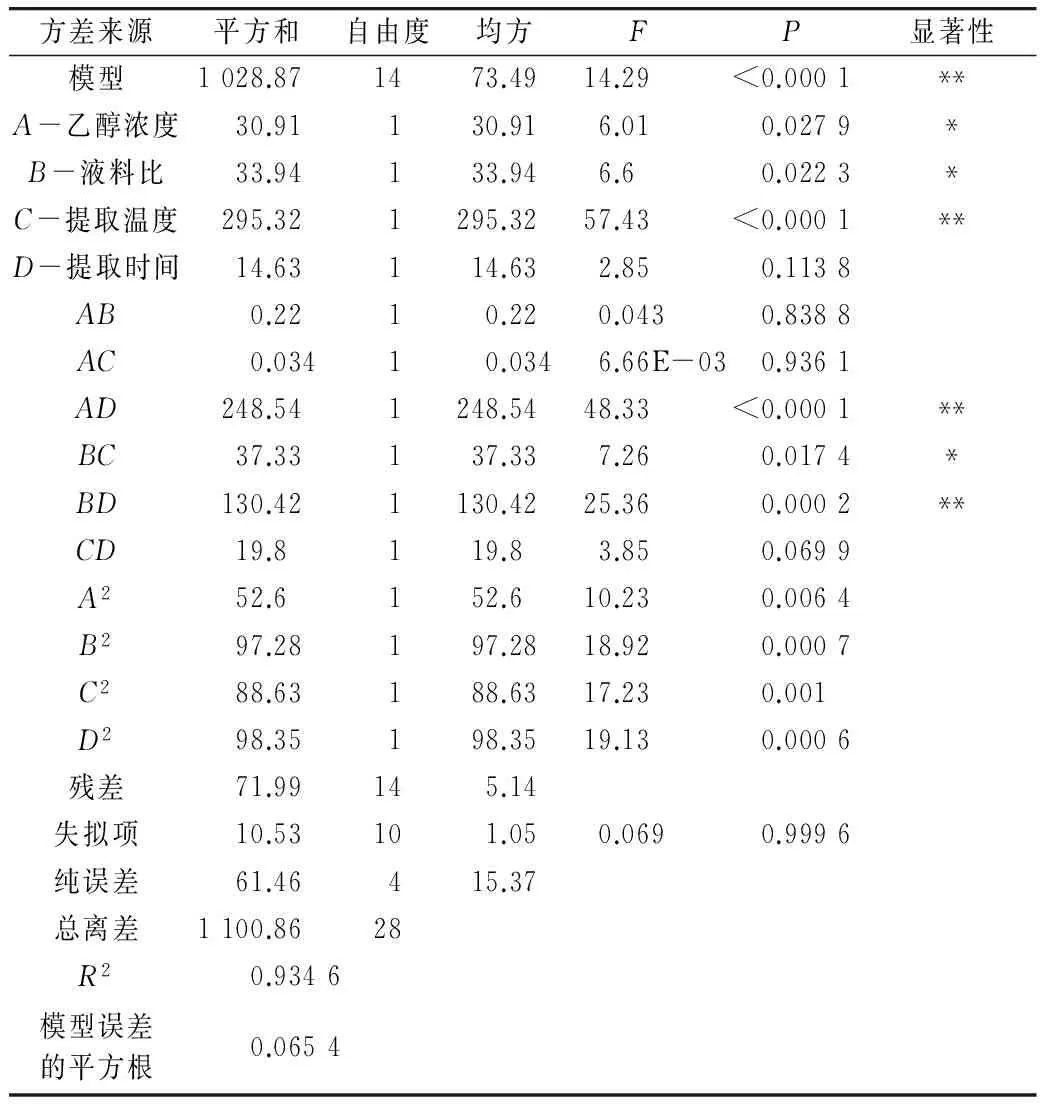
表3 回归方程的方差分析
由表3可知,该模型极显著(P<0.01),失拟项不显著(P>0.05;且R2为0.934 6,表明93.46%的实验数据可以用这个模型进行解释,证明该方程的可信度比较高。本实验的变异系数为7.39%,比较低。变异系数越低则实验的稳定性越高,故此本实验的稳定性较高,实验操作可信。该方程为优化花生茎叶乙醇提取黄酮的工艺条件提供了一个良好的模型。响应面分析可知A、B、BC具有显著性(P<0.05),C、AD、BD具有极显著性(P<0.01)。
2.3.3 响应面法优化结果
乙醇与提取时间、液料比与提取时间和液料比与提取温度的响应曲面分别如图3~图5所示。
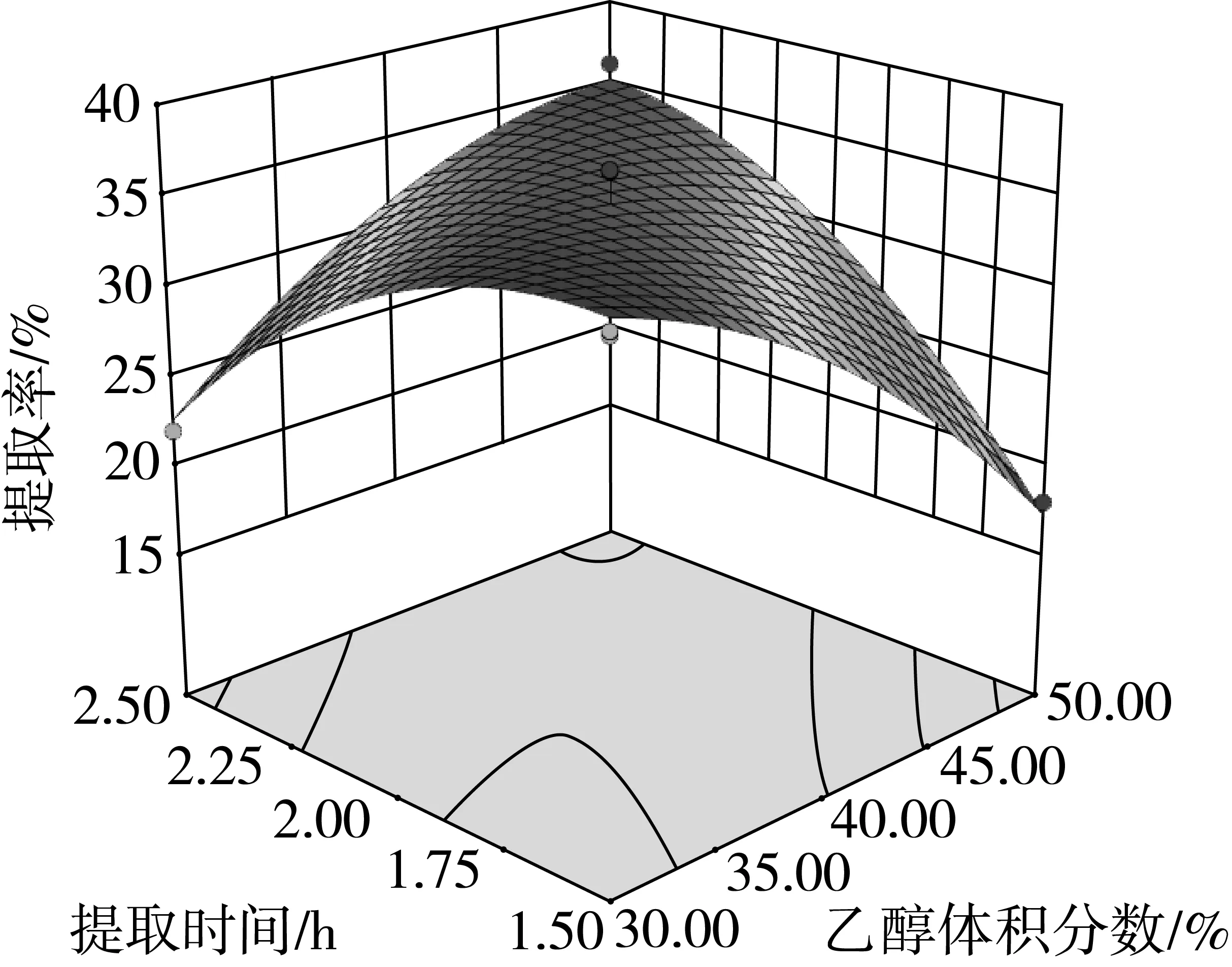
图3 乙醇浓度与提取时间的响应曲面图

图4 液料比与提取时间的响应曲面图
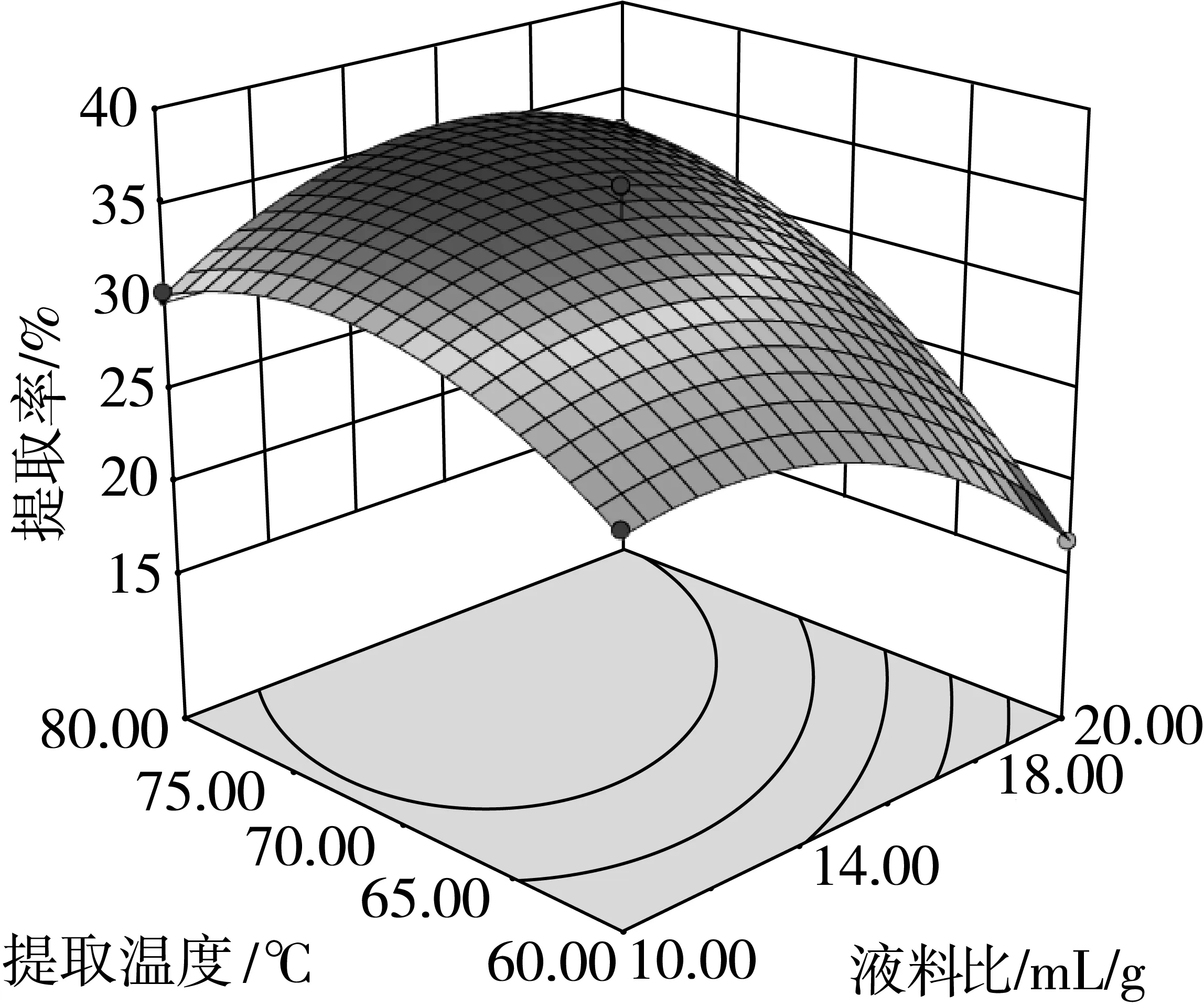
图5 液料比与提取温度的响应曲面图
由图3可知,乙醇浓度和提取时间的交互作用极显著,花生茎叶黄酮的提取量随着乙醇浓度和提取时间的增加而增加,由曲面图上可知,较高的乙醇浓度和较长的提取时间有利于黄酮的浸出。由图4和图5可知,液料比与提取温度、提取时间的交互作用均显著,在液料比较小的情况下,提取时间要很久,才能使黄酮的提取率较高。反之在提取时间较短的情况下,需要有一个较大的液料比才能达到较为理想的黄酮提取效果;在液料比不变的情况下,黄酮的提取率随着温度的升高而增大,但太高的温度和液料比则会使得黄酮的提取率降低。以上结果与二次回归方程的方差分析结果一致。
2.3.4 最佳工艺提条件的确定及验证实验
根据二次线性回归方程的分析结果,花生茎叶黄酮提取的最优条件为:乙醇体积分数49.19%、液料比10.16:1、提取温度为66.56 ℃、提取时间为2.43 h,黄酮的预测得率为37.66 mg/g。在实际生产中,考虑到操作性,确定花生茎叶黄酮的提取工艺为:乙醇浓度为49%、液料比为10:1、提取温度为67 ℃、提取时间为2.4 h。采用上述条件,重复3组实验进行验证,黄酮提取率为(37.32±0.12)mg/g,与预测值基本相符,表明模型正确,适用于花生茎叶黄酮提取工艺的优化。
2.4 花生茎叶体外抗氧化实验结果
2.4.1 DPPH自由基清除活性
从图6花生茎叶黄酮和VC对DPPH自由基的清除活性对比图中可以看出,二者对DPPH自由基的清除活性都随浓度的增加而增强,花生茎叶黄酮的DPPH自由基清除活性整体稍低于VC。质量浓度为125 μg/mL的花生茎叶黄酮对DPPH自由基清除率为78%,当质量浓度增加至500 μg/mL时,清除率上升到83.2%,其对DPPH自由基的清除活性的EC50为21.28 μg/mL,远低于10 mg/mL,这说明花生茎叶黄酮具有很好的抗氧化活性[21]。
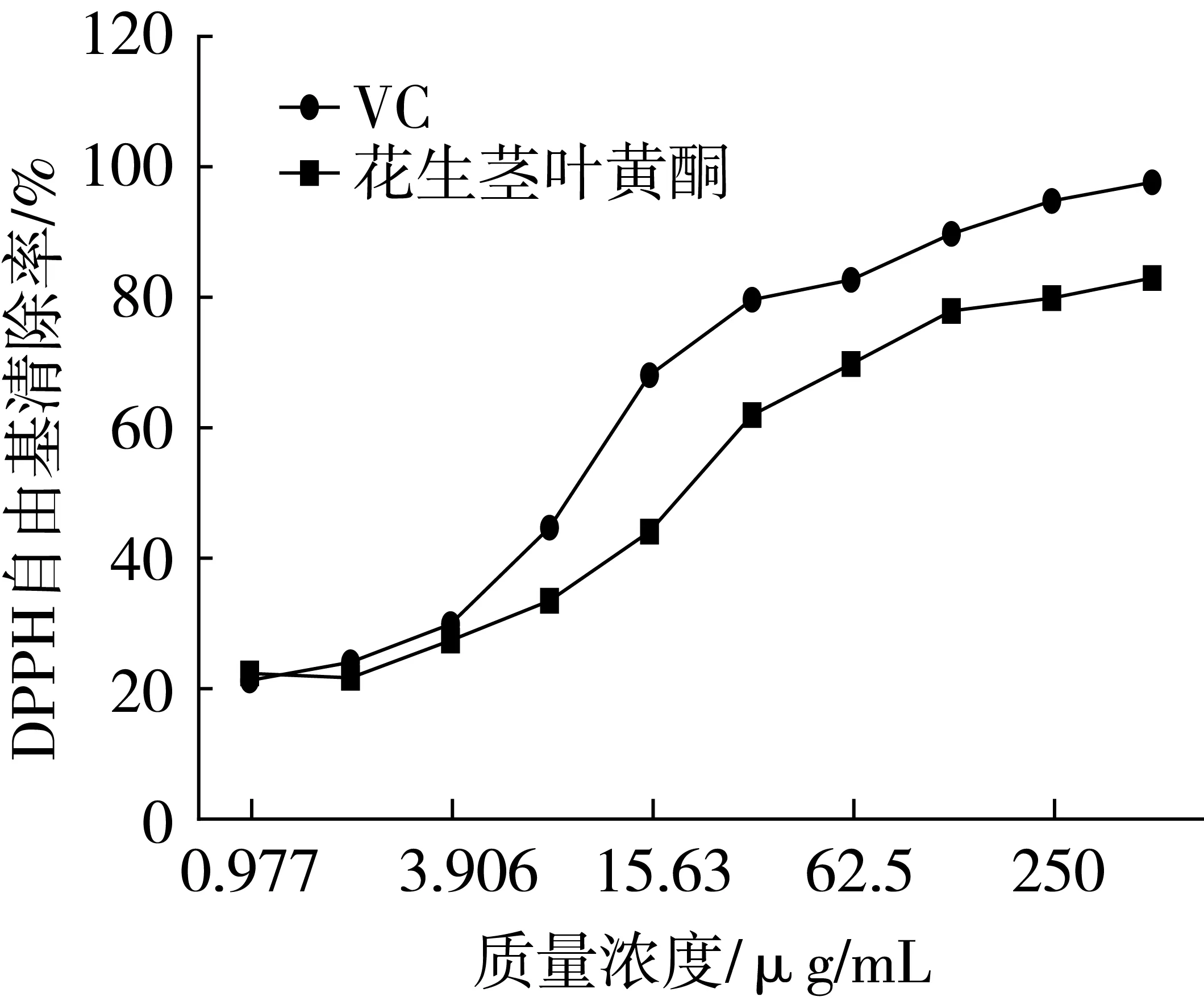
图6 花生茎叶黄酮清除DPPH自由基活性图
2.4.2 羟自由基清除活性
图7显示了花生茎叶黄酮和VC对羟自由基的清除活性对比。由图7可知,羟自由基的清除活性与浓度也呈正相关,花生茎叶黄酮和VC质量浓度在15 μg/mL以下时,二者对羟自由基的清除活性都较低且差异不显著,随浓度增加VC对羟自由基的清除活性增长稍快于花生茎叶黄酮,在250 μg/mL时VC的清除活性达到99.9%,此时花生茎叶黄酮的清除活性为85.4%,但在质量浓度达到500 μg/mL以后,二者的羟自由基清除活性都可达99.9%以上。所以花生茎叶黄酮具有很好的清除羟自由基活性。
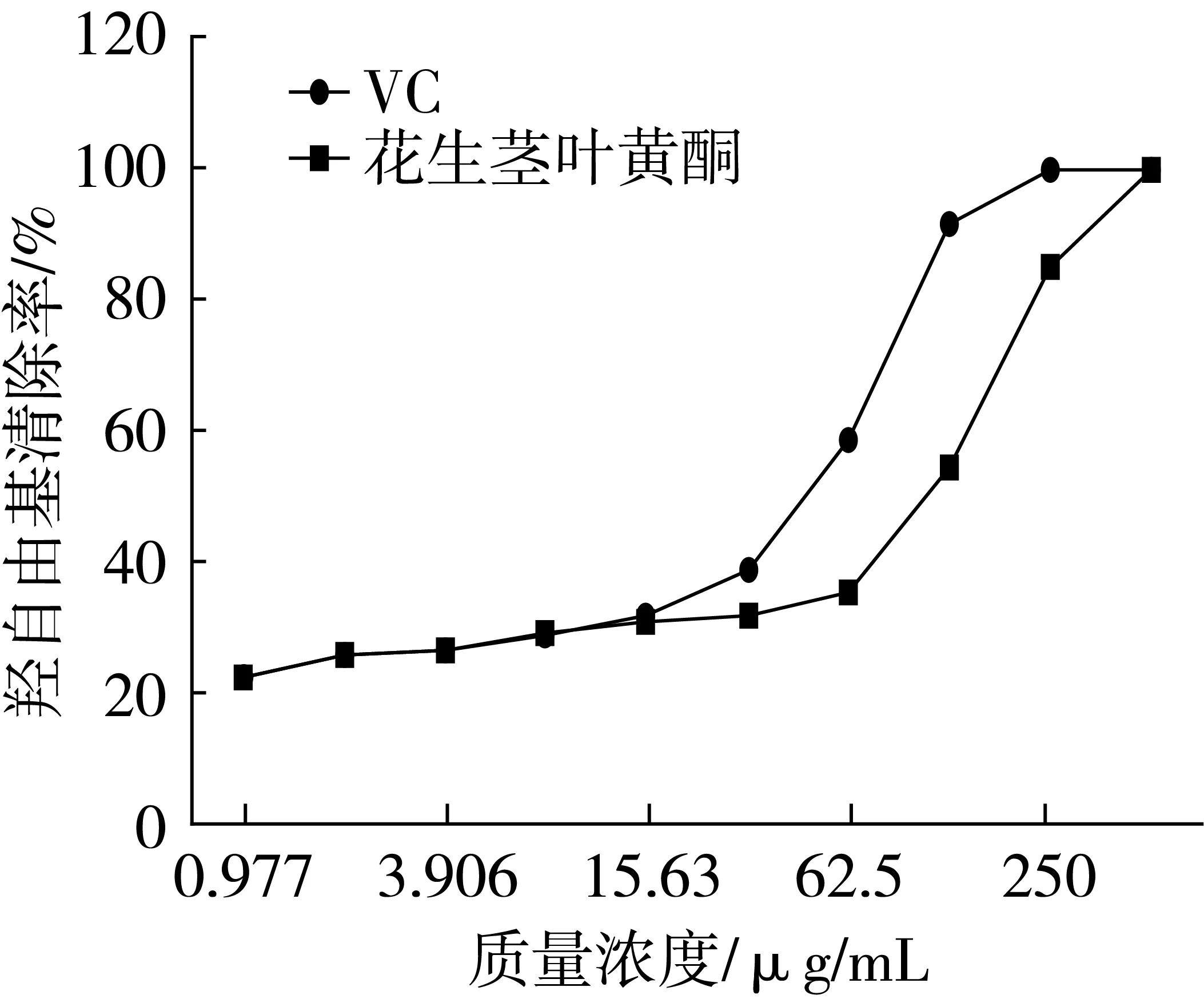
图7 黄生茎叶黄酮清除羟自由基活性
花生茎叶中黄酮类物质含量丰富,易于提取。上述抗氧化实验也表明了花生茎叶黄酮类物质具有很好的抗氧化活性。今后可在不同食品的加工过程中添加花生茎叶黄酮,考察其对不同食品加工过程和货架期内食品品质影响及其对食品的抗氧化效果表现,研究花生茎叶黄酮作为食品抗氧化剂的使用范围[22]。
3 结论
通过体外抗氧化活性实验发现,花生茎黄酮对羟自由基和DPPH自由基都有较好的清除能力。当花生茎叶黄酮质量浓度为500 μg/mL时,其对DPPH自由基的清除活性为:83.2%,对羟自由基的清除活性为99.9%,这说明花生茎叶黄酮具有较好的体外抗氧化活性,是很好的天然抗氧化剂。提取工艺优化的结果显示:乙醇体积分数49%、液料比10:1、提取温度67 ℃、提取时间2.4 h,为提取花生茎叶黄酮的最佳条件。此条件下黄酮提取率可达(37.32±0.12) mg/g,说明花生茎叶中黄酮类物质含量较大,是优质天然抗氧化剂的理想材料来源。
[1]李珊珊,吴倩,袁茹玉,等.莲属植物类黄酮代谢产物的研究进展[J].植物学报,2014,49(6):738-750 LI S S,WU Q,YUAN R Y,et al.Recent advances in metabolic products of flavonoids in nelumbo[J].Chinese Bulletin of Botany,2014,49(6):738-750
[2]郭飞,胡晓旭,雷红菲,等.大孔吸附树脂纯化无柄金丝桃茎部总黄酮工艺研究[J].天然产物研究与开发,2014,26(11):1853-1857+1863 GUO F,HU X X,LEI H F,et al.Optimization of purification conditions of flavonoids from the stem of Hypericum augustinii N.Robson by Macroporous Resin[J].Natural Product Research and Development,2014,26(11):1853-1857+1863
[3]RAVISHANKAR D,RAJORA A K,GRECO F,et al.Flavonoids as prospective compounds for anti-cancer therapy[J].International Journal of Biochemistry & Cell Biology,2013,45(12):2821-2831
[4]OKOTH D A,CHENIA H Y,KOORBANALLY N A.Antibacterial and antioxidant activities of flavonoids from Lannea alata(Engl.)Engl.(Anacardiaceae)[J].Phytochemistry Letters,2013,6(3):476-481
[5]FU Y,CHEN J,LI Y J,et al.Antioxidant and anti-inflammatory activities of six flavonoids separated from licorice[J].Food Chemistry,2013,141(2):1063-1071
[6]周泉城,黄景荣,李全宏.花生壳茎叶等综合利用研究进展[J].中国粮油学报,2009,24(10):140-144 ZHOU Q C,HUANG J R,LI Q H.Research advance of comprehensive utilization of peanut hull and stem[J].Journal of the Chinese Cereals and Oils Association,2009,24(10):140-144
[7]汪秋安.天然抗氧化剂及其在食品中的应用[J].粮油食品科技,2000,8(1):33-35 WANG Q A.Natural antioxidants and their application in food[J].Science and Technology of Cereals,Oils and Foods,2000,8(1):33-35
[8]杨国峰,周建新,汪海峰,等.花生壳提取物的制备及其抗氧化与抗菌活性的研究进展[J].食品与发酵工业,2007,33(2):97-101 YANG G F,ZHOU J X,WANG H F,et al.Research progresses on preparation,anti-oxidative and anti-microbial activity of extract from peanut hulls[J].Food and Fermentation Industries,2007,33(2):97-101
[9]LEE S C,JEONG S M,KIM S Y,et al.Effect of far-infrared radiation and heat treatment on the antioxidant activity of water extracts from peanut hulls[J].Food chemistry,2006,94(4):489-493
[10]BORGES BUBOLS G,DA ROCHA VIANNA D,MEDINA-REMON A,et al.The antioxidant activity of coumarins and flavonoids[J].Mini reviews in medicinal chemistry,2013,13(3):318-334
[11]汤松,禹山林,廖伯寿,等.我国花生产业现状、存在问题及发展对策[J].花生学报,2010,39(3):35-38 TANG S,YU S L,LIAO B S,et al.Industry status,existing problems and development strategy of peanut in China[J].Journal of Peanut Science,2010,39(3):35-38
[12]吴传江,刘艳华.花生粕、壳、茎叶在现代畜牧业上的应用[J].北京农业,2015,(18):90 WU C J,LIU Y H.The application of the peanut meal,peanut hulls,stems and leaves of peanut to the modern livestock industry[J].Beijing Agriculture,2015,(18):90
[13]邓保炜,杜芳艳.花生植株及其不同部位黄酮含量研究[J].花生学报,2009,38(1):5-9 DENG B W,DU F Y.Study on the total flavones content in variant organs of peanut plant[J].Journal o f Peanut Science,2009,38(1):5-9
[14]刘劲松,李莉,陈爱民,等.花生茎叶不同提取部位对小鼠镇静催眠作用的初步探讨[J].中药材,2012,35(11):1833-1836 LIU J S,LI L,CHEN A M,et al.Sedative and hypnotic effects of different extracted parts of stems and leaves of peanut in mice[J].Journal of Chinese Medicinal Materials,2012,35(11):1833-1836
[15]韦国锋,覃特营,何有成.花生茎叶降压作用有效成分的初步研究[J].右江民族医学院学报,1991,(02):11-13 WEI G F,TAN T Y,HE Y C.Effects of stems and leaves of Acrhishy pogaea L.on lowering blood Pressure[J].Journal of Youjiang Medical university for Nationalities,1991,(02):11-13
[16]梁柱华,杨建设,杨艺虹,等.酸枣仁中总黄酮的含量测定研究[J].分析测试技术与仪器,2008,14(1):34-37 LIANG Z H,YANG J S,YANG Y H,et al.Study on the total flavonoids content of seed of common Jujube[J].Analysis and Testing Technology and Instruments,2008,14(1):34-37
[17]马陶陶,张群林,李俊,等.三氯化铝比色法测定中药总黄酮方法的探讨[J].时珍国医国药,2008,19(1):54-56 MA T T,ZHANG Q L,LI J,et al.AlCl3colorimetry for determination of total flavonoids[J].Lishizhen Medicine and Materia Medica Research,2008,19(1):54-56
[18]LIU Lixiang,SUN Yi,LAURA T,et al.Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C.J.Tseng[J].Food Chemistry,2009,112(1):35-41
[19]熊双丽,李安林.夏枯草总黄酮的提取分离与自由基清除活性研究[J].食品科学,2010,31(22):194-197 XIONG S L,LI A L.Extraction,isolation and free radical-scavenging activity of flavonoids from Prunella vulgaris Linn[J].Food Science,2010,31(22):194-197
[20]井乐刚,张永忠.大豆异黄酮的物理化学性质[J].中国农学通报,2006,22(1):85-87 JING L G,ZHANG Y Z.Physical and chemical properies of soybean isoflavones[J].Chinese Agricultural Science Bulletin,2006,22(1):85-87
[21]郑义,邵颖,陈安徽,等.益智仁总黄酮超声辅助提取工艺优化及其抗氧化活性[J].食品科学,2014,35(6):44-49 ZHENG Y,SHAO Y,CHEN A H,et al.Optimization of ultrasonic-assisted extraction and antioxidant activities of total flavonoids from Alpinia oxyphylla fruits[J].Food Science,2014,35(6):44-49
[22]李银聪,阚建全,柳中.食品抗氧化剂作用机理及天然抗氧化剂[J].中国食物与营养,2011,17(2):24-26 LI Y C,GAN J Q,LIU Z.Food antioxidants mechanism and natural antioxidant[J].Food and Nutrition in China,2011,17(2):24-26.
