吉林省绿豆种质资源遗传多样性SSR分析及指纹图谱构建
2018-03-14赵雅楠张东杰
赵雅楠 王 颖,2 张东杰
(黑龙江八一农垦大学食品学院1,大庆 163319) (国家杂粮工程技术研究中心2,大庆 163319)
绿豆(Vignaradiate)是豇豆属(Vigna)亚洲豇豆亚属(Ceratotropis)的主要栽培豆种,富含多种维生素和矿物元素,是广受欢迎的药食同源作物,在我国具有悠久的栽种历史,种质资源丰富,种类繁多[1]。近些年,受优良品种广泛应用化和种质资源应用同质化趋势的影响,绿豆品种遗传基础越来越狭窄,优异基因大量流失,品种间相似度高,传统方法难以区分鉴别[2]。简单重复序列(Simple Sequence Repeat,SSR)分子标记技术因其多态性丰富、稳定性强、操作简便等显著特点,已逐渐成为作物遗传多样性分析及DNA指纹图谱构建的重要途径[3-5]。Molla等[6]利用5对SSR引物对42个绿豆品种进行遗传多样性并构建其SSR指纹图谱,共获得20个等位基因,平均等位基因数为4个,PIC值变幅介于0.538~0.803之间,平均为0.637,5对核心引物可将42个品种完全区分开,证明SSR技术是构建绿豆指纹图谱的有效途径,可为绿豆品种鉴定区分提供参考;刘岩等[7]对全国不同地理来源的272份绿豆品种进行遗传多样性分析,发现中国绿豆种质资源遗传多样性水平较高,但也存在一定程度的近交现象;任红晓等[8]利用39对SSR引物对中国北方地区78份绿豆名优品种进行遗传多样性分析,平均等位基因数为2.74,平均PIC值为0.26,发现内蒙古是绿豆名优资源较丰富地区,而山西大同绿豆资源的遗传多样性水平则相对较低。
吉林是我国绿豆播种和产出大省,以2014年为例,吉林省绿豆播种面积和产量均居全国首位,分别占总量的23.24%和19.27%,然而关于吉林省绿豆种质资源的研究较少,且目前鲜有基于SSR技术分析该地区绿豆资源遗传多样性及指纹图谱构建的报道,仅有少数研究中涉及了部分品种数量较少,不能客观反映该地区种质遗传背景。同时,传统的SSR分子标记都是基于聚丙烯酰胺凝胶电泳技术进行检测,分辨率低、操作复杂,易产生误差[9-11]。基于此,本研究利用SSR荧光标记技术对吉林省24个市县的74份绿豆品种进行遗传多样性分析并构建其指纹图谱,以期为理清吉林省绿豆资源遗传差异、加强资源利用效率奠定基础,也为我国绿豆品种真伪鉴定、种质资源评价及资源保护利用提供参考。
1 材料与方法
1.1 供试材料
本研究选取吉林省长春市、安图县及洮安县等24个县市的74份绿豆品种为实验材料,均由中国农业科学院作物科学研究所提供,详情见表1。
150对引物由中国农业科学院作物科学研究所提供,由上海生物工程技术公司合成。以不同地理来源的10份绿豆种质DNA为模板,初筛150对引物,选取条带清晰、重复性好、多态性丰富的9对引物用于全部供试绿豆种质资源的研究。9对核心SSR荧光标记引物由美国ABI公司合成,在正向引物上分别加注荧光染料5’HEX(绿色)、5’FAM(蓝色)和5’TMRA(黄色)。

表1 供试绿豆品种信息

表1(续)
1.2 主要试剂及仪器
植物基因组DNA提取试剂盒、Mg2+、Taq酶、dNTPs、Buffer、琼脂糖、标准分子质量等均购于北京天根生物技术有限公司。
ABI Prism 3730XL型基因分析仪:上海艾研生物科技有限公司;WD-9402C基因扩增仪:北京六一生物科技有限公司;2-16PK高速冷冻离心机:德国Sigma公司;Alpha凝胶成像系统:美国ProteinSimple公司;SW-CJ-1D超净工作台:上海皓庄仪器有限公司;SANYO SIM-F14全自动制冰机:上海迭戈生物科技有限公司。
1.3 实验方法
1.3.1 DNA提取
每份材料取3粒播种于营养钵中,室温条件下种植10 d左右,采集刚展开的新鲜嫩叶,液氮环境下研磨成粉。利用试剂盒法提取基因组DNA,用0.8%琼脂糖凝胶电泳检测,最后稀释成20 ng/μL置于4 ℃环境下备用。
1.3.2 SSR-PCR
PCR体系共20 μL,包括20 ng/μL DNA模板3 μL,2 μmol/L引物0.6 μL,2.5 U/μL Taq酶0.2 μL,10 mmol/L dNTP 0.4 μL,20 mmol/L MgCl21 μL,Buffer 2 μL,其余用ddH2O补齐。PCR反应程序为94 ℃ 5 min;94 ℃ 30 s,退火温度35 s,72 ℃ 40 s,共35个循环;最终72 ℃ 3 min;4 ℃保存。在WD-9402C基因扩增仪上进行。
1.3.3 荧光标记毛细管检测及数据分析
对74份绿豆样品荧光标记引物的扩增产物进行纯化,去除盐分、蛋白质等杂质,将甲酰胺与分子量内标按100:1的体积比混匀,取15 μL于上样板中,将纯化后的扩增产物稀释1倍,取1 μL加入,在3730XL测序仪上进行片段测定,用GeneMapper对上机结果进行片段大小及基因型分析。最后利用POPGENE version 1.32计算各遗传参数,用UPGMA[12,13]法绘制各材料间的亲缘关系聚类图。
2 结果与分析
2.1 SSR标记的多态性
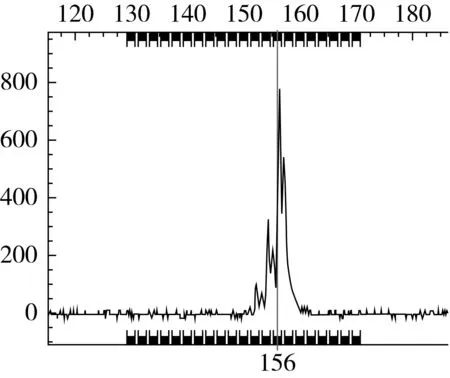
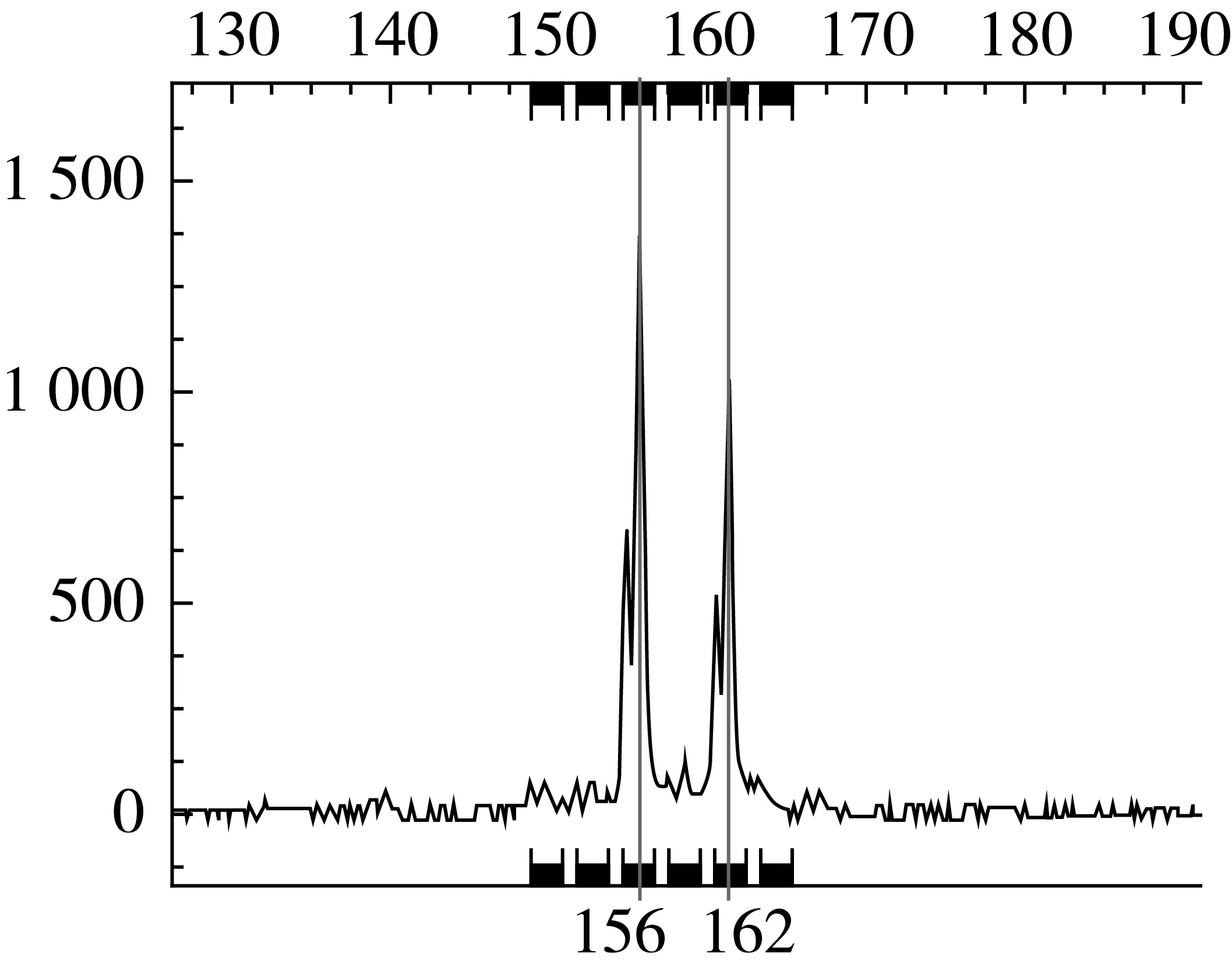
9对SSR引物在74份绿豆品种中共检测到40个等位基因,每对引物检测到的等位基因数从2(P3-581)~9(X55)个不等,平均为4.44个。Nei’s基因多样性指数变化范围介于0.195 5(GBssr-MB9)~1.688 9(X55)之间,平均为2.35。多态信息含量PIC值变化范围介于0.076 8~0.725 4之间,平均为0.45。其中标记X55(0.725 4)、X46(0.648 3)和X168(0.504 1)为高度多态位点(PIC>0.5),多态性较丰富;标记GBssr-MB91的PIC值小于0.25,为低度多态位点,检测能力较弱;而其余5个标记均为中度多态位点(0.25 表2 基于9个SSR分子标记的74个绿豆品种多态性信息 依据9对SSR引物在74份绿豆品种中所获得的40个等位基因,按Nei’s的方法利用NTSYSpc 2.0软件统计供试间的遗传相似系数[14-15]。所有参试品种间遗传相似系数变幅介于0.111 1~1.000 0之间,平均为0.499 0。根据所获得的2 701个遗传相似系数,以0.05为组距进行次数分布分析(图1)。74份绿豆品种的遗传相似系数不呈正态分布,在遗传相似系数为0.25~0.45之间存在一个高峰段,分布了1 279个遗传相似系数,占全部数据的47.35%;另一高峰段在遗传相似系数为0.55~0.70之间,数量为699个,占全部数据的25.88%。有1 159个遗传相似系数在0.6~1.0之间,占全部数据的42.91%,而仅有73个遗传相似系数在0~0.25之间,占全部数据的2.70%,说明目前吉林省绿豆种质资源的遗传相似性较高,遗传差异较大的品种数量较少。 图1 遗传相似系数的次数分布 通过UPGMA法利用遗传相似系数对74份吉林地区绿豆材料进行聚类分析。由图2可知,供试材料间遗传差异较小,在遗传相似系数为0.503 7的阈值处,可将74份绿豆材料分为三大类群。类群Ⅰ包括绿豆(C0688)、绿小豆(C0712)在内的40个品种;类群Ⅱ包括小鹦哥豆(C0705)、GCM8703-H-3(C4449)等30个品种;类群Ⅲ由绿豆(C0692)、小绿豆(C0754)、绿小豆(C0712)和大绿豆(C0743)4个品种组成。类群I品种的遗传相似性较高,如小绿豆(C0690)、小绿豆(C0716)、小粒绿豆(C0745)等4个县市的12个品种间遗传相似系数均达到了1.0,说明要想区分开这些品种需要筛选更多的SSR引物,同是也反映出吉林省绿豆种质资源间的亲缘关系较近,遗传多样性水平较低。在遗传相似系数为0.572 2处,可将类群Ⅱ分为2个亚群。类群Ⅲ仅包含4个品种,其中绿豆(C0692)和小绿豆(C0754)之间的遗传相系数为1.0,但该类群品种整体上与其他参试品种间的遗传相似度较低,遗传差异较大。聚类分析结果显示,大部分来自同一地理区域的品种都成簇分布,如柳河县绿豆品种除小绿豆(C0753)和小绿豆(C0754)外其余均聚集在第Ⅱ大类群的第Ⅱ亚群内,其他来自于同一地区的种质也呈现类似情形,如长春市绿豆品种,除GCM8703-H-3(C4448)、GCM8703-H-3(C4449)和GCM8806-7-2(C4459)聚集在第二大类群第二亚类内,其余10份均聚集在类群Ⅰ中。但同一地理来源的品种并没有完全聚在一起,不同地理来源品种相互交叉聚在一起,这可能是因为吉林省绿豆种质来源于共同的祖先,品种间亲缘关系较近,也可能是由于在长期种植生产中优良品种的频繁交流造成的。同时,各类群中都存在不同品种在遗传相似系数为1.0的水平上聚为一类的情况,这也再次说明吉林省绿豆资源不够丰富,品种间遗传差异较小,遗传相似度较高。 图2 基于SSR标记的74份绿豆聚类分析结果 利用9对SSR引物对74份绿豆材料进行扩增,部分毛细管电泳结果如图3和图4所示。整理电泳峰图,在同一峰值处有带记为1,无带记为0,建立起吉林省74个绿豆品种的DNA指纹图谱。按表2引物顺序,将每对引物在74份绿豆品种中检测的等位基因按其片段大小升序排列并依次编号,将9对引物在每个样品中检测到数据的编号串联起来,即得到由9位数字(有杂合带时则多于9位)构成的分子身份证。部分绿豆品种的SSR指纹图谱及分子身份证见表3。 图3 鹦哥豆(C0700)在标记座位GBssr-MB91上的毛细管电泳峰图 图4 小绿豆(C0771)在标记座位VR040上的毛细管电泳峰图 表3 74个品种在9个微卫星标记上的指纹数据及分子身份证 库编号名称指纹数据分子身份证C0692绿豆010-0001-01-10-000100-000001000-1000-00001-00010242146154C0693吉豆010-0010-10-01-000001-000000100-0100-01000-00100231267223C0694大绿豆010-0011-10-11-010001-010001000-0110-01010-1000023/411/22/62/62/32/41C0700鹦哥豆010-0010-10-01-100000-000000100-0010-01000-10000231217321C0701小明粒010-0010-10-01-100000-000000100-0010-01000-10000231217321C0702小绿豆010-0010-10-01-100000-000000100-0010-01000-10000231217321C0703大绿豆010-0010-01-10-010000-010000000-0100-00010-00010232122244C0704大粒豆010-0010-10-01-100000-000000100-0010-01000-10000231217322C0705小鹦哥豆010-0010-01-10-010000-010000000-0100-00010-00010232122244C0706小鹦哥豆010-0010-10-10-100000-*-1001-00001-0100023111-322C0707小绿豆010-0010-01-10-010000-010000000-0100-00010-*23212224-C0708小绿豆010-0010-10-01-100000-010000000-0001-00100-10000231212431C0709大眼绿豆010-0010-01-10-010000-010000000-0100-00010-00001232122245C0726小绿豆010-0010-01-10-000010-010000000-0010-01000-01000232152322C0729小绿豆010-0010-10-01-100000-000100000-0010-00010-01000231214342 注:*表示未检测到等位基因。 SSR分子标记技术因其多态性丰富、稳定性强、准确性高等显著特点已广泛应用于农作物遗传多样性分析及指纹图谱构建研究中[16-17]。此外,SSR-PCR扩增产物检测方法中,利用DNA测序仪建立的荧光标记SSR毛细管电泳检测法高效、精确、灵敏度高,可获得目标DNA片段的准确大小,实现数据的自动化收集与处理,克服了银染法的不足,能够区分识别大小相差1~2个碱基片段间差异,更加适用于大批量品种的检测[18]。高源等[19]、王瑞等[20]、程本义等[21]分别利用SSR荧光标记毛细管检测技术对梨、高粱及水稻进行遗传多样性分析及指纹图谱构建,均得出上述结论。本研究利用SSR荧光标记毛细管技术,对吉林省74个绿豆品种进行检测,可直接读取检测片段大小,数据更加精确,遗传多样性分析及指纹图谱数据也更加客观可靠。 本研究利用9对多态性丰富的SSR引物对吉林省74份绿豆品种进行分析,共检测到40个等位基因,每对引物检测到等位基因2~9个,平均为4.44个;多态信息含量PIC值变化范围介于0.076 8~0.725 4之间,平均为0.45。Li等[22]利用15对多态性引物对来自中国、韩国、日本、阿富汗、乌兹别克斯坦及尼加拉瓜等6个国家的66份绿豆种质进行遗传多样性分析,平均等位基因数为3.5个,平均PIC值为0.31;Lestari等[23]利用30对引物检测了83个绿豆品种,平均等位基因数为2.77,平均PIC值为0.33;王丽侠等[24]利用26对小豆SSR引物对国内外60个绿豆品种的遗传多样性进行分析,检测到的等位基因数从2~7个不等,平均为2.9个,PIC值从0.02~0.69不等,平均为0.36。而本研究得到的平均等位基因数和平均PIC值均高于前人研究,说明筛选得到的引物多态性较丰富,检测能力较强。同时,引物X46和X55的等位基因数(6,9)和PIC值(0.690 9,0.760 1)均较高,是吉林省绿豆种质研究中的骨干引物,这对于充分发掘吉林省乃至中国绿豆资源微卫星多态性信息十分有利。 遗传多样性分析发现,74个绿豆品种的遗传相似系数变幅介于0.111 1~1.000 0之间,平均为0.499 0。其中青绿豆(C0713)和绿豆(C0692)之间遗传相似系数最小,为0.111 1,亲缘关系较远。遗传相似系数在0.5以上的有1 260个,占全部数据的46.64%;而在0~0.25之间的遗传相似系数仅有73个,占全部数据的2.70%,说明吉林省绿豆种质资源遗传多样性水平较低,遗传背景狭窄,品种间差异较大的品种数量较少。同时,10组(37个)绿豆品种在遗传相似系数为1.0的水平上聚为一类,说明这几组品种间的遗传背景相同,但不排除“同种异名”现象。聚类分析显示,吉林省绿豆种质资源遗传相似程度较高,遗传背景比较相近,很多资源难以完全区分,需要筛选更多的多态性引物,同时也反映出吉林省绿豆种质资源遗传背景较狭窄。可能是因为吉林省绿豆资源在长期生产活动中种质交流频繁,遗传背景比较单一,而遗传差异较大的资源并没有很好的在生产中利用。因此今后应加强引进国内外其他资源丰富地区的材料以拓宽吉林省绿豆资源遗传背景,加强种质创新及新基因挖掘。 指纹图谱及分子身份证的构建是品种鉴定的重要途径,是防止假冒伪劣品种进入市场及名优品种保护的有效手段[25-27]。本研究所构建的74个绿豆品种的SSR指纹图谱可视为吉林省绿豆SSR指纹数据库的初步构建,而分子身份证将SSR指纹数据数字化,更加直观方便,应用性较强,可为新品种权保护提供支持。然而其中部分品种间遗传相似系数达到1.0,说明这些品种在DNA水平上的差异较小,需要更多的核心引物才能将其完全区分。随着吉林省绿豆品种数量增加,指纹图谱数据库也要不断扩充更新,因此在接下来的研究中应大力开发绿豆SSR引物,增加构建图谱的SSR引物数目,从而使数据库更加完善,以满足不断变化的实际需要。 [1]王兰芬,武晶,景蕊莲,等.绿豆种质资源芽期抗旱性鉴定[J].植物遗传资源学报,2014,15(3):498-503 WANG L F,WU J,JING R L, et al.Drought resistance identification of Mungbean Germplasm resources at bud stage[J].Journal of Plant Genetic Resources,2014,15(3):498-503 [2]任红晓.中国传统名优绿豆品种遗传多样性研究[D].北京.中国农业科学院,2013 REN H X.Genetic Diversity of Traditional Famous Mungbean in China[D].Beijing:Chinese Academy of Agricultural Sciences,2013 [3]MARTINS S,SIMES F,MENDONÇA D,et al.Chloroplast SSR genetic diversity indicates a refuge for Corylus avellana in northern Portugal[J].Genetic Resources and Crop Evolution,2013,60(4):1289-1295.DOI:10.1007/s10722-012-9919-2 [4]SMIT R,TOIT E S D,VORSTER B J.RAPD and SSR genetic diversity analysis of Moringa oleifera[J].South African Journal of Botany,2013,86(3):182 [5]NJUNG’E V,DESHPANDE S,SIAMBI M,et al.SSR genetic diversity assessment of popular pigeonpea varieties in Malawi reveals unique fingerprints[J].Electronic Journal of Biotechnology,2016,21:65-71.DOI:10.1016/j.ejbt.2016.02.004[6]MD.REZWAN Molla.Genetic Diversity Analysis and DNA Fingerprinting of Mungbean(Vigna radiata L.)Genotypes Using SSR Markers[J].Journal of Plant Sciences,2016,6(4):153-164.DOI:10.11648/j.jps.20160406.14 [7]刘岩,程须珍,王丽侠,等.基于SSR标记的中国绿豆种质资源遗传多样性研究[J].中国农业科学,2013,(20):4197-4209 LIU Y,CHENG X Z,WANG L X,et al.Genetic diversity research of mungbean germplasm resources by SSR markers in China[J].Scientia Agricultura Sinica,2013,(20):4197-4209 [8]任红晓,程须珍,徐东旭,等.应用SSR标记分析中国北方名优绿豆的遗传多样性[J].植物遗传资源学报,2015,16(2):395-399 REN H X,CHENG X Z,XU D X,et al.Genetic Diversity of Traditional Mungbean Varieties in Northern China by SSR Markers[J].Journal of Plant Genetic Resources,2015,16(2):395-399 [9]YOU Q,PAN Y B,XU L P,et al.Genetic diversity analysis of sugarcane germplasm based on fluorescence-labeled simple sequence repeat markers and a capillary electrophoresis-based genotyping platform[J].Sugar Tech,2016,18(4):380-390 [10]ZHENG X,YANG S,ZHOU X,et al.Identification of yunhe pears in Zhejiang province based on LFY2int2 and SSR analyses[J].Journal of Fruit Science,2016 [11]BORBA T C D O,BRONDANI R V,RANGEL P H N,et al.Evaluation of the number and information content of fluorescent-labeled SSR markers for rice germplasm characterization.[J].Crop Breeding & Applied Biotechnology,2005,5(2):157-165 [12]从夕汉,李莉,腾斌,等.56个杂交水稻骨干亲本SSR指纹图谱的构建及遗传相似性分析[J].生物学杂志,2010,27(1):87-91 CONG X H,LI L,TENG B,et al.Establish of SSR fingerprint map and analysis of genetic similarity among 56 backbone parental lines in hybrid rice[J].Journal of biology,2010,27(1):87-91 [13]BREDEMEIJER M,COOKE J,GANAL W,et al.2002.Construction and testing of microsatellite database containing more than 500 tomato varieties[J].Theoretical and Applied Genetics,105(6-7):1019-1026 [14]赵庆勇,张亚东,朱镇,等.30个粳稻品种SSR标记遗传多样性分析[J].植物遗传资源学报,2010-11(2):218-223 ZHAO Q Y,ZHANG Y D,Zhu Z,et al.Analysis on genetic diversity of 30 japonica rice varieties using SSR markers[J].Journal of Plant Genetic Resources,2010 11(2):218-223 [15]罗兵,徐港明,孙海燕,等.利用简单重复序列(SSR)标记分析太湖稻区现代粳稻品种的遗传多样性[J].农业生物技术学报,2014,22(12):1502-1513 LUO B,XU G M,SUN H Y,et al.Genetic diversity analysis of modern japonica rice(Oryza satiua L.)from taihu area based on simple sequence repeat(SSR)markers[J].Journal of Agricultural Biotechnology,2014,22(12):1502-1513 [16]ROYCHOWDHURY R,DATTA S,GUPTA P,et al.Analysis of genetic parameters on mutant populations of mungbean(Vigna radiata L.)after ethyl methane sulphonate treatment.[J].Notulae Scientia Biologicae,2012,4(1):137-143 [17]NICOLAï M,PISANI C,BOUCHET J P,et al.Discovery of a large set of SNP and SSR genetic,markers by high-throughput sequencing of pepper(Capsicum annuum)[J].Genetics & Molecular Research Gmr,2012,11(3):2295-300 [18]CHANDRA A,GRISHAM M P,Pan Y B.Allelic divergence and cultivar-specific SSR alleles revealed by capillary electrophoresis using fluorescence-labeled SSR markers in sugarcane[J].Genome,2014,57(6):363 [19]高源,田路明,刘凤之,等.利用SSR荧光标记构建92个梨品种指纹图谱[J].园艺学报,2012,39(8):1437 GAO Y,TIAN L M,LIU F Z,et al.Using the SSR fluorescent labeling to establish SSR fingerprints for 92 cultivars in pyrus[J].Acta Horticulturae Sinica,2012,39(8):1437 [20]王瑞,张福耀,程庆军,等.利用SSR荧光标记构建20个高粱品种指纹图谱[J].作物学报,2015,41(4):658-665 WANG R,ZHANG F Y,CHENG Q J,et al.Establishment of 20 sorghum hybrids fingerprints using SSR fluorescent marker[J].Acta Agronomica Sinica,2015,41(4):658-665 [21]程本义,吴伟,夏俊辉,等.浙江省水稻品种DNA指纹数据库的初步构建及其应用[J].浙江农业学报,2009,21(6):555-560 CHENG B Y,WU W,XIA J H,et al.Construction and application of DNA fingerprint database of rice varieties in Zhejiang Province[J].Acta Agriculturae Zhejiangensis,2009,21(6):555-560 [22]LI Gang.Genetic Diversity analysis of mungbean accessions from east and central asia using SSR markers[J].Journal of the Korean Society of International Agriculture,2011 [23]LESTARI P,KIM S K,REFLINUR,et al.Genetic diversity of mungbean(Vigna radiata L.)germplasm in Indonesia[J].Plant Genetic Resources,2014,12(S1):S91-S94 [24]王丽侠,程须珍,王素华,等.小豆SSR引物在绿豆基因组中的通用性分析[J].作物学报,2009,35(5):816-820 WANG L X,CHENG X Z,WANG S H,et al.Transferability of SSR from Adzuki bean to mungbean[J].Acta agronomica Sinica,2009,35(5):816-820 [25]BOWN S,HIGHAM T,Slon V,et al.Identification of a new hominin bone from Denisova Cave,Siberia using collagen fingerprinting and mitochondrial DNA analysis[J].Scientific Reports,2016,6:23559 [26]KOSMOWSKI F,ARAGAW A,KILIAN A,et al.Varietal identification in household surveys:Results from an experiment using DNA fingerprinting of sweet potato leaves in southern ethiopia[J].Policy Research Working Paper,2016 [27]SETIMELA P S,WARBURTON M L,ERASMUS T.DNA fingerprinting of open-pollinated maize seed lots to establish genetic purity using simple sequence repeat markers[J].South African Journal of Plant & Soil,2016,33(2):1-8.
2.2 遗传多样性分析

2.3 聚类分析

2.4 DNA指纹数据库及分子身份证构建

3 讨论与结论
